2. 华南师范大学 化学与环境学院,广东 广州 510006
2. School of Chemistry and Environment, South China Normal University, Guangzhou 510006, China
锂离子电池已广泛用于便携式电子装置、电动汽车和混合动力汽车中,并且由于其高能量密度,低自放电率和长循环寿命而被认为是电动汽车的最有前景的动力源[1-3]. 然而电解液在充电过程中是热力学不稳定的[4-5],在过充或过热条件下,电解液在正极容易被氧化,在负极表面容易被还原[6-7]. 一般情况下,电解液在电池负极表面发生还原反应之后会形成一层固态电解质相界面膜(SEI),从而抑制电解液的持续分解[8].
电解液对锂离子电池的性能有很大影响,是电池的重要组成部分. 与其他电解液溶剂相比,碳酸丙烯酯(PC),具有宽温度范围,高介电常数等优点[9],成为锂离子电池电解液的重要组成部分. 但是在石墨负极表面PC容易和Li+发生共嵌,从而引起石墨体积膨胀和电极材料的剥落,最后导致电池容量的下降和循环寿命的衰减[10]. 由于PC在0.8V vs.Li+/Li的电位下开始被还原分解,和Li+发生共嵌[11],因此可以通过加入低于0.8V vs.Li+/Li电位下发生还原反应的SEI成膜添加剂来抑制PC对石墨的破坏. 至今,研究者开发出了若干SEI成膜添加剂,包括亚硫酸乙烯酯[12],亚硫酸丙烯酯[13],氟代碳酸烯酯[14],碳酸亚乙烯酯(VC)[15]和含硼类化合物[16-18]等. 一般情况下,加入低于5%质量分数的添加剂就能在负极表面形成有效的SEI膜,其中VC的成膜效果最好而广泛应用于商品锂离子电池中,然而VC在正极表面容易发生聚合反应从而影响电池的性能[19-21]. 近年来,丙磺酸内酯(PS)和1,4-丁磺酸内酯(BS)对电池的高温性能有显著改善,因而受到研究者广泛关注[22-23].
丙烯基-1,3-丙磺酸内酯(PES)是一种新型的电解液成膜添加剂,因与PS具有类似结构而得到越来越多人的关注. 它也可以产生有效的阳极SEI膜,并且可以同时保护LiMn2O4/石墨电池的阴极和阳极[24-27]. 迄今为止,关于PES对电池性能的影响,以及其在负极的还原机制仍不清楚. 研究电解液添加剂反应机理,对搜索新的有效的添加剂和预测添加剂的性能具有重要意义[6-7, 28-29]. 本文采用密度泛函理论方法DFT,研究添加剂PES的作用机理.
1 计算方法本文的计算在Gaussian 09软件包中完成. 所有的结构是采用密度泛函理论方法中的B3LYP/6-311++G(d,p),在气态和液态下优化得到. 对液态环境的模拟通过采用连续极化介质模型(PCM)方法完成[30],采用的介电常数为20.5. 通过振动频率分析势能面上各驻点的性质,以确认优化得到的结构是势能面上的稳定点或是过渡态,以驻点虚频的唯一性确定反应的过渡态. 同时使用内禀反应坐标(IRC)方法对过渡态进行跟踪计算,验证反应势能面上各过渡态与反应物和产物之间的连接关系. 用自然键轨道(NBO)[31]方法分析优化得到的分子中原子的电荷分布以及分子键的键级.
2 成膜添加剂PES的还原分解反应机理 2.1 PES和PC分子的初始还原反应本文假设溶剂分子得到一个电子是PES和PC的初始还原反应,忽略了电极界面的影响. PES和PC分子得到电子前后的优化结构以及还原反应的过渡态及产物优化结构如图1所示. 气态下的结构与液态下的相似. 比较图1中PES和PC得到电子前后的结构变化可知,PC和PC+e计算几何参数相似, 因此PC+e的结构是稳定的. 比较PES和PES+e的结构可以明显地发现,对于PES,C1—O2,O2—S7,C3—S7和S7—O8 (S7—O9)的键长分别是0.144 7 nm,0.165 2 nm,0.177 5 nm和0.146 0 nm. PES得到一个电子形成PES+e之后,C1—O2,O2—S7,S7—O8和S7—O9的键长分别延长了0.002 0 nm,0.001 9 nm,0.003 0 nm和0.002 2 nm. 但是C3—S7的键长明显缩短了0.005 1 nm. —SO2基团的结构也发生了变化,从PES的117.3°到PES+e的112.0°. 计算结果表明,PES+e的结构是不稳定的.
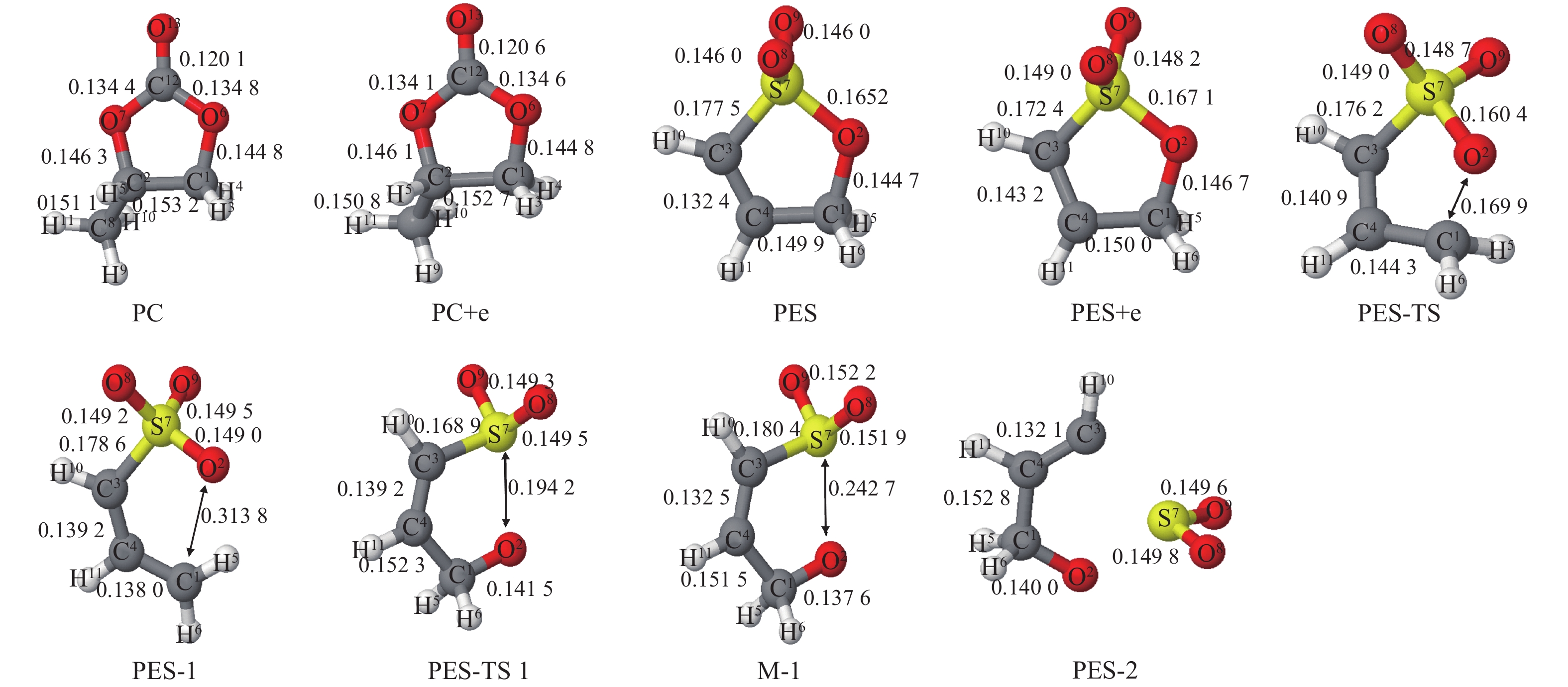
|
图 1 液态下,PES和PC分子得到电子前后的优化结构以及分解反应的过渡态及产物优化结构(“+e”表示得到电子)图中键长单位为nm Figure 1 Optimized geometric parameters (nm for bond lengths) at PCM-B3LYP/6-311++G(d,p) level in solvent |
PES和PC分子前线轨道能量和电子亲和能(ΔE=E(anion)–E(neutral))如表1所示. 根据分子轨道理论可知,分子的最低未占据轨道(LUMO)能量越低,分子越容易得到电子. 比较液态下PES和PC的LUMO能量可知,PES(–1.381 eV)明显比PC(–0.174 eV)低,表明PES具有更高的还原活性. 分子前线轨道能量得到的结果与分子的电子亲和能一致,PES(–210.277 kJ·mol–1)得到电子释放出的能量比PC(–85.806 kJ·mol–1)高. 计算结果可见,在含PES的PC基电解液中,PES将优先于PC发生还原反应,而不是PC优先于PES发生还原反应.
| 表 1 液态下PES和PC分子前线轨道能量和电子亲和能 Table 1 Frontier molecular orbital energy and electron affinity of PES and PC in solvent |
通过使用自然群体分析(NPA)获得的PES和PES+e中的原子上的电荷分布列于表2中. 从表2可以看出,PES和PES+e中的原子上的电荷分布完全不同. —SO2基团在PES得到电子后电荷由0.408 7变为0.224 5,而五元环中的5个原子在PES得到电子后电荷由0.198 6增加到0.861 1. 这表明,C1—O2或O2—S7键的断裂归因于环和—SO2基团之间弱的共轭效应,这也是由于五元环上的电子密度的增加. 在断裂C1—O2或O2—S7键后,电荷主要从五元环转移到—SO2基团,形成相对稳定的结构.
| 表 2 液态下,PES和PES+e的NBO原子电荷分布 Table 2 Atomic charges based on NPA for PES, PES+e |
为了阐明PES还原过程中键断裂的机理,使用基于NAO的Wiberg键指数矩阵的自然群体分析计算PES和PES+e的键级数. 计算PES得电子前后键的键级变化如表3所示. 相邻原子的键级反映原子的相互作用,即键强度与键级成比例. 表3中的键顺序遵循键长度的趋势(图1中的PES和PES+e). C1—C4和C3—S7的键合顺序分别从1.036 6和0.866 0增加到1.053 0和1.007 6. 但是C1—O2和O2—S7的比例分别从0.882 4和0.715 0降低到0.858 2和0.696 3. 这些结果表明,C1—C4和C3—S7被强化,而C1—O2和O2—S7在PES获得电子后被削弱. 基于结构和键序分析,可知PES+e的成膜机理经历C1—O2或O2—S7的断裂以形成稳定的开放环状阴离子自由基(PES-1或PES-2,如图1所示).
| 表 3 液态下PES和PES+e中键的NBO键级 Table 3 Wiberg bond orders in PES and PES+e |
考虑PES的单电子还原机理. 由PES阴离子(PES+e)的优化几何结构表明,初始还原反应伴随着C1—O2键的断裂,如图1所示. 为了确定PES分解反应的过渡态(TS),进行振动频率分析和内反应坐标(IRC)方法优化和确认. PES分解反应能量(ΔE/(kJ·mol–1)),焓(ΔH/(kJ·mol–1)),自由能(ΔG/(kJ·mol–1))以及过渡态的虚频频率结果列于表4中. 其相应的分解反应势能图见图2.
通过比较PES,PES+e,PES-TS 1和PES-1的结构,可以发现S7-O2的键长度从PES的0.165 2 nm显着缩短到PES-1的0.149 0 nm,而S7—O8和S7—O9的结合长度从PES的0.146 0 nm延伸到PES-1的0.149 2 nm和0.149 5 nm. 这可能是因为O原子的电负性比S原子更强,开始还原反应时电子首先攻击S原子,因此电子转移到O原子,随后的开环反应形成过渡态(PES-TS 1)和阴离子自由基(PES-1). 由于S7—O2,S7—O8和S7—O9的键长度基本相同,表明反应可能产生—SO3基团. 并且通过FTIR在含有PES的PC基电解质中检测到—SO3基团[26]. 同时形成PES-2的其他途径与ES相似[31].
因此由以上的分析,可以得出PES的还原机理,是通过PES+e经历C1—O2或O2—S7的断裂形成稳定的开环环状阴离子自由基(PES-1或PES-2).
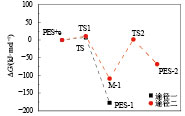
|
图 2 液态下PES分解反应的势能图 Figure 2 Potential energy profile for the decomposition process of PES in the forms of free PES |
| 表 4 PES分解反应能量 Table 4 Relative energy for the reductive decomposition of free PES |
采用密度泛函理论方法研究了锂离子电池成膜添加剂丙烯基-1,3-丙磺酸内酯(PES)的还原机理. 通过B3LYP/6-311++G(d,p)水平的密度函数理论与偏振连续模型(PCM)理论计算结果表明,溶剂中的PES容易在PC之前被还原成PES+e. 由于PES+e的结构不稳定,并且易于通过破坏C1—O2或O2—S7键而自发重排以形成接近平面. 基于结构,键序和电荷分布结果分析,负电荷主要分布在PES+e的—SO2基团上,因此PES+e的成膜机理经历C1—O2或O2—S7的断裂形成稳定的开环环状阴离子自由基(PES-1或PES-2).
| [1] | TARASCON J M, ARMAND M. Issues and challenges facing rechargeable lithium batteries[J]. Nature, 2001, 414(6861): 359-367. DOI: 10.1038/35104644. |
| [2] | ARMAND M, TARASCON J M. Building better batteries[J]. Nature, 2008, 451: 652-657. DOI: 10.1038/451652a. |
| [3] |
李新喜, 袁晓娇, 张国庆, 等.锂离子电池硅/石墨复合负极材料的制备及性能研究[J].广东工业大学学报, 2014, 31(2): 27-31.
LI X X, YUAN X J, ZHANG G Q, et al. Preparation and properties of silicon/graphite composites as anode materials for lithium batteries[J]. Journal of Guangdong University of Technology, 2014, 31(2): 27-31. |
| [4] | DEDRYVÈRE R, MARTINEZ H, LEROY S, et al. Surface film formation on electrodes in a LiCoO2/graphite cell: A step by step XPS study [J]. Journal of Power Sources, 2007, 174: 462-468. DOI: 10.1016/j.jpowsour.2007.06.033. |
| [5] | XU M Q, ZHOU L, XING L D, et al. Experimental and theoretical investigations on 4,5-dimethyl-[1,3] dioxol-2-one as solid electrolyte interface forming additive for lithium ion batteries[J]. Electrochimistry Acta, 2010, 55: 6743-6748. DOI: 10.1016/j.electacta.2010.05.096. |
| [6] | XING L D, WANG C Y, LI W S, et al. Theoretical insight into oxidative decomposition of propylene carbonate in the lithium ion battery[J]. Journal of Physical Chemistry B, 2009, 113: 5181-5187. DOI: 10.1021/jp810279h. |
| [7] | XING L D, WANG C Y, XU M Q, et al. Theoretical study on reduction mechanism of 1,3-benzodioxol-2-one for the formation of solid electrolyte interface on anode of lithium ion battery[J]. Journal of Power Sources, 2009, 189: 689-692. DOI: 10.1016/j.jpowsour.2008.08.076. |
| [8] | HIRAYAMA M, SAKAMOTO K, HIRAIDE T, et al. Characterization of electrode/electrolyte interface using in situ X-ray reflectometry and LiNi0.8Co0.2O2 epitaxial film electrode synthesized by pulsed laser deposition method [J]. Electrochimical Acta, 2007, 53: 871-881. DOI: 10.1016/j.electacta.2007.07.074. |
| [9] | XU K. Nonaqueous Liquid Electrolytes for Lithium-Based Rechargeable Batteries[J]. Chemical Reviews, 2004, 104: 4303-4417. DOI: 10.1021/cr030203g. |
| [10] | XU M Q, LI W S, ZUO X X, et al. Performance improvement of lithium ion battery using PC as a solvent component and BS as an SEI forming additive[J]. Journal of Power Sources, 2007, 174: 705-710. DOI: 10.1016/j.jpowsour.2007.06.112. |
| [11] | DEY A N, SULLIVAN B P. The electrochemical decomposition of propylene carbonate on Graphite[J]. Journal of the Electrochemical Society, 1970, 117: 222-224. DOI: 10.1149/1.2407470. |
| [12] | WRODNIGG G H, BESENHARD J O, WINTER M. Ethylene sulfite as electrolyte additive for lithium-ion cells with graphitic anodes[J]. Journal of the Electrochemical Society, 1999, 146: 470-472. DOI: 10.1149/1.1391630. |
| [13] | WRODNIGG G H, WRODNIGG T M, BESENHARD J O, et al. Propylene sulfite as film-forming electrolyte additive in lithium ion batteries[J]. Electrochemistry Communications, 1999, 1: 148-150. DOI: 10.1016/S1388-2481(99)00023-5. |
| [14] | MCMILLAN R, SLEGR H, SHU Z X, et al. Fluoroethylene carbonate electrolyte and its use in lithium ion batteries with graphite anodes[J]. Journal of Power Sources, 1999, 81: 20-26. |
| [15] | WANG Y, NAKAMURA S, TASAKI K, et al. Theoretical studies to understand surface chemistry on carbon anodes for lithium-ion batteries: how does vinylene carbonate play its role as an electrolyte additive[J]. Journal of the American Chemical Society, 2002, 124: 4408-4421. DOI: 10.1021/ja017073i. |
| [16] | XU M Q, ZHOU L, DONG Y N, et al. Improved perlormance of high voltage graphite/LiNi0.5Mn4 batteries with added lithium tetramethyl borate[J]. ECS Electrochemistry Letters, 2015, 4(8): 83-86. DOI: 10.1149/2.0021508eel. |
| [17] | LI J, XING Li D, ZHANG R Q, et al. Tris (trimethylsilyl) borate as an electrolyte additive for improving interfacial stability of high voltage layered lithium-rich oxide cathode/carbonate-based electrolyte[J]. Journal of Power Sources, 2015, 285: 360-366. DOI: 10.1016/j.jpowsour.2015.03.113. |
| [18] | ZUO X X, FAN C J, LIU J S, et al. Effect of tris(trimethylsilyl) borate on the high voltage capacity retention of LiNi0.5Co0.2Mn0.3O2/graphite cells [J]. Journal of Power Sources, 2013, 229(3): 308-312. |
| [19] | WANG Z X, HU Y S, CHEN L Q. Some studies on electrolytes for lithium ion batteries[J]. Journal of Power Sources, 2005, 146: 51-57. DOI: 10.1016/j.jpowsour.2005.03.092. |
| [20] | OESTEN R, HEIDER U, SCHMIDT M. Advanced electrolytes[J]. Solid State Ionics, 2002, 148: 391-397. DOI: 10.1016/S0167-2738(02)00078-4. |
| [21] | HU Y S, KONG W H, LI H, et al. Experimental and theoretical studies on reduction mechanism of vinyl ethylene carbonate on graphite anode for lithium ion batteries[J]. Electrochemistry Communications, 2004, 6: 126-131. DOI: 10.1016/j.elecom.2003.10.024. |
| [22] | XU M Q, LI W S, LUCHT B L. Effect of propane sultone on elevated temperature performance of anode and cathode materials in lithium-ion batteries[J]. Journal of Power Sources, 2009, 193: 804-809. DOI: 10.1016/j.jpowsour.2009.03.067. |
| [23] | LEE H, CHOI S, CHOI S, et al. SEI layer-forming additives for LiNi0.5Mn1.5O4/graphite 5 V Li-ion batteries[J]. Electrochemistry Communications, 2007, 9: 801-806. DOI: 10.1016/j.elecom.2006.11.008. |
| [24] | LI B, XU M Q, LI T T, et al. Prop-1-ene-1,3-sultone as SEI formation additive in propylene carbonate-based electrolyte for lithium ion batteries[J]. Electrochemistry Communications, 2012, 17: 92-95. DOI: 10.1016/j.elecom.2012.02.016. |
| [25] | LI B, XU M Q, LI B Z, et al. Properties of solid electrolyte interphase formed by prop-1-ene-1,3-sultone on graphite anode of Li-ion batteries[J]. Electrochimical Acta, 2013, 105: 1-6. DOI: 10.1016/j.electacta.2013.04.142. |
| [26] | LI B, WANG Y Q, RONG H B, et al. A novel electrolyte with the ability to form a solid electrolyte interface on the anode and cathode of a LiMn2O4/graphite battery [J]. Journal of Materials Chemistry A, 2013, 1: 12954-12961. DOI: 10.1039/c3ta13067c. |
| [27] | LI B, WANG Y Q, TU W Q, et al. Improving cyclic stability of lithium nickel manganese oxide cathode for high voltage lithium ion battery by modifying electrode/electrolyte interface with electrolyte additive[J]. Electrochimical Acta, 2014, 147: 636-642. DOI: 10.1016/j.electacta.2014.09.151. |
| [28] | XING L D, LI W S, WANG C Y, et al. Theoretical investigations on oxidative stability of solvents and oxidative decomposition mechanism of ethylene carbonate for lithium-ion battery use[J]. Journal of Physical Chemistry B, 2009, 113: 16596-16602. DOI: 10.1021/jp9074064. |
| [29] | XING L D, LI W S, XU M Q, et al. The reductive mechanism of ethylene sulfite as solid electrolyte interphase film-forming additive for lithium ion battery[J]. Journal of Power Sources, 2011, 196: 7044-7047. DOI: 10.1016/j.jpowsour.2010.08.092. |
| [30] | TOMASI J, MENNUCCI B, CAMM R. Quantum mechanical continuum salvation models[J]. Chemical Reviews, 2005, 105: 2999-3093. DOI: 10.1021/cr9904009. |
| [31] | WEINHOLD F. Natural bond orbitals and extensions of localized bonding concepts[J]. Chemistry Education Research and Practice, 2001, 2: 91-104. DOI: 10.1039/B1RP90011K. |
 2017, Vol. 34
2017, Vol. 34
