苯甲醇作为重要的有机工业原料,在染料、医药、食品、香料等方面有着广泛的应用. 其制备方法有甲苯氯化水解法、甲苯氧化法、苯甲酸甲酯还原法、苯甲醇氧化法等,甲苯氯化水解法存在不符合环境保护要求、产品含氯而不能用于食品等问题,甲苯氧化法的产率太低,苯甲酸甲酯还原法又成本较高,唯有苯甲醇液相氧化法有工艺操作简单、无毒不污染环境、产率高、产品容易提纯、催化剂与产品容易分离等优势,所以近年来苯甲醇的催化氧化成为学者们的研究热点[1].
苯甲醇的液相催化氧化关键在于催化剂的选择,目前,对贵金属的研究较多且比较成熟. 将贵金属Ru、Pd、Au、Ag等[2-5]负载在适当载体上,不但有较高的催化活性,而且克服了贵金属颗粒容易团聚的缺点. 但是贵金属价格都比较昂贵,资源短缺,很难大规模地应用与生产. 另外,过渡金属(Cu、Mn、Ni、Co等[6-11]金属)氧化物作为催化剂的研究也比较多,虽然该类催化剂的价格不高,但催化活性太低,若不进一步改性也无法应用在实际生产中. 将过渡金属改性的复合氧化物催化剂(Cu-Mn、Co-Mn、Ni-Mn等[12-14])在一定条件下可以达到贵金属催化剂的催化效果,而且制备方法简单,现在已成为催化领域研究的重点.
铜锰复合氧化物比单组分催化剂有更高的活性,将铜锰复合物应用在催化领域已经被广泛研究. 利用Cu和Mn氧化物之间很强的相互作用,将Cu-Mn复合氧化物用于低温选择性还原NOx [12],催化燃烧苯等VOCs[15],低温催化氧化CO[16-17],选择性氧化苯甲醇[18]的研究被大量报道. 实验证明铜锰复合氧化物是一种具有巨大潜力的非贵金属催化剂,在适当的改性条件下有望取代贵金属催化剂.
介孔材料作为一种新型纳米材料,已成为目前学术界研究的焦点之一. Tang W X等[19]人报道了以草酸路径合成介孔锰氧化物对VOC的催化氧化研究,取得了较好的消除VOC的催化剂的制备方法,施剑林团队[20]也曾研究了介孔材料在消除NO的应用. 由于其高比表面积,在室温条件下即能取得良好的催化效果. 其后来又发表了锰基双金属氧化物在消除NO的研究,但具有特殊结构的双金属氧化物在苯甲醇选择性氧化制苯甲醛的研究还比较少,尤其是制备一种高效的具有特殊性能的过渡双金属催化剂来催化氧化苯甲醇的研究值得关注.
本文采用共沉淀法快速合成Cu-Mn复合氧化物催化剂,以苯甲醇氧化反应为探针反应,在以甲苯为溶剂的条件下对其催化氧化苯甲醇的性能进行研究,考察了不同Cu复合量和不同催化剂量对催化性能的影响.
1 实验部分 1.1 实验材料四水合醋酸锰(Mn (CH3COO)2·4H2O, AR),一水合醋酸铜(Cu (CH3COO)2·H2O, AR),一水合草酸铵((NH4)2C2O4· H2O, AR). 所有试剂均没有进行额外的纯化处理.
1.2 催化剂的制备采用共沉淀法制备Cu-Mn-x催化剂,其中x表示Mn与Cu的比例,以Cu-Mn-2为例,催化剂的制备方法如下,以Mn (CH3COO)2为基准,准确称取4.901 6 g Mn (CH3COO)2·4H2O和1.996 5 g Cu (CH3COO)2·H2O于250 mL烧杯中并加入150 mL去离子水搅拌溶解(其中Cu2+与Mn2+物质的量比为1∶2),溶解充分后再将混合溶液转移至500 mL单口圆底烧瓶中,并将其加热到80 ℃[19]. 待温度稳定后向其中滴加配制好的0.1 mol/L的(NH4)2C2O4溶液并搅拌,采用恒速滴定管将滴速控制在1滴/s,待150 mL (NH4)2C2O4溶液滴定结束(保证C2O42-摩尔量与金属离子之和相等),继续保持反应3 h,然后停止加热继续搅拌过夜. 然后将反应液过滤洗涤,采用醇水交替各系3次. 最后置固体粉末于60 ℃烘箱内干燥12 h,置粉末于马弗炉内300 ℃下焙烧10 h,升温速度为1 ℃·min-1,得到黑色固体即为催化剂[21].
1.3 催化剂活性的测试将催化剂(500 mg),甲苯(20 mL)加入到50 mL三颈烧瓶中加热至102 ℃,同时剧烈搅拌,再将O2以40 mL/min的速度通入反应体系中,待温度和气流稳定后加入苯甲醇(520 μL)开始反应,并且开始计时,每隔10 min抽样1次. 然后用过滤器分离出溶液和固体催化剂,取溶液在带有FID检测器的安捷伦气相色谱仪上分析.
1.4 表征晶体结构采用日本的D/MAX-3A型X射线衍射仪测试,Cu Kα射线,管压40 kV,管流40 mA,扫描速率设为5°/min,扫描区间设为20°~80°. H2-TPR采用美国的AutoChem Ⅱ2920多用吸附仪分析,50 mg样品于U型石英管内,在350 ℃下用氩气预处理1 h后,冷却至50 ℃再通入5% H2-95% Ar的混合气吹扫一段时间后,设定升温速率为10 ℃/min,升温到600 ℃进行程序升温还原反应并记录谱图. N2-脱吸附等温曲线采用美国的GEMINI V2380型吸附仪测定,样品需先在200 ℃、氮气气氛下预处理3 h再进行测试;测试获得样品的孔径分布(BJH)与比表面积(BET)报告. 样品的EDS采用日本的JSM-6360LV型扫描电子显微镜分析,加速电压25.0 kV,测试样品的表面元素种类及其含量. 样品的表面形貌(SEM)表征采用日本的JSM-6360LV型扫描电子显微镜测试,工作电压为25.0 kV,样品的透射电镜(TEM)表征采用飞利浦TECNAI-10型透射电子显微镜测试,工作电压为100 kV. 先将样品制成丁醇悬浮溶液,再用超声波振荡分散,最后滴于铜网表面晾干后进行测试.
2 结果与讨论 2.1 XRD分析双金属草酸盐前驱体和双金属氧化物的XRD结果如图1,首先,由图1(a)双金属草酸盐的XRD表征结果可以看出3种不同比例的Cu、Mn草酸盐均表现为晶型较好的MnC2O4·2H2O单晶结构. 而由图1(b)金属氧化物的XRD表征图可知:当n(Cu)∶n(Mn)为1∶4时,其图谱特征峰表现为极弱的MnO2的衍射峰(JCPDS 42-1316),可视为无定型结构,未发现Cu0.451Mn0.549O2的特征峰,这可能是Cu0.451Mn0.549O2物种高度分散在MnO2的有序结构内或铜组分含量太少导致Cu0.451Mn0.549O2过少以致未检测出其特征峰;当n(Cu)∶n(Mn)为1∶2时,样品开始出现Cu0.451Mn0.549O2的衍射峰(JCPDS 41-0184);随着Cu掺入量的增加,Cu0.451Mn0.549O2的特征峰逐渐变强,说明Cu0.451Mn0.549O2晶粒的增长.
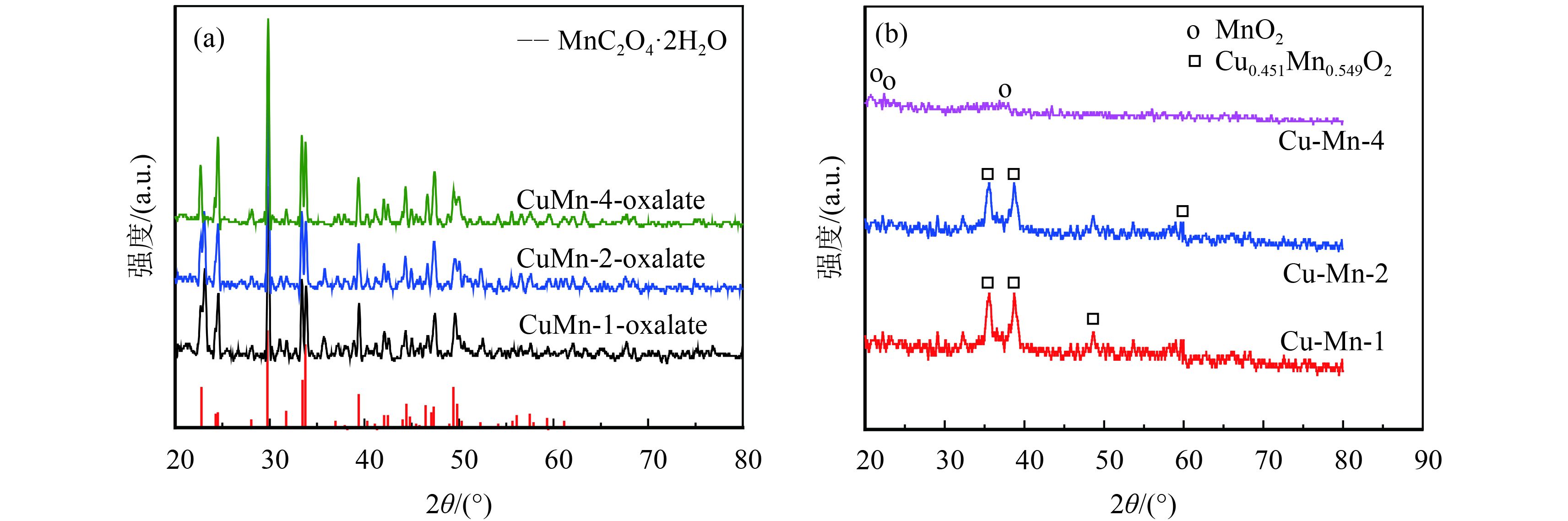
|
图 1 XRD分析 Figure 1 XRD analysis |
H2-TPR表征结果如图2显示,从图中可得出,当n(Cu)∶n(Mn)为1∶4时,只有一个很大的耗氢峰,其还原温度为218 ℃左右,该耗氢峰可归属为Mn4+的还原过程(Mn4+→Mn3+→Mn2+);而Cu的耗氢非常不明显. 随着Cu含量的增加,谱图上出现了两种耗氢峰Ⅰ和耗氢峰Ⅱ,当n(Cu)∶n(Mn)为1∶2时,耗氢峰Ⅰ的还原温度约为191 ℃,归属为Cu2+的还原过程,耗氢峰Ⅱ的还原温度为229 ℃,归属为Mn4+还原为低价态的锰,当n(Cu)∶n(Mn)为1∶1时,耗氢峰Ⅰ的还原温度约为182 ℃,归属为Cu2+的还原过程,耗氢峰Ⅱ的还原温度为211 ℃,归属为Mn4+还原为低价态的锰,可以很清楚看出随着Cu含量的增加,耗氢峰整体向低温转移,这是因为Cu对锰离子的还原有促进作用[22]. 也可能是Cu的加入调整了晶格氧参数,改变了Mn-O键的大小,使得Mn4+更容易被还原. 其中Cu-Mn-1和Cu-Mn-2耗氢峰的还原温度明显降低,这可能是Cu0.451Mn0.549O2的还原峰;这与XRD的表征结果是一致的.
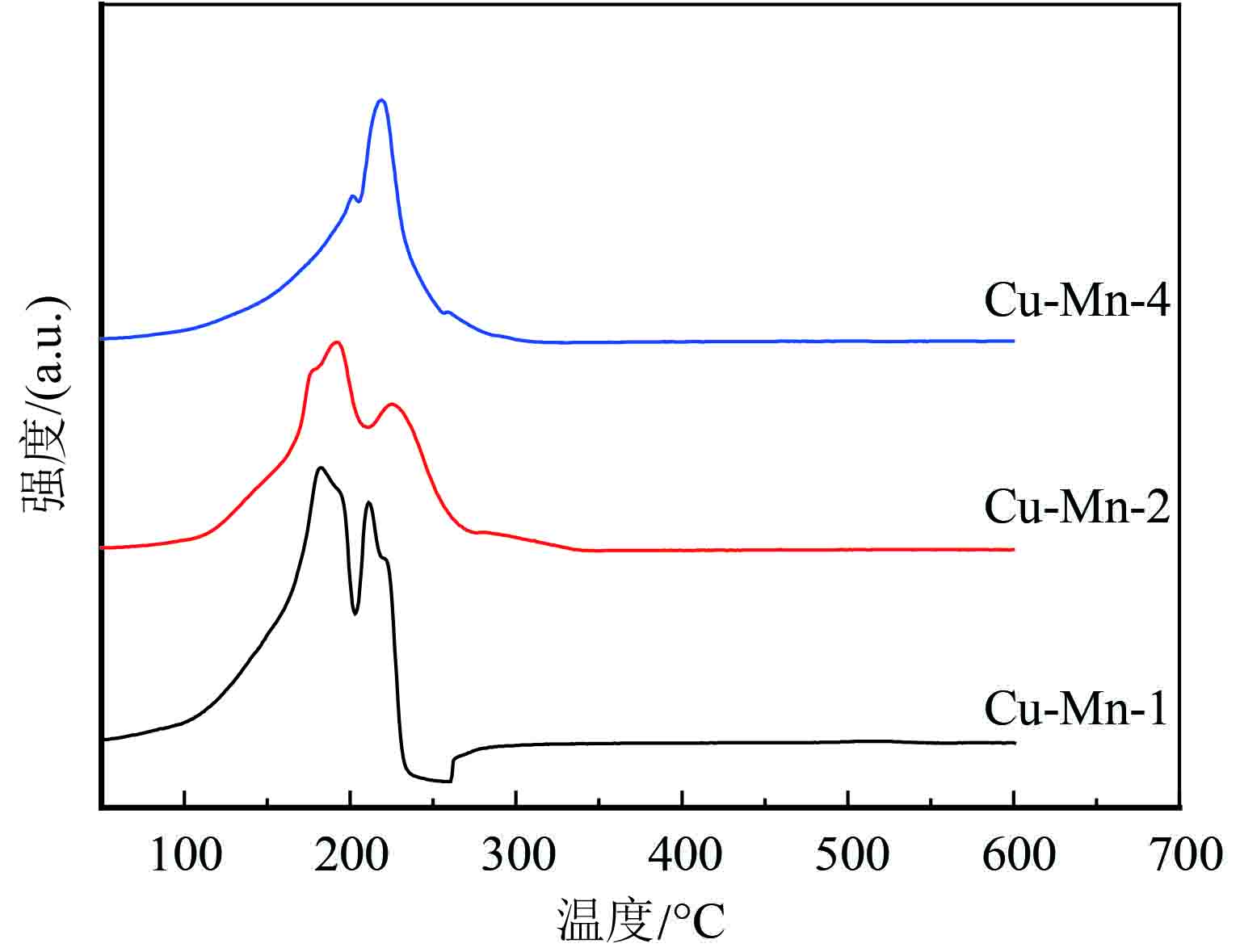
|
图 2 300 ℃焙烧的Cu-Mn-x复合氧化物的H2-TPR谱图 Figure 2 H2-TPR profiles of Cu-Mn-x complex oxides calcined at 300 ℃ |
氮气等温吸附–脱附表征分析如图3,从图3(a)中可看出,Cu-Mn-x复合物的N2-脱吸附曲线具有典型的H3回滞环特征,属于介孔材料,而且介孔尺寸比较均匀. 再由图3(b),300 ℃焙烧条件下的Cu-Mn-x复合氧化物的孔径分布谱图,可以看出Cu-Mn-x复合物的孔径多分布在20 nm以下,Cu-Mn-1和Cu-Mn-2表现较为突出. 结合表1数据分析可知,Cu-Mn-2催化剂的比表面积最大,在228.8 m2/g左右,平均孔径尺寸最小约为6.3 nm. Cu-Mn-1和Cu-Mn-4的比表面积略低于Cu-Mn-2,但是都体现出了介孔材料的性质,均具有比较大的比表面积. 将3种不同比例的催化剂进行对比,Cu-Mn-2双金属氧化物应该会有最好的催化活性,无论从孔径还是比表面积分析都具有优势.
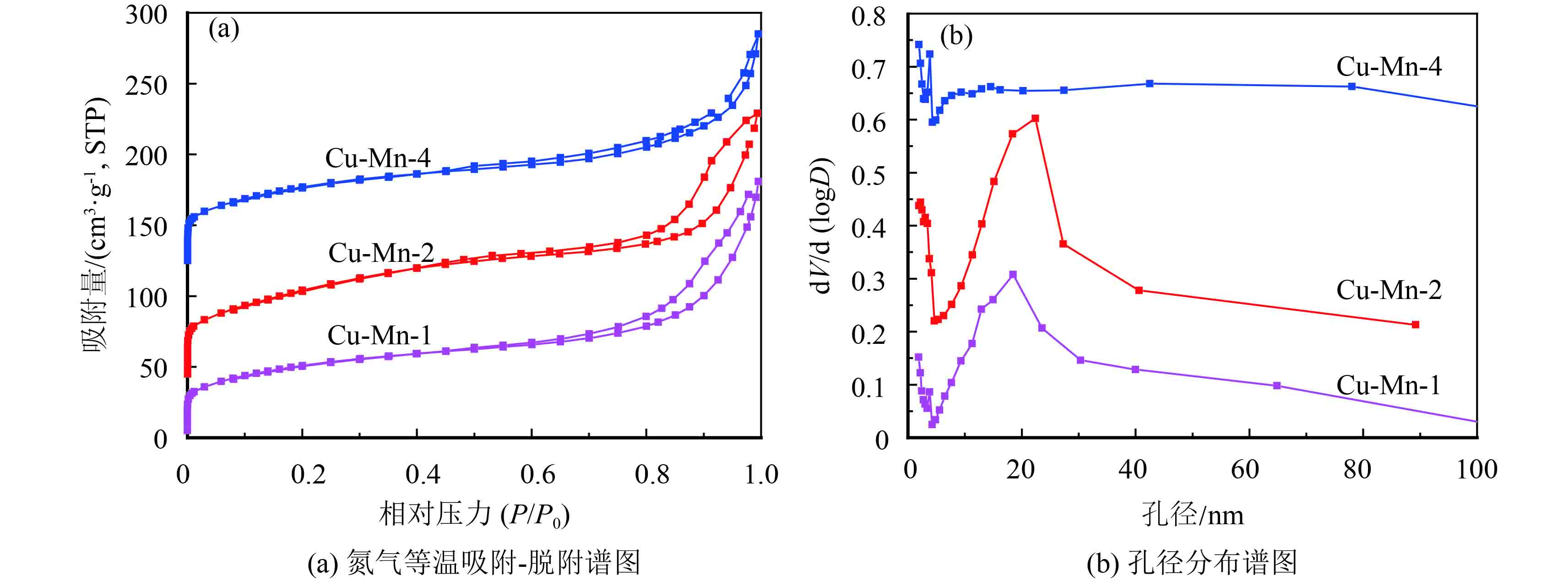
|
图 3 Cu-Mn-x复合氧化物的氮气等温吸附-脱附谱图和孔径分布谱图 Figure 3 N2 isothermal adsorption-desorption and BJH profiles of Cu-Mn-x complex oxides |
| 表 1 催化剂的BET,BJH分析结果 Table 1 BET, BJH analysis results of catalysts |
表2为催化剂的EDS分析结果,从图表可以进一步分析催化剂表面的物质构成. Cu-Mn复合氧化物是由Mn、Cu、O 3种元素组成的,结合XRD图可知,Cu并没有单独的氧化物晶相,说明Cu是化学掺入到锰氧化物之中. 随着Cu掺入量的增加,Cu-Mn复合氧化物中Cu组分的含量提高,而Mn的含量逐渐降低,这与前面XRD分析中Cu含量越高Cu0.451Mn0.549O2晶型越明显结果一致.
| 表 2 催化剂的EDS分析结果 Table 2 EDS analysis results of catalysts |
图4 为Cu-Mn-2复合氧化物的SEM图与TEM图,从SEM图中可看出,采用共沉淀法合成的Cu-Mn-2复合氧化物并没有明显的表面规整结构,但从其TEM图中可以看出其为孔状结构,其孔径在3~5 nm左右,再结合SEM、TEM图可以预测该催化剂为面包状的疏松多孔结构. 这也恰恰验证了它的高比表面积,与N2-脱吸附分析结果一致.

|
图 4 Cu-Mn-2复合氧化物的SEM图和TEM图 Figure 4 SEM and TEM images of Cu-Mn-2 complex oxide |
Cu-Mn-x复合氧化物催化剂在苯甲醇氧化反应中的催化性能如图5所示.
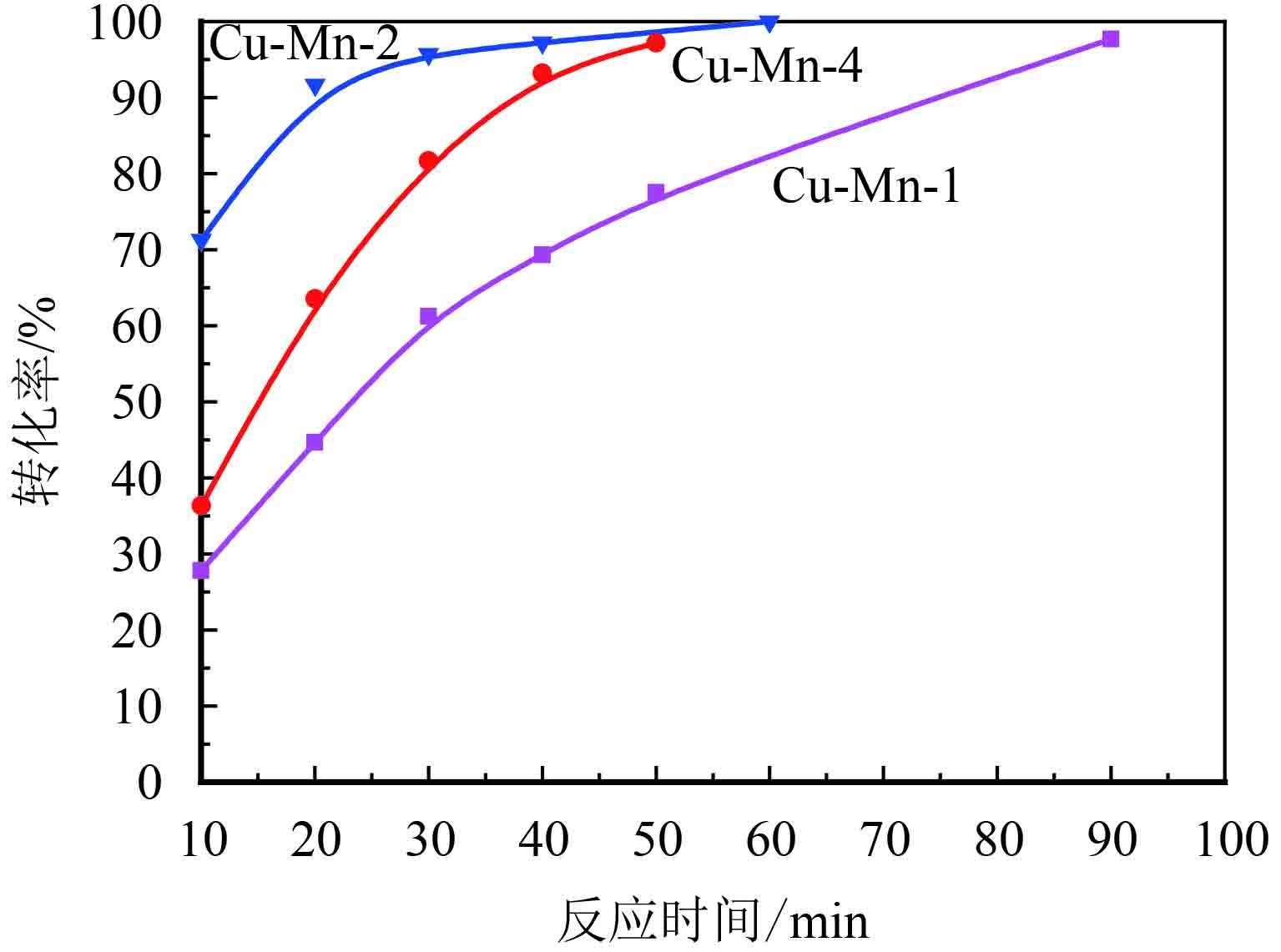
|
图 5 Cu-Mn-x复合氧化物上苯甲醇氧化反应结果比较 Figure 5 Oxidation of benzyl alcohol over Cu-Mn-x complex oxides |
由图5可知:3种催化剂都有比较高的催化活性,均在100 min之内可以完成苯甲醇的全部转化,其中Cu-Mn-2的催化效果最好. 结合表3可知,3种催化剂对苯甲醛的选择性也非常高,苯甲醇转化率最高时苯甲醛的选择性均在97%以上,其中Cu-Mn-2在选择性和转化率上面均比Cu-Mn-1 和Cu-Mn-4高,Cu-Mn-2仅需21 min就可以使得苯甲醛收率达到90%,且选择性能够达到98%以上,这与BET、BJH、H2-TPR测试结果是一致的. 同时这也说明了控制Cu的掺入比例可以有效地提高锰氧化物的催化活性.
| 表 3 300 ℃焙烧的Cu-Mn-x复合氧化物上苯甲醇氧化反应结果比较 Table 3 Oxidation of benzyl alcohol over Cu-Mn-x complex oxides calcined at 300 ℃ |
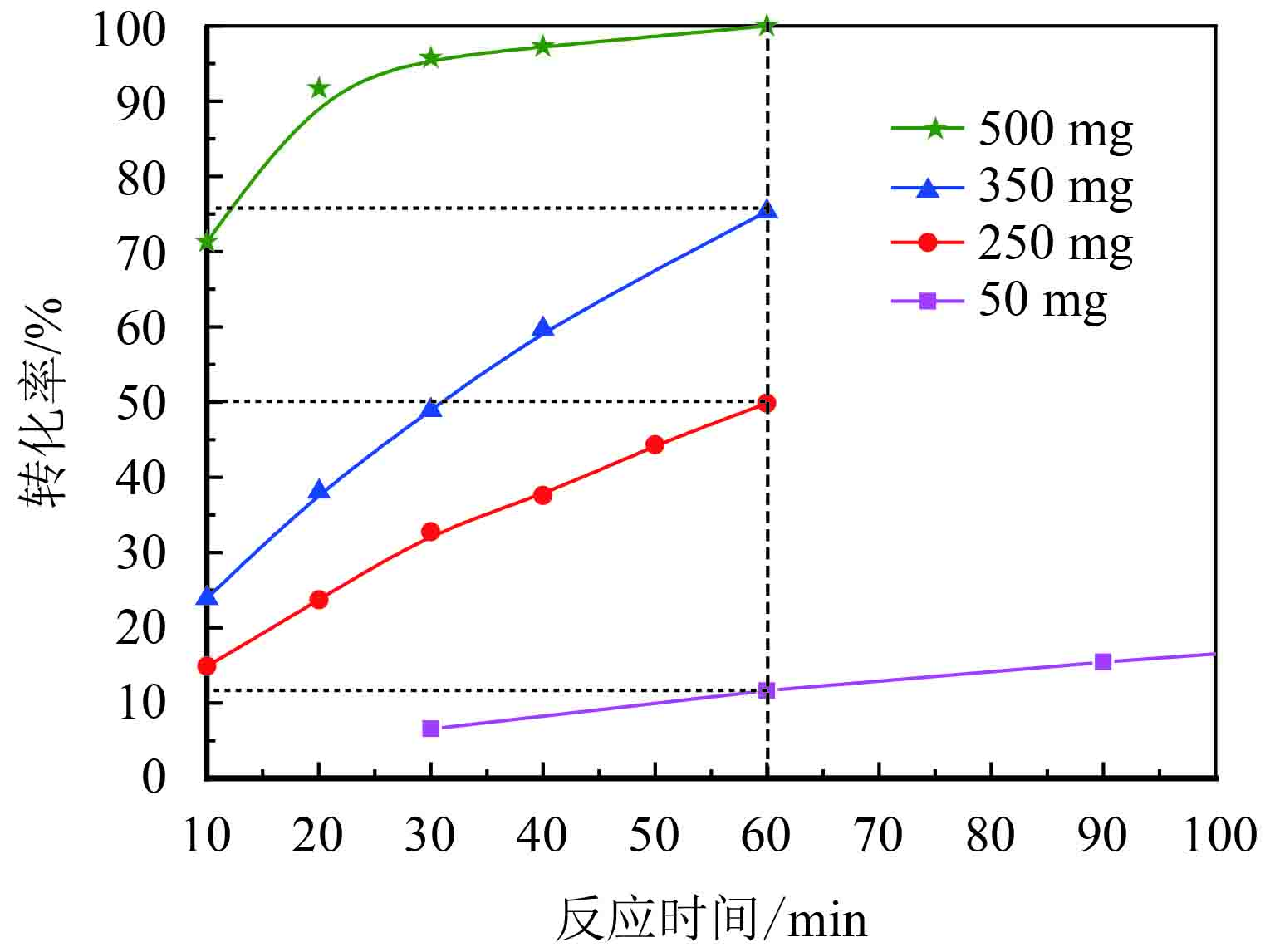
|
图 6 不同量Cu-Mn-2复合氧化物的催化结果比较 Figure 6 Oxidation of benzyl alcohol over different content of Cu-Mn-2 complex oxides |
由图6和表4可知:Cu-Mn-2催化剂的催化效果与催化剂的含量有很大的关系,当催化剂的含量为50 mg时,反应60 min苯甲醇的转化率仅12%,当催化剂的含量增加到500 mg时,反应60 min苯甲醇的转化率上升到100%. 而选择性与催化剂的含量关系不大,均可以达到96%以上. 这可能与介孔催化剂表面活性位点有关,随着催化剂含量的增加,活性位点增加,催化效果即增加. 也可能是催化剂的介孔结构为反应的氧化剂(O2)提供了着陆点,使得氧化反应能够快速高效地进行.
| 表 4 不同量Cu-Mn-2复合氧化物的催化结果比较 Table 4 Oxidation of benzyl alcohol over different content of Cu-Mn-2 complex |
采用共沉淀法将Cu2+和Mn2+在C2O42-的作用下合成了具有单一晶相的草酸盐前驱体,再通过可控的程序升温将前驱体煅烧分解便获得了具有介孔结构的双金属氧化物,调整Cu2+ 和Mn2+的相对含量可合成不同的催化剂(Cu-Mn-x).
表征证明该催化剂是含有介孔结构的高比表面积催化剂. 再通过其对苯甲醇催化氧化的测试分析得出:Cu2+和Mn2+的摩尔比为1∶2时催化活性最高,证明了Cu的掺入能够提高了锰氧化物的催化活性,但必须有一定的比例控制. 另外,催化剂的含量与该催化反应的效果有很大关系,可能与催化活性位数量有关,也可能是催化剂的介孔结构为反应提供了场所,也为氧气分子提供了着陆点的缘故,所以才造成催化剂的含量越高催化效果变化越显著.
| [1] |
张昕, 吴伟伟. 苯甲醇液相氧化制苯甲醛催化剂的研究进展[J].
石油化工, 2010, 02: 215-223.
W ZHANGX, Q WUW. Advance in catalysts for green liquid-phase oxidation of benzyl alcohol to benzaldehyde[J]. Electrochemical Technology, 2010, 02: 215-223. |
| [2] | KÖCKRITZA. Ru-catalyzed oxidation of primary alcohol[J]. J Mol Catal A: Chem, 2006, 246(1~2): 85-99. |
| [3] | L STUCHINSKAYAT, V KOZHEVNIKOVI. Liquid-phase oxidation of alcohols with oxygen catalysed by modified palladium (Ⅱ) oxide[J]. Catal Commum, 2003, 4(8): 417-422. DOI: 10.1016/S1566-7367(03)00096-7. |
| [4] | Z SUF, C CHENM. Aerobic oxidation of alcohols catalyzed by gold nanoparticles supported on gallia[J]. Polymorphs Catal Commum, 2008, 9(6): 1027-1032. DOI: 10.1016/j.catcom.2007.10.010. |
| [5] | J BEIERM, W HANSENT, D GRUNWALDTJ. Selective liquid-phase oxidation of alcohols catalyzed by a silver-based catalyst promoted by the presence of ceria[J]. Journal of Catalysis, 2009, 266(2): 320-330. DOI: 10.1016/j.jcat.2009.06.022. |
| [6] | J MENGX, F LINK, Y YANGX. Catalytic oxidation of olefins and alcohols by molecular oxygen under air pressure over Cu2(OH)PO4 and Cu4O(PO4)2 catalysts [J]. J Catal, 2003, 218(2): 460-464. DOI: 10.1016/S0021-9517(03)00079-4. |
| [7] | R CHOUDHARYV, K DUMBRED, S UPHADEB. Solvent-free oxidation of benzyl alcohol to benzaldehyde by tert-butyl hydroper oxide using transition metal containing layered double hydroxides and/or mixed hydroxides[J]. J Mol Catal A: Chem, 2004, 215(1-2): 129-135. DOI: 10.1016/j.molcata.2004.01.009. |
| [8] | Q HUJ, P SUNK. Amorphous manganese oxide for catalytic selective oxidation of benzyl alcohol[J]. Chinese Journal of Catalysis, 2007, 28(12): 1025-1027. DOI: 10.1016/S1872-2067(08)60001-7. |
| [9] | H TANGQ, N HUANGX, M WUC. Structure and catalytic properties of K-doped manganese oxide supported on alumina[J]. J Mol Catal A: Chem, 2009, 306(1-2): 48-53. DOI: 10.1016/j.molcata.2009.02.020. |
| [10] | F SHENY, L SUIBS, L O’YONGC. Cu containing octahedral molecular sieves and octahedral layered materials[J]. J Catal, 1996, 161(1): 115-122. DOI: 10.1006/jcat.1996.0168. |
| [11] |
符志伟. 二氧化锰制备及催化燃烧甲苯性能研究[J].
广东工业大学学报, 2016, 33(02): 85-90.
W FUZ. The preparation of MnO2 and application in catalytic combustion of toluene [J]. Journal of Guangdong University of Technology, 2016, 33(02): 85-90. |
| [12] | L FANGD. Effect of CuMn2O4 spinel in Cu-Mn oxide catalysts on selective catalytic reduction of NOx with NH3 at low temperature [J]. RSC Adv, 2014, 4(49): 25540-25551. DOI: 10.1039/c4ra02824d. |
| [13] | X TANGW, F WUX, D LIS. Porous Mn-Co mixed oxide nanorod as a novel catalyst with enhanced catalytic activity for removal of VOCs[J]. Catalysis Communications, 2014, 56(56): 134-138. |
| [14] | N LIG, J LIL. One-pot pyrolytic synthesis of mesoporous MCo2O4(4.5)(M=Mn, Ni, Fe, Cu) spinels and its high efficient catalytic properties for CO oxidation at low temperature [J]. Journal of Molecular Catalysis A-Chemical, 2014, 390(8): 97-104. |
| [15] | X TANGW, F WUX, D LIS. Co-nanocasting synthesis of mesoporous Cu-Mn composite oxides and their promoted catalytic activities for gaseous benzene removal[J]. Applied Catalysis B-Environmental, 2015, 162: 110-121. DOI: 10.1016/j.apcatb.2014.06.030. |
| [16] | S LIUX, N JINZ, Q LUJ. Highly active CuO/OMS-2 catalysts for low-temperature CO oxidation[J]. Chemical Engineering Journal, 2010, 162(1): 151-157. DOI: 10.1016/j.cej.2010.05.015. |
| [17] | KRÄMERM. Structural and catalytic aspects of sol-gel derived copper manganese oxides as low-temperature CO oxidation catalyst[J]. Applied Catalysis A: General, 2006, 302(2): 257-263. DOI: 10.1016/j.apcata.2006.01.018. |
| [18] | H TANGQ, N GONGX, Z ZHAOP. Copper-manganese oxide catalysts supported on alumina: Physicochemical features and catalytic performances in the aerobic oxidation of benzyl alcohol[J]. Applied Catalysis A-General, 2010, 389(1-2): 101-107. DOI: 10.1016/j.apcata.2010.09.014. |
| [19] | X TANGW, F WUX, F CHENY. Oxalate route for promoting activity of manganese oxide catalysts in total VOCs’ oxidation: effect of calcination temperature and preparation method[J]. Mater Chem A, 2014, 2(8): 2544-2554. DOI: 10.1039/c3ta13847j. |
| [20] | M SHUZ, L HUANGW. Template-free synthesis of mesoporous X-Mn (X = Co, Ni, Zn) bimetal oxides and catalytic application in the room temperature removal of low-concentration NO[J]. Mater Chem A, 2013, 1(35): 10218-10227. DOI: 10.1039/c3ta10971b. |
| [21] | R ALIR, A SIDDIQUIM. Selective oxidation of benzyl alcohol with molecular oxygen over copper-manganese oxide catalyst[J]. Oxidation Communications, 2011, 34(4): 778-787. |
| [22] | PAPAVASILIOUJ. Combined steam reforming of methanol over Cu-Mn spinel oxide catalysts[J]. Journal of Catalysis, 2007, 251(1): 7-20. DOI: 10.1016/j.jcat.2007.07.025. |
 2017, Vol. 34
2017, Vol. 34