蛋白酶是水解蛋白质肽键的一类酶的总称[1-2],广泛应用于食品、纺织、医药、有机合成、洗涤剂及制革脱毛等领域,其份额占整个酶制剂市场的一半以上[3-6]. 蛋白酶可以从动植物中提取(如木瓜蛋白酶、菠萝蛋白酶、胰蛋白酶和胃蛋白酶等),也可以通过微生物发酵工艺进行生产[7-9],如固态发酵法[10-11]和液态发酵法[12-13]. 微生物发酵制备蛋白酶主要来源于细菌、真菌和酵母[14]. 目前生产蛋白酶制剂主要利用曲霉、芽孢杆菌等微生物发酵[15-19],本文用黑曲霉液体发酵法制备蛋白酶,对其培养基的配方和培养条件进行研究,为黑曲霉液体发酵生产蛋白酶提供理论依据.
1 材料与方法 1.1 材料与仪器黑曲霉(ATCC 16404)由广东工业大学微生物实验室提供.
种子培养基:马铃薯培养基,马铃薯购于广州大学城南亭市场.
发酵培养基:麸皮、豆粕粉、玉米粉.
酪氨酸(分析纯),天津市进丰化工有限公司;干酪素,天津市进丰化工有限公司;所用其他试剂均为分析纯.
722型可见分光光度计,上海舜予恒平科学仪器有限公司;KDC-4低速离心机,科大创新股份有限公司中佳分公司;YX-280手提式压力蒸汽灭菌器,合肥华泰医疗设备有限公司;DHP-9012电热恒温培养箱,上海一恒科学仪器有限公司.
1.2 黑曲霉初始发酵条件取3个250 mL三角瓶中,各加入硫酸铵4 g,磷酸氢二钾0.3 g,氯化钙0.5 g,纯水100 mL,做X、Y、Z3组实验.X组w(玉米粉)∶w(豆粕粉)=1∶4;Y组w(玉米粉)∶w(豆粕粉)=2∶5;Z组w(麸皮)∶w(豆粕粉)=4∶1,高压灭菌20 min后冷却至35 ℃,接种(5环/100 g),于35±1 ℃、180 r/min的转速培养72 h,测定液体培养基的吸光值.
1.3 黑曲霉液体发酵生产蛋白酶的培养条件优化通过单因素实验,分别考察基础培养基种类、基础培养基含量、pH、加水量、接种量、温度、培养时间对蛋白酶的影响. 在单因素实验基础上,采用正交实验对条件优化,以蛋白酶活力作为评价指标,确定液体发酵的最佳条件.
1.3.1 pH对黑曲霉发酵蛋白酶活力的影响设定基础培养基为4 g麸皮和1 g豆粕粉、加水量为100 mL、接种量为6环、培养温度为45 ℃、培养时间为120 h,分别控制pH为5、6、7、8、9,探究pH对黑曲霉发酵蛋白酶活力的影响.
1.3.2 加水量对黑曲霉发酵蛋白酶活力的影响设定基础培养基为4 g麸皮和1 g豆粕粉、pH 7、接种量为6环、培养温度为45 ℃、培养时间为120 h,分别控制加水量为50、75、100、125、150 mL,探究加水量对黑曲霉发酵蛋白酶活力的影响.
1.3.3 接种量对黑曲霉发酵蛋白酶活力的影响设定基础培养基为4 g麸皮和1 g豆粕粉、pH为7、加水量为100 mL、培养温度为45 ℃、培养时间为120 h,分别控制接种量为2、4、6、8、10环,探究接种量对黑曲霉发酵蛋白酶活力的影响.
1.3.4 培养温度对黑曲霉发酵蛋白酶活力的影响设定基础培养基为4 g麸皮和1 g豆粕粉、pH为7、加水量为100 mL、接种量为6环、培养时间为120 h,分别控制培养温度为30、35、40、45、50 ℃,探究培养温度对黑曲霉发酵蛋白酶活力的影响.
1.3.5 培养时间对黑曲霉发酵蛋白酶活力的影响设定基础培养基为4 g麸皮和1 g豆粕粉、pH为7、加水量为100 mL、接种量为6环、培养温度为45 ℃,分别控制培养时间为72、96、120、144、168 h,探究培养时间对黑曲霉发酵蛋白酶活力的影响.
1.4 蛋白酶活力测定方法根据单因素实验结果,考虑到各个因素之间的相互作用,对黑曲霉液体发酵法制备蛋白酶的各因素进行正交试验. 因素水平表见表1.
| 表 1 正交试验因素水平表 Table 1 Factors and levels of orthogonal test |
参照GB/T 23527-2009蛋白酶制剂[20]测定.
1.4.1 酪氨酸标准曲线的绘制配制质量浓度为0、20、40、60、80、100 μg/mL的酪氨酸溶液,分别吸取不同浓度酪氨酸1 mL,各加入0.4 mol/L碳酸钠5 mL,再各加入已稀释的福林试剂1 mL. 摇匀置于水浴锅中. 40 ℃保温发色20 min后用分光光度计进行测定吸光值 (波长660 nm). 测3次,取平均值. 结果如图1所示.
1.4.2 样品处理取
在40℃下每分钟水解酪蛋白产生1 μg酪氨酸,定义为1个蛋白酶活力单位.
| $\text{样品蛋白酶活力单位}= \frac{{ 4 \times CN}}{{10}},\text{单位为U/mL}.$ |
式中:C为样品稀释后酪氨酸浓度,μg/mL;4为4 mL反应液取出1 mL测定(即4倍);N为酶液稀释的倍数;10为反应10 min.
在酪氨酸质量浓度为1~100 μg/mL范围内测定其吸光值. 结果表明其线性关系良好,得到回归方程y=0.006 3x+0.006 7,R2=0.996.
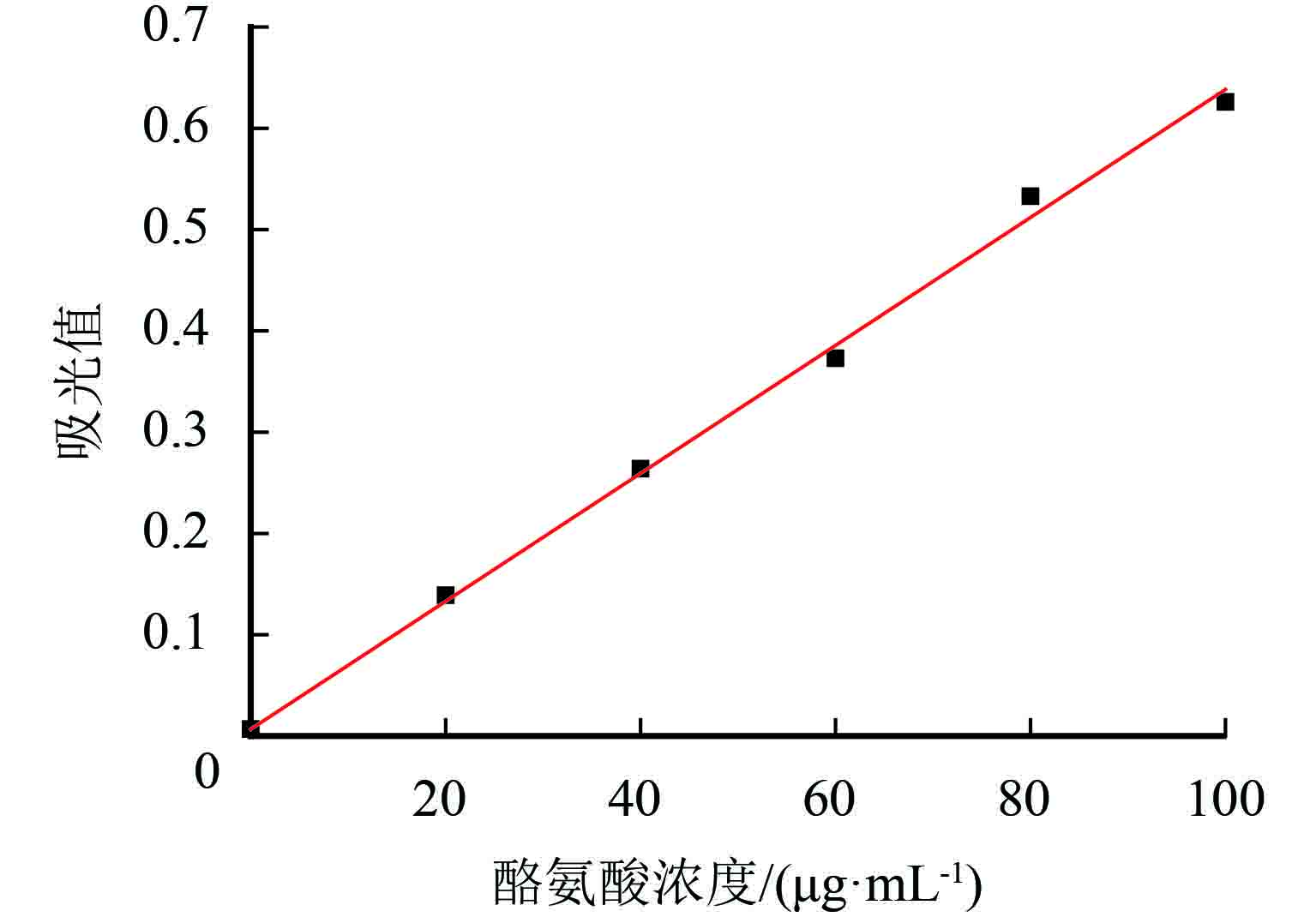
|
图 1 酪氨酸标准曲线 Figure 1 Standard curve of tyrosine |
从图2(a) 可以看出,在无机盐与水含量相同的情况下,添加麸皮与豆粕粉为基础物质的培养基里黑曲霉所产蛋白酶的活力远大于以玉米粉和豆粕粉为基础物质的培养基,这说明了麸皮与豆粕粉更适合黑曲霉产蛋白酶,而玉米粉与豆粕粉的组合并不能很好诱导黑曲霉产蛋白酶,选取麸皮与豆粕粉作为培养基的基础成分,两者不是越多越好,而是要比例协调才利于黑曲霉的生长与产酶,麸皮的比例过高可能导致培养基黏度很高不利于氧气的溶解,导致黑曲霉不能很好地生长,豆粕粉比例过高导致氮源营养过剩,不利于菌体产蛋白酶. 当麸皮与豆粕粉比例为4∶1时所产酶的活力最高(图2(b)). 黑曲霉液体发酵法制备蛋白酶的最佳基础培养基为麸皮4 g,豆粕粉1 g,硫酸铵4 g,磷酸氢二钾0.3 g,氯化钙0.5 g. 在接下来的试验中,都是在最佳基础培养基的条件下,探讨其他环境条件对酶活力的影响.
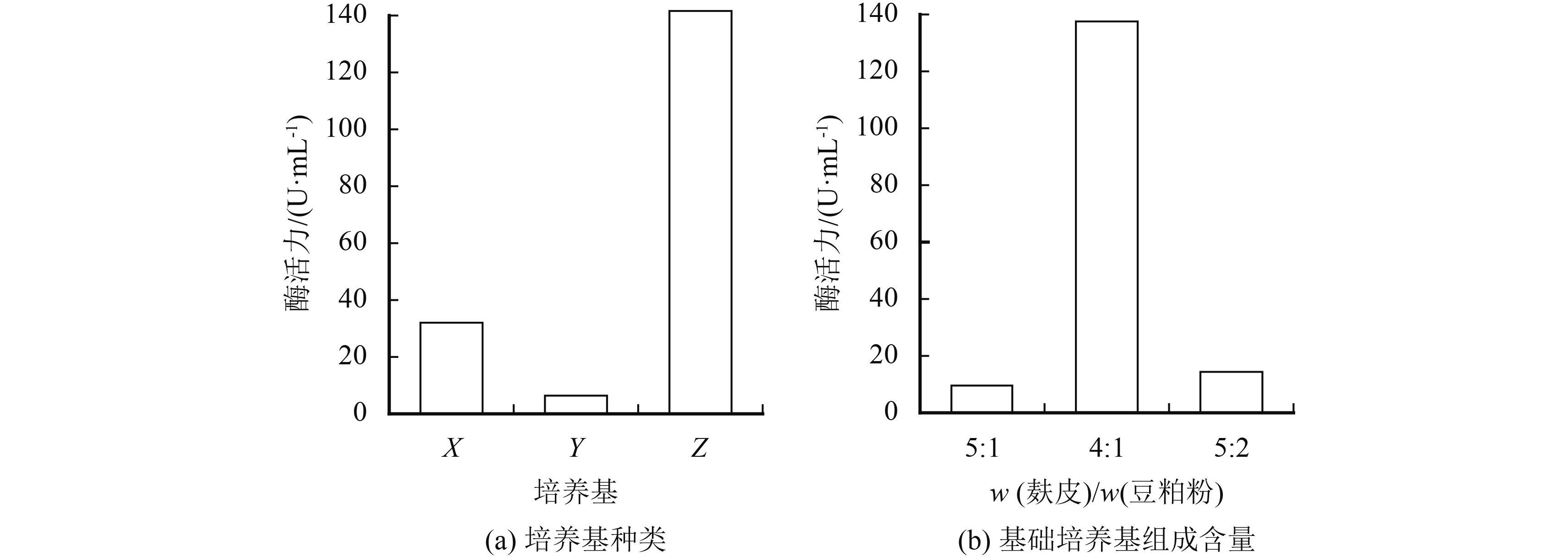
|
图 2 不同基础培养基对酶活力的影响 Figure 2 Influence of enzyme activity by (a) different basal culture medium and (b) the ratio between bran and soybean powder |
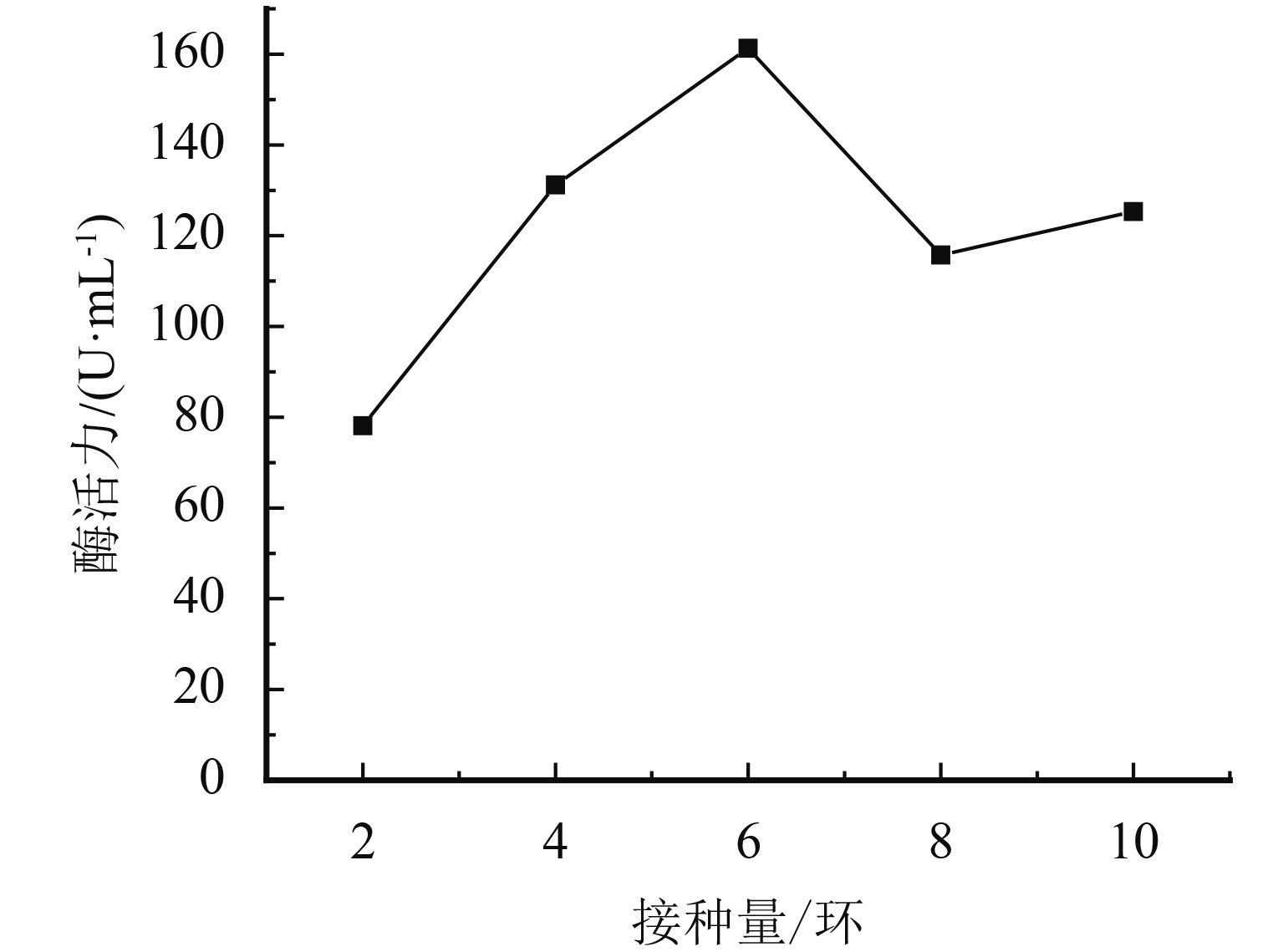
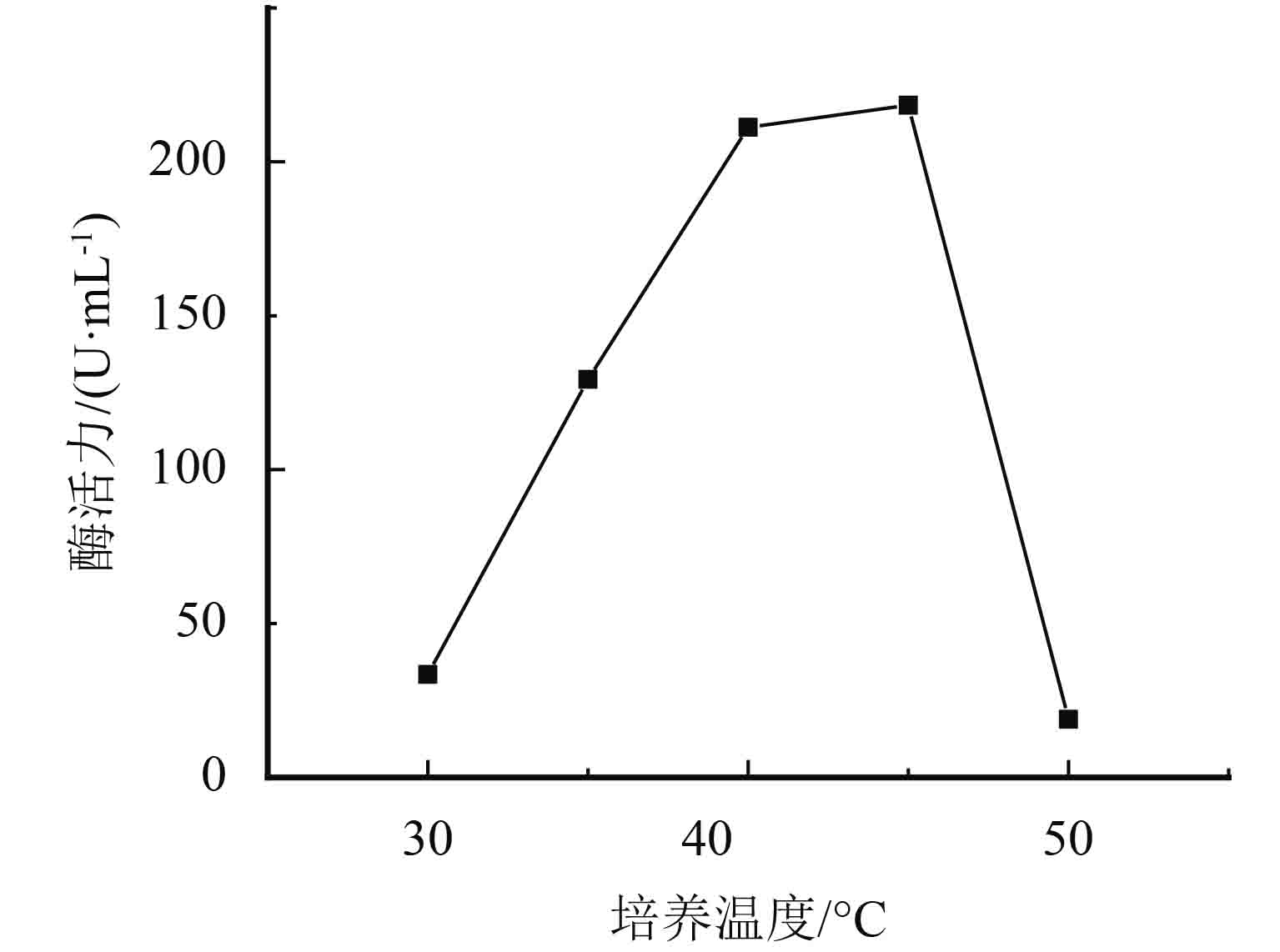
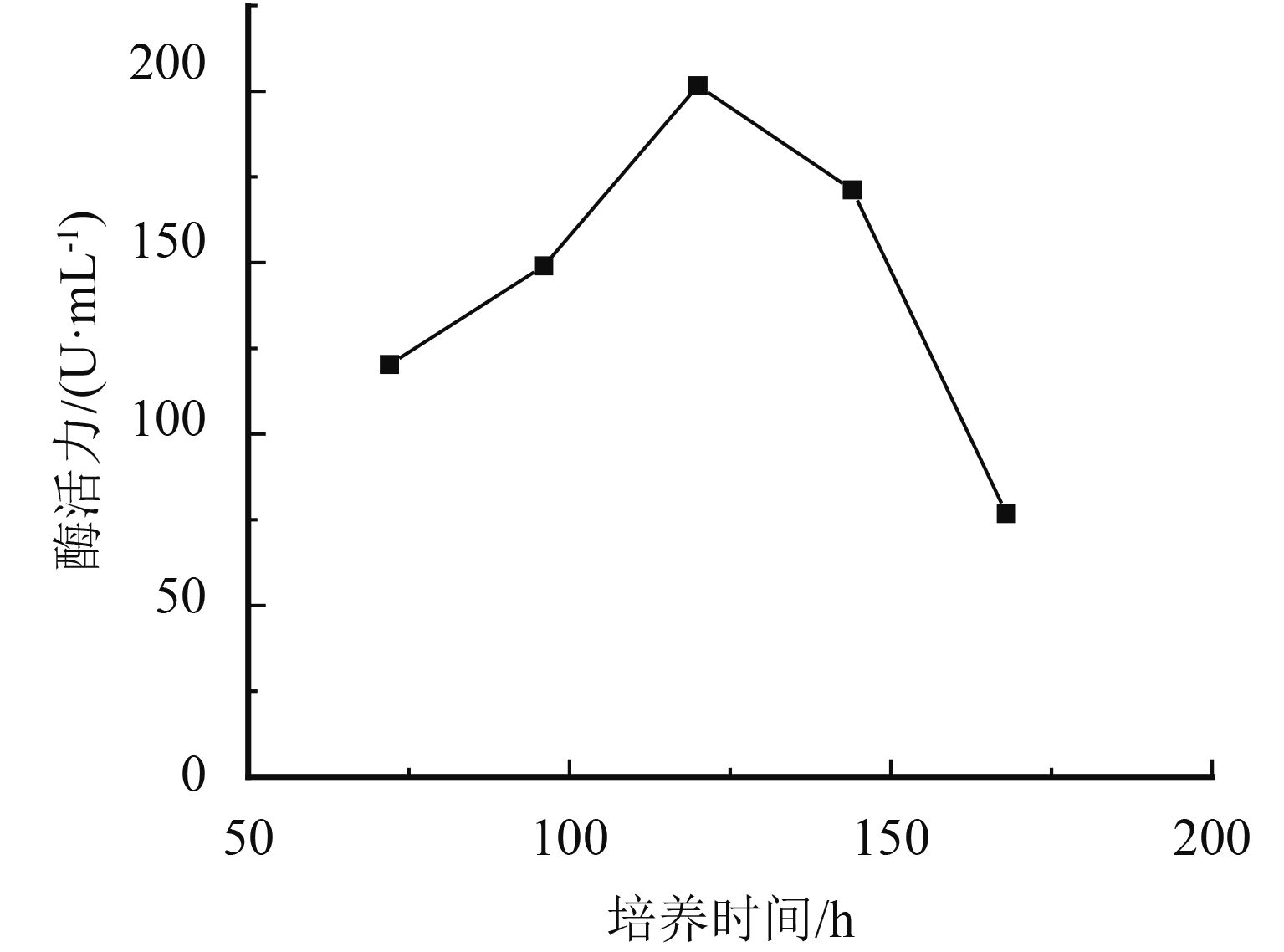
采用单因素实验对黑曲霉发酵条件进行优化,结果如图3~图7所示. pH为7时蛋白酶产量最高,这与黑曲霉和蛋白酶的最适生长环境相关. 培养液中加水量会直接影响培养基中各营养物质的浓度及比例,菌株的产酶能力随之增加,当液体培养基加水量为100 mL时达到最佳状态. 菌株在接种量低于6环时发酵不稳定,增加接种量有利于黑曲霉产蛋白酶,当接种量增加至6环,发酵液的蛋白酶活性最高,随着接种量继续增加,培养液与菌株的比例失衡,产酶能力随之降低. 适于菌株产蛋白酶的温度是40~45 ℃之间,符合菌株的生长温度,最适温度为45 ℃. 温度过低不利于菌株的生长繁殖,温度过高容易使产生的酶失活. 最适发酵培养时间则为120 h,延长发酵培养时间到180 h产酶活性显著降低. 通过单因素考察,确定发酵条件为:pH为7,加水量为100 mL,接种量为6环,培养温度为45 ℃,培养时间为120 h.
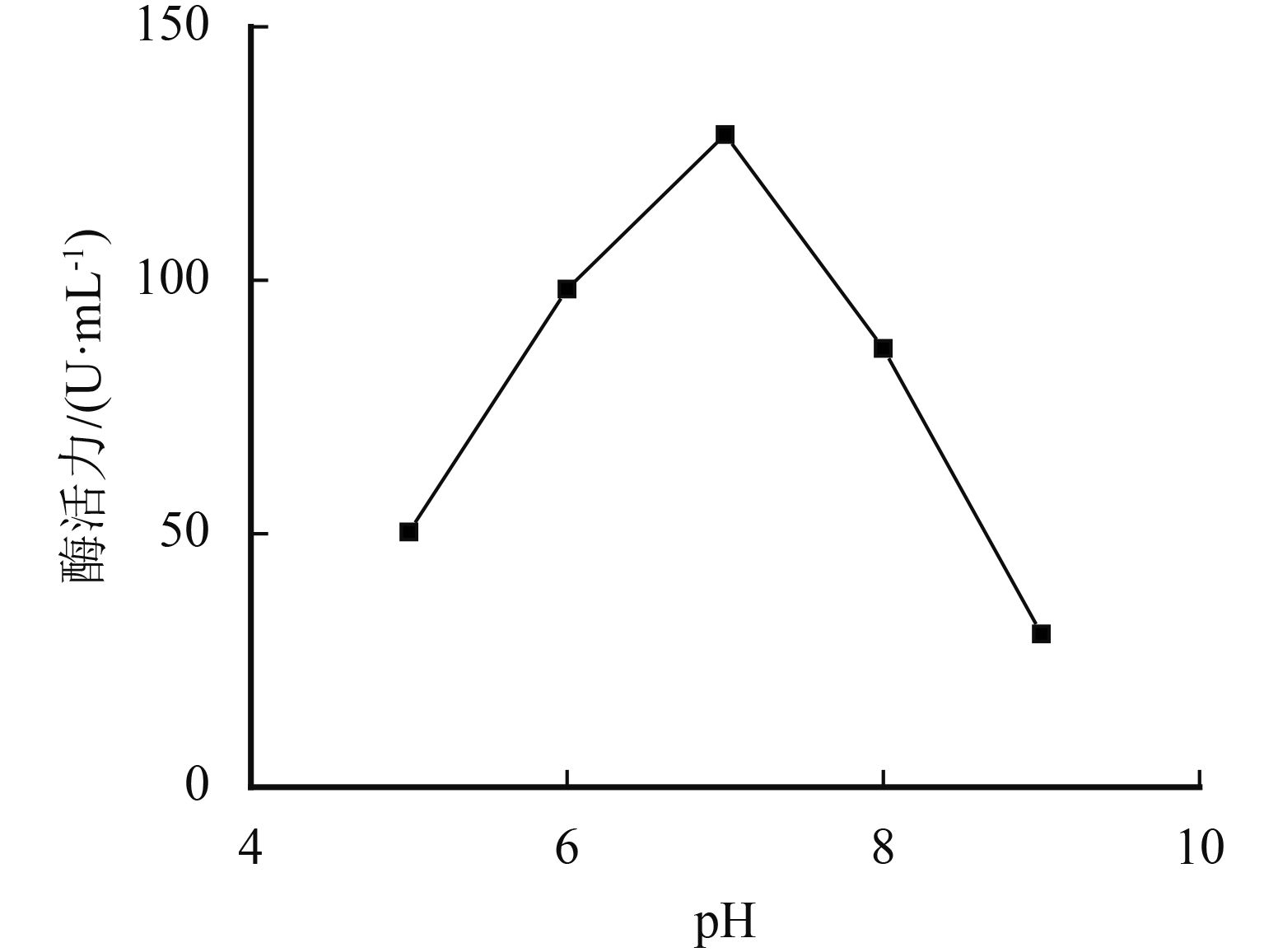
|
图 3 pH对酶活力的影响 Figure 3 Influence of pH on enzyme activity |
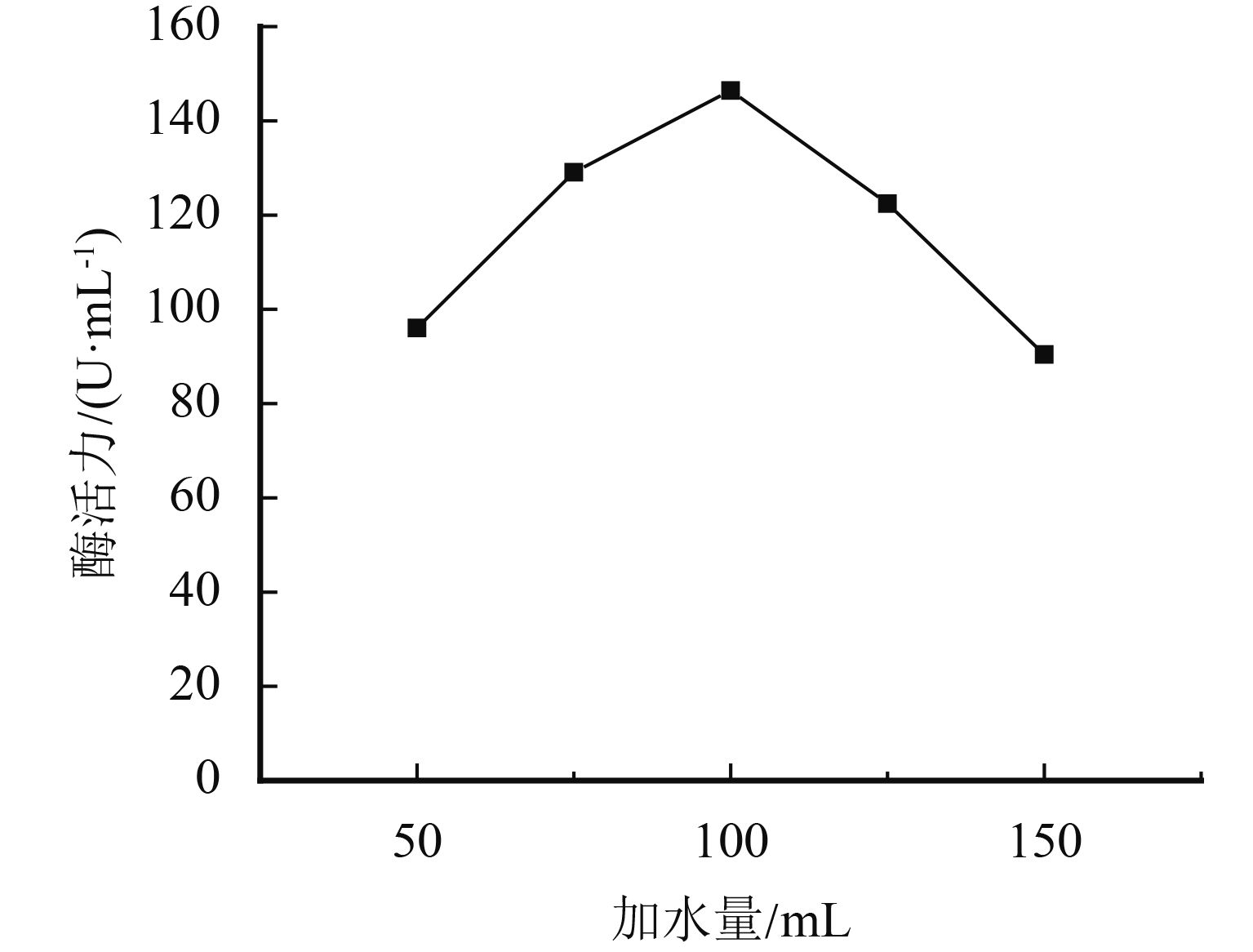
|
图 4 加水量对酶活力的影响 Figure 4 Influence of water addition on enzyme activity |
|
图 5 接种量对酶活力的影响 Figure 5 Influence of inoculums dosage on enzyme activity |
|
图 6 培养温度对酶活力的影响 Figure 6 Influence of cultivation temperature on enzyme |
|
图 7 培养时间对酶活力的影响 Figure 7 Influence of cultivation time on enzyme activity |
黑曲霉液体发酵法制备蛋白酶的正交试验结果如表2所示. 由表2中极差值可以得到4个因素对黑曲霉液体发酵产生蛋白酶活力的影响大小次序为:培养时间>pH值>加水量>培养温度.表2结果表明,黑曲霉液体发酵生产蛋白酶的最佳条件是:A2B2C3D3,即在加水量为125 mL,pH为7,45 ℃条件下培养120 h.
| 表 2 黑曲霉液体发酵生产蛋白酶的正交试验结果分析 Table 2 Optimal condition for protease produced byAspergillus niger liquid state fermentation selected by orthogonal experimental design and result |
在正交试验结果分析中,酶活力最高的组合为A2B2C3D3,即在pH为7,加水量为125 mL,45 ℃下培养120 h,此条件下得到的酶活为269.68 U/mL,比加水量为75 mL (A2B2C3D1)得到的蛋白酶活性提高12.90%,具有显著的优越性.
3 结论本文针对于黑曲霉的液体发酵条件产蛋白酶进行了统计学优化研究,通过单因素实验、正交试验进行了优化. 确定最佳培养条件为:以麸皮、豆粕粉为基本原料进行液体发酵,加水量125 mL,pH为7,45 ℃条件下培养120 h,得到的蛋白酶酶活力为269.68 U/mL. 由此可见,以麸皮、豆粕粉为基本原料,利用黑曲霉通过液体发酵制备蛋白酶,蛋白酶得率高,生产工艺简单,有良好的参考应用价值.
| [1] |
张士伟, 黄建飞, 罗立新. 枯草芽孢杆菌产蛋白酶发酵培养基的优化[J].
中国酿造, 2013, 32(2): 20-24.
ZHANG S W, HUANG J F, LUO L X. Optimization of fermentation medium for protease production byBacillus subtilis [J]. China Brewing, 2013, 32(2): 20-24. |
| [2] | S PRABHAM, D A DIVAKARK. Statistical analysis of production of protease and esterase by a newly isolatedLysinibacillus fusiformis AU01: purification and application of protease in sub-culturing cell lines [J]. Annals of Microbiology, 2014: 1-14. |
| [3] |
陈显玲. 蛋白酶产生菌的筛选及发酵条件的优化[J].
广州化工, 2014, 42(7): 67-70.
CHEN X L. Optimization of screening of protease producing strain and the fermentation condition[J]. Guangzhou Chemical Industry, 2014, 42(7): 67-70. |
| [4] | J HANS. Enhanced production of protease byPseudoalteromonas Arctica PAMC 21717 via statistical optimization of mineral components and FED-batch fermentation [J]. Preparative Biochemistry & Biotechnology, 2016, 46(4): 328-335. |
| [5] | C KASANAR. Proteases from psychrotrophs: an overview[J]. Critical Reviews in Microbiology, 2010, 36(2): 134-145. DOI: 10.3109/10408410903485525. |
| [6] | G MADHUMITHAHC. Utilization of vegetable wastes for production of protease by solid state fermentation usingAspergillus niger [J]. World Journal of Agricultural Sciences, 2011, 7(5): 550-555. |
| [7] |
李曹龙, 柴秀娟. 响应面法优化产蛋白酶菌株的发酵条件[J].
中国酿造, 2013, 32(6): 89-100.
LI C L, CHAI X J. Optimization for fermentation conditions of protease-producing strain by response surface analysis[J]. China Brewing, 2013, 32(6): 89-100. |
| [8] |
顾瑾麟, 张红发, 夏永军. 响应面法优化嗜麦芽窄食单胞菌产蛋白酶发酵培养基[J].
食品工业科技, 2013, 34(24): 168-172.
GU J L, ZHANG H F, XIA Y J. Optimization of fermentation medium for protease production byStenotrophomonas maltophilia using response surface methodology [J]. Science and Technology of Food Industry, 2013, 34(24): 168-172. |
| [9] | N NIYONZIMAF. Detergent-compatible proteases: microbial production, properties, and stain removal analysis[J]. Preparative Biochemistry and Biotechnology, 2015, 45(3): 233-258. DOI: 10.1080/10826068.2014.907183. |
| [10] | P ZAMBAREV, S NILEGAONKARS, R KSHIRSAGARP. Scale up production of protease usingPseudomonas aeruginosa MCM B-327 and its detergent compatibility [J]. Journal of Biochemical Technology, 2014, 5(2): 698-707. |
| [11] |
程德勇, 缪礼鸿. 高产蛋白酶活性的枯草芽孢杆菌筛选及鉴定[J].
武汉轻工大学学报, 2014, 33(1): 6-10.
CHENG D Y, MIAO L H. Screening and identification of high yield protease producingBacillus strains [J]. Journal of Wuhan Polytechnic University, 2014, 33(1): 6-10. |
| [12] |
刘颖, 张彬彬. 枯草芽孢杆菌高产中性蛋白酶发酵条件的优化[J].
食品科学, 2014, 35(13): 166-170.
LIU Y, ZHANG B B. Optimization of fermentation conditions for production of neutral protease byBacillus subtilis 10075 [J]. Food Science, 2014, 35(13): 166-170. |
| [13] | S KUMARS, R SHARMAN. Extracellular acid protease fromRhizopus Oryzae: purification and characterization [J]. Process Biochemistry, 2005, 40(5): 1701-1705. DOI: 10.1016/j.procbio.2004.06.047. |
| [14] | S NILEGAONKARS, P ZAMBAREV, P KANEKARP. Production and partial characterization of dehairing protease fromBacillus Cereus, MCM B-326 [J]. Bioresource Technology, 2007, 98(6): 1238-1245. DOI: 10.1016/j.biortech.2006.05.003. |
| [15] |
莫重文. 固态发酵法生产发酵豆粕的研究[J].
中国油脂, 2007, 32(7): 38-40.
MO C W. Production of fermented soybean meal by solid state fermentation[J]. China Oils and Fats, 2007, 32(7): 38-40. |
| [16] | S RAJMALWARS. Production of protease byAspergillus sp. using solid-state fermentation [J]. African Journal of Biotechnology, 2009, 8(17): 4197-4198. |
| [17] |
李祖明, 李鸿玉, 荣瑞芬. 碱性蛋白酶生产菌的育种及其液态发酵条件的研究[J].
食品研究与开发, 2008, 29(5): 19-23.
LI Z M, LI H Y, RONG R F. Studies on the Breeding of Alkaline Protease Producing Strain and its Submerged Fermentation Conditions[J]. Food Research and Development, 2008, 29(5): 19-23. |
| [18] |
刘红梅, 师广波, 马艳芳. 液态发酵法生产花生抗氧化肽和中性蛋白酶的工艺优化[J].
食品工业科技, 2014, 35(18): 175-179.
LIU H M, SHI G B, MA Y F. Optimization of the production of peanut antioxidative peptides and Neutrase using liquid state fermentation[J]. Science and Technology of Food Industry, 2014, 35(18): 175-179. |
| [19] | 中国国家标准化管理委员会. GB/T 23527-2009 蛋白酶制剂[S]. 北京: 中国标准出版社, 2009. |
| [20] | 瞿叶辉,丁利君,彭文媛,等. 响应面优化弹性蛋白酶酶解罗非鱼下脚料的工艺研究[J]. 广东工业大学学报,2016,33(5): 77-82. |
 2017, Vol. 34
2017, Vol. 34

