血栓是威胁人类生命和健康的多发性疾病,此类疾病主要为血栓导致血管腔狭窄或堵塞,以及血流不畅和血管所在脏器和组织发生局部缺血或梗死。因此,预防血栓形成及有效治疗血栓类病,对于维护公众健康和提高人类生存质量有着极为重要的意义。
黄粉虫(Tenebrio molitor L.)隶属于鞘翅目拟步行虫科,是有广泛用途的经济昆虫[1]。我们前期研究发现该虫体内存在一组强溶栓活性蛋白(Fibrinolyric Proteins ofTenebrio molitor, TFP)[2-3],经药理实验已证明该蛋白不会引发内出血等副作用[4-5]。因此,有望将其开发成为新型抗凝血、抗血栓及纤溶药物。
酵母表达系统是较成熟的真核表达体系,能够对目的蛋白进行类似高等真核生物的二硫键形成、糖基化修饰等蛋白质翻译后修饰,且具有遗传稳定性好,易于大规模化生产等特点[6]。本文对前期成功克隆的黄粉虫溶纤溶活性蛋白TFP,进行了酵母真核表达的相关研究,构建了该基因的真核表达载体,并在毕赤酵母GS115菌株中表达了重组纤溶酶,为TFP基因工程药物的研发奠定了实验基础。
1 材料和方法 1.1 模板、载体、菌株模板TFP基因由本研究室从黄粉虫(Tenebrio molitor L.)组织中经RT-PCR扩增获得并保存。克隆宿主菌E. coli JM109和E.coli DH5α均由本实验室保存,pMD19-T Vector质粒载体由本实验室保存,表达载体pPIC9K由暨南大学生命科学学院微生物室惠赠。
1.2 主要试剂总RNA提取试剂盒购自华舜生物工程(上海)公司;DNA marker、Taq酶、10×Taq Buffer、上样缓冲液、Golden View、氨苄青霉素、dNTP均购自鼎国昌盛生物技术(北京)有限公司;质粒小量纯化试剂盒(MiniBEST Plasmid Purification Kit Ver.2.0)、回收纯化DNA试剂盒(TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.3.0)、限制性内切酶EcoRⅠ和NotⅠ及DL2000 DNA Maker、pMD19-T Vector、DNA Ligation Kit Ver.2.1均购于Takara公司;其他常用试剂均为国产或进口分析纯。
1.3 引物的设计和合成根据本研究室前期研究已发表的TFP基因(GenBank登录号:JN662461)序列设计引物,引物由Invitrogen广州分公司合成。引物序列如下:上游引物(P1):5′-CG GAATTCAGAATCGTAGGAGGC TCCAG-3′(下划线处为EcoRⅠ酶切位点),下游引物(P2):5′-TAT GCGGCCGCTTATATTCCGGCGG TTTGT-3′(下划线处为NotⅠ酶切位点)。
1.4 目的基因的扩增 1.4.1 黄粉虫纤溶活性蛋白基因(TFP)的PCR扩增与检测将本室保存的含有pMD-19T载体质粒(含有TFP基因)的DH5α菌接种培养,分离纯化质粒得到模板DNA,以特异性引物P1和P2进行目的片段的PCR扩增,反应体系为(50 uL):引物P1、P2各1 μL,dNTP Mixture 2 μL,10×Taq缓冲液(含Mg2+)5 μL,模板2 μL,Taq DNA Polymerase 0.5 μL。反应程序:95.0 ℃维持5 min,94.0 ℃维持30 s,55.0 ℃维持30 s,72.0 ℃维持1 min,72.0 ℃维持10 min,33个循环,PCR产物经琼脂糖凝胶电泳检测。
1.4.2 扩增片段回收、载体连接以及转化切下预计大小的目的条带,采用DNA凝胶纯化试剂盒回收DNA,利用T载体试剂盒进行目的基因与pMD19-T载体的连接,连接反应在16 ℃水浴中进行16 h。然后,转化大肠杆菌DH5α感受态细胞,采用蓝白斑法筛选阳性克隆。
1.4.3 转化检测与序列测定挑选阳性克隆进行PCR,反应体系为(25 μL):10×Taq Buffer 2.5 μL,dNTP Mixture 1 μL,引物P1和引物P2各1 μL,Taq DNA Polymerase 0.5 μL,加ddH2O至25 μL,反应条件:95 ℃维持5 min,94 ℃维持30 s,55 ℃维持30 s,72 ℃维持1 min,33个循环,72 ℃维持10 min,4 ℃维持5 min。取PCR产物经1%的琼脂糖凝胶电泳检测扩增结果,电泳检测,经EcoR I (10 U/μL)0.5 μL和Not I (10 U/μL)双酶切及测序(Invitrogen广州分公司),并对测序结果进行对比。
1.5 毕赤酵母表达载体的构建、鉴定以及酵母菌的转化 1.5.1 重组表达载体的构建、转化及鉴定提取重组质粒pMD-19T-TFP,将初步鉴定的pMD-19T-TFP进行EcoR I和Not I双酶切,回收TFP基因,并将阳性克隆菌测序鉴定,同时,对毕赤酵母表达载体pPIC9K进行EcoR I和Not I双酶切,将酶切后的TFP基因片段与pPIC9K经T4连接酶在16 ℃下连接过夜。
1.5.2 大肠杆菌DH5α的转化与序列测定将上述重组体转化大肠杆菌DH5α感受态细胞,培养于LB液体培养基,37 ℃下摇床中培养60 min,挑取单个菌落进行PCR和抽提质粒与酶切鉴定,鉴定正确的质粒送Invitrogen广州分公司进行测序分析。
1.6 重组表达质粒的提取与酵母菌的转化 1.6.1 重组表达质粒的提取与酵母菌感受态细胞的制备将阳性克隆DH5α接种于LB培养液(含AMP)中,37 ℃培养16 h,提取质粒。挑取酵母单菌落,接种于含YPD培养基中,28 ℃,250 r/min培养过夜;取培养物接种于含新鲜培养基的三角摇瓶中,28 ℃,250 r/min培养20 h,至OD600达1.3~1.5;将培养物于4 ℃下1 500 g离心5 min,弃上清;以50 mL预冷无菌水重悬菌体沉淀,1 500 g离心,25 mL预冷无菌水重悬菌体沉淀,离心,弃上清,用5 mL预冷1 mol/L山梨醇重悬菌体沉淀,离心,用1 mL预冷1 mol/L山梨醇重悬菌体沉淀,离心,弃上清,加200 μL预冷1 mol/L山梨醇重悬细胞,分装每管80 μL。
1.6.2 重组质粒的线性化与酵母菌的电击转化重组表达质粒经Sac I酶切,电泳观察结果,回收DNA,将20 μg线性化DNA溶解于10 μL TE中,与80 μL感受态酵母菌体混匀,转入预冷的电转化杯中。将电转化杯冰浴5 min,电击转化,电击参数:1.5 V,电容25 μF,电阻200 Ω。电击后迅速加入预冷的1 mL 1 mol/L山梨醇,混匀后转至1.5 mL Eppendorf管中。将菌体悬液涂布于MD平板,将平板置30 ℃培养至出现单个菌落。
1.7 重组酵母的诱导表达及活性检测 1.7.1 重组酵母的诱导表达将阳性单菌落置含酵母浸出粉胨葡萄糖(BMGY)培养基摇瓶中,30 ℃,250 r/min培养至OD600=2~6。室温下3 000 r/min离心5 min,收集细胞并重悬于BMGY中,使OD600=1,将菌液置摇瓶中,于0 ℃下250 r/min培养,间隔24 h向培养基中加无水甲醇至终浓度0.5%;间隔24 h取菌液1 mL,置1.5 mL Eppendorf管中,13 000 r/min离心3 min,分别收集上清液和菌体,用50%硫酸铵浓缩上清液,SDS-PAGE检测表达蛋白。
1.7.2 纤溶平板测定酶活力[7]参照文献方法[7]制备纤维蛋白平板,在纤维蛋白凝胶板上打孔,每孔加入样品5 μL,以尿激酶为阳性对照,置37 ℃保温18 h,经考马斯亮蓝R-250染色及脱色后观察,样品孔出现清晰纤维蛋白溶解圈的为样品有纤溶活性。
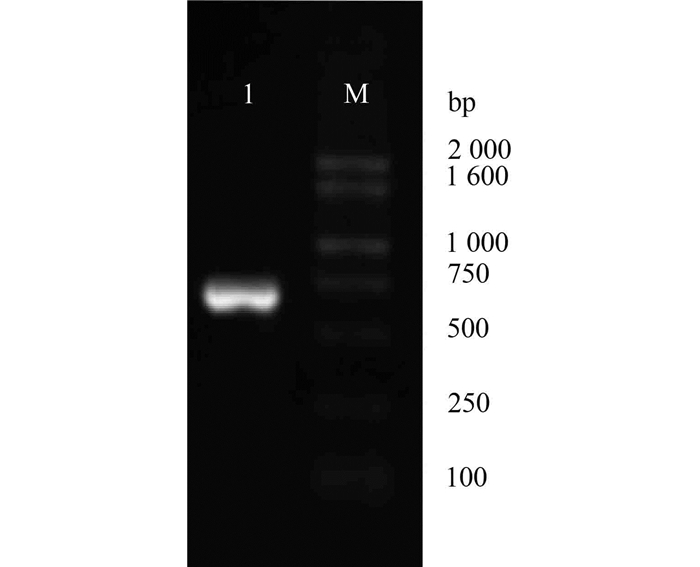
2 结果与分析 2.1 PCR扩增目的基因以质粒pMD-19T为模板,以引物P1和P2进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳分析,可见680 bp的特异条带(如图 1所示),其与预期片段大小相符。
|
图 1 黄粉虫TFP基因PCR产物电泳图 Figure 1 Electrophoretic profile of PCR product of TFP gene 1-黄粉虫TFP基因PCR产物;M-DNA Marker |
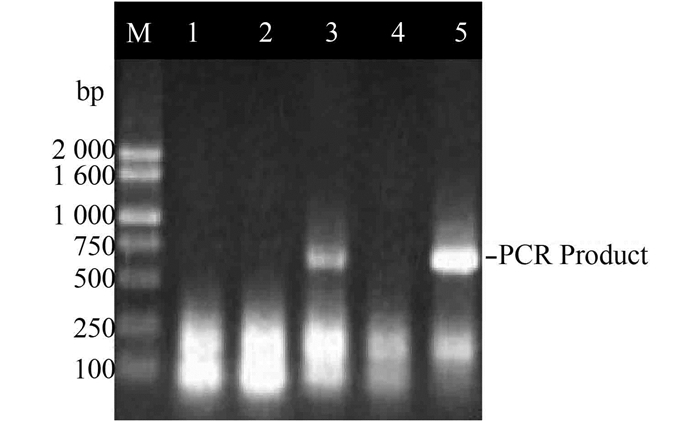
将目的片段与载体pMD19-T连接并转化DH5α,经蓝白斑法筛选转化阳性克隆,挑选白色菌落进行PCR鉴定,结果见图 2,出现一条预期大小的条带,初步认为是带有黄粉虫TFP基因的阳性重组克隆。
|
图 2 菌落PCR筛选结果 Figure 2 PCR analysis of the DH5α (T-Vector) M-DNA分子量标记物;1、2、3、4、5-阳性菌落PCR产物 |
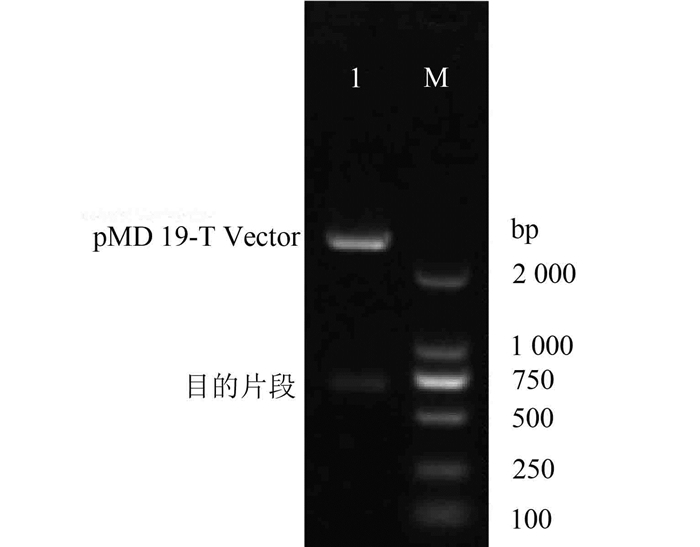
将阳性克隆小量提取质粒后经双酶切和凝胶电泳检测,结果出现2条DNA条带,分别是载体片段2 300 bp和目的基因700 bp,与预期结果相符(见图 3),表明目的基因已克隆到pMD-19T中。经测序表明重组子中的目的片段序列与GenBank公布的TFP基因序列完全一致(数据略),表明重组质粒构建成功,将此重组克隆载体命名为pMD19-T-TFP。
|
图 3 重组质粒双酶切鉴定 Figure 3 Identification of recombinant plasmids degested by EcoR I and Not I 1-载体和目的片段;M-DNA分子量标记物 |
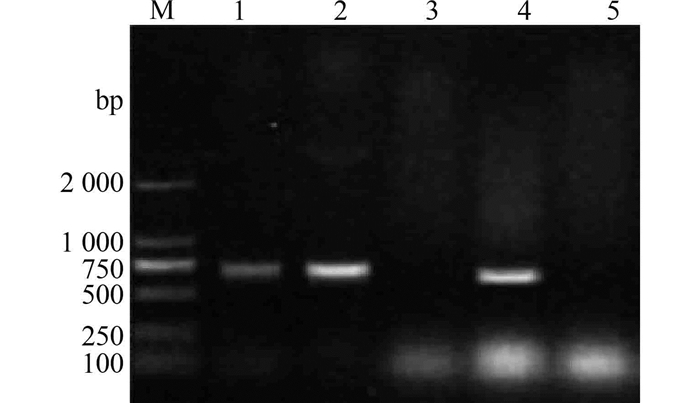
目的基因与表达载体pPIC9K连接后转化大肠杆菌DH5α,挑取菌落,经PCR和双酶切验证转化和连接结果(见图 4),由图看出菌落1、2、4为阳性克隆,均扩增出分子量约700 bp的条带,挑取1号菌提取质粒,双酶切结果,显现2条DNA条带(见图 5),分别是分子量680 bp的目的片段和9.3 kp的pPIC9K载体片段,表明重组载体构建成功,测序结果表明插入的序列与原TFP基因序列完全相同。
|
图 4 重组质粒菌落PCR筛选结果 Figure 4 PCR analysis of the DH5α (pPIC9K-TFP) 1-pMD-19T载体和目的片段;M-DNA分子量标记物 |
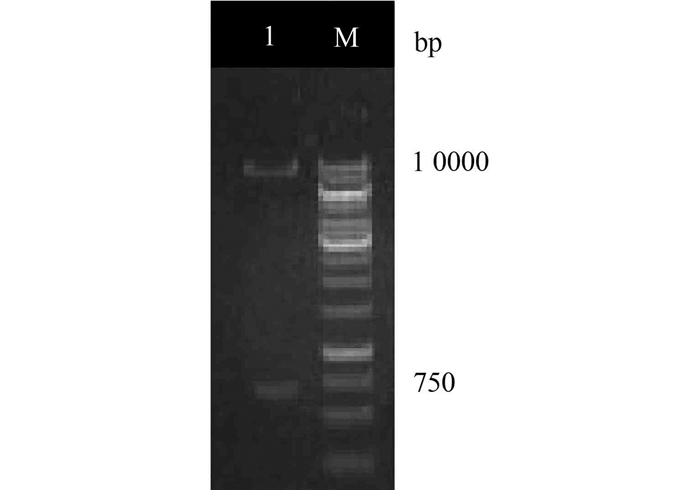
|
图 5 PIC9K-TFP质粒双酶切图 Figure 5 Restriction endonuclease of PIC9K-TFP 1-重组质粒pPIC9K-TFP;M-DNA分子量标记物 |
重组质粒经SacI线性化处理后转化GS115,将转化的酵母细胞涂布于MD平板,3 d后可观察到每板上均长出20-30个单菌落,将转化子分别点于MM和MD两平板上,培养后发现,MD板上少数转化子生长缓慢,对应于MM板上的转化子几乎不生长;其余则生长正常,且MD板上的转化子较MM板上的生长快,表明在MM板上生长缓慢而在MD板上生长正常的菌落为Muts表型,在MM和MD板上均生长正常的菌落为Mut+表型。转化株表型与其线性化的位置有关。Mut+能快速利用甲醇为碳源,而Muts则不能利用其作为碳源。
2.5 重组毕赤酵母的PCR鉴定挑取MM平板上生长良好的单菌落提取基因组DNA,用引物P1、P2进行菌落PCR扩增。扩增结果见图 6,可看出,8个菌落均扩增出约700 bp片段,说明重组载体pMD-19T (+)-TFP已成功转入毕赤酵母GS115中。
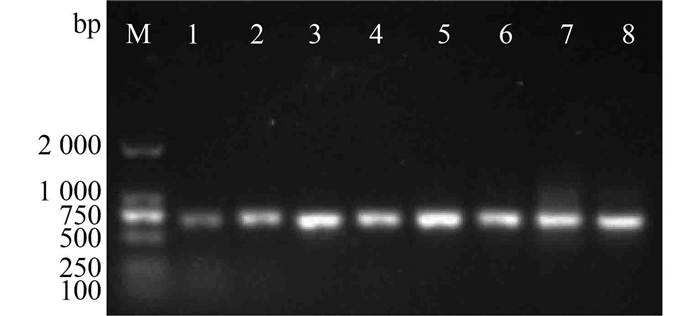
|
图 6 重组菌种的PCR结果 Figure 6 PCR analysis of the GS115 (pPIC9K-TFP) M-DNA Marker;1~8-重组酵母基因组DNA |
对得到的阳性工程菌株进行甲醇诱导使其表达,对得到的产物进行SDS-PAGE电泳检测,得到26KD目标蛋白带,该蛋白与预期目标蛋白分子量相符。收集不同时期的培养物,进行纤溶平板检测,实验结果见图 7,由图可以看出,甲醇诱导到达72 h时表达产物具有纤溶活性,且诱导时间进一步加长到96 h时,溶解圈最大,即纤溶活性较强,之后则溶解圈变小。相比于阳性对照--尿激酶的纤溶活性,表达蛋白的表达量还是较少且活性较弱。进一步提高表达蛋白的活性,尚有待于下一步在优化诱导表达条件和目的蛋白的分离纯化途径方面进行深入研究。

|
图 7 纤维蛋白平板法检测目的蛋白活性 Figure 7 Fibrin plate analysis of the activity of interest protein C-阳性对照(尿激酶);1-阴性对照(水);2~6-pPIC9K-TMTLSP/GS115诱导48 h、72 h、96 h、120 h、144 h后的表达产物 |
酵母是一类单细胞真核生物,其生长代谢与原核生物很相似,具有细胞繁殖快,易于培养、遗传操作简单和易于工业化生产等原核生物的特点,同时,其在基因表达与调控方面又与真核生物十分类似,具有较完备的基因表达调控机制和对表达产物的加工修饰能力,外源基因在其细胞内表达可以避免产物活性低、包涵体变性和复性等问题,因此,将其作为真核基因表达系统,可以克服原核表达系统缺乏蛋白翻译后加工和修饰等不足[8-10]。
本文所采用的毕赤酵母(Pichia pastoris)是甲醇营养型酵母中的一类能够利用甲醇作为唯一碳源和能源的酵母菌,也是近年来发展最迅速和应用最广泛的表达系统,已经有一系列重要生物活性蛋白利用此系统得到表达。该系统除了有一般酵母的特点外,尚具备其他载体无法替代的优点,如具有醇氧化酶AOX1基因启动子,这是目前最强、调控机理最严格的启动子;表达质粒能在基因组的特点位点以单拷贝或多拷贝的形式稳定整合,菌株易于进行高密度发酵,表达效率高,其表达的外源蛋白可占总表达蛋白的90%以上,有利于目的蛋白的分离纯化,同时,表达的外源蛋白储存过氧化物酶体中,可以免受细胞内蛋白酶的降解[11-12]。
此外,Pichia pastoris酵母菌体内无天然质粒,所以表达载体需与宿主染色体发生同源重组,将外源基因表达框架整合于染色体中以实现外源基因的表达,包括启动子、外源基因克隆位点、终止序列、筛选标记等。表达载体都是穿梭质粒,先在大肠杆菌复制扩增,然后被导入宿主酵母细胞。为使产物分泌至胞外,表达载体还需带有信号肽序列。
毕赤酵母表达系统有多种分泌型表达质粒,有许多蛋白在毕赤酵母中得到了高效分泌表达[13-14]。胞外表达需要在外源蛋白的N末端添加一段信号肽序列,引导重组蛋白进入分泌途径,可使蛋白质在分泌到胞外之后获得准确的构型[15]。本课题采用的就是毕赤酵母分泌性表达载体pPIC9K,成功实现了黄粉虫纤溶活性蛋白在毕赤酵母中的分泌表达。目前国外尚无TFP在毕赤酵母中成功表达的报道,本研究为黄粉虫纤溶活性蛋白(TFP)的应用与开发奠定了重要的实验基础。
| [1] |
刘玉升, 王付斌, 崔俊霞, 等. 黄粉虫资源研究利用现状与进展[J].
环境昆虫学报, 2010, 32 (1): 106-114.
LIU Y S, WANG F B, CUI J X, et al. Recent status and advances on study and utilization of Tenebrio molitor[J]. Journal of Environmental Entomology, 2010, 32 (1): 106-114. |
| [2] |
叶韵, 韩雅莉, 黄明星, 等. 黄粉虫胰蛋白酶样酶基因TMTLSP全长cDNA的克隆和序列分析[J].
中国生物化学与分子生物学报, 2012, 28 (2): 169-176.
YE Y, HAN Y L, HUANG M X, et al. Cloning and analysis of trypsin-like serine protease cDNA of yellow mealworm (Tenebrio molitor) larvae[J]. Chinese Journal of Biochemistry Biology, 2012, 28 (2): 169-176. |
| [3] |
陈雅雄, 谭竹均, 韩雅莉, 等. 黄粉虫蛋白提取物纤溶活性及性质研究[J].
时珍国医国药, 2011, 22 (1): 169-171.
CHEN Y X, TAN Z J, HAN Y L, et al. The fibrinolytic activity and properties of protein from Tenibrio molitor[J]. Lishizhen Medicine and Materia Medica Research, 2011, 22 (1): 169-171. |
| [4] | HUANG M X, YE Y, CHEN Y X, et al. Partial Purification and Characterization of Fibrinolytic Enzymes from Yellow Mealworm[J]. Int J Pept Res Ther, 2012, 18 : 153-161. DOI: 10.1007/s10989-012-9288-x. |
| [5] |
张冰, 谭竹钧. 黄粉虫纤溶活性蛋白免疫原性与抗血栓作用的研究[J].
广东工业大学报, 2015, 32 (2): 144-148.
ZHANG B, TAN Z J. The study of immuongenicity and anti-thrombotic effect of Tenebrio Fibrinolyric Proteins[J]. Journal of Guangdong University of Technology, 2015, 32 (2): 144-148. |
| [6] | CEREGHINO, LIN J, CREG G, et al. Heterologous protein expression in the methylotrophic yeast Pichia pastoris[J]. Federation of European Microbiological Societies, 2000, 24 (1): 45-46. |
| [7] |
黄明星, 叶韵, 谭竹钧, 等. 一种改良的纤维平板法[J].
广东工业大学报, 2012, 29 (3): 78-91.
HUANG M X, YE Y, TAN Z J, et al. An improved fiber plate method[J]. Journal of Guangdong University of Technology, 2012, 29 (3): 78-91. |
| [8] | ANANGI R, CHEN C Y, CHENG C H, et al. Expression of snake venom toxins in Pichia pastoris[J]. Toxin Reviews, 2007, 26 (2): 169-187. DOI: 10.1080/15569540701209815. |
| [9] | GUO M J, ZHUANG Y P, CHU J, et al. Production and purification of a novel the rmostable phytase by Pichia pastoris FPHY34[J]. Process Biochemistry, 2007, 42 (12): 1660-1665. DOI: 10.1016/j.procbio.2007.09.003. |
| [10] | CHOI B K, BOBROWICZ P, DAVIDSON R C, et al. Use of combinational genetic libraries to umanize N-linked glycosylation in the yeast Pichia pastoris[J]. Proc Natl Aacd Sci USA, 2003, 100 : 5022-5027. DOI: 10.1073/pnas.0931263100. |
| [11] | ADRIAAN V, A JEENA M, A FERENC J, et al. Hilgh level expression and secretion of truncated forms of herpes simplex virus type I and type II glycoprotein D by the methylotrophie yeast Pichia pastoris[J]. Protein Expression and Purification, 2002, 25 : 400-408. DOI: 10.1016/S1046-5928(02)00034-7. |
| [12] | MICHIRO M. Secretory expression of synthetic human Fas ligand extracellular domain gene in Pichia patoris:Influences oftag addition and N·glyeosylation site deletion, and developmentof a purification method[J]. Protein Expression and Purifieation, 2006, 50 (2): 137-146. DOI: 10.1016/j.pep.2006.08.006. |
| [13] | GHEN Z, WANG D, GONG Y, et al. Recombinant antimicrobial peptide hPAB-B expressed in Pichia pastorisa potential agent active against methicillin-resistant Staphylococcus ureas[J]. Appl Microbiol Biotechnol, 2011, 89 (2): 281-291. DOI: 10.1007/s00253-010-2864-0. |
| [14] | DAMASCENO L M, HUANG C J, BATF C A. Protein secretion in Pichia pastoris and advances in protein production[J]. Appl Microbiol Biotechnol, 2012, 93 (1): 31-39. DOI: 10.1007/s00253-011-3654-z. |
| [15] | CREGG J M, CEREGHINO J L, SHI J, et al. Recombinant protein expression in Pichia pastoris[J]. Mol Biotechnol, 2000, 16 (1): 23-52. DOI: 10.1385/MB:16:1. |
 2017, Vol. 34
2017, Vol. 34