2. 荆楚理工学院 智能制造学院, 湖北 荆门 448000
2. School of Intelligent Manufacturing, Jingchu University of Technology, Jingmen 448000, China
在生物医学工程领域,超声换能器作为一项关键技术在医学成像、治疗和生物效应研究中的应用日益增多。这些设备将电能和机械能相互转化,在无创诊断和治疗中扮演着至关重要的角色。随着新材料、新设计和新工艺的不断涌现,超声换能器的性能和应用范围得到了显著扩展[1-5]。超声换能器的不断进步为生物医学领域带来了革命性的变化,它们不仅能够提供高分辨率的成像,还能用于非侵入性治疗和生物组织的精确操控。
超声换能器的基本原理是利用压电效应,即压电材料在电场作用下产生形变,从而产生超声波;相反,当压电材料受到机械压力时,会产生电荷。这种转换效率和性能是超声换能器在医学成像中应用的关键。超声换能器能够提供实时、无损的体内成像,对于疾病的早期发现和治疗监测具有重要意义。此外,超声换能器在非侵入性治疗、生物效应研究以及工业检测等领域也展现出广泛的应用潜力[6-7]。随着技术的发展,超声换能器的设计和功能也在不断地改进和扩展,以满足更高的性能要求和更广泛的应用需求[8-9]。
新型超声换能器的发展背景主要集中在提高成像分辨率、增强穿透力、实现多模态成像以及开发柔性可穿戴设备等方面。技术进步包括新型压电材料的开发、设计方法、加工工艺等。例如,高频阵列超声换能器能够提供更高的成像分辨率,而柔性超声换能器则能够更好地适应人体曲面,提供更为舒适的佩戴体验[10-11]。此外,透明超声换能器的发展为光和超声的结合提供了新的可能性[12]。
本文的目的在于综述新型超声换能器在生物医学领域的研究进展以及面临的挑战和未来的发展方向,研究范围涵盖了小型超声换能器、非接触空气耦合超声换能器、透明超声换能器、柔性超声换能器、高频超声换能器以及低功率超声换能器等多种类型,如图1所示。本文通过对这些新型超声换能器的深入分析,旨在为生物医学工程领域的研究者和工程师提供最新的技术动态和研究方向。
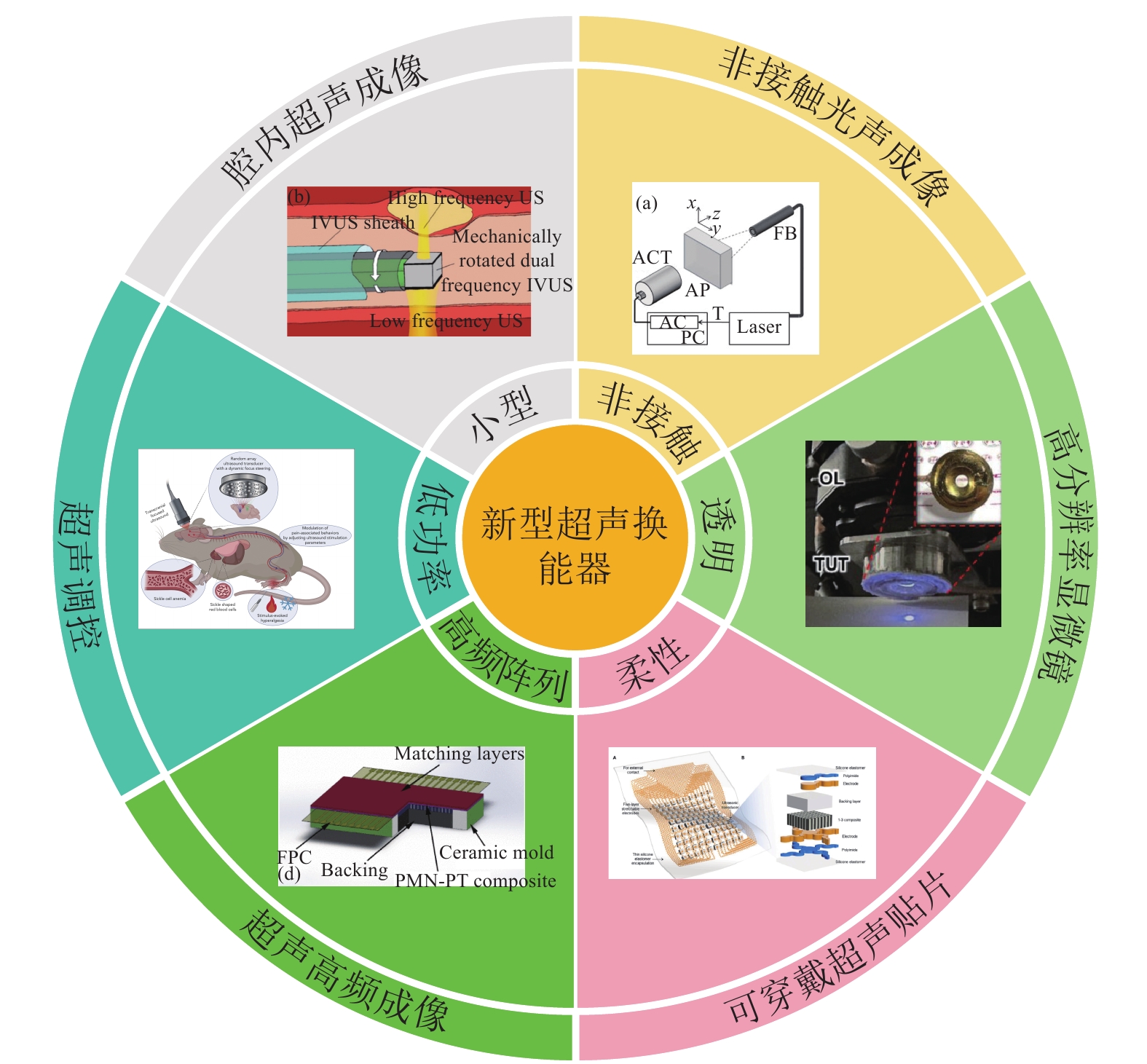
|
图 1 新型超声换能器 Figure 1 Novel ultrasonic transducers |
小型超声换能器因其高分辨率成像能力,在生物医学成像领域,特别是对小血管、皮肤表层及其他微细结构的成像中展现出巨大潜力[13-16]。近年来,研究者们致力于开发具有更小尺寸、更高频率和更优性能的小型高频超声换能器,以满足日益增长的临床需求。Li等[10] 开发了一种用于便携式和体内治疗应用的小型化压电超声换能器,该换能器的重量、外径和长度分别为 0.15 g、2 mm 和 10.35 mm,其紧凑的尺寸使其具有广泛的应用前景。Fleischman等[12] 利用膜偏转技术制备的微型换能器 (30~50 MHz) 成功对人体主动脉进行了成像,验证了微机械超声换能器的组织成像能力。Snook等[17] 研制的高频单晶超声换能器 (50~100 MHz) 专注于眼部和皮肤等浅层组织的病变检测,其高中心频率和宽带宽 (50%~70%) 确保了高质量的成像效果。Li等[18]使用30 μm的单晶PMN-PT开发了一种中心频率为82 MHz的高频超声换能器,该换能器的带宽为65%,插入损耗为23 dB,成像后的轴向和横向分辨率分别为35 μm和176 μm,具有良好的穿透能力,主要用于血管内疾病的检测。
针对腔内超声成像的应用需求,Chen等[19]开发了一种超声高频微型凸阵换能器(如图2(a)所示),它具有 64 个阵列元件以曲线配置排列,换能器的平均中心频率、−6 dB 带宽和灵敏度分别约为 17.85 MHz、61.95% 和 32.64 mV,通过对猪的动脉和食道进行离体成像来评估实际成像能力,证明了高频微型凸阵探针适用于腔内超声成像应用。吕圣苗等[20]研究者设计并制备了一种60 MHz的微型高频换能器,用于血管内超声成像系统,该系统在提高成像分辨率的同时,保证了足够的穿透深度,有助于获取动脉粥样硬化斑块的细节信息。He等[21]使用了中心频率分别为15 MHz和50 MHz的探测器(如图2(b)所示),对仿体和新鲜猪食管样本进行了测量,并比较了这2种探测器的成像性能,结果表明,50 MHz探测器在区分层结构方面比15 MHz探测器表现得更好,这为光声内窥镜的设计和优化提供了重要的指导。Ji等[22]成功开发了一种血管内共聚焦内窥镜(如图2(c)所示),该内窥镜配备了对称排列的双超声换能器,具有1.2 mm的外径,能够实现高分辨率的血管内成像。通过实验验证了该内窥镜在监测血管内斑块方面的潜力,为血管内成像技术的发展提供了新的工具。Zhang等[23]利用血管内光声断层成像技术(Intravascular Photoacoustic Tomography, IVPAT)成功对动物模型动脉粥样硬化斑块中的脂质含量进行了空间分布和定量分析(如图2(d)所示)。IVPAT技术结合了光学对比度和超声分辨率的优势,实现了动脉粥样硬化斑块脂质含量的空间定位和相对浓度测定。此外,IVPAT技术与组织学结果具有高度一致性,为动脉粥样硬化的基础科学研究和临床诊断提供了新的工具。Wang等[24]开发一种用于超声内窥成像的微型高频超声阵列换能器(如图2(e)所示),通过采用旋转螺线管−线圈电机系统和电子控制技术,实现了换能器的精确旋转和全方位成像,实验结果表明,这款换能器具备高达39 MHz的中心频率,能够产生60 μm的高分辨率图像,为超声胶囊内窥镜技术带来了突破性进展。食管癌是一种侵袭性疾病,手术或放化疗的生存率很差。早期诊断食管占位病变对于预防食管癌至关重要。Jiao等[25]设计了一种薄而灵活的食管镜探头(如图2(f)所示),提出了一种剪切波内窥镜弹性成像方法,该方法将内窥镜技术和剪切波弹性成像相结合,它将克服传统方法穿透深度差和缺乏弹性信息的缺点,为食管癌的早期诊断提供了新的手段,弥补了传统方法的不足。

|
图 2 小型超声换能器:(a) 用于猪的动脉和食道超声成像应用的高频微型凸阵探头[19],(b) 用于猪食管的光声内窥镜系统和2种微型超声换能器[21],(c) 用于监测血管内斑块的新型血管内共聚焦光声内窥镜[22],(d) 用于表征主动脉斑块的血管内光声断层扫描成像系统[23],(e) 用于胃肠道检查的小型胶囊高频超声换能器[24],(f) 用于食管癌诊断成像的微型超声换能器[25] Figure 2 Small ultrasound transducer (a) High-frequency miniature convex array probe for arterial and esophageal ultrasound imaging applications in swine, (b) Photoacoustic endoscopic system for porcine esophagus and two types of miniature transducers, (c) A novel intravascular confocal photoacoustic endoscope for monitoring intravascular plaque, (d) An intravascular photoacoustic tomography imaging system for characterizing aortic plaque, (e) Small capsule high-frequency ultrasound transducer for gastrointestinal exams, (f) Miniature ultrasound transducer for diagnostic imaging of esophageal cancer |
非接触空气耦合超声换能器是一种利用空气作为介质来传播超声波的器件,它能够在不接触被检测物体的情况下进行超声波检测,这种换能器在许多领域有着广泛的应用,尤其是在那些需要非接触检测的场合,如航空航天、复合材料检测、食品工业、医疗应用等[26-29]。然而,空气与组织间的声阻抗显著差异导致能量传输效率低,成为制约其广泛应用的主要瓶颈。
为了克服高阻抗失配造成的能量损失,研究者致力于优化换能器结构。例如,Blum等[30]设计并构建了一个 50~100 kHz 的聚焦二维阵列换能器,以增强超声信号振幅;Wang等[31]通过改进多层匹配层的设计和增强背衬材料来提高换能器的灵敏度和带宽,制作了一种基于 1-3 压电复合材料的空气耦合双层匹配超声换能器(如图3(a)所示),实现了−56.86 dB 的最低双向插入损耗和15.6%的最高−6 dB带宽。空气耦合超声换能器中,1-3 复合压电陶瓷是换能器的关键部件,铅基压电陶瓷,特别是锆钛酸铅 (Lead Zirconate Titanate,PZT),因其优异的压电和机电耦合性能,广泛应用于 1-3 复合陶瓷的制造 [32-34],然而,这些铅基材料对人体有害,会导致严重的环境污染。Zhou等[35]基于3D 打印制备了一种无铅压电陶瓷的空气耦合超声换能器,为环保型非接触式超声换能器的开发提供了新途径。

|
图 3 非接触空气耦合超声换能器:(a)1-3 型压电复合空气耦合超声换能器及其性能[31],(b) 空气耦合超声换能器非接触式光声成像系统和兔耳烧伤前后血管成像[36],(c) 基于非接触式聚焦空气耦合超声换能器的墨水成像结果[37] Figure 3 Non-contact air-coupled ultrasound transducer (a) Model 1-3 piezoelectric composite air-coupled ultrasound transducer and its performance, (b) Air-coupled ultrasound transducer non-contact photoacoustic imaging system and vascular imaging of rabbit ear before and after burn injury, (c) Ink imaging results based on non-contact focusing air-coupled ultrasound transducer |
空气耦合超声技术在生物医学成像领域也展现出显著的潜力。Ma等[36]提出了一种基于定制空气耦合超声换能器的非接触式光声成像系统(如图3(b)所示),实现了对体内脉管系统的无造影剂成像。该系统利用 532 nm 激光激发下血液的光吸收差异,能够有效区分烧伤组织中的活血和热凝血,并在体模和烧伤兔皮肤成像实验中得到了验证,为烧伤的辅助诊断提供了新的技术手段。Deán-Ben等[37]设计并制造了一款专用的聚焦空气耦合压电传感器(如图3(c)所示),并用其组装了一个具备声学解析度的成像装置,该系统在20 mJ/cm²的激光激发强度下,对墨水样本进行了成像,初步结果表明,空气耦合超声检测方法适用于非接触式光声生物医学成像。此外,这项技术已经被有效地应用于监测激光手术过程中切口的深度,实现了无需接触的精确测量[38]。
1.3 透明超声换能器透明超声换能器能够集成声学模块和光学模块,允许光路的径直通过,从而有利于各种光学系统的介入和光学操作的实施,它在生物医学成像领域具有重要的应用价值[39]。这种换能器的主要优势在于其高透明度可以使光学成像和声学成像技术相结合,简化光路,实现多模态融合成像的效果。透明超声换能器采用了透明的压电材料和透明的电极。这种设计使得透明超声换能器能够有效传输声波,同时保持高光学透明度,为超声和光声成像的集成提供了有效的解决方案。Qiu等[40]通过交流电场极化技术,成功制备了一种透明铁电晶体(如图4(a)所示),所得到的铁电晶体材料具有接近理论极限的透光性,同时展现出超高的压电系数、出色的机电耦合系数和大的电光系数,这些性能远远超过了常用的透明铁电晶体,为透明超声换能器的设计提供了重要基础。为了解决声阻抗失配问题,Cho等[41]开发了一种透明超声换能器(如图4(b)所示)。该换能器采用匹配层和背衬层设计,提高了声功率和传输效率,并实现了高灵敏度、宽带宽的体内超声和光声成像。

|
图 4 透明超声换能器:(a) 具有超高压电性的透明铁电晶体[40],(b) 透明超声换能器的结构及光学透射率[41],(c) 用于体内皮下微血管系统的光声显微镜[43],(d) 用于光声组织病理学分析的紫外透明超声换能器 [44],(e) 利用透明超声换能器实现大鼠烧伤前后眼部四模态体内融合成像[45] Figure 4 Transparent ultrasound transducer (a) Transparent ferroelectric crystals with ultra-high voltage electrical properties, (b) Structure and optical transmittance of a transparent ultrasound transducer, (c) Photoacoustic microscopy for in vivo subcutaneous microvascular system, (d) UV transparent ultrasound transducer for photoacoustic histopathologic analysis, (e) Four-modality in vivo fusion imaging of rat eye before and after burn injury using transparent ultrasound transducer |
透明超声换能器已经在多个场景得到了应用。基于透明超声换能器的光声显微镜 (如图4(c)所示) 实现了小型化、低成本、大视场的快速光扫描成像,其横向分辨率达 18 μm,信噪比高达 38 dB,成像范围可达 20 mm × 20 mm,可有效对小鼠耳部皮下血管等生物组织进行成像[42-43]。Kim等[44]开发了一种紫外透明超声换能器 (UV-TUT) (如图4(d)所示),它可以通过提高光学透镜的数值孔径(0.38) 和由此产生的空间分辨率 ((0.47 ± 0.03) μm) 来实现高分辨率反射模式紫外光声显微镜。该研究成功证明了其在小鼠脑组织中的优越性能,并对癌性动物组织进行了光声组织病理学分析。此外,透明超声换能器还可以用于四模态体内融合成像系统,结合超声成像、光声成像、光学相干断层扫描和荧光成像(如图4(e)所示),以提高成像质量。这种多模态成像系统可以全面监测生物组织对损伤的多参数反应,如角膜新生血管、结构变化、白内障和炎症[45]。总而言之,透明超声换能器独特的声光特性为生物医学成像提供了新的技术手段,尤其在多模态成像和深层组织成像方面具有巨大的应用潜力。
1.4 柔性超声换能器柔性超声换能器因其独特的性能和广泛的应用前景,近年来在生物医学领域受到了极大的关注。与传统的刚性超声换能器相比,柔性超声换能器能够更好地贴合人体复杂的曲面,提供更为舒适的佩戴体验,同时在成像质量上也有显著提升[46]。这些换能器的核心优势在于其电极材料的柔韧性和可伸缩性,这使得它们能够在不限制组织运动的情况下,实现对深部组织的长期监测[47-48](如图5(a) ~(b)所示)。柔性超声换能器在设计上采用了柔性基底材料,如聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)、聚对苯二甲酸乙二醇酯(Polyethylene Terephthalate,PET)、Ecoflex00-30等,这使得换能器能够适应不同的弯曲表面,从而提高了成像的准确性和可靠性[49]。此外,柔性超声换能器在制造过程中采用了微电子的微加工工艺,包括机械分割、激光切割、图形化方法以及极化方法等,这些工艺的优化使得换能器的性能得到了显著提升[50]。

|
图 5 柔性超声换能器:(a) 用于贴合皮肤的柔性可拉伸超声换能器[47],(b) 柔性线阵列换能器单层结构示意图[48],(c) 可拉伸超声换能器阵列的结构原理图[51],(d) 用于连续监测脑血流的适超声贴片结构示意图[53],(e) 用于小鼠脑刺激的柔性超声换能器[54],(f) 用于加速慢性伤口愈合的柔性超声贴剂[55],(g) 用于乳腺癌检测的柔性超声换能器[57] Figure 5 Flexible ultrasound transducer (a) Flexible stretchable ultrasound transducer used to fit the skin, (b) Schematic of the single-layer structure of the flexible line array transducer, (c) Schematic of the structure of the stretchable ultrasound transducer array, (d) Schematic structure of the adapted ultrasound patch used for continuous monitoring of cerebral blood flow, (e) Flexible ultrasound transducer used for cerebral stimulation in mice, (f) Flexible ultrasound patch used to accelerate the healing of chronic wounds, (g) Flexible ultrasound transducer for breast cancer detection |
在应用方面,柔性超声换能器已被广泛用于医学成像、传感和治疗。例如,Hu等[51]开发一种能够适应并检测非平面复杂表面的可拉伸超声探头(如图5(c)所示),利用“岛−桥”布局和多层电极制作,这种可拉伸探头具有出色的机电耦合性能、最小的串扰和超过50%的拉伸能力,并以高空间分辨率进行成像,为超声技术在复杂表面成像的应用提供了新的可能性,尤其是在结构健康监测和医疗诊断方面。De等[52]开发了一种中心频率为2.25 MHz的柔性阵列超声换能器,这种换能器能够被用于动脉血压监测,并且直接耦合到人体曲率上,与传统的刚性超声换能器相比,提供了更好的适应性和舒适性。Zhou等[53]设计了一种新型的超声贴片(如图5(d)所示),该贴片能够实现经颅三维成像并连续监测脑血流,成功克服了传统经颅多普勒超声技术在三维血管网络测量精度和长期监测方面的限制。Lee等[54]介绍了一种新型的柔性压电微机械超声换能器(如图5(e)所示),该换能器集成在柔性聚二甲基硅氧烷(PDMS)上,所开发的柔性阵列能够在小鼠大脑表面实现超声刺激,为超声在脑刺激中的应用提供了一种新的技术平台。Lyu等[55]开发了一款柔性超声贴片(如图5(f)所示),用于促进慢性伤口愈合,在II型糖尿病大鼠的实验中,该贴片通过激活Rac1信号通路,显著加快了伤口的愈合速度,使愈合时间平均缩短了40%。Peng等[56]设计并制造了一种基于银纳米线的可伸缩电极的压电复合超声传感器,该感器能够连续监测心脏周期中的血压波形,为非侵入性、非压迫性和无需校准的血压监测提供了一个有前景的解决方案。Wang等[57]提出了一种全新的全柔性光声耦合系统(如图5(g)所示),该系统基于光纤束和柔性超声换能器,展示了形态自适应、快速成像、大视场和体积成像的能力,在临床常规乳腺癌筛查方面有巨大潜力,该系统不仅能够适应不同形态的组织结构,还提供了大视场和高能量利用率。此外,得益于自制的数据采集系统,该系统具有实时成像的优势。
1.5 高频阵列超声换能器在超声成像领域,高频阵列超声换能器凭借其高分辨率成像能力而备受关注[58-59]。其工作原理基于压电效应,利用压电材料实现电能与高频机械振动之间的相互转换,从而产生高频声波用于成像。通常,将中心频率高于20 MHz的超声波定义为高频超声,其特点是波长短、空间分辨率高,能够更精细地探测微小结构。与传统的低频换能器相比,高频换能器能提供更高的空间分辨率,但其穿透力有限,其主要应用于皮肤科、眼科、血管和小动物研究等领域,在微观结构成像和早期疾病检测方面具有显著优势[60-61]。传统制造高频 (>20 MHz) 1-3 型压电复合材料的“切块和填充”方法受限于薄刀片厚度 (10 μm)。Lei等[62]采用改进的皮秒 (1.5 ps) 激光技术成功制备了30 MHz 和 50 MHz 的 1-3 型压电复合材料,并将其用于制造由 32 个晶片组成的阵列传感器(如图6(a)所示)。这项技术显著减少了 PMN-PT 柱周围的微裂纹,实现了最小切缝小于 4.5 μm,最大长宽比超过 7.5 的精细加工,为高频超声换能器的制造提供了新的途径。此外,高频换能器在设计上也有所不同,如凸阵列超声换能器,通过特定的成像算法,能实现宽波束成像,增加成像的覆盖范围[63]。

|
图 6 高频阵列超声换能器:(a) 32阵列传感器示意图[62],(b) 小尺寸 50 MHz 线性阵列示意图[64],(c) 用于小动物成像的高频微凸阵传感器示意图[65],(d) 用于乳腺活检的高频超声阵列换能器[68],(e) 用于超声刺激的2D 高频超声相控阵[69],(f) 用于小动物经颅超声输送的球形高频相控阵[70] Figure 6 High-frequency array ultrasound transducer (a) Schematic of a 32-array transducer, (b) Schematic of a small-size 50 MHz linear array, (c) Schematic of a high-frequency microconvex array transducer used for small-animal imaging, (d) High-frequency ultrasound array transducer used for mammary biopsy, (e) 2D high-frequency ultrasound phased array used for ultrasound stimulation, (f) Spherical high-frequency phased array used for small animal transcranial ultrasound delivery |
在应用方面,高频阵列超声换能器在医学成像领域尤其重要。Roa等[64]开发了一款小型化的50 MHz线性阵列超声换能器(如图6(b)所示),该换能器采用了创新的互连技术,实现了紧凑的设计。脉冲回波测量结果表明,换能器的平均中心频率为55 MHz,−6 dB带宽为41%。这款换能器因其高分辨率成像能力和小型化特点,展现出在临床和前临床应用中的潜力,尤其是在需要使用小型化或内窥镜设备到达特定解剖结构的场合。Chen等[65]开发了一种用于提升小动物成像的高频微凸阵传感器(如图6(c)所示),通过在大鼠体内成像其整个肾脏及其内部动脉,验证了该换能器在小动物成像中的有效性。Foster等[66]介绍了一种新型的商业化高频超声成像系统,该系统能够实现15~50 MHz中心频率的微型超声成像,线性阵列方法的优势在于在整个视场范围内保持了均匀的高分辨率,极大地扩展了实时功能成像的应用范围。Bezanson等[67]开发了一款微型高频内窥镜相控阵换能器,该阵列有 64 阵元,阵元间距为 38 μm,中心频率为 42 MHz,为了研究探头的软组织成像能力,他们对猪脑组织进行了成像,实验结果表明这种类型的相控阵内窥镜在实际内窥镜应用中具有巨大潜力。Cummins等[68]开发了一种小型化高频线性阵列,该阵列的中心频率和分数带宽 (−6 dB) 分别为59.1 MHz和29.4%,并且该阵列可以集成到核心活检针中(如图6(d)所示),以提高乳腺癌活检过程中的组织采样准确性。Rivandi等[69]开发了一种二维超声相控阵发射器(如图6(e)所示),能够在三维空间内以高空间分辨率和超声压力引导聚焦超声波,同时保持结构小型化。不仅展示了在高频操作和最小化功耗方面实现的优化,而且为超声神经调节和植入设备超声能量传输提供了一种有效的解决方案。Rahimi等[70]提出了一种高频相控阵系统(如图6(f)所示),该系统能够显著提高传输效率和精度。通过微加工技术制造的64阵元相控阵换能器,能够在小型啮齿动物模型中实现高度局部化的焦点体积,并通过相位校正技术补偿了头盖骨引起的声场畸变。
1.6 低功率超声换能器(超声调控)低功率超声换能器(超声调控)技术在神经科学和精神疾病治疗领域中的重要性日益凸显,该技术不仅能够精确调控大脑深层区域的神经活动,还具有调控其他身体区域神经活动的潜力。这种精准调控能力源于低功率超声换能器所具有的诸多优势:非侵入性、高空间分辨率、高穿透深度以及与其他成像技术(例如磁共振成像)的良好兼容性,这使其成为研究和治疗神经退行性疾病以及精神障碍的理想工具。低功率超声换能器的工作原理主要基于超声波的机械效应、空化效应和热效应[71]等,通过这些效应,可以外部控制神经元的兴奋性,从而实现对神经活动的精准调制。
在动物模型研究中,已有诸多研究验证了低功率超声换能器的有效性和潜力。He等[72]开发了一种低功率超声换能器,这种换能器与声全息透镜相结合,通过虚拟源时间反转法和3D打印技术优化设计,成功实现了在自由移动小鼠中的双目标神经调制。这一系统的设计和制造,不仅展示了低功率超声换能器在小动物模型中的应用潜力,而且体现了其在实现精确神经调控方面的技术进步。Yang等[73]开发了一种可穿戴式超声换能器 (如图7(a)所示),并将其安装在自由活动的小鼠头部,对下丘脑视前区施加超声脉冲,结果显示超声刺激导致小鼠体温下降、心率减缓和氧消耗降低,进入低能耗的蛰眠样状态。这项研究表明,超声技术能够非侵入性地诱导出类似冬眠的状态,这为未来的医疗应用或太空探索提供了新的可能性。Yang等[74] 进一步探索了经颅超声刺激对小鼠行为和神经振荡的调节作用(如图7(b)所示)。研究结果显示,经颅超声刺激能有效改善小鼠的认知行为并调节神经振荡,为阿尔茨海默病的治疗提供了新的视角。He等[75]利用低功率超声换能器结合微型声全息透镜技术,实现了大鼠多靶点经颅超声治疗(如图7(c)所示),在 1.0 MHz 频率下成功实现了大鼠双侧次级视觉皮层 (V2ML) 的多靶点血脑屏障打开。Kim 等[76]则利用低强度经颅聚焦超声探索了其对小鼠模型中疼痛处理脑回路的调节作用及其在疼痛管理中的潜在应用(如图7(d)所示)。他们开发了一种具有高空间特异性的超声换能器,能够精确靶向小鼠大脑中与疼痛处理相关的特定脑区,显著降低野生型小鼠的热痛敏感性,且不影响运动功能或大脑神经病理学。

|
图 7 低功率超声换能器:(a) 用于诱导低代谢休眠状态的超声装置[73],(b) 利用低功率超声换能器对阿尔茨海默病超声调控的实验设备[74],(c) 利用低功率超声换能器实现多靶点经颅超声治疗实验装置[75],(d) 利用低功率超声换能器实现低强度经颅聚焦超声镇痛[76] Figure 7 Low-power ultrasound transducer (a) Ultrasound device for inducing hypometabolic dormancy, (b) Experimental device for ultrasound modulation of Alzheimer's disease using a low-power ultrasound transducer, (c) Experimental device for multi-target transcranial ultrasound therapy using a low-power ultrasound transducer, (d) Experimental device for low-intensity transcranial focused ultrasound analgesia using a low-power ultrasound transducer |
在抑郁症等神经精神疾病的治疗中,低功率超声换能器同样展现出巨大的应用前景。Zhu等[77] 通过同时刺激前额叶皮层 (PrL) 和中缝背核 (DRN),发现这种多靶点超声神经调制相较于单一靶点刺激具有更显著的抗抑郁效果,突显了多靶点超声刺激在复杂神经精神疾病治疗中的重要性。此外,Zhu等[78]通过建立慢性束缚应激诱导的小鼠抑郁模型,研究了经颅超声刺激对抑郁样行为的改善作用,进一步证实了低功率超声换能器在改善抑郁样行为方面的有效性。Zhuang等[79]开发了一种基于高功率2D阵列换能器的空间多目标超声神经调制系统,该系统能够同时在3D场中产生多个焦点,为神经科学研究提供了一个评估多靶点超声刺激治疗方案可行性的平台,进一步推动了低功率超声换能器技术的发展。
2 挑战与未来发展方向尽管新型超声换能器在生物医学成像等领域展现出巨大潜力,但在其设计、制造和应用方面仍面临诸多挑战。这些挑战涉及材料科学、电子工程、声学设计以及生物医学工程等多个学科领域,需要多学科交叉融合才能有效解决。新型超声换能器的技术挑战及局限性将聚焦在以下几个方面:
(1) 小型超声换能器:小型超声换能器因其高分辨率成像能力在生物医学成像领域展现出巨大潜力。然而,现有研究主要集中在提高频率和减小尺寸上,这可能导致信号衰减和成像深度的降低。为了解决这一问题,建议开发高机电耦合系数的压电材料,以实现在保持高分辨率的同时保证高的检测灵敏度。此外,将超声换能器与其他成像技术或检测手段进行融合,如超声与光声等多模态成像,实现优势互补,提供更全面、更准确的诊断信息。
(2) 非接触空气耦合超声换能器:非接触空气耦合超声换能器在无需直接接触的情况下进行超声波检测方面具有明显优势。但是,空气与组织间的声阻抗差异导致能量传输效率低,限制了其在生物医学成像中的应用。为了克服这一挑战,建议研究者探索新的阻抗匹配层设计,以提高能量传输效率。同时,开发新型的信号处理算法,如自适应滤波器和图像重建技术,可以提高成像质量,减少噪声干扰。
(3) 透明超声换能器:透明超声换能器的发展为光声与超声成像的结合提供了新策略。尽管如此,现有研究在实现高透明度和高声学性能之间的平衡方面面临挑战。未来的研究应该探索新型透明压电材料和透明导电材料,这些材料可能在保持高透明度的同时保证优异的电学性能。此外,通过优化换能器的电极设计,可以进一步提高其声学效率和成像质量。
(4) 柔性超声换能器:柔性超声换能器因其能够贴合人体复杂曲面而受到关注。然而,现有研究在提高柔性换能器的成像质量和长期稳定性方面存在不足。未来的研究应该集中在开发新型柔性基底材料和电极材料,这些材料需要在保持柔韧性的同时,提供足够的机械强度和电气性能。此外,通过改进制造工艺,如微电子的微加工技术,可以提高换能器的性能和可靠性。
(5) 高频阵列超声换能器:高频阵列超声换能器在提供高分辨率成像方面具有显著优势。但是,高频换能器的穿透力有限,这限制了它们在深层组织成像中的应用。未来的研究应该致力于开发新型压电材料,以提高高频换能器的穿透力。同时,通过优化阵列设计和信号处理技术,可以提高成像深度和分辨率,从而扩展高频换能器的应用范围。
(6) 低功率超声换能器(超声调控):低功率超声换能器在神经调控领域展现出巨大潜力。然而,现有研究在精确控制超声能量的聚焦和传输方面存在挑战。未来的研究应该集中在开发新型超声调控技术,如利用声全息技术来精确控制超声束的形状和方向。此外,通过研究超声与生物组织的相互作用,可以提高调控效率和特异性,同时确保安全。
未来新型超声换能器的发展方向将集中在以下几个方面:(1) 开发具有优异性能的新型压电材料:研究和合成具有更高压电系数、更低声阻抗和更宽频率响应范围的新型压电材料;探索环境友好型、生物相容性高的压电材料,以满足医疗和环境监测的需求。设计和制造具有高灵敏度和宽频带特性的超声换能器,以适应多种成像和治疗应用;探索新型压电材料与匹配层,优化换能器结构设计(如多层匹配、微纳结构)。(2) 换能器结构设计的优化:通过仿真和实验研究,优化换能器的结构设计,提高能量转换效率和声场控制能力;研究新型换能器阵列配置,增强成像深度和分辨率,同时扩大视场范围;利用先进的加工技术,如增材制造、激光微加工、电子束曝光等,实现超声换能器的高精度制造。(3) 柔性穿戴式发展:研发柔性、可拉伸的超声换能器,以实现在人体皮肤上紧密贴合,这些换能器能够适应人体皮肤在各种运动状态下的变化,保持紧密贴合。同时结合小型化的超声成像设备,实现长时间的健康监测和疾病预防。此外,开发先进的信号处理和图像重建算法,以提升超声图像的准确性和高信噪比。(4) 高密度二维阵列化发展:研究新型的高密度集成技术,以实现更多的换能器阵元在有限空间内的排列,提高阵列的阵元数量;开发新的互连技术,以支持高密度集成,确保信号的高速传输和低损耗。(5) 超声设备诊疗一体化的发展:结合超声成像与治疗功能,开发能够同时进行诊断和治疗的超声设备;利用超声换能器进行药物递送、热疗和机械刺激等多种治疗方式;针对特定应用场景,如心血管、神经、肿瘤等,开发专用的高频、超高频、微型化、柔性超声换能器。
3 结论本文综述了近年来新型超声换能器在生物医学领域的快速发展,分析了小型超声换能器、非接触空气耦合超声换能器、透明超声换能器、柔性超声换能器、高频超声换能器以及低功率超声换能器等不同类型换能器的特点和应用,并总结了其在提高成像质量、实现精准治疗和神经调控等方面所取得的显著进展。其中,高频超声换能器为高分辨率成像提供了可能;非接触空气耦合换能器扩展了超声应用至无需直接接触的场合;透明超声换能器的问世,为结合光声与超声成像提供了新策略;柔性超声换能器则为穿戴式生物医学监测铺平了道路;低功率超声换能器在神经调控等领域展现了巨大潜力。尽管如此,这些换能器的进一步发展仍面临材料开发、结构优化、生物医学应用等挑战。未来研究应着力于解决这些挑战,进一步推动超声换能器技术的发展。
| [1] |
LI F, LIN D, CHEN Z, et al. Ultrahigh piezoelectricity in ferroelectric ceramics by design[J].
Nature Materials, 2018, 17(4): 349-354.
DOI: 10.1038/s41563-018-0034-4. |
| [2] |
LI F, ZHANG S, YANG T, et al. The origin of ultrahigh piezoelectricity in relaxor-ferroelectric solid solution crystals[J].
Nature Communications, 2016, 7(1): 13807.
DOI: 10.1038/ncomms13807. |
| [3] |
PAN H, LI F, LIU Y, et al. Ultrahigh-energy density lead-free dielectric films via polymorphic nanodomain design[J].
Science, 2019, 365(6453): 578-582.
DOI: 10.1126/science.aaw8109. |
| [4] |
LI F, CABRAL M J, XU B, et al. Giant piezoelectricity of Sm-doped Pb (Mg1/3Nb2/3) O3-PbTiO3 single crystals[J].
Science, 2019, 364(6437): 264-268.
DOI: 10.1126/science.aaw2781. |
| [5] |
CHEN Z, LI F, HUANG Q, et al. Giant tuning of ferroelectricity in single crystals by thickness engineering[J].
Science Advances, 2020, 6(42): eabc7156.
DOI: 10.1126/sciadv.abc7156. |
| [6] |
WANG H, CHEN Z, YANG H, et al. A ceramic PZT-based PMUT array for endoscopic photoacoustic imaging[J].
Journal of Microelectromechanical Systems, 2020, 29(5): 1038-1043.
DOI: 10.1109/JMEMS.2020.3010773. |
| [7] |
WANG J, ZHENG Z, CHAN J, et al. Capacitive micromachined ultrasound transducers for intravascular ultrasound imaging[J].
Microsystems & Nanoengineering, 2020, 6(1): 73.
|
| [8] |
JUNG J, LEE W, KANG W, et al. Review of piezoelectric micromachined ultrasonic transducers and their applications[J].
Journal of Micromechanics and Microengineering, 2017, 27(11): 113001.
DOI: 10.1088/1361-6439/aa851b. |
| [9] |
QIU Y, GIGLIOTTI J V, WALLACE M, et al. Piezoelectric micromachined ultrasound transducer (PMUT) arrays for integrated sensing, actuation and imaging[J].
Sensors, 2015, 15(4): 8020-8041.
DOI: 10.3390/s150408020. |
| [10] |
LI T, CHEN Y, MA J. Development of a miniaturized piezoelectric ultrasonic transducer[J].
IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 2009, 56(3): 649-659.
DOI: 10.1109/TUFFC.2009.1081. |
| [11] |
CHENG X, CHEN J, LI C. A miniature capacitive micromachined ultrasonic transducer array for minimally invasive photoacoustic imaging[J].
Journal of Microelectromechanical Systems, 2010, 19(4): 1002-1011.
DOI: 10.1109/JMEMS.2010.2049824. |
| [12] |
FLEISCHMAN A, MODI R, NAIR A, et al. Miniature high frequency focused ultrasonic transducers for minimally invasive imaging procedures[J].
Sensors and Actuators A: Physical, 2003, 103(1-2): 76-82.
DOI: 10.1016/S0924-4247(02)00323-0. |
| [13] |
ATAR S, LUO H, NAGAI T, et al. Ultrasonic thrombolysis: catheter-delivered and transcutaneous applications[J].
European Journal of Ultrasound, 1999, 9(1): 39-54.
DOI: 10.1016/S0929-8266(99)00007-5. |
| [14] |
YASUI A, HAGA Y, CHEN J J, et al. Focused ultrasonic transducer for localized sonodynamic therapy[C]// The 13th International Conference on Solid-State Sensors, Actuators and Microsystems, 2005. Seoul: IEEE, 2005: 1660-1663.
|
| [15] |
MAIONE E, SHUNG K K, MEYER R J, et al. Transducer design for a portable ultrasound enhanced transdermal drug-delivery system[J].
IEEE Transactions on Ultrasonics Ferroelectrics & Frequency Control, 2002, 49(10): 1430-1436.
|
| [16] |
YASUI A, HAGA Y, CHEN J, et al. Focused ultrasonic device for sonodynamic therapy in the human body[C]//2005 3rd IEEE/EMBS Special Topic Conference on Microtechnology in Medicine and Biology. Oahu, HI: IEEE, 2005: 154-157.
|
| [17] |
SNOOK K A, ZHAO J Z, ALVES C H, et al. Design, fabrication, and evaluation of high frequency, single-element transducers incorporating different materials[J].
IEEE Transactions on Ultrasonics Ferroelectrics & Frequency Control, 2002, 49(2): 169-176.
|
| [18] |
LI X, WU W, CHUNG Y, et al. 80-MHz intravascular ultrasound transducer using PMN-PT free-standing film[J].
IEEE Transactions on Ultrasonics Ferroelectrics & Frequency Control, 2011, 58(11): 2281-2288.
|
| [19] |
CHEN W, WANG B, CHEN J, et al. Development of a high-frequency mini-convex array probe for intraluminal ultrasonic imaging applications[J].
IEEE Sensors Journal, 2024(11): 24.
|
| [20] |
吕圣苗, 王振常, 蔡杰, 等. 用于血管内成像的 60 MHz 高频超声换能器设计及其成像实验[J].
集成技术, 2022, 11(5): 34-44.
LYU S M, WANG Z C, CAI J, et al. 60 MHz high frequency intravascular ultrasound transducer and in vivo imaging[J]. Journal of Integration Technology, 2022, 11(5): 34-44. DOI: 10.12146/j.issn.2095-3135.20220517001. |
| [21] |
HE H, BUEHLER A, BOZHKO D, et al. Importance of ultrawide bandwidth for optoacoustic esophagus imaging[J].
IEEE Transactions on Medical Imaging, 2017, 37(5): 1162-1167.
|
| [22] |
JI X, XIONG K, YANG S, et al. Intravascular confocal photoacoustic endoscope with dual-element ultrasonic transducer[J].
Optics Express, 2015, 23(7): 9130-9136.
DOI: 10.1364/OE.23.009130. |
| [23] |
ZHANG J, YANG S, JI X, et al. Characterization of lipid-rich aortic plaques by intravascular photoacoustic tomography: ex vivo and in vivo validation in a rabbit atherosclerosis model with histologic correlation[J].
Journal of the American College of Cardiology, 2014, 64(4): 385-390.
DOI: 10.1016/j.jacc.2014.04.053. |
| [24] |
WANG X, SEETOHUL V, CHEN R, et al. Development of a mechanical scanning device with high-frequency ultrasound transducer for ultrasonic capsule endoscopy[J].
IEEE Transactions on Medical Imaging, 2017, 36(9): 1922-1929.
DOI: 10.1109/TMI.2017.2699973. |
| [25] |
JIAO Y, CUI Y, WU J, et al. A shear wave endoscopic elasticity imaging approach with micro focused piezoelectric transducer[C]//2017 IEEE International Ultrasonics Symposium (IUS) . Washington, DC: IEEE, 2017: 1-4.
|
| [26] |
CHIMENTI D. Review of air-coupled ultrasonic materials characterization[J].
Ultrasonics, 2014, 54(7): 1804-1816.
DOI: 10.1016/j.ultras.2014.02.006. |
| [27] |
GINEL A M, ÁLVAREZ-ARENAS T G. Air-coupled transducers for quality control in the food industry[C]//2019 IEEE International Ultrasonics Symposium (IUS) . Glasgow: IEEE, 2019: 803-806.
|
| [28] |
RATHOD V T. A review of acoustic impedance matching techniques for piezoelectric sensors and transducers[J].
Sensors, 2020, 20(14): 4051.
DOI: 10.3390/s20144051. |
| [29] |
ZHOU J, BAI J, LIU Y. Fabrication and modeling of matching system for air-coupled transducer[J].
Micromachines, 2022, 13(5): 781.
DOI: 10.3390/mi13050781. |
| [30] |
BLUM F, JARZYNSKI J, JACOBS L J. A focused two-dimensional air-coupled ultrasonic array for non-contact generation[J].
NDT & E International, 2005, 38(8): 634-642.
|
| [31] |
WANG C, GAO H, ZHOU X, et al. Design, fabrication, and characterization of 1-3 piezoelectric composite air-coupled ultrasonic transducers with micro-membrane filter matching layer [J]. Sensors and Actuators A: Physical, 2024: 115955.
|
| [32] |
JAE LEE H, ZHANG S, MEYER R J, et al. Characterization of piezoelectric ceramics and 1-3 composites for high power transducers[J].
Applied Physics Letters, 2012, 101(3): 032902.
DOI: 10.1063/1.4737651. |
| [33] |
MANBACHI A, COBBOLD R S. Development and application of piezoelectric materials for ultrasound generation and detection[J].
Ultrasound, 2011, 19(4): 187-196.
DOI: 10.1258/ult.2011.011027. |
| [34] |
YANG Y, ZHU K, SUN E, et al. Ultrabroad-bandwidth ultrasonic transducer based on Sm-doped PMN-PT ceramic/epoxy 1-3 composite[J].
Sensors and Actuators A: Physical, 2022, 346: 113873.
DOI: 10.1016/j.sna.2022.113873. |
| [35] |
ZHOU X, MA W, GAO H, et al. Air-coupled ultrasonic transducer based on lead-free piezoceramics prepared by digital light processing 3D printing[J].
Ultrasonics, 2024, 143: 107429.
DOI: 10.1016/j.ultras.2024.107429. |
| [36] |
MA H, XIONG K, WU J, et al. Noncontact photoacoustic angiography with an air-coupled ultrasonic transducer for evaluation of burn injury[J].
Applied Physics Letters, 2019, 114(13): 133701.
DOI: 10.1063/1.5088857. |
| [37] |
DEáN-BEN X L, PANG G A, MONTERO DE ESPINOSA F, et al. Non-contact optoacoustic imaging with focused air-coupled transducers[J].
Applied Physics Letters, 2015, 107(5): 051105.
DOI: 10.1063/1.4928123. |
| [38] |
LANDA F J O, DEáN-BEN X L, MONTERO DE ESPINOSA F, et al. Noncontact monitoring of incision depth in laser surgery with air-coupled ultrasound transducers[J].
Optics Letters, 2016, 41(12): 2704-2707.
DOI: 10.1364/OL.41.002704. |
| [39] |
QIU C, ZHANG Z, XU Z, et al. Transparent ultrasonic transducers based on relaxor ferroelectric crystals for advanced photoacoustic imaging[J].
Nature Communications, 2024, 15(1): 1-14.
DOI: 10.1038/s41467-023-43650-z. |
| [40] |
QIU C, WANG B, ZHANG N, et al. Transparent ferroelectric crystals with ultrahigh piezoelectricity[J].
Nature, 2020, 577(7790): 350-354.
DOI: 10.1038/s41586-019-1891-y. |
| [41] |
CHO S, KIM M, AHN J, et al. An ultrasensitive and broadband transparent ultrasound transducer for ultrasound and photoacoustic imaging in-vivo[J].
Nature Communications, 2024, 15(1): 1444.
DOI: 10.1038/s41467-024-45273-4. |
| [42] |
何勇, 廖唐云, 吴俊伟, 等. 基于透明超声换能器的光声显微镜设计[J].
中国激光, 2022, 49(3): 98-104.
HE Y, LIAO T Y, WU J W, et al. Design of photoacoustic microscope based on transparent ultrasonic transducer[J]. Chinese Journal of Lasers, 2022, 49(3): 98-104. |
| [43] |
LIAO T, LIU Y, WU J, et al. Centimeter-scale wide-field-of-view laser-scanning photoacoustic microscopy for subcutaneous microvasculature in vivo[J].
Biomedical Optics Express, 2021, 12(5): 2996-3007.
DOI: 10.1364/BOE.426366. |
| [44] |
KIM D, PARK E, PARK J, et al. An ultraviolet-transparent ultrasound transducer enables high-resolution label‐free photoacoustic histopathology[J].
Laser & Photonics Reviews, 2024, 18(2): 2300652.
|
| [45] |
PARK J, PARK B, KIM T Y, et al. Quadruple ultrasound, photoacoustic, optical coherence, and fluorescence fusion imaging with a transparent ultrasound transducer[J].
Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(11): e1920879118.
|
| [46] |
XUE X, WU H, CAI Q, et al. Flexible ultrasonic transducers for wearable biomedical applications: a review on advanced materials, structural designs, and future prospects[J].
IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 2024, 71(7): 786-810.
DOI: 10.1109/TUFFC.2023.3333318. |
| [47] |
CHEN J, LIU J, CHEN W, et al. Skin-conformable flexible and stretchable ultrasound transducer for wearable imaging[J].
IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 2024, 71(7): 811-820.
DOI: 10.1109/TUFFC.2024.3352655. |
| [48] |
CHEN W, LIU J, LEI S, et al. Flexible ultrasound transducer with embedded optical shape sensing fiber for biomedical imaging applications[J].
IEEE Transactions on Biomedical Engineering, 2023, 70(10): 2841-2851.
DOI: 10.1109/TBME.2023.3266367. |
| [49] |
KIM T, CUI Z, CHANG W Y, et al. Flexible 1-3 composite ultrasound transducers with silver-nanowire-based stretchable electrodes[J].
IEEE Transactions on Industrial Electronics, 2019, 67(8): 6955-6962.
|
| [50] |
李尧, 夏子颐, 李晓兵, 等. 柔性无损检测超声线阵换能器的仿真研究[J].
建模与仿真, 2024, 13(3): 2223-2232.
LI Y, XIA Z Y, LI X B, et al. Simulation study on flexible non-destructive testing of ultrasonic linear array transducers[J]. Modeling and Simulation, 2024, 13(3): 2223-2232. DOI: 10.12677/mos.2024.133204. |
| [51] |
HU H, ZHU X, WANG C, et al. Stretchable ultrasonic transducer arrays for three-dimensional imaging on complex surfaces[J].
Science Advances, 2018, 4(3): eaar3979.
DOI: 10.1126/sciadv.aar3979. |
| [52] |
DE OLIVEIRA T F, PAI C N, MATUDA M Y, et al. Development of a 2.25 MHz flexible array ultrasonic transducer[J].
Research on Biomedical Engineering, 2019, 35: 27-37.
DOI: 10.1007/s42600-019-00006-1. |
| [53] |
ZHOU S, GAO X, PARK G, et al. Transcranial volumetric imaging using a conformal ultrasound patch[J].
Nature, 2024, 629(8013): 810-818.
DOI: 10.1038/s41586-024-07381-5. |
| [54] |
LEE J H, CHO I J, KO K, et al. Flexible piezoelectric micromachined ultrasonic transducer (pMUT) for application in brain stimulation[J].
Microsystem Technologies, 2017, 23: 2321-2328.
DOI: 10.1007/s00542-016-2912-5. |
| [55] |
LYU W, MA Y, CHEN S, et al. Flexible ultrasonic patch for accelerating chronic wound healing[J].
Advanced Healthcare Materials, 2021, 10(19): 2100785.
DOI: 10.1002/adhm.202100785. |
| [56] |
PENG C, CHEN M, SIM H K, et al. Noninvasive and nonocclusive blood pressure monitoring via a flexible piezo-composite ultrasonic sensor[J].
IEEE Sensors Journal, 2020, 21(3): 2642-2650.
|
| [57] |
WANG X, JI Z, YANG S, et al. Morphological-adaptive photoacoustic tomography with flexible transducer and flexible orientation light[J].
Optics Letters, 2017, 42(21): 4486-4489.
DOI: 10.1364/OL.42.004486. |
| [58] |
CHEN J, FEI C, LIN D, et al. A review of ultrahigh frequency ultrasonic transducers[J].
Frontiers in Materials, 2022, 8: 733358.
DOI: 10.3389/fmats.2021.733358. |
| [59] |
王嘉程, 王丽坤, 仲超. 1-3 型压电复合材料研究进展[J].
电子元件与材料, 2021, 40(3): 219-228.
WANG J C, WANG L K, ZHONG C. Recent advance in 1-3 piezoelectric composites[J]. Electron Compon Mater, 2021, 40(3): 219-228. |
| [60] |
史新旺, 冯炼, 周小伟. 基于凸阵列超声换能器的宽波束成像算法研究 [J]. 中国生物医学工程学报, 2024, 43(3): 278-285.
SHI X W, FENG L, ZHOU X W. Implementation of wide-beam ultrasound imaging based on a convex transducer [J]. Chinese Journal of Biomedical Engineering, 2024, 43(3): 278-285. |
| [61] |
孔凡国, 陈然然, 段文科. 高频医用超声换能器的研究现状及发展趋势[J].
功能材料与器件学报, 2015(5): 133-138.
KONG F G, CHEN R R, DUAN W K. Research status and development trend of high-frequency medical ultrasonic transducer[J]. Journal of Functional Materials and Devices, 2015(5): 133-138. |
| [62] |
LEI Z, XU G, LIU J, et al. Low-stress ultrafast laser micromachining for high-frequency pmn-pt/epoxy composite transducers[J].
IEEE Sensors Journal, 2024, 24(5): 5873-5884.
DOI: 10.1109/JSEN.2023.3347881. |
| [63] |
田俊亭, 李晓兵, 丁伟艳, 等. 软模板法制备高频超声换能器用 1-3 复合压电材料[J].
Journal of Inorganic Materials, 2022, 37(5): 507-512.
TIAN J T, LI X B, DING W Y, et al. Fabrication of 1-3 piezocomposites via soft mold method for high-frequency ultrasound transducer[J]. Journal of Inorganic Materials, 2022, 37(5): 507-512. DOI: 10.15541/jim20210282. |
| [64] |
ROA C F, CHéRIN E, SINGH N, et al. Development of a small-footprint 50 mhz linear array: fabrication and micro-ultrasound imaging demonstration[J].
Sensors, 2024, 24(6): 1847.
DOI: 10.3390/s24061847. |
| [65] |
CHEN W, ZHANG Q, LIU J, et al. Design and fabrication of a high-frequency microconvex array transducer for small animals imaging[J].
IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 2022, 69(6): 1943-1951.
DOI: 10.1109/TUFFC.2022.3146309. |
| [66] |
FOSTER F S, MEHI J, LUKACS M, et al. A new 15~50 MHz array-based micro-ultrasound scanner for preclinical imaging[J].
Ultrasound in medicine & biology, 2009, 35(10): 1700-1708.
|
| [67] |
BEZANSON A, ADAMSON R, BROWN J A. Fabrication and performance of a miniaturized 64-element high-frequency endoscopic phased array[J].
IEEE Transactions on Ultrasonics Ferroelectrics & Frequency Control, 2014, 61(1): 33-43.
|
| [68] |
CUMMINS T, ELIAHOO P, SHUNG K K. High-frequency ultrasound array designed for ultrasound-guided breast biopsy[J].
IEEE Transactions on Ultrasonics Ferroelectrics & Frequency Control, 2016, 63(6): 817-827.
|
| [69] |
RIVANDI H, COSTA T L. A 2d ultrasound phased-array transmitter asic for high-frequency us stimulation and powering[J].
IEEE Transactions on Biomedical Circuits and Systems, 2023, 17(4): 701-712.
DOI: 10.1109/TBCAS.2023.3288891. |
| [70] |
RAHIMI S, JONES R M, HYNYNEN K. A high-frequency phased array system for transcranial ultrasound delivery in small animals[J].
IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 2020, 68(1): 127-135.
|
| [71] |
BLACKMORE J, SHRIVASTAVA S, SALLET J, et al. Ultrasound neuromodulation: a review of results, mechanisms and safety[J].
Ultrasound in Medicine & Biology, 2019, 45(7): 1509-1536.
|
| [72] |
HE J, ZHU Y, WU C, et al. Simultaneous multi-target ultrasound neuromodulation in freely-moving mice based on a single-element ultrasound transducer[J].
Journal of Neural Engineering, 2023, 20(1): 016021.
DOI: 10.1088/1741-2552/acb104. |
| [73] |
YANG Y, YUAN J, FIELD R L, et al. Induction of a torpor-like hypothermic and hypometabolic state in rodents by ultrasound[J].
Nature Metabolism, 2023, 5(5): 789-803.
DOI: 10.1038/s42255-023-00804-z. |
| [74] |
YANG H, YAN J, JI H, et al. Modulatory effect of low-intensity transcranial ultrasound stimulation on behaviour and neural oscillation in mouse models of alzheimer’s disease[J].
IEEE Transactions on Neural Systems and Rehabilitation Engineering, 2024, 32: 770-780.
DOI: 10.1109/TNSRE.2024.3363912. |
| [75] |
HE J, WU J, ZHU Y, et al. Multitarget transcranial ultrasound therapy in small animals based on phase-only acoustic holographic lens[J].
IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 2021, 69(2): 662-671.
|
| [76] |
KIM M G, YU K, YEH C Y, et al. Low-intensity transcranial focused ultrasound suppresses pain by modulating pain-processing brain circuits[J].
Blood, 2024, 144(10): 1101-1115.
DOI: 10.1182/blood.2023023718. |
| [77] |
ZHU Y, HE J, WU C, et al. Multi-Target Ultrasound Neuromodulation in the Treatment of Freely Moving Depression Mice[C]//2022 IEEE International Ultrasonics Symposium (IUS) . Venice: IEEE, 2022: 1-3.
|
| [78] |
ZHU Y, HE J, WU C, et al. Transcranial ultrasound stimulation relieves depression in mice with chronic restraint stress[J].
Journal of Neural Engineering, 2023, 20(3): 036011.
DOI: 10.1088/1741-2552/ac8bfd. |
| [79] |
ZHUANG X, HE J, WU J, et al. A spatial multitarget ultrasound neuromodulation system using high-powered 2-D array transducer[J].
IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 2022, 69(3): 998-1007.
DOI: 10.1109/TUFFC.2022.3140889. |
 2025, Vol. 42
2025, Vol. 42

