随着人口老龄化程度的加重,帕金森病和脑卒中的发病人数快速增长,这类疾病会导致手部肌肉难以控制[1–4],需要长时间的损伤评估和康复治疗才能改善。压力传感器可以将外力转化为电信号[5],因此在诊断和治疗方面有广泛应用。然而,传统的金属基传感器质地较硬,操作困难,如手握测力计的使用需要专业医护人员协助。水凝胶材料兼具优异的柔韧性和可变形性,且具有良好的生物相容性[6],因此被广泛应用于组织工程、生物医学、柔性电子器件和柔性固态储能领域[7-8]。然而,传统水凝胶的机械性能较差,其强度和韧性之间存在显著冲突[9-11],提高强度会导致水凝胶硬化,从而降低其韧性,因此,制备一种兼具强度和韧性的导电水凝胶仍然具有挑战性。
天然材料如木材、肌腱、骨骼和韧带等,在不同尺度上具有多级结构,这类多级结构被研究者认为对其机械性能有着关键作用[12]。近年来,研究者通过静电纺丝、机械训练[13]、3D打印、定向冷冻[14]等方法构建了仿天然材料的多级结构。Wu等[15]通过盐析辅助预拉伸处理制备了具有全面力学性能的聚乙烯醇/纤维素纳米纤维杂化水凝胶,其具有类似木质各向异性。但这类水凝胶制备方法仍然存在明显缺陷,例如通过定向冷冻制备时,聚合物链只能进行有限的浓缩与交联,这会影响水凝胶的凝胶化过程甚至无法成胶。此外,水凝胶材料如用于柔性传感领域,还需要额外的步骤引入导电填充材料或者引导导电聚合物进行原位聚合[16-17]。这种需求会使得制备过程更为复杂,或影响到材料的强度或韧性。
对水凝胶进行盐析处理,通过霍夫迈尔斯特效应使聚合物链增加交联密度或诱导链纠缠,从而进一步强化水凝胶的机械性能和韧性[18-22]。研究者将水凝胶浸泡在盐溶液中,利用盐析效应引入疏水交联和增强晶域,增加水凝胶网络的密度。此外,水凝胶网络密度的提升有助于形成额外的交联键,这也进一步地提升了水凝胶的机械性能。Wu等[23]详细探究了不同阴阳离子的霍夫迈尔斯特效应及其对PVA基水凝胶力学性能的影响。
本文通过定向冷冻制备PVA/PEI水凝胶,并将其浸泡在硫酸钠(Na2SO4)水溶液中,不同的浸泡时间得到不同的PVA/PEI-Na2SO4(PP-S)水凝胶。在定向冷冻过程中,聚乙烯醇(PVA)和聚乙烯亚胺(Polyetherimide,PEI)链沿冰柱生长,形成有序的内部取向结构。浸入Na2SO4溶液引起的盐析作用提高了网络结构密度,增强了水凝胶的力学性能和电学性能。通过对其成分、机械性能、电学性能和由其组装的压阻传感器传感性能的分析,探讨了定向冷冻和盐析效应协同对PP-S水凝胶机械性能、韧性及其对外界刺激产生稳定电信号响应的影响。
1 实验部分 1.1 材料聚乙烯醇1799型(PVA)(醇解度:98%~99%(摩尔分数))、聚乙烯亚胺(PEI)(分析纯,相对分子质量为10 000)和硫酸钠(Na2SO4)(分析纯,相对分子质量为142)均购自上海阿拉丁生化科技股份有限公司。
1.2 试验仪器FD-1C型冷冻干燥机,北京松源华兴科技发展有限公司;Nicolet6700型全波段研究级红外光谱仪(FT-IR) ,美国 Thermofisher 公司;S-3700N型钨灯丝扫描电子显微镜,日本 Hitachi 公司;CMT-
将1.0 g的PVA粉末和1.0 g的PEI溶液溶解在10.0 mL的去离子水中,然后通过磁力搅拌在水浴(95 ℃) 中加热2 h以制备均相的溶液。冷却至室温后,将预凝胶溶液导入自制的容器内(侧壁为3 mm厚聚四氟乙烯,底部为铜底),使用液氮作为冷源,将容器置于液氮中。预凝胶溶液从底部开始结冰,直至预凝胶溶液完全冻结,在室温下解冻,重复3次后放入−20 ℃冰箱冷冻3 h,在室温下解冻,然后将前驱体PVA/PEI水凝胶放入40 mL1 mol/LNa2SO4溶液中浸泡0,3,6,12 h,分别命名为PP-S-0、PP-S-3、PP-S-6和PP-S-12。
1.4 PP-S水凝胶成分结构测试采用FTIR表征材料化学结构。将冻干后的水凝胶试样经充分研磨后,与KBr以1:100的质量比进行混合。在400~4 000 cm−1范围内获得样品的FTIR曲线,扫描次数32次。
1.5 PP-S水凝胶微观形貌测试使用冷冻干燥机将样品进行真空冷冻干燥,然后在液氮中进行淬断,粘贴在样品台中,并喷铂金覆盖。使用场发射扫描电子显微镜在5 kV的加速电压下获得有机凝胶横截面形貌图像。
1.6 PP-S水凝胶机械性能测试在25 ℃下通过电子万能试验机对水凝胶样品进行单轴压缩测试,压缩速度为10 mm/min,采样频率为30 Hz。通过电子万能试验机对水凝胶样品进行循环压缩测试,压缩速度为10 mm/min,采样频率为30 Hz,压缩形变率为10%、20%、30%、40%、50%,样品为圆柱状。通过电子万能试验机对水凝胶样品进行加载−卸载压缩循环测试,压缩速度为10 mm/min,采样频率为30 Hz,压缩形变率为50%,连续压缩50次,样品为圆柱状。
1.7 PP-S水凝胶电学性能测试采用四探针测量仪对PP-S水凝胶的电导率进行测量,所有样品裁剪为圆柱体。将2个带有铜线的铜箔固定在水凝胶样品两端,用作组装传感器。采用数字万用表测量水凝胶在不同形变下电阻变化,电阻变化率由式(1)计算。
| $ \frac{{\Delta }R}{{R}_{0}}=\frac{{R}_{1}-{R}_{0}}{{R}_{0}}$ | (1) |
式中:R0为水凝胶的初始电阻,R1为施加应变后水凝胶的实时电阻。水凝胶传感器的压力敏感度S计算如式(2)所示,其中ΔP是测试时施加的应变。
| $ S=\left({\Delta }R/{R}_{0}\right) /{\Delta }P$ | (2) |
将2个带有铜线的铜箔固定在水凝胶样品两端,用作组装传感器,通过自制传感器导出传感数据用于手指肌肉康复训练。
2 实验结果及讨论 2.1 PP-S水凝胶的构建原理PP-S水凝胶是通过将PVA/PEI水溶液填充至自制的聚四氟乙烯模具中,然后在以液氮为冷源的基板上进行冷冻制得。根据在Na2SO4溶液中浸泡时间的不同,分为PP-S-0、PP-S-3、PP-S-6和PP-S-12四组,构建原理如图1所示,冷冻过程中存在的温度差使冰晶从底部开始生长,过程中使得PVA/PEI相与水溶液分离和浓缩,促进了PVA/PEI链发生链纠缠。PVA上的大量羟基(−OH)和PEI上的大量胺基(−NH2)在密集环境中形成了氢键的富集区。PVA的结晶域和氢键完成了水凝胶的交联。后将PVA/PEI水凝胶浸泡入1 mol/L的Na2SO4溶液中,水凝胶在浸泡过程中失水体积收缩,减小了PVA/PEI链之间的距离,提高了交联密度。

|
图 1 PP-S水凝胶构建原理示意图 Figure 1 Schematic diagram of PP-S hydrogel construction principle |
将PP-S-0水凝胶浸泡在硫酸钠溶液一定时间后,水凝胶形态会发生明显变化,变得更为密致,从半透明状态变为不透明状态,如图2 (a) 所示。为了确定PP-S水凝胶内化学结构的变化,利用FTIR测试进行证明,如图2 (b) 所示,PP-S-0水凝胶在3 350 cm−1处的宽峰是PVA的−OH基团和PEI的−NH2的拉伸震动,当水凝胶浸泡入Na2SO4溶液后,这些峰都向更高的波数移动(3 374 cm−1),表明聚合物链之间的氢键相互作用增强[24]。PP-S-0水凝胶在1 100 cm−1处的峰来自于C−O的拉伸震动,当水凝胶浸泡入Na2SO4溶液后,PP-S水凝胶的1 100 cm−1处的峰出现增强,表明成功引入

|
图 2 浸泡硫酸钠前后PP-S水凝胶的实物图和微观形貌 Figure 2 Physical and microscopic morphology of PP-S hydrogels before and after soaking in sodium sulphate |
PP-S水凝胶优异的机械性能和韧性源自其多级结构,其特点是具有沿冰晶方向的纤维状微观结构和PVA/PEI链纠缠的亚微米级纤维结构。为了观察PP-S水凝胶的微观结构,使用扫描电子显微镜(SEM)对各组PP-S水凝胶的微观结构进行观察。
如图2 (c) 所示,各组PP-S水凝胶均出现沿冰晶生长方向的高度有序的纤维结构。PP-S-0水凝胶在纤维结构和侧壁上有大孔结构。通过Na2SO4溶液浸泡,PVA/PEI链在盐析效应作用下发生了链缠结,使网络结构致密化[25]。随着浸泡时间的延长,水凝胶侧壁的孔洞直径减小,纤维结构明显增强。PP-S-6和PP-S-12表现出相似的纤维结构和在表面有Na2SO4晶体析出。
2.3 PP-S水凝胶的机械性能分析PP-S水凝胶具有双网络结构,通过定向冷冻和盐析处理的协同作用,形成纤维状的几何结构,从而导致了PP-S水凝胶兼具了良好的抗压强度和韧性。为了评价不同浸泡时间对于PP-S水凝胶力学压缩性能的影响,使用电子万能测试仪对各组PP-S水凝胶进行力学压缩实验。
如图3 (a) 所示,所有浸泡后的水凝胶的力学性能均优于未浸泡的PP-S-0水凝胶,且随着浸泡时间的增加,水凝胶的抗压强度不断增加。如图3 (b) 所示,PP-S水凝胶与已报道的水凝胶对比,具有更高的应变和压缩强度,说明了PP-S水凝胶的优异性[26-34]。如图3 (c) 和(d) 所示,对比未进行盐析处理的PP-S-0,PP-S-6的压缩强度提高了4.92倍,从1.21 MPa提高到5.98 MPa。PP-S-6的压缩模量从

|
图 3 PP-S水凝胶的压缩性能(* p≤0.05 ** p≤0.01 *** p≤0.001) Figure 3 Compression properties of PP-S hydrogel (* p≤0.05 ** p≤0.01 *** p≤0.001) |
随后,对PP-S-6水凝胶进行不同应变下循环压缩测试,测试其在负载−卸载过程中的能量耗散,如图4 (a) 所示。在10%~50%应变的压缩下,PP-S-6水凝胶的循环压缩曲线都为闭合的滞后曲线,表明了其优秀的恢复能力。随着压缩应变的增加,滞后曲线的面积也随之提升,这表明所耗散的能量增多。如图4 (b)所示,相应耗散能量从0.03 MJ/m3增加到3.97 MJ/m3。
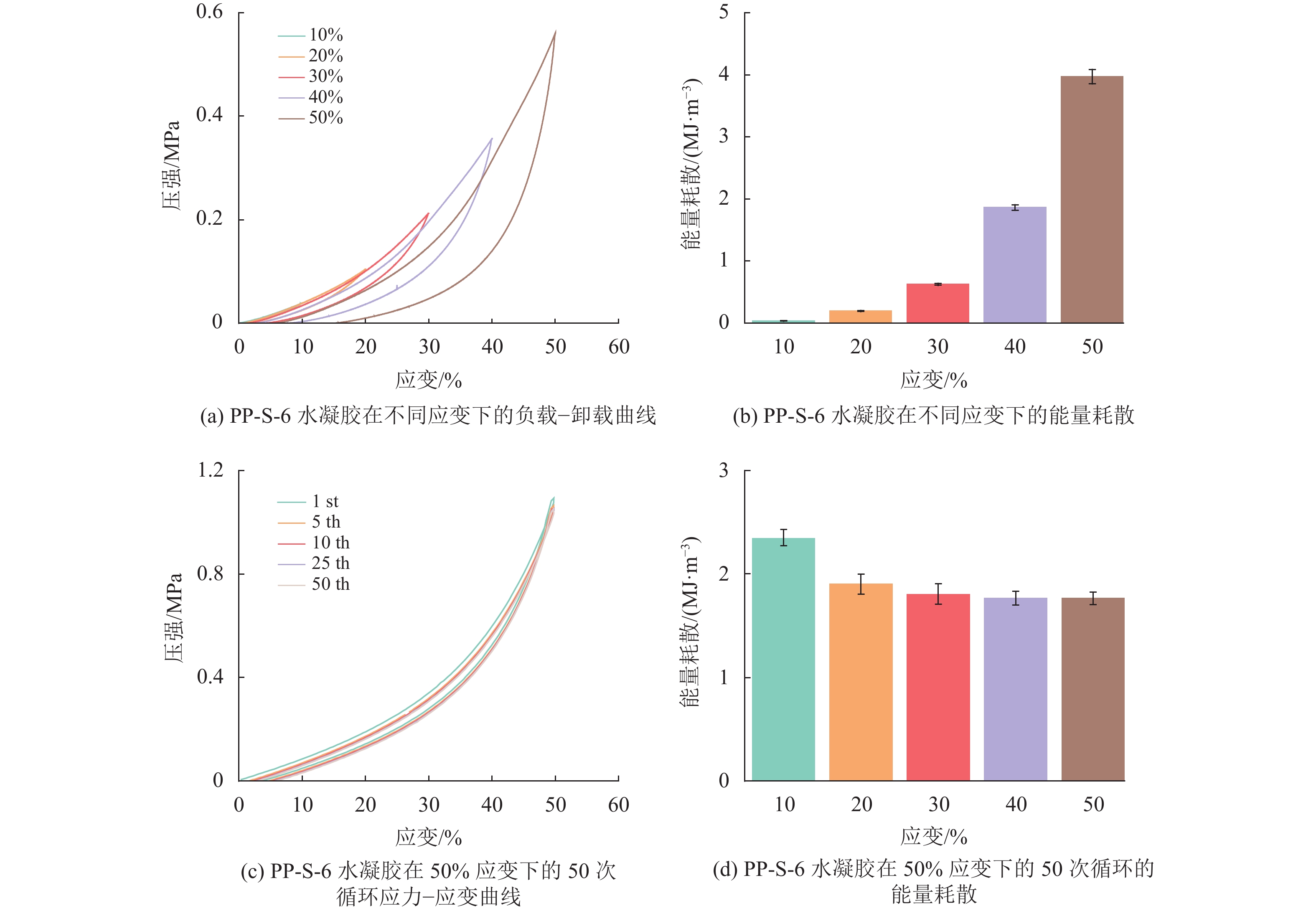
|
图 4 PP-S水凝胶的机械性能 Figure 4 Mechanical properties of PP-S hydrogel |
对PP-S-6水凝胶进行50%应变下的循环压缩,结果如图4 (c) 所示,可以看出在50次循环中,PP-S水凝胶的负载−卸载曲线几乎重合,滞后曲线的面积保持相近。如图4 (d) 所示,相应的耗散能量仅从2.34 MJ/m3略微下降到1.77 MJ/m3,表明PP-S-6水凝胶在50%应变下具有优异的回弹性和循环稳定性。
2.4 PP-S水凝胶的电学性能分析PP-S水凝胶通过浸泡Na2SO4获得了离子导电的能力,使用四探针测试法测定了PP-S水凝胶的电导率,如图5 (a) 所示。随着浸泡时间的增加,PP-S水凝胶的电导率出现明显的提升,从0.111±
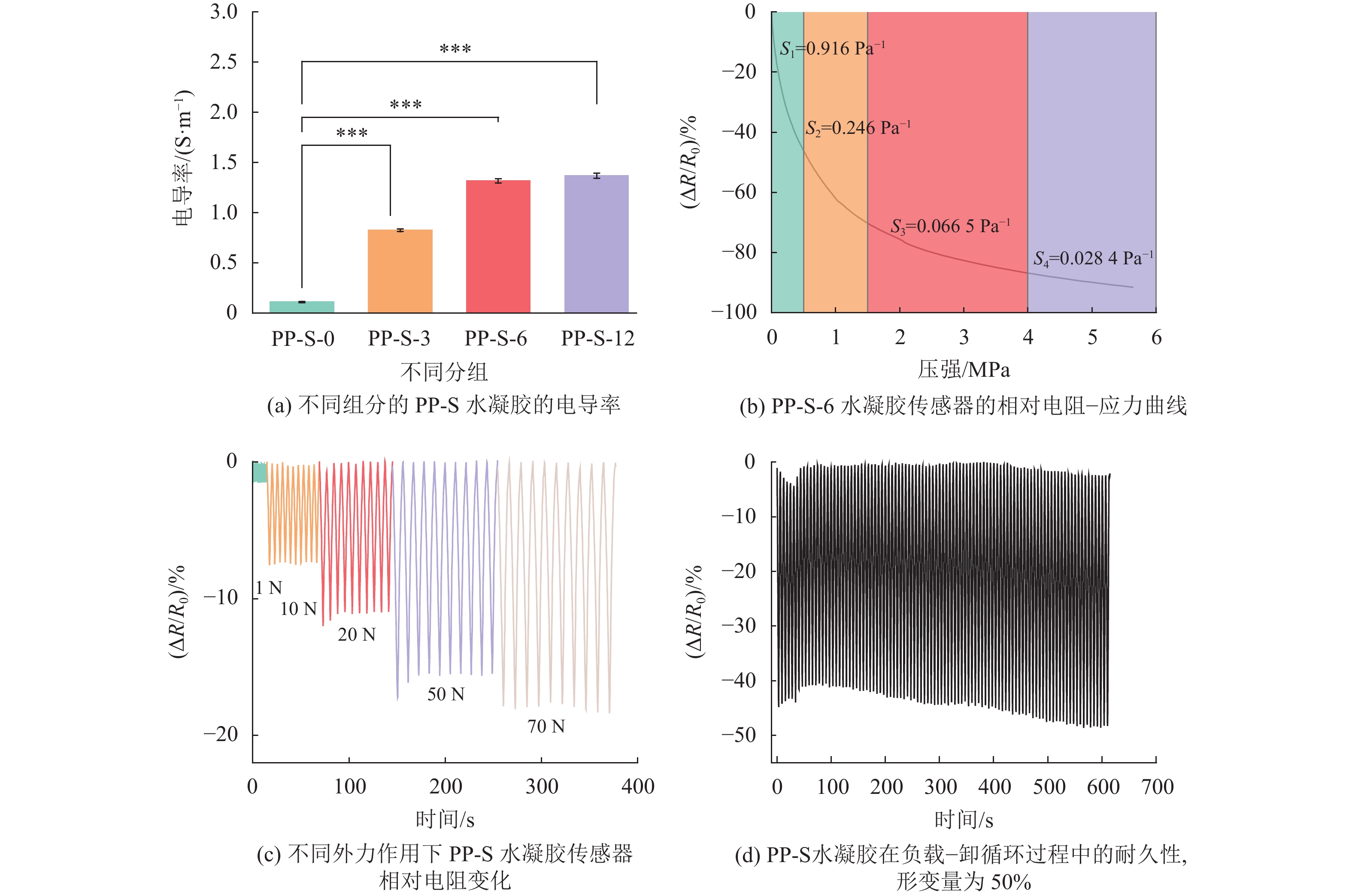
|
图 5 PP-S水凝胶的电学性能(* p≤0.05 ** p≤0.01 *** p≤0.001) Figure 5 Electrical properties of PP-S hydrogel (* p≤0.05 ** p≤0.01 *** p≤0.001) |
PP-S水凝胶除了具有优秀的机械性能和韧性外,得益于盐析处理时引入的丰富的游离离子(Na+和
压力传感器的压力敏感度是其性能的重要指标,如图5 (b) 所示,通过相对电阻−应力测试证明PP-S-6水凝胶压力传感器拥有良好的灵敏度,具体而言,在0~0.5 MPa范围内灵敏度S1=0.916 Pa−1,在0.5~1.5 MPa范围内灵敏度S2=0.246 Pa−1,在1.5~4 MPa范围内灵敏度S3=0.066 5 Pa−1,在4~5.6 MPa范围内灵敏度S4=0.028 4 Pa−1。为了测试PP-S-6水凝胶压力传感器在不同外力作用下的电阻变化情况,如图5 (c) 所示,当外力低至1 N时,仍能准确稳定地产生电信号,说明水凝胶压力传感器有高灵敏度。
为了进一步表明PP-S-6水凝胶的耐久性和可重复性,对其进行了100次负载−卸载循环,如图5 (d) 所示,在100次循环中,电阻变化稳定,表明PP-S-6水凝胶具有良好的耐久性和可重复性。通过不同外力下的负载−卸载循环100次测试,表明PP-S-6水凝胶具有良好的应变响应稳定性和耐久性,可作为人体柔性应变传感器使用。
2.5 PP-S水凝胶用于康复训练帕金森或卒中患者会表现出显著的肢体肌肉控制能力异常,因此需要对其进行长时间的恢复锻炼,以增强其关节运动范围、肌肉舒展程度,提升运动能力。目前主流的训练设备是握力球或气动康复手套,然而这些设备难以量化训练指标。
在此设计了一种基于PP-S水凝胶压力传感器的手指肌力训练设备,用于评估训练手指的肌肉力量。该设备由3部分组成:(1) 由PP-S-6水凝胶组装成的水凝胶传感器;(2) 由模数转换器和放大器组装的信号处理设备;(3) 用于处理输入信号并进行训练设置的软件程序。当使用者用手指按压PP-S水凝胶压力传感器时,水凝胶的电阻发生变化,数据采集设备捕获并分析电阻值变化,以直观的图形界面进行显示。如图6 (a) 所示,使用者可以根据图形界面控制按压PP-S水凝胶压力传感器,在检测仪器上可以观察按压力度的变化,以此控制按压力量来达到对肌力控制的训练。图6 (b) 为手指力量耐久测试,需要使用者以合适的力量按压并维持8 s。图6 (c) 为手指肌肉灵敏度测试,需要使用者以相同的力量以1次/s的频率按压传感器。
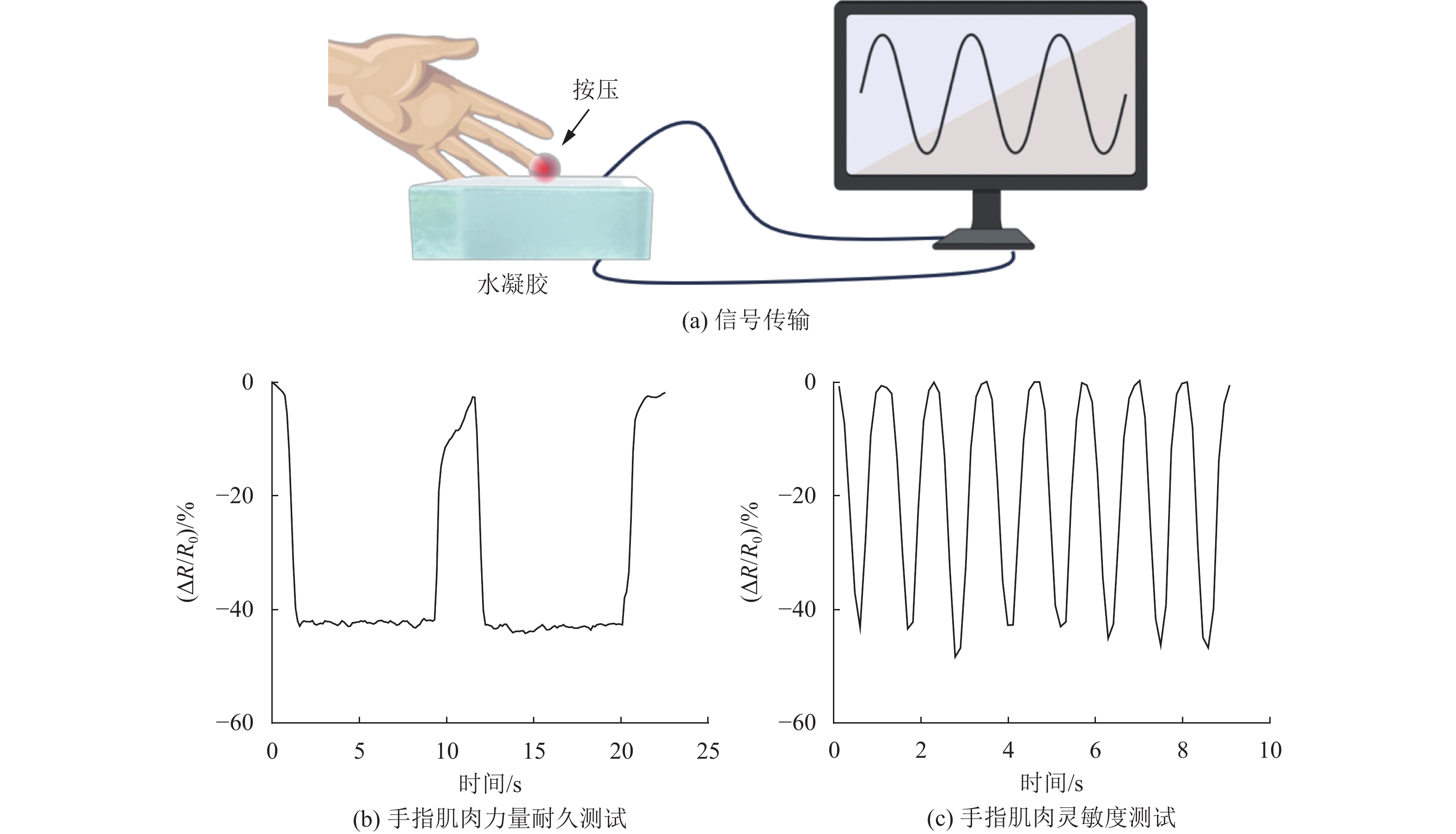
|
图 6 PP-S水凝胶作为柔性可穿戴传感器的应用 Figure 6 Application of PP-S hydrogel as a flexible wearable sensor |
本研究通过定向冷冻与盐析协同作用,制备了兼具高强度、高韧性和优异电学性能的PVA/PEI-Na2SO4(PP-S)水凝胶。通过定向冷冻构建纤维状微观结构,并利用盐析效应增加交联密度,显著提升了水凝胶的机械性能和电导率。PP-S水凝胶在6 h盐析处理后,抗压强度提升至5.98 MPa,表现出优异的回弹性和循环稳定性,且其电导率达
| [1] |
BEK J, GOWEN E, VOGT S, et al. Observation and imitation of object-directed hand movements in Parkinson’s disease[J].
Scientific Reports, 2023, 13(1): 18749.
DOI: 10.1038/s41598-023-42705-x. |
| [2] |
ISLAM A, ALCOCK L, NAZARPOUR K, et al. Effect of Parkinson’s disease and two therapeutic interventions on muscle activity during walking: a systematic review[J].
npj Parkinson’s Disease, 2020, 6(1): 22.
DOI: 10.1038/s41531-020-00119-w. |
| [3] |
FADIL R, HUETHER A X A, SADEGHIAN F, et al. The effect of skeletal muscle-pump on blood pressure and postural control in Parkinson’s disease[J].
Cardiovascular Engineering and Technology, 2023, 14(6): 755-773.
DOI: 10.1007/s13239-023-00685-z. |
| [4] |
HUANG Y Z, CHANG F Y, LIU W C, et al. Fatigue and muscle strength involving walking speed in Parkinson’s disease: insights for developing rehabilitation strategy for PD[J].
Neural Plasticity, 2017, 2017: 1-9.
|
| [5] |
VEDADGHAVAMI A, MINOOEI F, MOHAMMADI M H, et al. Manufacturing of hydrogel biomaterials with controlled mechanical properties for tissue engineering applications[J].
Acta Biomaterialia, 2017, 62: 42-63.
DOI: 10.1016/j.actbio.2017.07.028. |
| [6] |
NING X J, HUANG J N, A Y H, et al. Research advances in mechanical properties and applications of dual network hydrogels[J].
International Journal of Molecular Sciences, 2022, 23(24): 15757.
DOI: 10.3390/ijms232415757. |
| [7] |
HUANG L, ZENG R, XU J, et al. Point-of-care immunoassay based on a multipixel dual-channel pressure sensor array with visual sensing capability of full-color switching and reliable electrical signals[J].
Analytical Chemistry, 2022, 94(38): 13278-13286.
DOI: 10.1021/acs.analchem.2c03393. |
| [8] |
XUE X, HU Y, DENG Y, et al. Recent advances in design of functional biocompatible hydrogels for bone tissue engineering[J].
Advanced Functional Materials, 2021, 31(19): 2009432.
DOI: 10.1002/adfm.202009432. |
| [9] |
LONG R, HUI C Y. Fracture toughness of hydrogels: measurement and interpretation[J].
Soft Matter, 2016, 12(39): 8069-8086.
DOI: 10.1039/C6SM01694D. |
| [10] |
FU J, IN HET PANHUIS M. Hydrogel properties and applications[J].
Journal of Materials Chemistry B, 2019, 7(10): 1523-1525.
DOI: 10.1039/C9TB90023C. |
| [11] |
ZHANG Y S, KHADEMHOSSEINI A. Advances in engineering hydrogels[J].
Science, 2017, 356(6337): eaaf3627.
DOI: 10.1126/science.aaf3627. |
| [12] |
WANG Y, XIE Y, XIE X, et al. Compliant and robust tissue-like hydrogels via ferric ion-induced of hierarchical structure[J].
Advanced Functional Materials, 2023, 33(12): 2210224.
DOI: 10.1002/adfm.202210224. |
| [13] |
MATSUDA T, KAWAKAMI R, NAMBA R, et al. Mechanoresponsive self-growing hydrogels inspired by muscle training[J].
Science, 2019, 363(6426): 504-508.
DOI: 10.1126/science.aau9533. |
| [14] |
YETISKIN B, OKAY O. High-strength and self-recoverable silk fibroin cryogels with anisotropic swelling and mechanical properties[J].
International Journal of Biological Macromolecules, 2019, 122: 1279-1289.
DOI: 10.1016/j.ijbiomac.2018.09.087. |
| [15] |
WU L, KANG Y, SHI X, et al. Natural-wood-inspired ultrastrong anisotropic hybrid hydrogels targeting artificial tendons or ligaments[J].
ACS Nano, 2023, 17(14): 13522-13532.
DOI: 10.1021/acsnano.3c01976. |
| [16] |
WANG L, XU T, ZHANG X. Multifunctional conductive hydrogel-based flexible wearable sensors[J].
TrAC Trends in Analytical Chemistry, 2021, 134: 116130.
DOI: 10.1016/j.trac.2020.116130. |
| [17] |
CUI J, CHEN J, NI Z, et al. High-sensitivity flexible sensor based on biomimetic strain-stiffening hydrogel[J].
ACS Applied Materials & Interfaces, 2022, 14(41): 47148-47156.
|
| [18] |
ALEID S, WU M, LI R, et al. Salting-in effect of zwitterionic polymer hydrogel facilitates atmospheric water harvesting[J].
ACS Materials Letters, 2022, 4(3): 511-520.
DOI: 10.1021/acsmaterialslett.1c00723. |
| [19] |
HUA M, WU S, MA Y, et al. Strong tough hydrogels via the synergy of freeze-casting and salting out[J].
Nature, 2021, 590(7847): 594-599.
DOI: 10.1038/s41586-021-03212-z. |
| [20] |
CUI W, ZHENG Y, ZHU R, et al. Strong tough conductive hydrogels via the synergy of ion-induced cross-linking and salting-out[J].
Advanced Functional Materials, 2022, 32(39): 2204823.
DOI: 10.1002/adfm.202204823. |
| [21] |
YE Z, CHI T, EVANS C J, et al. Implications of Supramolecular crosslinking on hydrogel toughening by directional freeze-casting and salting-out [J]. Advanced Functional Materials, 2024 : 2402613.
|
| [22] |
FENG X, XING C, WANG C, et al. Degradable, anti-swelling, high-strength cellulosic hydrogels via salting-out and ionic coordination[J].
International Journal of Biological Macromolecules, 2024, 267: 131536.
DOI: 10.1016/j.ijbiomac.2024.131536. |
| [23] |
WU S, HUA M, ALSAID Y, et al. Poly(vinyl alcohol) hydrogels with broad-range tunable mechanical properties via the hofmeister effect[J].
Advanced Materials, 2021, 33(11): 2007829.
DOI: 10.1002/adma.202007829. |
| [24] |
ZHANG L, WANG K, WENG S, et al. Super strong and tough anisotropic hydrogels through synergy of directional freeze-casting, metal complexation and salting out[J].
Chemical Engineering Journal, 2023, 463: 142414.
DOI: 10.1016/j.cej.2023.142414. |
| [25] |
DONG X, GUO X, LIU Q, et al. Strong and tough conductive organo-hydrogels via freeze-casting assisted solution substitution[J].
Advanced Functional Materials, 2022, 32(31): 2203610.
DOI: 10.1002/adfm.202203610. |
| [26] |
XIANG S. Hierarchical structural double network hydrogel with high strength, toughness, and good recoverability[J].
New Journal of Chemistry, 2017, 41(23): 14397-14402.
DOI: 10.1039/C7NJ03263C. |
| [27] |
REN J, DAI Q, ZHONG H, et al. Quaternized xylan/cellulose nanocrystal reinforced magnetic hydrogels with high strength[J].
Cellulose, 2018, 25(8): 4537-4549.
DOI: 10.1007/s10570-018-1858-4. |
| [28] |
WANG S, LI K, ZHOU Q. High strength and low swelling composite hydrogels from gelatin and delignified wood[J].
Scientific Reports, 2020, 10(1): 17842.
DOI: 10.1038/s41598-020-74860-w. |
| [29] |
WU L, MAO G, NIAN G, et al. Mechanical characterization and modeling of sponge-reinforced hydrogel composites under compression[J].
Soft Matter, 2018, 14(21): 4355-4363.
DOI: 10.1039/C8SM00678D. |
| [30] |
HARRASS K, KRÜGER R, MÖLLER M, et al. Mechanically strong hydrogels with reversible behaviour under cyclic compression with MPa loading[J].
Soft Matter, 2013, 9(10): 2869.
DOI: 10.1039/c2sm27603h. |
| [31] |
AWASTHI S, GAUR J K, PANDEY S K, et al. High-strength, strongly bonded nanocomposite hydrogels for cartilage repair[J].
ACS Applied Materials & Interfaces, 2021, 13(21): 24505-24523.
DOI: 10.1021/acsami.1c05394. |
| [32] |
KANG B, LANG Q, TU J, et al. Preparation and properties of double network hydrogel with high compressive strength[J].
Polymers, 2022, 14(5): 966-966.
DOI: 10.3390/polym14050966. |
| [33] |
FU R. A stretchable, biocompatible, and self-powered hydrogel multichannel wireless sensor system based on piezoelectric barium titanate nanoparticles for health monitoring[J].
Nano Energy, 2023, 114: 108617.
DOI: 10.1016/j.nanoen.2023.108617. |
| [34] |
YU G, ZHANG Y, WANG Q, et al. Wearable and flexible hydrogels for strain sensing and wound electrical stimulation[J].
Industrial & Engineering Chemistry Research, 2023, 62(13): 5468-5481.
|
 2025, Vol. 42
2025, Vol. 42

