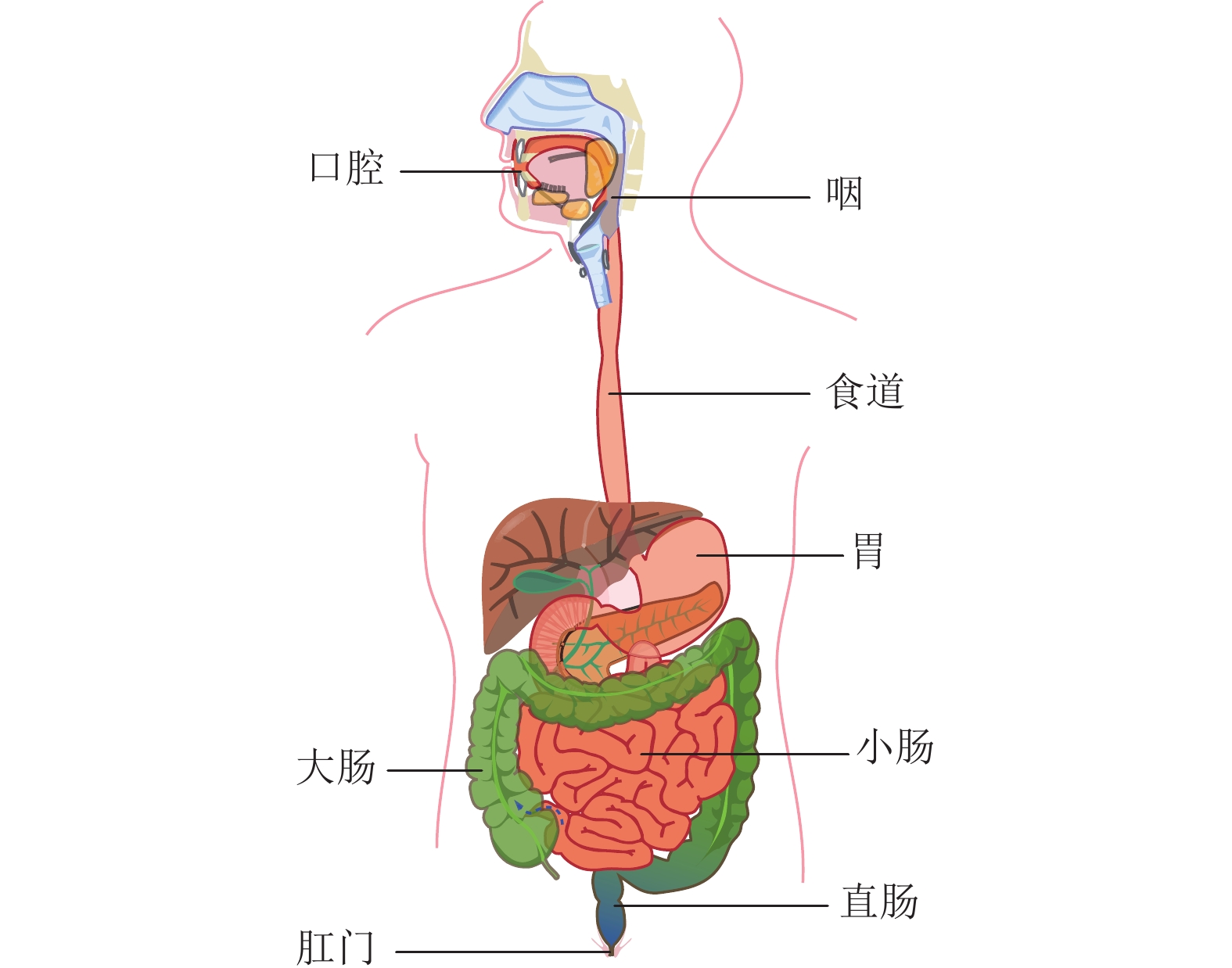
人类的消化系统(或胃肠道系统)主要负责营养物质的消化和吸收,主要由口腔、咽喉、食道、胃、小肠、大肠和肛门七部分组成,如图1所示[1]。胃肠道疾病如胃肠道炎症、胃肠道出血、胃肠道癌症、肠易激综合征(IBS)[2]等是全球范围内的常见疾病,发病率高和致死率高。比如胃肠道癌症约占病发癌症的15%,其中胃癌和食管癌的发病率和死亡率均居前十[3]。癌症患者的生存率与诊断阶段高度相关,如在第一阶段检测到结直肠癌的患者存活率为97.7%,而在第四阶段检测到结直肠癌的存活率降至43.9%[4]。癌症前期筛查诊断和预防能有效提高患者的存活率、提高治疗效果及降低治疗费用[5]。因此,胃肠道疾病(特别是癌症)的早期筛查诊断至关重要[6]。
|
图 1 人体消化系统示意图[1] Figure 1 Schematic diagram of human digestive system |
胃肠道疾病的早筛一般采用传统内窥镜。但传统内窥镜检查具有侵入性,引起患者不适和疼痛,导致患者接受度低,且对小肠段无法进行检查,造成小肠段疾病无法进行有效诊治。另外传统内窥镜对医生技能要求高,以防对患者造成穿孔撕裂等二次伤害,加重医师的治疗负担。胶囊内窥镜最初由Swain等[7-8]于1981年提出,吞服后通过胃肠道的蠕动和重力作用被动穿过整个胃肠道。期间胶囊内窥镜上的摄像头对小肠内部进行拍摄,通过图像发射器将图片传输到体外的接收设备。1999年英国伦敦皇家医院首次使用胶囊内窥镜进行人体临床实验,最终成功获取了小肠图像[9]。此次实验不仅验证了胶囊内窥镜的可行性,更是胶囊内窥镜的里程碑突破。此后,胶囊内窥镜得到了广泛关注并得到飞速发展,成功进入商业医疗应用阶段。
相较于传统内窥镜,胶囊内窥镜不会给患者造成明显不适,一次性胶囊内窥镜能有效降低传统内窥镜重复使用带来的交叉感染风险,且在疾病诊断效率方面,敏感性和特异性与传统内窥镜相当[10]。胶囊内窥镜在2001年商业化后即成为小肠全面筛查的金标准,现已广泛应用于胃肠道疾病的诊断,且成为部分胃肠道疾病的优先初始诊断方案,如胃肠道不明原因出血、炎症性小肠病、克罗恩病和小肠肿瘤等[11-12]。
虽然胶囊内窥镜在使用性、安全性和诊断敏感性等方面有优势,但还存在一定的局限性:(1) 功能单一,现有的胶囊内窥镜仅具有成像功能,不具备组织活检、病变位置标记、给药等功能;(2) 主动运动能力弱,现有的胶囊内窥镜大多是被动运动,无法精准控制其在胃肠道内的运动;(3) 供能不足,如增加新的功能模块,现有供能模式功率不足;(4) 诊断效率和质量需要提升,现在人工阅片时间长,且影响诊断质量[13]。研究人员正在积极探索将机器人技术集成到胶囊内窥镜当中,将功能单一的胶囊内窥镜发展为多功能的主动运动胶囊机器人,使得新研制的胶囊机器人具有主动运动、活检采样、药物输送等功能[14]。
目前胶囊机器人的驱动方式包括:(1) 微型电机驱动[15-16];(2) 磁驱动[17-18];(3) 能量转换型驱动,包括利用磁铁相互作用力和冲击驱动[19]、利用振动驱动[20]、利用形状记忆合金驱动[21]等。微型电机驱动方式对电量需求高,不利于胶囊机器人的续航;能量转换型驱动方式所需空间大,不利于胶囊机器人微型化和多功能集成。磁驱动方式具有可使胶囊本体内部响应机构简化、低频磁场对人体无害、远程供能等优点而被认为是最具发展潜力的驱动方式[22]。
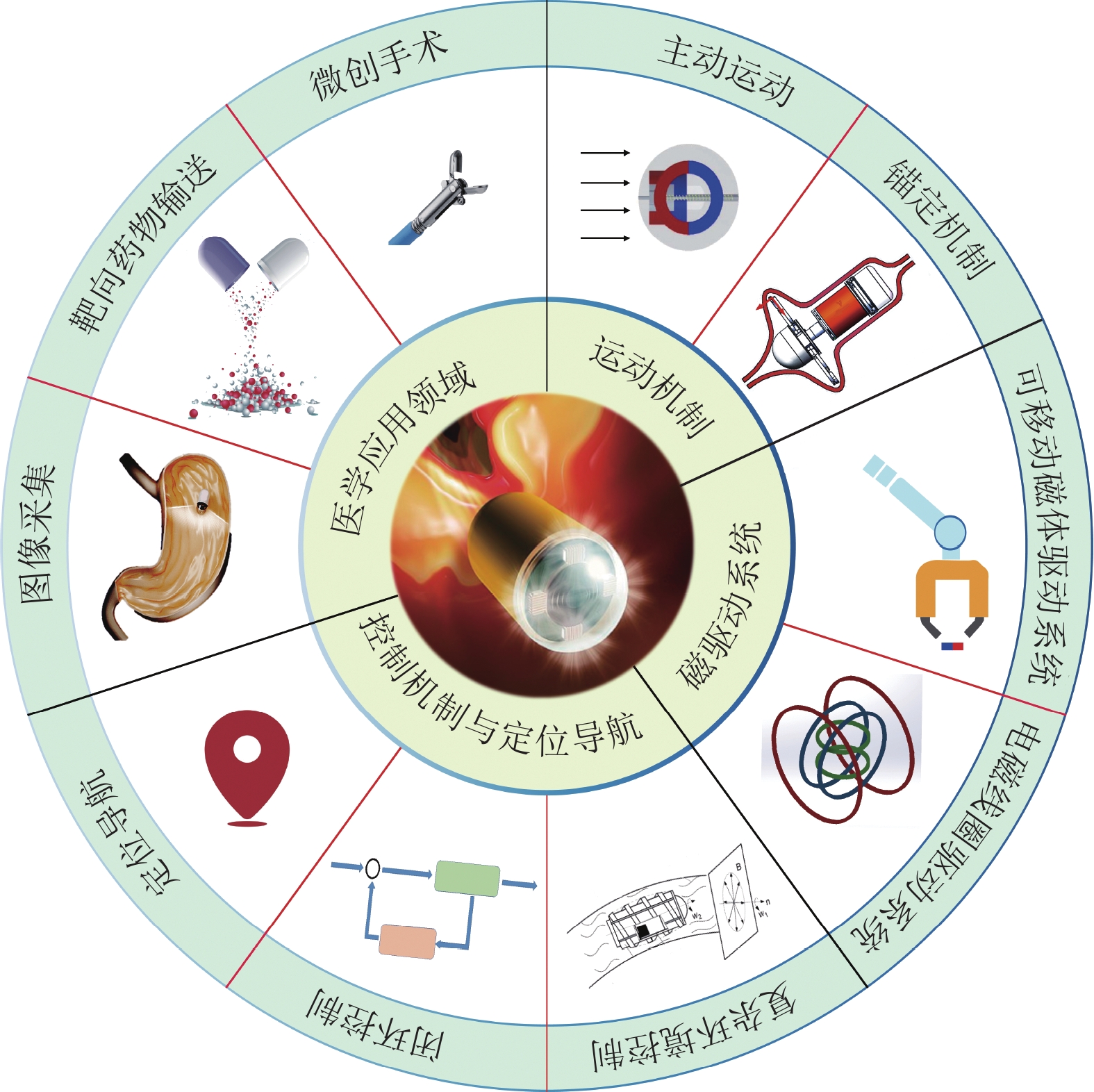
本文系统综述了磁驱动胶囊机器人的设计、控制机制和多样化应用。第1节总结了磁驱动胶囊机器人系统的设计问题,分析了磁驱动胶囊机器人的设计准则。第2节分析总结了磁驱动原理及系统。第3节讨论了胶囊机器人的控制机制和定位导航策略。第4节分析了目前胶囊机器人在医学上的应用。第5节讨论了磁驱动胶囊机器人存在的挑战和潜在研究方向。磁驱动胶囊机器人的主要研究领域如图2所示。
|
图 2 磁驱动胶囊机器人的研究领域 Figure 2 Research fields of magnetically actuated capsule robots |
胶囊机器人的设计需要综合考虑多种因素,以确保其能够在人体胃肠道中安全有效地执行特定任务。本节将通过尺寸形状、材料和运动机制等方面介绍胶囊机器人的设计准则。
1.1 尺寸形状胶囊机器人通常需要足够小巧,以适应人体内部的狭小空间,例如消化道系统。尺寸小巧有助于减少对人体的侵入性和不适感,避免吞咽困难,同时也有利于胶囊机器人在狭小环境中执行任务。胶囊机器人通常采用圆柱或类似胶囊的形状,以便于在人体内部的移动和通过器官。圆滑的外形可以减少对组织的损伤,并有助于胶囊机器人顺利通过生物通道,降低滞留和阻塞等风险[23-24]。
美国食品药品监督管理局(Food and Drug Administration, FDA)给出了关于药物胶囊尺寸的设计要求,胶囊的最大长度应不超过22 mm且最好不超过00号标准胶囊的尺寸(ϕ7.70 mm×20.19 mm) [25]。而根据固体药物控释口服给药系统(Osmotic-controlled Release Oral-delivery System, OROS) 剂型给出的信息,直径为9 mm、长度为15 mm的胶囊形可摄入系统为胶囊机器人提供了安全的吞咽尺寸范围[26]。然而目前胶囊机器人(主要为胶囊内窥镜)直径一般为10~12 mm、长度在24~33 mm之间,认为是可吞咽的。胃肠道不同器官内部结构存在差异,针对不同胃肠道部位可设计不同尺寸的胶囊机器人,目前针对食管、小肠和结肠段的胶囊内窥镜产品已取得临床应用[27-28]。
为避免胶囊机器人的滞留阻塞风险,胶囊机器人的尺寸设计需要考虑胃肠道中的狭小生物通道。胃肠道最狭窄的通道为幽门,健康成年人的幽门直径约为15 mm,故直径大于15 mm的胶囊机器人在通过幽门时很可能会发生胶囊滞留阻塞的风险,严重者还需通过手术取出摄入装置[24,29]。
1.2 材料由于胶囊机器人需要在生物体内执行任务,因此通常采用生物相容性良好的材料,如聚合物、生物降解材料或者金属材料,并且要能在胃肠道不同区域的酸碱环境(如表1所示)中保持完整。通常来说,一个胶囊机器人的内部组件都需要集成在圆柱形的不透水聚合物胶囊中,聚合物可以是聚对二甲苯、PDMS、聚乙烯、塑料和环氧树脂等材料,再通过涂层技术使其具有生物相容性[30];同时该材料制成的胶囊外壳还应能抵抗胃酸环境[31]。如胶囊机器人内部组件中有含化学物质的电子元器件,则应采用由无毒材料或者以惰性金属为主的电子元件,以避免胃肠道受到污染。例如美敦力公司PillCam系列的胶囊内窥镜产品采用无汞氧化银纽扣电池供能,即使发生电池泄露现象,无毒的无汞氧化银也不会对胃肠道造成过度伤害[32]。
| 表 1 胃肠道不同区域的壁厚、pH值和通过时间[26] Table 1 The wall thickness, pH and transit time in different regions of the gastrointestinal tract |
为了使胶囊机器人能在胃肠道中有满意的运动表现,运动系统需要满足:(1) 运动速度应在15 cm/min范围内,与胃肠道运动兼容并允许合适的成像能力;(2) 电力需求应尽量小;(3) 胶囊尺寸和形状应符合1.1节的要求;(4) 胶囊的温度不能超过43 ℃,保证与组织接触时的安全;(5) 运动机构不能损伤机体组织[33]。大致可将胶囊机器人的运动系统分为两大类:(1) 非磁驱动;(2) 磁驱动方式。非磁驱动方式主要包括:(1) 电刺激方法[34-35],通过电极周期刺激肠肌驱动胶囊运动,此种方式没有商业化,且存在安全性问题,比如会降低心率等;(2) 依靠与胃肠道间摩擦力方法,包括类尺蠖、蚯蚓的爬行方式[36],或基于桨或腿结构的运动方式[37-38],主要依靠形状记忆合金、压电或者电机驱动方式,一般都需要体外供能,且形状记忆合金响应速度较慢;(3) 基于流体动力学的方法,通过水力驱动胶囊机器人,需要提前摄入大量的水,且只适用于胃器官[39];(4) 基于振动的方法,同样需要电机驱动胶囊内部的偏心机构[40]。磁驱动方式主要利用外部磁场作用于胶囊内部的永磁体实现运动,外部磁场可由永磁铁、电磁线圈系统和机械臂辅助的永磁铁或者电磁铁产生。本节主要分析采用磁驱动实现胶囊机器人主动运动和锚定的方法。
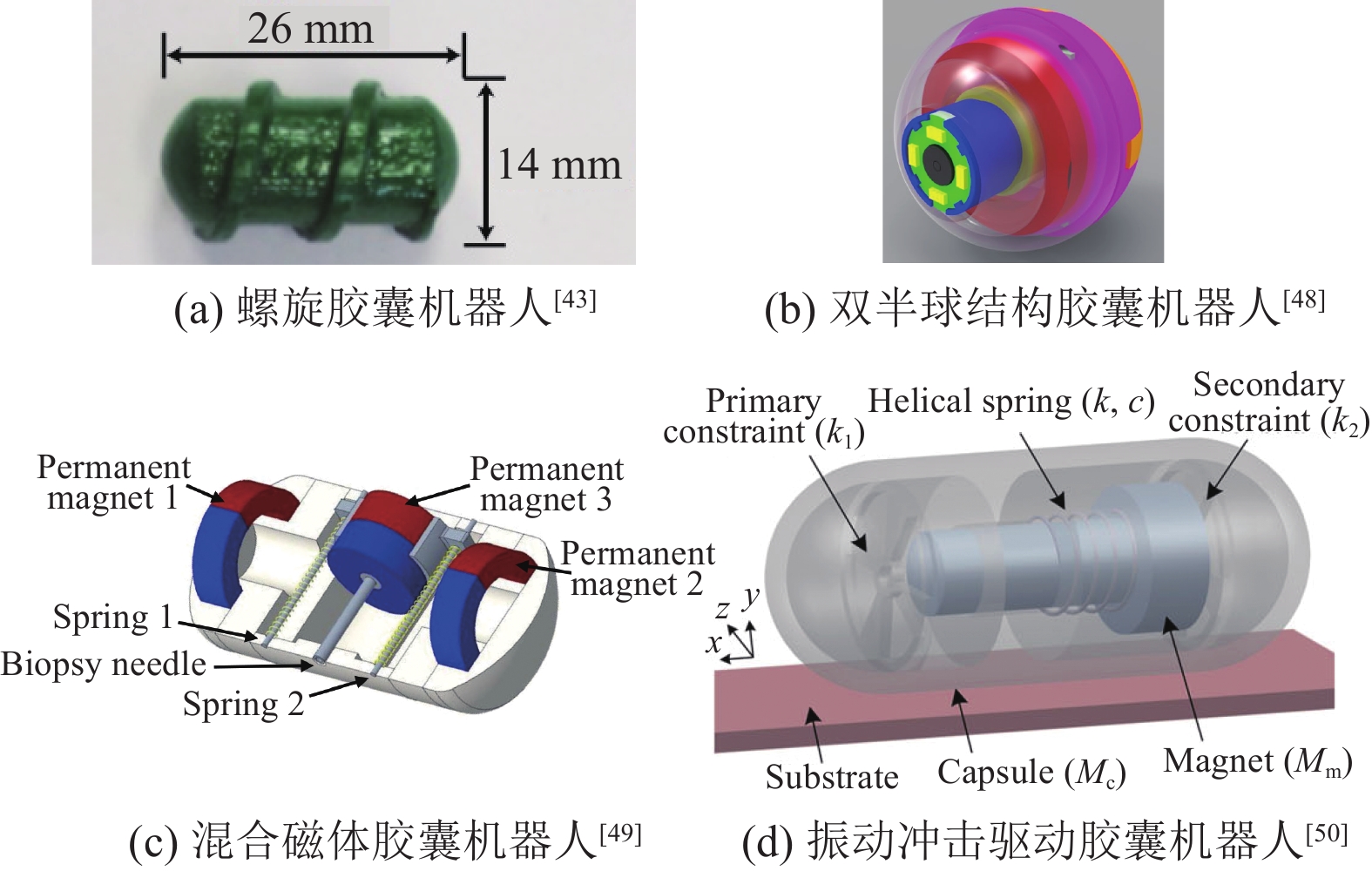
(1) 主动运动:外部磁场驱动的胶囊机器人主动运动形式一般是通过施加旋转磁场或者梯度磁场到机器人内部嵌入的永磁体实现对胶囊机器人的转动和平动。类似于螺旋肠镜[41-42],螺旋胶囊机器人外壁上设有多圈螺旋肋[43](见图3(a)),内部设有径向充磁的永磁体[44-45],利用一组或多组亥姆霍兹线圈产生的旋转磁场使得胶囊机器人随之转动,通过外壁上的螺旋结构利用液体向后推的反作用力驱动胶囊前进[46]。改变旋转磁场旋转方向,胶囊机器人的运动方向也随之改变,实现俯仰和偏摆运动,该方法的前提是以流体膜厚度和流体动压模型为基础,故局限性首先是需要患者在胃肠道检查前摄入大量液体以充满胃腔;其次胶囊机器人在旋转过程中摄像头也处于旋转状态,不利于图像采集以及病变位置的准确定位。Erin等[47]提出一种磁驱动胶囊机器人,采用磁共振成像(Magnetic Resonance Imaging, MRI) 设备产生的磁场来驱动胶囊机器人,但产生的梯度磁场和匀强磁场存在耦合使得胶囊机器人在旋转过程中发生一定的偏移,造成运动控制偏差。
|
图 3 主动运动胶囊机器人 Figure 3 Active motion capsule robots |
Zhang等[48]提出一种双半球结构的胶囊机器人(见图3(b))用于降低与胃肠道间的摩擦力,该机器人由主动半球和被动半球组成,在主动模式下,胶囊机器人的主动半球受到旋转磁场的作用沿肠壁滚动,在被动模式下则是被动半球紧贴肠壁保持静止,主动半球则在旋转磁场下进行姿态变换,但缺点是在其滚动过程中摄像头也随之滚动,给图像采集和处理带来麻烦。Ye等[49]提出一种径向永磁体与轴向永磁体混合磁体配置的胶囊机器人(见图3(c)),在径向永磁体受到旋转磁场作用进行旋转的同时,轴向永磁体也有一个向前的趋势,从而产生滚动运动。Zhang等[50]提出了一种振动冲击胶囊机器人的力驱动模型(见图3(d)),胶囊机器人内部分布有永磁体以及两根弹簧,通过改变线圈的磁场频率、幅度以及占空比来调整磁力,而其中的弹簧则是为了将胶囊机器人内部永磁体恢复为原始位置。实验证明使用振动冲击驱动比单纯使用磁力驱动更为有效。
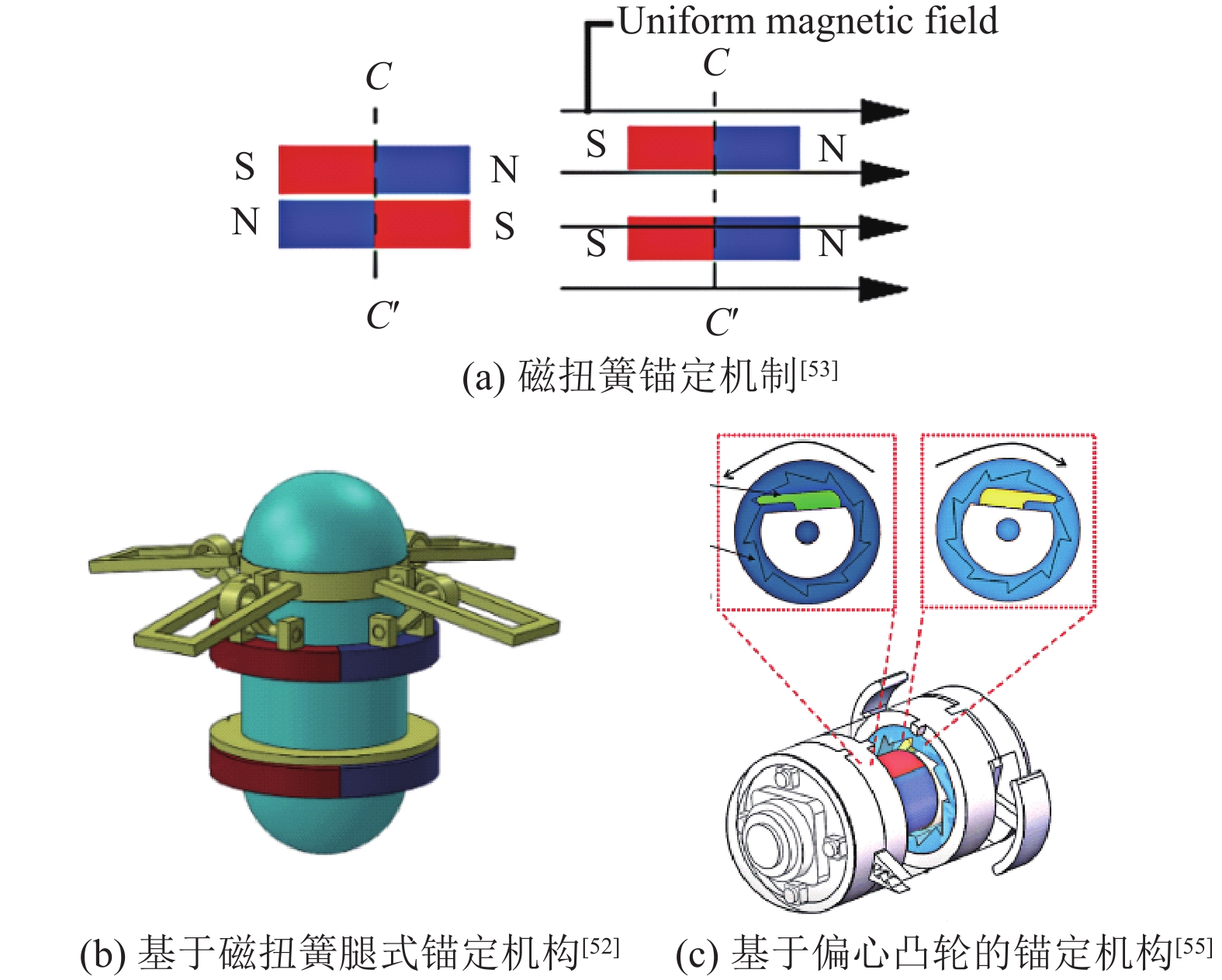
(2) 锚定机制:胶囊机器人在肠道中的运动会受到肠道蠕动的影响导致无法固定在某一位置,对给体内活检、给药以及病变位置诊断等带来一定困难[51]。故胶囊机器人需要锚定机构进行固定,克服胃肠道的蠕动。磁扭簧机构是由两个同轴放置的径向永磁环组成[52],开始因磁矩方向相反而相吸,当有足够大外磁场作用在两磁环使外磁场对磁环的吸引力大于磁环间的吸引力时,两磁环发生旋转而分离(见图4(a))[53]。Zhou等[52]提出了一种基于磁扭簧原理的腿式锚定机构(见图4(b)),固定一磁环,通过外磁场控制另一磁环的运动而启动锚定机制。同一课题组又提出了一种基于剪刀延伸机制和磁弹簧的胶囊机器人锚定机构[54],该机构将直杆状扩展器改为适应肠道的弧形扩展器,并镶嵌在径向永磁体上,施加均匀磁场时通过磁体间旋转打开弧形扩展,达到锚定目的。Song等[55-56]提出一种利用径向永磁体旋转带动偏心凸轮旋转的锚定机构(见图4(c)),该锚定结构能同时伸出两个C形锚定腿,实现在肠道内锚定。此外该机构还包括一个磁性解耦模块,可以在锚定之后实施药物释放及活检操作。
|
图 4 胶囊机器人的锚定 Figure 4 Capsule robot anchoring |
本节首先介绍磁驱动的基本原理,然后分析两种常用的磁驱动系统,即电磁线圈系统和可移动外部磁体系统。
2.1 磁驱动原理由磁驱动系统生成的磁场作用到胶囊机器人内部的永磁体或者电磁线圈上,产生磁力或磁力矩,从而驱动胶囊机器人运动。磁力矩τ和磁力F可通过式(1)~(2)计算[57]:
| $ \tau=m \times B $ | (1) |
| $ F=(m \cdot \nabla) B $ | (2) |
式中:m为磁矩,B为胶囊机器人所处位置的磁通密度,
(1) 电磁线圈系统:电磁线圈系统通常由多组电磁线圈构成,通过控制施加到每组线圈的电流强度,来控制工作空间所需磁场的强度和方向。电磁线圈系统典型配置包括经典的亥姆霍兹线圈和麦克斯韦线圈等。亥姆霍兹线圈中心区域的磁场在一定偏差范围内可认为是均匀磁场,三对正交的亥姆霍兹线圈可在一定空间内产生空间三维匀强磁场,其产生的旋转磁场通过调节磁场频率驱动异构的螺旋胶囊机器人[59-60]。Song等[61]提出了一种六个方形线圈组成的亥姆霍兹线圈系统,结合Z轴的磁悬浮线圈可使胶囊机器人在胃中实现悬浮状态或胃壁上的俯仰和偏航运动控制。麦克斯韦线圈可在中心一定区域内产生均匀梯度磁场,通过磁力驱动胶囊机器人。通过亥姆霍兹线圈和麦克斯韦线圈的不同组合形式,可在一定空间区域内生成三维的匀强和梯度磁场,进而实现胶囊机器人的空间多自由度运动控制[62-63](见图5(a))。Lee等[64-65]提出与三轴亥姆霍兹−麦克斯韦线圈类似的鞍型线圈系统(见图5(b)),包括1对亥姆霍兹线圈、1对麦克斯韦线圈以及3对鞍型线圈,该系统可在胶囊机器人的轴向和径向同时产生梯度磁场,旋转推进胶囊机器人。以上驱动系统大多限于实验室阶段,如要临床应用至少需要扩大2.5倍,这种放大会导致磁耦合损耗的影响。在商业领域,由Olympus和Siemens共同开发具有12个线圈的磁引导胶囊内窥镜系统(Magnetically Guided Capsule Endoscopy, MGCE)[66-67](见图5(c)),可通过2个摇杆控制均匀磁场或梯度磁场去驱动胶囊内窥镜在胃部的五自由度运动。

|
图 5 电磁线圈系统 Figure 5 Electromagnetic coil systems |
在电磁线圈中插入软磁体可增强产生的磁场强度[68-69]。Son等[70]开发了由9个电磁铁组成的磁驱动系统(见图5(d)),根据胶囊机器人在胃部的运动调节某个电磁铁的电流强度,利用磁场的不均匀性实现机器人的运动。Sun等[71-72]利用8块空间对称分布的电磁铁系统在猪模型中进行了磁导航实验,证明了磁导航胶囊内镜系统在体内胃肠道检查中的可行性和安全性。
电磁线圈系统的优点是拥有高精度和可编程磁场的能力,因为磁场是通过调节线圈中的电流产生的,所以该系统可根据需要驱动不同大小、不同结构的胶囊机器人[73]。但如需真正应用到临床上,等比例放大的同时还需考虑到系统过热的问题,需要冷却系统进行降温[74]。
(2)可移动外部磁体系统:可移动外部磁体系统一般是手持永磁铁驱动或利用机器人辅助移动单个或多个永磁铁或者电磁铁系统驱动胶囊机器人在体内的运动。英国伦敦皇家医院的Swain和以色列Raphael的Iddan课题组在1999年联合报告了采用手持永磁铁驱动无线胶囊内窥镜在上消化道内运动的首次人体实验[75],通过改变手持永磁铁的位置和方位来控制胶囊机器人在充满水的胃部区域移动和转动,虽然所有胃部区域可以被检查到,但胶囊机器人姿态的控制比较困难且不直观。Ohta等[76]提出了另一种手持永磁铁驱动系统,此驱动系统由两对圆柱形永磁铁组成,每对圆柱形永磁铁相互垂直布置,发现与传统的胃镜检查的敏感性和特异性相当,但操作不直观。总的来说,手持永磁铁驱动系统成本低、学习曲线低,可以适应大范围内的驱动,更适合临床环境,但操作不够直观,无法精确控制,且长时间操作易造成操作者疲劳。
机器人辅助移动永磁铁或者电磁铁系统比手持永磁铁系统在操作的准确性、精确性和稳定性方面更有优势。Ankon Technology公司推出一种医用磁性胶囊制导系统[77],通过五自由度C型机械臂搭载单个球形永磁体控制胶囊机器人的运动(见图6(a))。Pittiglio等[78]也将单个永磁体集成到多自由度机械臂末端(见图6(b)),基于非线性反演方法,实现了胶囊机器人五自由度的运动控制和重力补偿悬浮驱动,避免胃肠道的内部褶皱影响胶囊机器人的运动。通过精密的控制系统模型以及闭环控制算法,这种类型的驱动系统可以实现胶囊机器人的五自由度驱动控制[79]。Lucarini等[80]认为使用永磁体会受到磁偶极子场的复杂几何形状影响,提出采用机械臂搭载电磁铁的方式,电磁铁可以通过调节电流大小来控制生成磁场的强弱,可以随时启闭磁场,与机械臂结合可以实现多自由度的灵活操作[81]。Wright等[82]提出一种球形制动器磁铁机械手(Spherical-Actuator-Magnet Manipulator,SAMM),该系统可利用3个全向轮闭环控制球形磁体,使其能围绕任何旋转轴进行连续旋转,实现无奇点控制(见图6(c))。Popek等[83]将载有径向磁体的螺旋型胶囊机器人置于该SAMM系统下,实现了胶囊机器人在旋转磁场中的同步闭环推进与跟踪。Ryan等[84-85]提出采用8个永磁体叠加产生磁场的系统(见图6(d)),每个永磁体由独立的电机控制其方向和转速,以在各个方向上产生均匀磁场或梯度磁场。Yang等[86]提出一种并联移动线圈的机构DeltaMag(见图6(e)),包括3个电磁线圈和3个用于驱动线圈的电机,通过调节并联机构的末端位置和输入的电流大小,可实现比现有固定线圈更大的磁场工作空间。表2概括了不同磁场驱动系统的优缺点。

|
图 6 可移动外部磁体系统 Figure 6 Mobile external magnet systems |
| 表 2 磁驱动系统优缺点比较 Table 2 Comparison of advantages and disadvantages of magnetically actuation systems |
磁驱动胶囊机器人的控制机制和导航策略通常是基于外部磁场的操控,并可能结合其他传感器和算法,以确保在复杂的生物体内部环境中能够准确、安全地完成任务。
3.1 复杂环境中的控制方法利用外部磁场对胶囊机器人进行定向和推进,通过调节磁场的方向和强度,可以控制胶囊机器人在人体内的位置和移动轨迹,从而实现精准的导航。Zhang等[87-88]基于交变磁矢量空间正交叠加定理,提出一种连续调节磁矢量取向和旋转方向的驱动方法,并在螺旋管道及动物肠道中进行了弯曲环境下充满黏性液体的转向实验,并提出一种离散逼近控制策略,根据两步优化方法确定预先施加的通用自旋矢量方向,实现了花瓣型胶囊机器人在肠道模型中的非接触转向运动。Teng等[89]通过建立肠液和肠的流−固耦合模型,模拟了在动态肠液环境下胶囊机器人的应力分布,验证了胶囊机器人在水平和弯曲肠道环境下的运动受力状态。Liang等[90]认为实际肠道中存在固体颗粒(例如食物残渣等)或黏液,因此肠液的成分应为液−固或液−液的两相混合成分,通过正交实验优化的方法得出两相混合成分下螺旋胶囊机器人的优化设计,发现螺旋胶囊机器人在高黏度肠液中的驱动性能是高于在含有固体颗粒肠道环境下的。然而,基于流体状态下的实验并不能完全适用于所有的肠道位置,所以对于更复杂的肠道环境还需进一步研究。
3.2 精确操纵与导航的开环和闭环控制在特定管道内的直线运动由于对环境变化不敏感,可采用开环控制策略进行精确操纵和导航,不需要考虑实际反馈信息,仅按照预先设定的轨迹和运动参数执行任务。但实际在胃肠道环境中由于存在胃肠道的蠕动、人体在检查过程中的运动以及呼吸运动使得胶囊机器人的运动环境比较复杂,需要闭环控制策略,通过不断获取胶囊机器人的位置和环境信息,并将其作为反馈信息来实时调节控制指令,使胶囊机器人能够根据实际反馈调整运动轨迹。Erin等[47]将核磁共振设备(Magnetic Resonance Imaging, MRI) 应用于三维磁性液体环境中,完成胶囊机器人的旋转运动,通过比例积分微分(Proportional Integral Derivative, PID) 控制实现了无系绳胶囊机器人的姿态控制和转速控制,最终闭环方向控制的方向变化为2.51 rad,最大净位移为18.4 mm,角速度控制为0.2~0.6 rad/s。Eqtami等[91]则研究了多个磁驱动胶囊机器人的MRI闭环控制策略。研究了一组毫米级颗粒在流体中的闭环控制,由MRI扫描仪驱动,使用不同的磁驱动系统,允许在定制工作空间中多自由度驱动胶囊机器人,并采用各种运动控制方法,实现开环预编程控制到闭环路径跟踪控制。Zarychta等[92]使用神经网络研究不连续胶囊驱动器的闭环控制器优化问题,该闭环控制器是基于一个优化的开环控制功能所设计的,在没有任何扰动的情况下,神经网络闭环控制器的性能比开环控制器提高了1.16%,并且抗干扰能力的最大优势超过开环控制器的7%,工作效率更高。
使用传感器来获取胶囊机器人所处环境的信息包括图像、位置、姿态和速度等,可用于实时监控机器人状态并提供导航反馈。Ye等[93]结合图像导航实现胶囊机器人闭环主动控制,胶囊机器人内部包括了陀螺仪,可获得其姿态。基于胶囊中相机捕获的图像,建立胶囊机器人在胃肠道中的相对位置,通过此相对位置和姿态,采用机械臂控制胶囊机器人沿肠道中心运动,实现胶囊机器人的闭环主动控制。Xu等[94]提出一种新颖的磁驱动系统,该系统采用径向磁体和外部传感器阵列来实现胶囊机器人同时驱动和定位,并提出不同的模型求解胶囊的位姿,利用定位结果更新执行机构的位姿,实现闭环控制,通过实验得出其状态精度达到96.7%,姿态精度为5.2 μm,验证了该系统闭环控制的精度。
3.3 定位导航策略获取胶囊机器人在人体内部精确的位姿信息对识别病变位置、执行定点手术操作等方面至关重要。目前常用的定位技术主要包含:(1) 射频定位[95-96];(2) 惯性导航定位[96-98];(3) 视觉定位[99];(4) 基于CT、MRI或者超声影像的医学影像辅助定位[100];(5) 磁定位[101-102];(6) 多源信息融合定位[96,103]。其中医学影像辅助定位不适合长时间定位;射频定位由于人体不同组织或者器官对射频信号的吸收率不同,造成定位精度低;基于加速度计、陀螺仪等惯性导航传感器的定位可以获得精确运动状态变化,但位姿无法确定;视觉定位受环境影响较大且定位精度低。而静态或低频磁信号受人体组织影响小,磁定位技术可以实现高精度定位[104]。目前的磁定位方法主要包括:永磁体激励定位、电磁线圈激励定位及移动式磁驱动系统定位。
3.3.1 永磁体激励定位永磁体定位法是利用外部传感器阵列(霍尔效应、线圈传感器等)测量胶囊机器人内携带的永磁体在各传感器位置的磁感应强度,计算胶囊位姿信息。Ye等[105]采用上下5×5磁敏传感器对称阵列测量螺旋胶囊机器人的永磁体磁信号(见图7(a)),并利用自适应最小均方(Least Mean Squares, LMS) 法来抵消同步永磁电机产生的强磁干扰,以不同次数加权迭代的方式将永磁体的磁信号与混合磁信号进行分离,最后实验表明永磁体三轴的平均相对误差分别是2.04%、2.20%和1.47%。Hua等[106]针对多磁驱动环境提出基于多磁偶极子模型的近场误差校正方法,提高胶囊机器人磁场模型的精度,通过设计双层对称传感器阵列并记录胶囊机器人的具体位置和相应的磁场强度,训练了BP神经网络模型,能更好地提高Levenberg-Marquardt (LM) 算法的定位精度,在离体猪胃实验中的平均定位误差为3.4 mm。为了解决基于绝对位置的结果带来的非结构性环境不能与胃肠道结构相匹配的问题,Wang等[107]提出一种胶囊机器人导航的相对位置估计方法,利用磁传感器跟踪胶囊机器人的绝对位置,随后根据运动方向确定机器人在胃肠道的运动状态,最后用Bézier曲线拟合方法得出胶囊机器人的运动轨迹,得出仅3.3%的运动误差。另外,使用磁传感器定位导航胶囊机器人前,不可避免地需要校准磁传感器阵列[108]。

|
图 7 定位导航策略 Figure 7 Positioning and navigation strategy |
电磁线圈定位法的原理是在人体的上或者下表面放置电磁线圈,此时人体胃肠道内含有感应设备的胶囊机器人可以测量机器人受到的磁场强度的大小,从而确定胶囊机器人的位置信息。Fu等[109]提出一种基于电磁线圈的磁定位补偿算法,该算法通过建立磁偶模型推导误差拟合公式,并使用最小二乘法拟合胶囊机器人在人体内的实际位置误差,通过数字运算得到新的补偿位置,从而解决了胶囊机器人与外部驱动磁场之间的磁耦合问题,并提高了机器人的定位精度。Liu等[110]利用3个外部发射线圈产生的磁场作用于含有1个单轴接收线圈的胶囊机器人图7(b),经过3D非线性Biot-Savart方程求解,来确定胶囊机器人相对于电磁线圈中相应磁准静态场的位置,并且在螺旋轨迹跟踪实验中,该装置的误差为(2.03±1.14) mm。在随后的研究中,该课题组研究出六维定位的方法[111-112],同时定位3D位置和3D方向,将上述胶囊机器人内部单轴接收线圈调整为3个正交接收线圈,检测磁准静态场,并通过求解非线性网络磁场模型以及旋转磁场,最终能获得胶囊机器人的位姿信息。实验表明该系统的位置和方向的最大误差分别为(1.68±0.76) mm和(1.74±1.06)°。
3.3.3 移动式磁驱动系统定位移动式磁驱动系统定位一方面是基于磁的驱动,另一方面是胶囊机器人的定位。通常利用患者体外的磁体与胶囊机器人内部的磁体之间的磁耦合关系,但这样会对定位系统带来不必要的干扰。Taddese等[113]提出了一种新的混合方法(见图7(c)),使用静态和时变磁场源来解决磁场奇异性和胶囊姿态的准确初始化问题,该方法使用电磁线圈和轴向磁化圆柱磁铁来估计胶囊的位置和偏航角。为了缓解奇异性问题,系统增加了一个电磁线圈,生成一个弱的时变磁场,与轴向磁体的磁场正交,能同时估计胶囊机器人6个自由度的位姿,且其位姿估计的平均误差小于5 mm,方位角的平均误差小于6º。Xu等[114]提出了一种自适应方法,旨在解决胶囊内窥镜在未知复杂管状环境中的推进和定位问题。通过改进外部传感器的磁定位策略,自动激活最佳传感器子集,并开发简化的多目标跟踪算法,实时估计胶囊的姿态。此外,通过研究不同形状管状环境中胶囊的运动,提出动态调整驱动器姿态以实现胶囊在未知管状环境中的高效稳定推进,以闭环方式同时致动和定位胶囊,在具有不同形状和材料的环境中显示出良好的鲁棒性。Hoang等[115]提出了一种双电磁致动器系统(Dual Electromagnetic Actuation, DEAM) ,能产生强梯度磁场,将其与关节机器人手臂集成,能实现胶囊机器人五自由度运动和定位,通过结合机器人运动学和感应效应可以确定胶囊机器人的3D位置,其定位数据能用作位置反馈信号以执行实时闭环控制;但与永磁体相比,该系统仍需消耗大功率以维持足够的磁力和扭矩。
4 磁驱动胶囊机器人的应用磁驱动胶囊机器人在主动运动控制和定位导航等方面不断进步,应用领域和范围不断拓展。在医学应用方面主要包括胃肠道疾病检查、靶向药物输送和微创手术等。
4.1 胃肠道疾病检查初始的胶囊内窥镜仅用于小肠疾病检查,但其无创、患者接受度高等优势使胶囊内窥镜应用不断拓展,按检测对象可分为小肠胶囊机器人、结肠胶囊机器人、胃胶囊机器人、上消化道胶囊机器人、克罗恩氏胶囊机器人等[116]。胶囊机器人的检测方式是拍摄胃肠道相关部位的图像,为医师的诊断提供支持。通常胶囊机器人检测一次的图像数量有数万张,经验丰富的医师对其解读的时间大概为2~3 h。这不仅会加重医师的治疗负担,而且长时间的高度关注将会使得医师疲惫从而降低诊断的准确度。为了降低医师的负担及诊断时间、提高诊断的准确度,研究人员从图像增强及人工智能辅助诊断两方面开展研究。
在图像增强方面,主要的方法有3D图像重建、胶囊染色内镜检查[117]。Rondonotti等[118]利用专业软件对胶囊机器人捕获的各个帧图像进行3D图像重建,之后选择合适的显示视角将各个帧图像的3D图像拼合形成3D视频。Pohl等[119]利用智能色彩增强系统及普通的内窥镜图像和算术处理对不同波长的反射光子进行选择并重构图像,以此来增加图像的分辨率。这些方法都是对胶囊机器人拍摄的图像进行处理,以此来突出小肠病变位置及三维尺寸。这有助于医师理解胶囊机器人的拍摄图像,提高医师的诊断准确度。
在人工智能辅助诊断方面,主要的研究热点是基于卷积神经网络算法(Convolutional Neural Networks, CNN)对胃肠道疾病的辅助诊断。Aoki等[120]设计了一个基于CNN的程序用于检测胃肠道的溃疡和糜烂,整体的检测准确度为90.8%。Saito等[121]同样开发了一种基于CNN的新型计算机辅助系统,这个系统用于检测息肉、结节、上皮性肿瘤、黏膜下肿瘤及静脉结构。该系统对相关疾病的诊断准确率在77%~98.6%之间。另外人工智能辅助对大部分胃肠道疾病具有良好的诊断准确性,且对特定的疾病(息肉、上皮性肿瘤、胃肠道出血)的准确率在95%以上[122-124]。但由于相关研究都停留在CNN对某个特定疾病的辅助诊断,后续还需要对面向总体胃肠道疾病的人工智能辅助诊断的准确性进行研究。
4.2 靶向药物输送磁驱动胶囊机器人可以通过受控的磁场导航,精确地将药物输送到目标组织或部位,从而实现高效的靶向治疗,提高药物的利用率和降低全身毒性。通过胶囊机器人在小肠段给药的研究可分为两大类,一类是利用胶囊机器人舱体携带药物,在胶囊机器人到达指定位置之后释放;一类是利用胶囊机器人携带载药微针,在胶囊机器人到达指定位置之后定点靶向给药。
在舱体给药方面,Le等[125]利用磁驱动胶囊机器人(见图8(a)),以消磁−磁化的方式对胶囊机器人中的软磁体材料进行控制,利用磁铁之间异性相吸同性相斥的特性来控制胶囊机器人舱体的闭合,间接控制药物的释放。Song等[55]在胶囊机器人中内置一个永磁铁和多个棘轮机构(见图8(b)),通过棘轮机构单向转动的特性及多个棘轮机构的叠加实现对胶囊机器人前端锚定机构和后端舱体药物的分别控制。Nguyen等[126]设计了一款给药的磁驱动胶囊机器人,其采用了磁阀门控制化学反应产生气体推动活塞的方式来控制舱体药物释放。Cai等[127]采用凸轮和永磁体的方式对给药胶囊机器人进行研究,其主动运动方式是通过螺旋结构将永磁体的旋转转变为直线运动,同时胶囊机器人利用永磁体另一维度的旋转控制前后端舱体药物的释放。
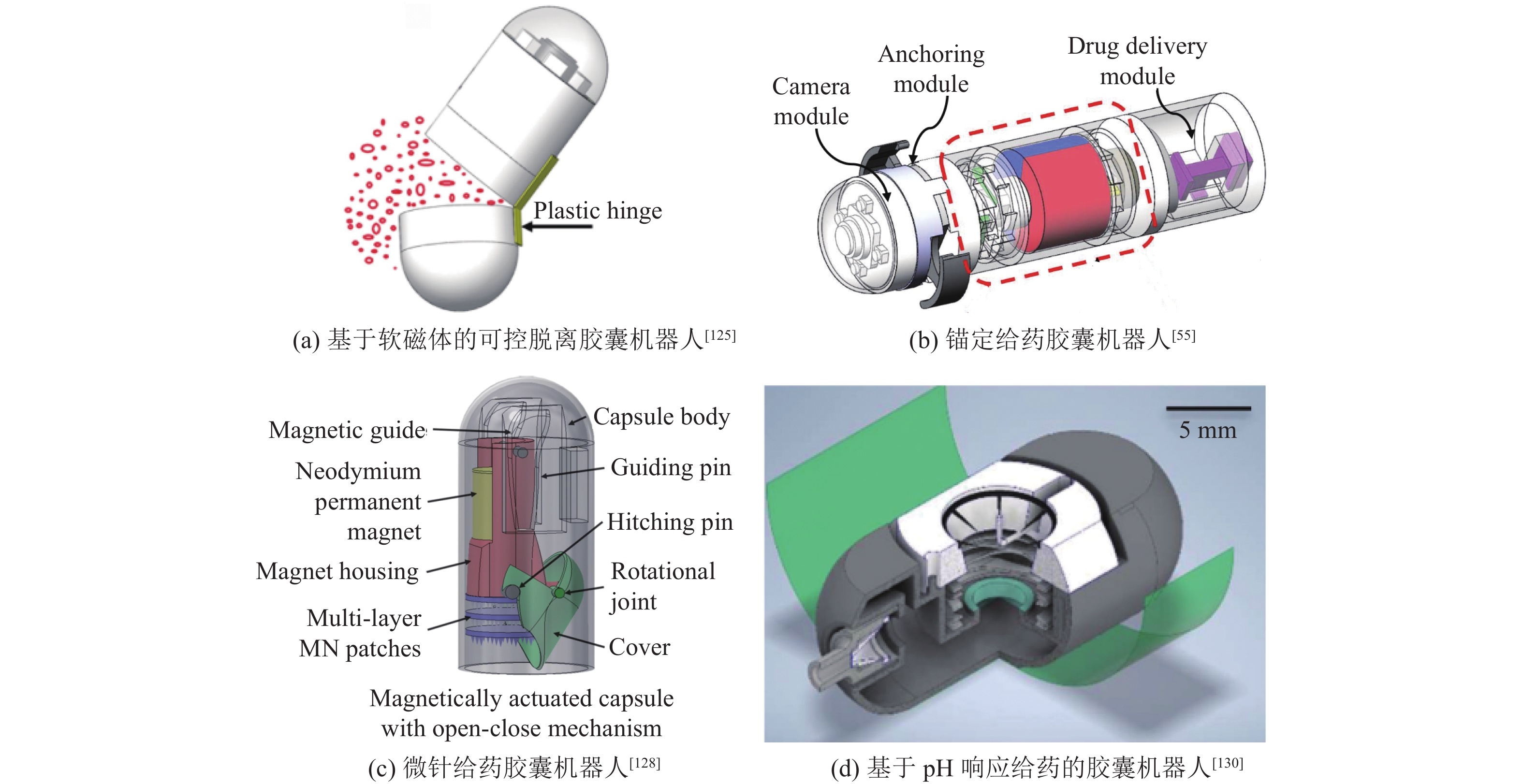
|
图 8 药物输送胶囊机器人 Figure 8 Drug delivery capsule robots |
在微针给药方面,Lee等[128-129]研究了多层微针胶囊机器人(见图8(c)),将置于舱体的永磁体与多层微针连接,利用外磁场控制胶囊机器人的运动及姿态调整。当胶囊机器人运动到指定位置时,胶囊机器人通过机构运动释放药物保护机制,之后改变自身姿态,控制微针面向病灶并刺入小肠组织,利用载药微针的溶解性及扩散现象实现给药。同时,胶囊机器人上的多层微针利用不同层次之间的黏附力差距进行微针的逐层释放,实现了小肠多点病灶给药的目标。Sarker等[130]利用小肠不同部位的pH值作为药物释放信号(见图8(d))。当胶囊机器人运动到指定部位时,通过软化胶囊机器人中的pH依赖性薄膜,触发一系列例如固定、吸附、分离等动作,将药物输送模块固定于小肠特定位置,并利用针头将药物输送到小肠组织内。Zhou等[131]研究了新颖的球形胶囊机器人,利用内部的环形永磁体及外部磁场实现胶囊机器人在小肠内的滚动。当到达特定位置时,胶囊机器人通过内部的磁性复合膜(将磁性物质与聚合物基质相结合)实现针头刺入小肠组织并给药。
4.3 微创手术磁驱动胶囊机器人也可用于微创手术,如取出异物、止血、活检等。通过操纵机器人在体内执行操作,可以减少患者的痛苦和康复时间。目前活检采样方式主要包括活检针、活检钳、刀片切割以及胃肠液吸取,由于胃肠道不同区域的特殊性,活检针常用在胃部病变的活检,活检钳及刀片切割一般用在肠道组织,而胃肠液的吸取有助于分析胃肠道微生物菌群与人体健康的关系,预防病变的发生。
通常活检模块需要搭载额外的机构来激活活检结构。Hoang等[132]提出一种活检针结合螺旋机构的胶囊机器人(见图9(a)),该螺旋机构配有径向永磁体,可通过施加或关闭外旋转磁场伸出和缩回活检针,以达到活检目的。Ye等[49]则提出一种利用弹簧机构来激活可伸缩活检针的胶囊机器人,胶囊内的弹簧机构由轴向永磁体和弹簧组成,当受到外部梯度磁场作用时,轴向永磁体受磁力压缩弹簧并将活检针推出。活检针可采集深层组织样本,提高黏膜下肿瘤或疾病的检出率。Son等[133]提出一种配备活检针的软胶囊机器人(见图9(b)),在磁力矩和磁力的作用下通过滚动运动到病变位置,并利用梯度磁场进行自身轴向压缩,在病变位置处伸出活检针,达到活检采集目的。并且为了防止胃的痉挛导致在到达病变位置前意外划伤食管,吞咽前必须使用冰块或明胶对胶囊机器人进行封装,在完成任务后通过系绳将其从体内取出,但在收回途中,软胶囊活检针将有划伤患者的风险。Le等[134]提出一种活检胶囊机器人(见图9(c)),结合形状记忆合金(Shape Memory Alloys, SMA) 来触发活检刀片,并在外部磁场的作用下旋转切割病变组织。但形状记忆合金的触发温度高,难免会给人体肠道带来不适甚至会有并发症。随后该课题组提出利用活检钳和小型齿轮组集成的胶囊机器人(见图9(d))[135],在旋转磁场的作用下,带动与径向永磁体相连的齿轮组启闭活检钳以夹取病变组织。类似的,Song等[136]也提出利用径向磁体结合齿轮机构将螺旋弹簧的能量传递给刀片,带动刀片旋转以获取组织。Guo等[137]提出一种基于磁扭簧机构的活检胶囊机器人,在外部磁场作用下,利用磁扭簧带动曲柄滑块机构将磁扭矩转化为活检时刀片的切割力,但该结构占据空间大,难以集成图像采集功能。此外,Hoang等[138]提出了另外一种以磁扭簧为基础的胶囊机器人,改变磁扭簧的结构,使得两磁体的磁矩一致,并将活检刀片旋转轴垂直于胶囊机器人的轴,通过旋转磁场破坏两磁体间的吸引力,转化为刀片的组织切割力。

|
图 9 活检采样胶囊机器人 Figure 9 Biopsy sampling capsule robots |
对胃肠道微生物菌群的采样可用于研究胃肠道微生物菌群与宿主的关系。Park等[139]提出一种主动式多位置采样胶囊机器人(见图9(e)),可从胃肠道中提取出三处不同位置的胃肠液,胶囊内的旋转磁体与叶轮集成,在外部磁场下,叶轮在气室内旋转产生离心泵作用,在气囊内部和外部之间产生压差,随后目标位置的胃肠液可以通过微通道的进气口被收集。Nam等[140]提出一种基于共振的胶囊机器人(见图9(f)),利用两个可旋转的不同磁矩磁体组成的磁扭簧,在常规条件下相互吸引,而施加一个均匀磁场后,两磁体在磁场作用下旋转打开密封橡胶,完成采集后撤去磁场,完成胃肠液采集。
5 挑战与潜在研究方向当前磁驱动胶囊机器人面临的技术挑战和局限性包括以下几个方面。(1) 定位精度:磁驱动胶囊机器人在复杂的生物体内或管道中,需要具备高精度的定位能力,以确保准确执行任务。然而,磁场的复杂性以及生物组织的影响可能导致定位精度不足。(2) 环境适应性:磁驱动胶囊机器人需要适应多变的环境,包括生物体内部的不同器官中的各种结构。机器人的设计需要具备对环境变化的适应性。(3) 操控难度:控制磁驱动胶囊机器人通常需要具有复杂的控制系统,以保证其在复杂环境中的稳定运动和精准操作,而这也增加了操控的难度。(4) 能量供应:磁驱动胶囊机器人通常需要长时间工作,因此其能源供应和续航能力也是一项挑战。如何在体内或管道中为机器人提供稳定的能源仍然是一个技术难题。(5) 安全性:机器人在生物体内的应用需要考虑到其对人体组织的影响,包括潜在的损伤风险、排斥反应等,因此安全性是一个重要的局限性。(6) 成本和制造难度:制造高度微型化且精密的磁驱动胶囊机器人通常需要先进的制造技术和材料,这可能导致制造成本较高且制造难度大。
磁驱动胶囊机器人的潜在研究方向涵盖了多个领域,包括仿生设计、新型材料、先进控制策略、多模态功能和能源供应等。(1) 仿生设计:借鉴生物学原理,设计更具生物学灵活性和适应性的胶囊机器人,以适应不同的消化道环境和任务需求。(2) 新型材料:开发新型材料以提高机器人的磁响应性能和生物相容性,例如磁敏感材料、可穿戴材料和生物降解材料,以增强机器人的定位精度和安全性,减少其对患者的副作用和不良反应。(3) 先进控制策略:研究人员可以探索采用先进的控制策略,例如基于深度学习的控制、自适应控制算法和强化学习等,以提高磁驱动机器人在复杂环境中的导航和操作能力。研究人员也可以探索如何实现远程操作和自主导航相结合的模式,使得医生可以在需要的时候进行干预,同时让机器人具备一定程度的自主决策能力。(4) 多模态功能:将多种传感器集成到磁驱动胶囊机器人中,如光学成像、超声波检测、化学传感等,以实现对生物体内不同信息的多模态感知和处理,提高机器人的应用灵活性和全面性。(5) 能源供应:研究如何改进胶囊机器人的能源供应方式,以延长其工作时间和持续性,比如开发更高效和生物安全性更高的电池或利用人体内的生物能源。
通过对这些潜在研究方向的深入探索,磁驱动胶囊机器人有望实现更加精确的操作、更广泛的应用场景和更高效的治疗效果,从而为医学和生物学领域带来革命性的改变。
6 结论本文系统综述了现有关于磁驱动胶囊机器人的研究,提供了设计、控制定位和应用的全面视角,并总结了其当前面临的挑战以及潜在的研究方向。总体而言,磁驱动胶囊机器人系统具有广阔的应用前景,但仍需克服许多技术挑战,包括定位精度、控制策略、材料性能和跨学科合作等。通过不断的研究和创新,磁驱动胶囊机器人系统将为医学治疗和生物学研究领域带来重大突破和进步。
| [1] |
Wikipedia Contributors. Human digestive system[EB/OL]. (2024-03-02) [2024-03-11]. https://en.wikipedia.org/w/index.php?title=Human_ digestive_system&oldid=1211385739.
|
| [2] |
MUKHTAR K, NAWAZ H, ABID S. Functional gastrointestinal disorders and gut-brain axis: what does the future hold?[J].
World Journal of Gastroenterology, 2019, 25(5): 552-566.
DOI: 10.3748/wjg.v25.i5.552. |
| [3] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].
CA:a Cancer Journal for Clinicians, 2021, 71(3): 209-249.
DOI: 10.3322/caac.21660. |
| [4] |
HAWKES N. Cancer survival data emphasise importance of early diagnosis[J].
BMJ, 2019, 364: l408.
|
| [5] |
World Health Organization. Cancer[EB/OL]. (2022-02-03) [2024-01-01]. https://www.who.int/zh/news-room/fact-sheets/detail/cancer.
|
| [6] |
GRIFFIN-SOBEL J P. Gastrointestinal cancers: screening and early detection[J]. In Seminars in Oncology Nursing, 2017, 33(2) : 165-171.
|
| [7] |
DELVAUX M, GERARD G. Capsule endoscopy in 2005: facts and perspectives[J].
Best Practice & Research Clinical Gastroenterology, 2006, 20(1): 23-39.
|
| [8] |
AKPUNONU B, HUMMELL J, AKPUNONU J D, et al. Capsule endoscopy in gastrointestinal disease: evaluation, diagnosis, and treatment[J].
Cleveland Clinic Journal of Medicine, 2022, 89(4): 200-211.
DOI: 10.3949/ccjm.89a.20061. |
| [9] |
IDDAN G, MERON G, GLUKHOVSKY A, et al. Wireless capsule endoscopy[J].
Nature, 2000, 405(6785): 417.
|
| [10] |
IONESCU A G, GLODEANU A D, IONESCU M, et al. Clinical impact of wireless capsule endoscopy for small bowel investigation[J].
Experimental and Therapeutic Medicine, 2022, 23(4): 1-9.
|
| [11] |
HONG S M, JUNG S H, BAEK D H. Diagnostic yields and clinical impacts of capsule endoscopy[J].
Diagnostics, 2021, 11(10): 1842.
DOI: 10.3390/diagnostics11101842. |
| [12] |
WANG A, BANERJEE S, BARTH B A, et al. Wireless capsule endoscopy[J].
Gastrointestinal Endoscopy, 2013, 78(6): 805-815.
DOI: 10.1016/j.gie.2013.06.026. |
| [13] |
CHEN W, SUI J, WANG C. Magnetically actuated capsule robots: a review[J].
IEEE Access, 2022, 10: 88398-88420.
DOI: 10.1109/ACCESS.2022.3197632. |
| [14] |
MOGLIA A, MENCIASSI A, SCHURR M O, et al. Wireless capsule endoscopy: from diagnostic devices to multipurpose robotic systems[J].
Biomedical Microdevices, 2007, 9(2): 235-243.
DOI: 10.1007/s10544-006-9025-3. |
| [15] |
SUN Z J, GU W, XIN Y, et al. Preliminary study of a novel capsule robot with spring-connected legs[J]. Advances in Mechanical Engineering, 2022, 14(3) : 16878132221085126.
|
| [16] |
PARK S, PARK H, PARK S, et al. A paddling based locomotive mechanism for capsule endoscopes[J].
J Mechanical Science and Technology, 2006, 20: 1012-1018.
DOI: 10.1007/BF02916000. |
| [17] |
ZHENG L, GUO S, KAWANISHI M. Multi modular capsule robot system with drug release for intestinal treatment[J].
IEEE Sensors Journal, 2023, 23(16): 18568-18578.
DOI: 10.1109/JSEN.2023.3281579. |
| [18] |
LEON-RODRIGUEZ H, LEE C, ZHEN J, et al. Novel active locomotive capsule endoscope with micro-hydraulic pump for drug delivery function[C]//2016 6th IEEE International Conference on Biomedical Robotics and Biomechatronics (BioRob) . Singapore: IEEE, 2016: 311-316.
|
| [19] |
WU L, LU K. Experimental investigation of a new type of driving concept for capsule robot[J].
Intelligent Service Robotics, 2022, 15(5): 661-669.
DOI: 10.1007/s11370-022-00443-5. |
| [20] |
GUO B, LIU Y, BIRLER R, et al. Self-propelled capsule endoscopy for small-bowel examination: proof-of-concept and model verification[J].
International Journal of Mechanical Sciences, 2020, 174: 105506.
DOI: 10.1016/j.ijmecsci.2020.105506. |
| [21] |
ALSHORMAN A M, ABABNEH O A, ABUSHAKER A I, et al. A novel design of a locomotion system for active capsule endoscopy[C]//2021 7th International Conference on Mechatronics and Robotics Engineering (ICMRE) . Budapest: IEEE, 2021: 93-97.
|
| [22] |
SLAWINSKI P R, OBSTEIN K L, VALDASTRI P. Capsule endoscopy of the future: what’s on the horizon?[J].
World Journal Gastroenterology, 2015, 21(37): 10528-10541.
DOI: 10.3748/wjg.v21.i37.10528. |
| [23] |
BAICHI M M, ARIFUDDIN R M, MANTRY P S. What we have learned from 5 cases of permanent capsule retention[J].
Gastrointestinal Endoscopy, 2006, 64(2): 283-287.
DOI: 10.1016/j.gie.2006.02.036. |
| [24] |
LIAO Z, GAO R, XU C, et al. Indications and detection, completion, and retention rates of small-bowel capsule endoscopy: a systematic review[J].
Gastrointestinal Endoscopy, 2010, 71(2): 280-286.
DOI: 10.1016/j.gie.2009.09.031. |
| [25] |
Food and Drug Administration. Size, shape, and other physical attributes of generic tablets and capsules[EB/OL]. (2022-10-03) [2024-01-01]. https://www.fda.gov/regulatory-information/search-fda- guidance-documents/size-shape-and-other-physical-attributes-generic-tablets-and-capsules.
|
| [26] |
BYRNE J, HUANG H W, MCRAE J C, et al. Devices for drug delivery in the gastrointestinal tract: a review of systems physically interacting with the mucosa for enhanced delivery[J].
Advanced Drug Delivery Reviews, 2021, 177: 113926.
DOI: 10.1016/j.addr.2021.113926. |
| [27] |
MEDTRONIC. PillCam SB 3 capsule endoscopy system[EB/OL]. [2023-12-13]. https://www.medtronic.com/covidien/en-us /products/capsule-endoscopy/pillcam-sb-3-system.html.
|
| [28] |
MEDTRONIC. PillCam crohn’s capsule[EB/OL]. [2023-12-3]. https://www.medtronic.com/covidien/en-us/products /capsule-endoscopy/pillcam-crohns-system.html.
|
| [29] |
CHU J N, TRAVERSO G. Foundations of gastrointestinal-based drug delivery and future developments[J].
Nature Reviews Gastroenterology & Hepatology, 2022, 19(4): 219-238.
|
| [30] |
LU T, JI S, JIN W, et al. Biocompatible and long-term monitoring strategies of wearable, ingestible and implantable biosensors: reform the next generation healthcare[J].
Sensors, 2023, 23(6): 2991.
DOI: 10.3390/s23062991. |
| [31] |
KALANTAR-ZADEH K, HA N, OU J Z, et al. Ingestible sensors[J].
ACS Sensors, 2017, 2(4): 468-483.
DOI: 10.1021/acssensors.7b00045. |
| [32] |
ZEISING S, CHEN L, THALMAYER A, et al. Towards differential static magnetic localization of commercial capsule endoscopes: an evaluation using different ring and cylindrical magnets[J].
Advances in Radio Science, 2023, 20: 105-112.
DOI: 10.5194/ars-20-105-2023. |
| [33] |
LIU L, TOWFIGHIAN S, HILA A. A review of locomotion systems for capsule endoscopy[J].
IEEE Reviews in Biomedical Engineering, 2015, 8: 138-151.
DOI: 10.1109/RBME.2015.2451031. |
| [34] |
SWAIN P, MILLS T, KELLEHER B, et al. Radiocontrolled movement of a robot endoscope in the human gastrointestinal tract[J].
Gastrointestinal Endoscope, 2005, 61(5): AB101.
|
| [35] |
WOO S H, KIM T W, MOHY-UD-DIN Z, et al. Small intestinal model for electrically propelled capsule endoscopy[J].
Biomedical Engineering Online, 2011, 10(1): 1-20.
DOI: 10.1186/1475-925X-10-1. |
| [36] |
PHEE L, ACCOTO D, MENCIASSI A, et al. Analysis and development of locomotion devices for the gastrointestinal tract[J].
IEEE Transactions on Biomedical Engineering, 2002, 49(6): 613-619.
DOI: 10.1109/TBME.2002.1001976. |
| [37] |
KIM B, LEE S, PARK J H, et al. Design and fabrication of a locomotive mechanism for capsule-type endoscopes using shape memory alloys (SMAs)[J].
IEEE/ASME Trans Mechatronics, 2005, 10: 77-86.
DOI: 10.1109/TMECH.2004.842222. |
| [38] |
KIM B, PARK S, PARK J O. Microrobots for a capsule endoscope[C] //IEEE/ASME International Conference on Advanced Intelligent Mechatronics. Singapore: IEEE, 2009: 729-734.
|
| [39] |
CARTA R, TORTORA G, THONÉ J, et al. Wireless powering for a self-propelled and steerable endoscopic capsule for stomach inspection[J].
Biosensors and Bioelectronics, 2009, 25(4): 845-51.
DOI: 10.1016/j.bios.2009.08.049. |
| [40] |
SFAKIOTAKIS M, PATEROMICHELAKIS N, TSAKIRIS D P. Vibration-induced frictional reduction in miniature intracorporeal robots[J].
IEEE Transactions on Robotics, 2014, 30(5): 1210-21.
DOI: 10.1109/TRO.2014.2334931. |
| [41] |
BEYNA T, SCHNEIDER M, PULLMANN D, et al. Motorized spiral colonoscopy: a first single-center feasibility trial[J].
Endoscopy, 2018, 50(5): 518-523.
DOI: 10.1055/s-0043-123577. |
| [42] |
SELIMAGIC A, DOZIC A, HUSIC-SELIMOVIC A. The role of novel motorized spiral enteroscopy in the diagnosis of cecal tumors[J].
Diseases, 2022, 10(4): 79.
DOI: 10.3390/diseases10040079. |
| [43] |
MAHONEY A W, ABBOTT J J. Control of untethered magnetically actuated tools with localization uncertainty using a rotating permanent magnet[C] //2012 4th IEEE RAS & EMBS International Conference on Biomedical Robotics and Biomechatronics (BioRob) . Rome: IEEE, 2012: 1632-1637.
|
| [44] |
LECLERC J, ZHAO H, BECKER A T. 3D control of rotating millimeter-scale swimmers through obstacles[C] //2019 International Conference on Robotics and Automation (ICRA) . Montreal: IEEE, 2019: 8890-8896.
|
| [45] |
XU Y, LI K, ZHAO Z, et al. On reciprocally rotating magnetic actuation of a robotic capsule in unknown tubular environments[J].
IEEE Transactions on Medical Robotics and Bionics, 2021, 3(4): 919-927.
DOI: 10.1109/TMRB.2021.3123407. |
| [46] |
CHOI J, CHOI H, CHA K, et al. Two-dimensional locomotive permanent magnet using electromagnetic actuation system with two pairs stationary coils[C]//2009 IEEE International Conference on Robotics and Biomimetics (ROBIO) . Guilin: IEEE, 2009: 1166-1171.
|
| [47] |
ERIN O, GILBERT H B, TABAK A F, et al. Elevation and azimuth rotational actuation of an untethered millirobot by MRI gradient Coils[J].
IEEE Transactions on Robotics, 2019, 35(6): 1323-1337.
DOI: 10.1109/TRO.2019.2934712. |
| [48] |
ZHANG Y, LIU X, LIU G, et al. Design and implementation of a highly integrated dual hemisphere capsule robot[J].
Biomedical Microdevices, 2022, 24(1): 10.
DOI: 10.1007/s10544-022-00611-5. |
| [49] |
YE D, XUE J, YUAN S, et al. Design and control of a magnetically-actuated capsule robot with biopsy function[J].
IEEE Transactions on Biomedical Engineering, 2022, 69(9): 2905-2915.
DOI: 10.1109/TBME.2022.3157451. |
| [50] |
ZHANG J, LIU Y, ZHU D, et al. Simulation and experimental studies of a vibro-impact capsule system driven by an external magnetic field[J].
Nonlinear Dynamics, 2022, 109(3): 1501-1516.
DOI: 10.1007/s11071-022-07539-8. |
| [51] |
REHAN M, AL-BAHADLY I, THOMAS D G, et al. Measurement of peristaltic forces exerted by living intestine on robotic capsule[J].
IEEE/ASME Transactions on Mechatronics, 2021, 26(4): 1803-1811.
DOI: 10.1109/TMECH.2021.3078139. |
| [52] |
ZHOU H, ALICI G, MUNOZ F. A magnetically actuated anchoring system for a wireless endoscopic capsule[J].
Biomedical Microdevices, 2016, 18: 1-9.
DOI: 10.1007/s10544-015-0028-9. |
| [53] |
SIMI M, GERBONI G, MENCIASSI A, et al. Magnetic torsion spring mechanism for a wireless biopsy capsule[J].
Journal of Medical Devices, 2013, 7(4): 041009.
DOI: 10.1115/1.4025185. |
| [54] |
ZHOU H, ALICI G. A novel magnetic anchoring system for wireless capsule endoscopes operating within the gastrointestinal tract[J].
IEEE/ASME Transactions on Mechatronics, 2019, 24(3): 1106-1116.
DOI: 10.1109/TMECH.2019.2909288. |
| [55] |
SONG S, YUAN S, ZHANG F, et al. Integrated design and decoupled control of anchoring and drug release for wireless capsule robots[J].
IEEE/ASME Transactions on Mechatronics, 2021, 27(5): 2897-2907.
|
| [56] |
ZHANG F, YE D, SONG S, et al. Design of a novel biopsy capsule robot with anchoring function for intestinal tract[C]//2019 IEEE International Conference on Robotics and Biomimetics (ROBIO) . Dali: IEEE, 2019: 1471-1476.
|
| [57] |
PETRUSKA A J, NELSON B J. Minimum bounds on the number of electromagnets required for remote magnetic manipulation[J].
IEEE Transactions on Robotics, 2015, 31(3): 714-722.
DOI: 10.1109/TRO.2015.2424051. |
| [58] |
BOEHLER Q, GERVASONI S, CHARREYRON S L, et al. On the workspace of electromagnetic navigation systems[J].
IEEE Transactions on Robotics, 2023, 39(1): 791-807.
DOI: 10.1109/TRO.2022.3197107. |
| [59] |
ABBOTT J J. Parametric design of tri-axial nested Helmholtz coils[J].
Review of Scientific Instruments, 2015, 86(5): 054701.
DOI: 10.1063/1.4919400. |
| [60] |
ZHENG L, GUO S, WANG Z, et al. A multi-functional module-based capsule robot[J].
IEEE Sensors Journal, 2021, 21(10): 12057-12067.
DOI: 10.1109/JSEN.2021.3058354. |
| [61] |
SONG L, DAI Y, WANG L, et al. Motion control of capsule robot based on adaptive magnetic levitation using electromagnetic coil[J].
IEEE Transactions on Automation Science and Engineering, 2023, 20(4): 2720-2731.
DOI: 10.1109/TASE.2022.3201966. |
| [62] |
SONG S, SONG S, MENG Q H. Electromagnetic actuation system using stationary six-pair coils for three-dimensional wireless locomotive microrobot[C]//2017 IEEE International Conference on Information and Automation (ICIA) . Macau: IEEE, 2017: 305-310.
|
| [63] |
WANG L, LI P, FENG X, et al. Analyzing the influence of square Maxwell coil’s assembly errors on the uniformity of magnetic field gradient[J].
AIP Advances, 2023, 13(3): 035106.
DOI: 10.1063/5.0137857. |
| [64] |
LEE C, CHOI H, GO G, et al. Active locomotive intestinal capsule endoscope (ALICE) system: a prospective feasibility study[J].
IEEE/ASME Transactions on Mechatronics, 2015, 20(5): 2067-2074.
DOI: 10.1109/TMECH.2014.2362117. |
| [65] |
LEE C, CHOI H, GO G, et al. Feasibility study of electromagnetic guidance system for intestinal capsule endoscope[C] //2016 IEEE International Conference on Robotics and Biomimetics (ROBIO) . Qingdao: IEEE, 2016: 1542-1547.
|
| [66] |
REY J F, OGATA H, HOSOE N, et al. Feasibility of stomach exploration with a guided capsule endoscope[J].
Endoscopy, 2010, 42(7): 541-545.
DOI: 10.1055/s-0030-1255521. |
| [67] |
KELLER H, JULOSKI A, KAWANO H, et al. Method for navigation and control of a magnetically guided capsule endoscope in the human stomach[C]//2012 4th IEEE RAS & EMBS International Conference on Biomedical Robotics and Biomechatronics (BioRob) . Rome: IEEE, 2012: 859-865.
|
| [68] |
NIU F, LI J, MA W, et al. Development of an enhanced electromagnetic actuation system with enlarged workspace[J].
IEEE/ASME Transactions on Mechatronics, 2017, 22(5): 2265-2276.
DOI: 10.1109/TMECH.2017.2743021. |
| [69] |
KUMMER M P, ABBOTT J J, KRATOCHVIL B E, et al. OctoMag: an electromagnetic system for 5-DOF wireless micromanipulation[J].
IEEE Transactions on Robotics, 2010, 26(6): 1006-1017.
DOI: 10.1109/TRO.2010.2073030. |
| [70] |
SON D, DOGAN M D, SITTI M. Magnetically actuated soft capsule endoscope for fine-needle aspiration biopsy[C]//2017 IEEE International Conference on Robotics and Automation (ICRA) . Singapore: IEEE, 2017: 1132-1139.
|
| [71] |
SUN H, LIU J, WANG Q. Magnetic actuation systems and magnetic robots for gastrointestinal examination and treatment[J].
Chinese Journal of Electrical Engineering, 2023, 9(1): 3-28.
DOI: 10.23919/CJEE.2023.000009. |
| [72] |
SUN H, LIU J, WANG L, et al. A novel control method of magnetic navigation capsule endoscope for gastrointestinal examination[J].
IEEE Transactions on Magnetics, 2022, 58(1): 1-9.
|
| [73] |
ABBOTT J J, PEYER K E, LAGOMARSINO M C, et al. How should microrobots swim?[J].
The International Journal of Robotics Research, 2009, 28(11-12): 1434-1447.
DOI: 10.1177/0278364909341658. |
| [74] |
LECLERC J, ISICHEI B, BECKER A T. A magnetic manipulator cooled with liquid nitrogen[J].
IEEE Robotics and Automation Letters, 2018, 3(4): 4367-4374.
DOI: 10.1109/LRA.2018.2863358. |
| [75] |
BRODSKY L M. Wireless capsule endoscopy[J].
Issues in Emerging Health Technologies, 2003, 53: 1-4.
|
| [76] |
OHTA H, KATSUKI S, DOI T, et al. Magnetic navigation of capsule endoscopes assisted by wireless real-time monitoring[J].
Endoscopy, 2011, 43: A326.
DOI: 10.1055/s-0030-1256741. |
| [77] |
LIAO Z, HOU X, LIN-HU E Q, et al. Accuracy of magnetically controlled capsule endoscopy, compared with conventional gastroscopy, in detection of gastric diseases[J].
Clinical Gastroenterology and Hepatology, 2016, 14(9): 1266-1273.
DOI: 10.1016/j.cgh.2016.05.013. |
| [78] |
PITTIGLIO G, BARDUCCI L, MARTIN J W, et al. Magnetic levitation for soft-tethered capsule colonoscopy actuated with a single permanent magnet: a dynamic control approach[J].
IEEE Robotics and Automation Letters, 2019, 4(2): 1224-1231.
DOI: 10.1109/LRA.2019.2894907. |
| [79] |
MAHONEY A W, ABBOTT J J. Five-degree-of-freedom manipulation of an untethered magnetic device in fluid using a single permanent magnet with application in stomach capsule endoscopy[J].
The International Journal of Robotics Research, 2016, 35(1-3): 129-147.
DOI: 10.1177/0278364914558006. |
| [80] |
LUCARINI G, MURA M, CIUTI G, et al. Electromagnetic control system for capsule navigation: novel concept for magnetic capsule maneuvering and preliminary study[J].
Journal of Medical and Biological Engineering, 2015, 35: 428-436.
DOI: 10.1007/s40846-015-0055-2. |
| [81] |
SIKORSKI J, HEUNIS C M, FRANCO F, et al. The ARMM system: an optimized mobile electromagnetic coil for non-linear actuation of flexible surgical instruments[J].
IEEE Transactions on Magnetics, 2019, 55(9): 1-9.
|
| [82] |
WRIGHT S E, MAHONEY A W, POPEK K M, et al. The Spherical-actuator-magnet manipulator: a permanent-magnet robotic end-effector[J].
IEEE Transactions on Robotics, 2017, 33(5): 1013-1024.
DOI: 10.1109/TRO.2017.2694841. |
| [83] |
POPEK K M, HERMANS T, ABBOTT J J. First demonstration of simultaneous localization and propulsion of a magnetic capsule in a lumen using a single rotating magnet[C] //2017 IEEE International Conference on Robotics and Automation (ICRA) . Singapore: IEEE, 2017: 1154-1160.
|
| [84] |
RYAN P, DILLER E. Five-degree-of-freedom magnetic control of micro-robots using rotating permanent magnets[C] //2016 IEEE International Conference on Robotics and Automation (ICRA) . Stockholm: IEEE, 2016: 1731-1736.
|
| [85] |
RYAN P, DILLER E. Magnetic actuation for full dexterity microrobotic control using rotating permanent magnets[J].
IEEE Transactions on Robotics, 2017, 33(6): 1398-1409.
DOI: 10.1109/TRO.2017.2719687. |
| [86] |
YANG L, DU X, YU E, et al. DeltaMag: an electromagnetic manipulation system with parallel mobile coils[C]//2019 International Conference on Robotics and Automation (ICRA) . Montreal: IEEE, 2019: 9814-9820.
|
| [87] |
ZHANG Y, WANG N, DU C, et al. Control theorem of a universal uniform-rotating magnetic vector for capsule robot in curved environment[J].
Science China Technological Sciences, 2013, 56: 359-368.
DOI: 10.1007/s11431-012-5088-y. |
| [88] |
ZHANG Y, BAI J, CHI M, et al. Optimal control of a universal rotating magnetic vector for petal-shaped capsule robot in curve environment[J].
Chinese Journal of Mechanical Engineering, 2014, 27(5): 880-889.
DOI: 10.3901/CJME.2014.0619.114. |
| [89] |
TENG Z, LIU J, SUN H, et al. Research on driving force of capsule endoscope in fluid[J].
Archive of Applied Mechanics, 2023, 93(12): 4387-4398.
DOI: 10.1007/s00419-023-02499-w. |
| [90] |
LIANG L, CHEN B, TANG Y, et al. Operational performance analysis of spiral capsule robot in multiphase fluid[J].
Robotica, 2019, 37(2): 213-232.
DOI: 10.1017/S0263574718000954. |
| [91] |
EQTAMI A, FELFOUL O, DUPONT P E. MRI-powered closed-loop control for multiple magnetic capsules[C]//2014 IEEE/RSJ International Conference on Intelligent Robots and Systems. Chicago: IEEE, 2014: 3536-3542.
|
| [92] |
ZARYCHTA S, BALCERZAK M, DENYSENKO V, et al. Optimization of the closed-loop controller of a discontinuous capsule drive using a neural network[J].
Meccanica, 2023, 58(2-3): 537-553.
DOI: 10.1007/s11012-023-01639-4. |
| [93] |
YE B, FU Y, ZHANG S, et al. Closed-loop active control of the magnetic capsule endoscope with a robotic arm based on image navigation[J].
Journal of Magnetism and Magnetic Materials, 2023, 565: 170268.
DOI: 10.1016/j.jmmm.2022.170268. |
| [94] |
XU Y, LI K, ZHAO Z, et al. A novel system for closed-loop simultaneous magnetic actuation and localization of WCE based on external sensors and rotating actuation[J].
IEEE Transactions on Automation Science and Engineering, 2021, 18(4): 1640-1652.
DOI: 10.1109/TASE.2020.3013954. |
| [95] |
THAN T D, ALICI G, HARVEY S, et al. An effective localization method for robotic endoscopic capsules using multiple positron emission markers[J].
IEEE Transactions on Robotics, 2014, 30(5): 1174-86.
DOI: 10.1109/TRO.2014.2333111. |
| [96] |
JEONG S, KANG J, PAHLAVAN K, et al. Fundamental limits of TOA/DOA and inertial measurement unit-based wireless capsule endoscopy hybrid localization[J].
International Journal of Wireless Information Networks, 2017, 24: 169-79.
DOI: 10.1007/s10776-017-0342-7. |
| [97] |
VEDAEI S S, WAHID K A. A localization method for wireless capsule endoscopy using side wall cameras and IMU sensor[J].
Scientific Reports, 2021, 11(1): 11204.
DOI: 10.1038/s41598-021-90523-w. |
| [98] |
REN H, KAZANZIDES P. Investigation of attitude tracking using an integrated inertial and magnetic navigation system for hand-held surgical instruments[J].
IEEE/ASME Transactions on Mechatronics, 2012, 17(2): 210-7.
DOI: 10.1109/TMECH.2010.2095504. |
| [99] |
SPYROU E, IAKOVIDIS D K. Video-based measurements for wireless capsule endoscope tracking[J].
Measurement Science and Technology, 2013, 25(1): 015002.
|
| [100] |
GENG Y, PAHLAVAN K. Design, implementation, and fundamental limits of image and RF based wireless capsule endoscopy hybrid localization[J].
IEEE Transactions on Mobile Computing, 2015, 15(8): 1951-64.
|
| [101] |
ALSUNAYDIH F N, YUCE M R. Next-generation ingestible devices: sensing, locomotion and navigation[J].
Physiological Measurement, 2021, 42(4): 04TR01.
DOI: 10.1088/1361-6579/abedc0. |
| [102] |
GLEICH B, SCHMALE I, NIELSEN T, et al. Miniature magneto-mechanical resonators for wireless tracking and sensing[J].
Science, 2023, 380(6648): 966-971.
DOI: 10.1126/science.adf5451. |
| [103] |
TURAN M, ALMALIOGLU Y, ORNEK E P, et al. Magnetic-visual sensor fusion-based dense 3d reconstruction and localization for endoscopic capsule robots[C]//2018 IEEE/RSJ International Conference on Intelligent Robots and Systems (IROS) . Madrid: IEEE, 2018: 1283-1289.
|
| [104] |
HU C, LI M, SONG S, et al. A cubic 3-axis magnetic sensor array for wirelessly tracking magnet position and orientation[J].
IEEE Sensors Journal, 2010, 10(5): 903-913.
DOI: 10.1109/JSEN.2009.2035711. |
| [105] |
YE B, FANG G, HU J, et al. A novel positioning method for magnetic spiral-type capsule endoscope using an adaptive LMS algorithm[J].
Journal of Magnetism and Magnetic Materials, 2022, 563: 169939.
DOI: 10.1016/j.jmmm.2022.169939. |
| [106] |
HUA D, LIU X, DU H, et al. Positioning a magnetically controlled capsule robot based on double-layer symmetric sensor array[J].
IEEE Transactions on Instrumentation and Measurement, 2023, 72: 1-12.
|
| [107] |
WANG M, SHI Q, SONG S, et al. A novel relative position estimation method for capsule robot moving in gastrointestinal tract[J].
Sensors, 2019, 19(12): 2746.
DOI: 10.3390/s19122746. |
| [108] |
WU X, SONG S, WANG J. Calibration-by-pivoting: a simple and accurate calibration method for magnetic tracking system[J].
IEEE Transactions on Instrumentation and Measurement, 2022, 71: 1-9.
|
| [109] |
FU Q, FAN C, WANG X, et al. A compensation method for magnetic localization on capsule robot in medical application[J].
IEEE Sensors Journal, 2021, 21(23): 26690-26698.
DOI: 10.1109/JSEN.2021.3121908. |
| [110] |
LIU S L, KIM J, KANG B, et al. Three-dimensional localization of a robotic capsule endoscope using magnetoquasistatic field[J].
IEEE Access, 2020, 8: 141159-141169.
DOI: 10.1109/ACCESS.2020.3012533. |
| [111] |
LIU S L, KIM J, HONG A, et al. Six-dimensional localization of a robotic capsule endoscope using magnetoquasistatic field[J].
IEEE Access, 2022, 10: 22865-22874.
DOI: 10.1109/ACCESS.2022.3154031. |
| [112] |
HOANG M C, KIM J, PARK J, et al. Six-DOF localization using magnetic induction effect for automated locomotion of an active capsule endoscope[C]//2022 9th IEEE RAS/EMBS International Conference for Biomedical Robotics and Biomechatronics (BioRob) . Seoul: IEEE, 2022: 1-6.
|
| [113] |
TADDESE A Z, SLAWINSKI P R, PIROTTA M, et al. Enhanced real-time pose estimation for closed-loop robotic manipulation of magnetically actuated capsule endoscopes[J].
International Journal of Robotics Research, 2018, 37(8): 890-911.
DOI: 10.1177/0278364918779132. |
| [114] |
XU Y, LI K, ZHAO Z, et al. Adaptive simultaneous magnetic actuation and localization for WCE in a tubular environment[J].
IEEE Transactions on Robotics, 2022, 38(5): 2812-2826.
DOI: 10.1109/TRO.2022.3161766. |
| [115] |
HOANG M C, LIU S, NGUYEN K T, et al. DEMA: robotic dual-electromagnet actuation system integrated with localization for a magnetic capsule endoscope[J].
Sensors and Actuators A:Physical, 2023, 361: 114596.
DOI: 10.1016/j.sna.2023.114596. |
| [116] |
CHETCUTI ZAMMIT S, SIDHU R. Capsule endoscopy-recent developments and future directions[J].
Expert Review of Gastroenterology & Hepatology, 2021, 15(2): 127-137.
|
| [117] |
OH D J, KIM K S, LIM Y J. A new active locomotion capsule endoscopy under magnetic control and automated reading program[J].
Clinical Endoscopy, 2020, 53(4): 395-401.
DOI: 10.5946/ce.2020.127. |
| [118] |
RONDONOTTI E, KOULAOUZIDIS A, KARARGYRIS A, et al. Utility of 3-dimensional image reconstruction in the diagnosis of small-bowel masses in capsule endoscopy (with video)[J].
Gastrointestinal Endoscopy, 2014, 80(4): 642-651.
DOI: 10.1016/j.gie.2014.04.057. |
| [119] |
POHL J, MAY A, RABENSTEIN T, et al. Computed virtual chromoendoscopy: a new tool for enhancing tissue surface structures[J].
Endoscopy, 2007, 39(1): 80-83.
DOI: 10.1055/s-2006-945045. |
| [120] |
AOKI T, YAMADA A, AOYAMA K, et al. Automatic detection of erosions and ulcerations in wireless capsule endoscopy images based on a deep convolutional neural network[J].
Gastrointestinal Endoscopy, 2019, 89(2): 357-363.
DOI: 10.1016/j.gie.2018.10.027. |
| [121] |
SAITO H, AOKI T, AOYAMA K, et al. Automatic detection and classification of protruding lesions in wireless capsule endoscopy images based on a deep convolutional neural network[J].
Gastrointestinal Endoscopy, 2020, 92(1): 144-151.
DOI: 10.1016/j.gie.2020.01.054. |
| [122] |
SOFFER S, KLANG E, SHIMON O, et al. Deep learning for wireless capsule endoscopy: a systematic review and meta-analysis[J].
Gastrointestinal Endoscopy, 2020, 92(4): 831-839.
DOI: 10.1016/j.gie.2020.04.039. |
| [123] |
YANG Y J. The Future of capsule endoscopy: the role of artificial intelligence and other technical advancements[J].
Clinical Endoscopy, 2020, 53(4): 387-394.
DOI: 10.5946/ce.2020.133. |
| [124] |
MOEN S, VUIK F E, KUIPERS E J, et al. Artificial intelligence in colon capsule endoscopy-a systematic review[J].
Diagnostics, 2022, 12(8): 1994.
DOI: 10.3390/diagnostics12081994. |
| [125] |
LE V H, RODRIGUEZ H L, LEE C, et al. A soft-magnet-based drug-delivery module for active locomotive intestinal capsule endoscopy using an electromagnetic actuation system[J].
Sensors and Actuators A:Physical, 2016, 243: 81-89.
DOI: 10.1016/j.sna.2016.03.020. |
| [126] |
NGUYEN K T, HOANG M C, CHOI E, et al. Medical microrobot—a drug delivery capsule endoscope with active locomotion and drug release mechanism: proof of concept[J].
International Journal of Control, Automation and Systems, 2020, 18: 65-75.
DOI: 10.1007/s12555-019-0240-0. |
| [127] |
CAI Z, FU Q, ZHANG S, et al. Performance evaluation of a magnetically driven microrobot for targeted drug delivery[J].
Micromachines, 2021, 12(10): 1210.
DOI: 10.3390/mi12101210. |
| [128] |
LEE J, LEE H, KWON S, et al. Active delivery of multi-layer drug-loaded microneedle patches using magnetically driven capsule[J].
Medical Engineering & Physics, 2020, 85: 87-96.
|
| [129] |
LEE J, SOHN S W, LEE H, et al. Open-close mechanism of magnetically actuated capsule for multiple hemostatic microneedle patch delivery[J].
International Journal of Control, Automation and Systems, 2022, 20(7): 2285-2296.
DOI: 10.1007/s12555-021-0306-7. |
| [130] |
SARKER S, WANKUM B, PEREY T, et al. A novel capsule-delivered enteric drug-injection device for delivery of systemic biologics: a pilot study in a porcine model[J].
IEEE Transactions on Biomedical Engineering, 2021, 69(6): 1870-1879.
|
| [131] |
ZHOU H, ALICI G. A magnetically actuated novel robotic capsule for site-specific drug delivery inside the gastrointestinal tract[J].
IEEE Transactions on Systems, Man, and Cybernetics:Systems, 2021, 52(6): 4010-4020.
|
| [132] |
HOANG M C, LE V H, NGUYEN K T, et al. A robotic biopsy endoscope with magnetic 5-DOF locomotion and a retractable biopsy punch[J].
Micromachines, 2020, 11(1): 98.
DOI: 10.3390/mi11010098. |
| [133] |
SON D, GILBERT H, SITTI M. Magnetically actuated soft capsule endoscope for fine-needle biopsy[J].
Soft Robotics, 2020, 7(1): 10-21.
DOI: 10.1089/soro.2018.0171. |
| [134] |
LE V H, HERNANDO LR, LEE C, et al. Shape memory alloy-based biopsy device for active locomotive intestinal capsule endoscope[J].
Proceedings of the Institution of Mechanical Engineers, Part H: Journal of Engineering in Medicine, 2015, 229(3): 255-263.
DOI: 10.1177/0954411915576946. |
| [135] |
LE V H, NGUYEN V D, LEE C, et al. Miniaturized biopsy module using gripper tool for active locomotive capsule endoscope[J].
Mechatronics, 2017, 44: 52-59.
DOI: 10.1016/j.mechatronics.2017.04.011. |
| [136] |
SONG Z, ZHANG W, ZHANG W, et al. A novel biopsy capsule robot based on high-speed cutting tissue[J]. Cyborg and Bionic Systems, 2022(1):118-128.
|
| [137] |
GUO S, HUANG F, GUO J, et al. Study on the active movement capsule robot for biopsy[C] //2020 IEEE International Conference on Mechatronics and Automation (ICMA) . Beijing: IEEE, 2020: 1780-1785.
|
| [138] |
HOANG M C, LE V H, KIM J, et al. Untethered robotic motion and rotating blade mechanism for actively locomotive biopsy capsule endoscope[J].
IEEE Access, 2019, 7: 93364-93374.
DOI: 10.1109/ACCESS.2019.2927894. |
| [139] |
PARK S, LEE H, KIM D I, et al. Active multiple-sampling capsule for gut microbiome[J].
IEEE/ASME Transactions on Mechatronics, 2022, 27(6): 4384-4395.
DOI: 10.1109/TMECH.2022.3155534. |
| [140] |
NAM J, LAI Y P, GAUTHIER L, et al. Resonance-based design of wireless magnetic capsule for effective sampling of microbiome in gastrointestinal tract[J].
Sensors and Actuators A:Physical, 2022, 342: 113654.
DOI: 10.1016/j.sna.2022.113654. |
 2024, Vol. 41
2024, Vol. 41