2. 广东工业大学 轻工化工学院, 广东 广州 510006
2. School of Chemical Engineering and Light Industry, Guangdong University of Technology, Guangzhou 510006, China
持续增加的CO2排放不仅导致全球变暖,而且威胁着人类赖以生存的环境[1]。碳捕集、利用和储存技术(Carbon Capture Utilization and Storage, CCUS)可帮助实现碳中和的目标,为企业创造额外的竞争优势[2]。其中,CO2与环氧化物的环加成反应具有非常高的原子经济性,其产物环状碳酸酯也极具工业价值[3]。目前工业上主要采用溴化四乙基铵或聚乙二醇−碘化钾络合物体系作为催化剂制得相关产品[4]。然而,该催化体系往往存在着需要苛刻的反应条件和催化剂难以循环使用等缺点。为提高产品质量和催化效率,改善反应条件,降低反应能垒,发展新型的多相催化剂意义重大[5]。迄今为止,金属氧化物、碳材料、金属有机框架(Metal Organic Frameworks,MOFs)和多孔有机聚合物(Porous Organic Polymers,POPs)等多相催化系统已经成功地实现上述反应[6-7]。
超交联聚合物(Hypercrosslinked Polymer,HCPs)是一类基于有机构件共价键联的无定形微孔三维网络材料,具有比表面积高、制备容易、催化稳定性高、易于功能化和大规模生产等优点[8],在CO2催化转化领域受到广泛关注。目前已报道的HCPs 制备方法主要有4种:后交联法、直接缩合法、外交联或溶剂编织法、自由基聚合法[9]。其中,基于外交联编织法所构筑的功能型HCPs催化材料在CO2环加成反应中展现了出色的催化性能,具有一定的应用前景[10]。另一方面,第二代工业催化剂碘化钾(KI),由于其单独存在于反应体系时通常表现出较低的溶解度,限制了其催化活性[11]。利用18-冠-6结构中独特的供电子空腔,与钾离子络合形成稳定的配合物,可以大幅度地提高KI在反应体系中的溶解度,进而有利于亲核的碘离子对环氧化物的开环进攻[12]。由于绝大多数冠醚基POPs的柔性结构单元具有较低的孔隙率,限制了底物与产物的传质[13-14],所以构筑冠醚基超交联聚合物催化材料用于CO2环加成转化中,有望能进一步提高催化性能[15]。
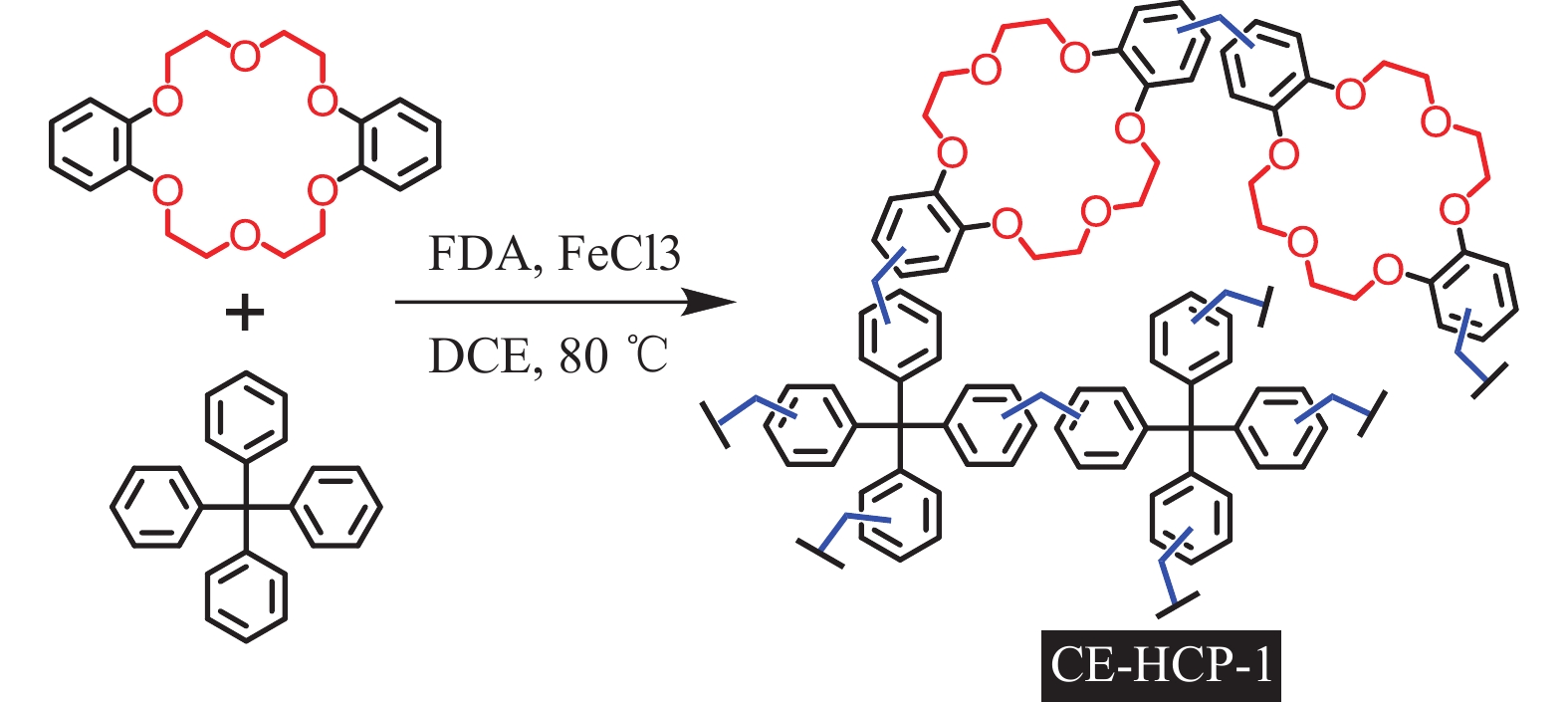
本文以二苯并-18-冠醚-6和四苯基甲烷为基本原料,二甲氧基甲烷(FDA)为交联剂,1,2-二氯乙烷(DCE)作溶剂,通过Friedel -Crafts烷基化反应,采用外交联编织法在温和条件下制备得到了一种具有丰富微孔结构的冠醚型HCPs(命名为CE-HCP-1),如图1所示。由于CE-HCP-1中的冠醚结构对钾离子表现出优良的结合能力,碘离子的亲核性大幅度提高,所以当使用KI作为助催化剂时,在相对温和的无溶剂条件下,CE-HCP-1催化材料在CO2制备环状碳酸酯的反应中展现出优异的催化性能[16]。为了进一步降低反应温度,利用CE-HCP-1中特殊的孔道结构对季铵阳离子发挥限域作用[17],以四丁基溴化铵(TBAB)为助催化剂,在更加温和的条件下实现了CO2与环氧化物的环加成反应。此外,该催化材料能够通过简单过滤分离后循环使用5次,且产率基本保持在75%以上。
|
图 1 CE-HCP-1的合成 Figure 1 Synthesis of CE-HCP-1 |
二苯并-18-冠醚-6(98%)、二甲氧基甲烷(99%)、无水FeCl3(99%)、1,2-二氯乙烷(99%)、碘化钾(98%):购自上海麦克林生化科技有限公司。乙酸乙酯(分析纯)、无水乙醇(分析纯)、丙酮(分析纯)、N,N-二甲基甲酰胺(分析纯):购自广州化学试剂厂。环氧丙烷(99%)、环氧氯丙烷(99%)、环氧溴丙烷(99%)、环氧丁烷(99%)、正丁基缩水甘油醚(99%)和氧化苯乙烯(98%):购自上海百灵威试剂有限公司。高纯CO2(99.99%)购自广州粤佳气体有限公司。四苯基甲烷按照文献[18]制得。
1.2 仪器采用Bruker AVANCE III HD 400超导核磁共振仪进行1H NMR(液体核磁)测试。采用Nicolet 6700型研究型红外光谱仪进行傅里叶变换红外光谱(FT-IR)测试。采用JEM-2100F场发射电子显微镜进行透射电子显微镜(Transmission Electron Microscope,TEM)测试。用ESCALAB 250能谱仪进行X射线光电子能谱(X Ray Photoelectron Spectroscopy,XPS)测试,其激发源为Al Kα X射线,最终的电子结合能(Binding Energy,BE)利用C 1s峰(284.9 eV)校正。在液氮温度下,采用Micromeritic ASAP2020M自动吸附仪进行氮气吸脱附测试,测试前样品在150 ℃真空条件下预处理6 h。比表面积由Brunauer-Emmett-Teller(BET)法测得。孔径分布由Nonlocal Density Functional Theory (NLDFT)法分析得到。气相色谱(Gas Chromatography,GC)分析是在装有Rtx-5(30 m × 0.32 mm × 0.25 µm)毛细管柱的气相色谱仪(常州磐诺A60)上进行,以分析底物的转化率和产物的选择性。
1.3 CE-HCP-1制备氮气条件下,向50 mL 的Schlenk瓶中加入无水FeCl3(0.26 g,1.6 mmol) 、二苯并-18-冠醚-6(0.27 g,0.4 mmol)、四苯基甲烷(0.27 g,0.4 mmol)、FDA(0.12 g,1.6 mmol)和8 mL超干1,2-二氯乙烷,搅拌均匀。体系升温至80 ℃反应24 h后,冷却至室温,经减压抽滤,乙醇、二氯甲烷、DMF和丙酮反复洗涤至滤液呈无色,得到黄棕色固体粉末。进一步通过索氏提取器(甲醇/二氯甲烷为溶剂,体积比为1∶1)洗涤24 h,再经60 ℃真空干燥 24 h,最终得到产品。
1.4 CE-HCP-2制备CE-HCP-2制备方法类似于CE-HCP-1,除不添加四苯基甲烷外,其他合成条件基本一致。
1.5 催化性能测试CO2环加成反应在配备有CO2压力表的10 mL高压反应釜中进行。向反应釜中加入一定量的催化剂、助催化剂和环氧化物。密封后,用氮气置换3次,再充入CO2至所需压力值。随后将反应釜置于带有搅拌装置的恒温油浴锅中反应一定时间。反应完毕后,冷却至室温,缓慢释放CO2并加入乙酸乙酯萃取(3×2 mL),离心分离出催化剂,所得催化剂经乙酸乙酯和丙酮洗涤、真空干燥后用于下一次反应,反应液加入联苯作为内标,通过GC分析反应转化率和选择性。
2 实验结果及讨论 2.1 FT-IR和TEM表征首先,利用FT-IR光谱技术分析了CE-HCP-1的基本结构,测试结果见图2(a) 。从图中可以看出,最显著的特征是在1 120 cm−1和1 053 cm−1处出现了强的吸收峰,归属于冠醚结构C—O—C键的伸缩振动;而2 925 cm−1处是亚甲基C—H的伸缩振动峰,证明了冠醚已经成功地接技到了CE-HCP-1的骨架中。另外,在1 637 cm−1和1 510 cm−1处的吸收峰是由CE-HCP-1中大量的苯环伸缩振动所致,证明了该多孔有机聚合物中四苯基甲烷结构单元的存在[19]。这些结果说明了冠醚基超交联聚合物CE-HCP-1的成功制备。接下来,通过TEM对所获得的CE-HCP-1的形态特征进行观察,测试结果如图2(b) 所示。从图中可以看出,CE-HCP-1呈现出蜂窝状的堆叠状态,证明了所制备的聚合物具有清晰的管状形态[20]。这种特殊的空间结构能够增加CE-HCP-1与底物分子的接触面积,有利于CO2的转化。

|
图 2 CE-HCP-1的红外光谱图和透射电子显微镜图 Figure 2 FT-IR spectrum and TEM image of CE-HCP-1 |
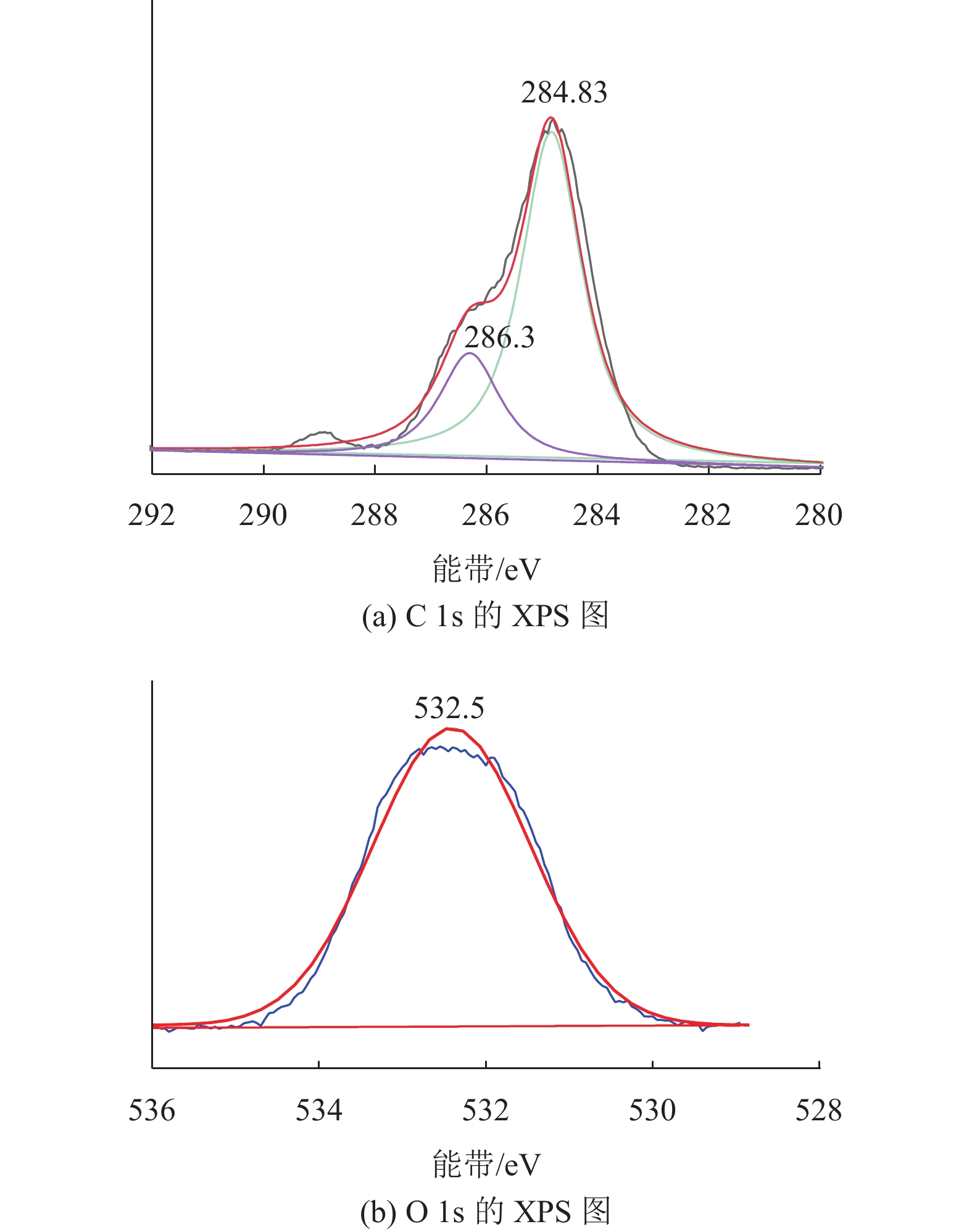
为了研究CE-HCP-1结构中各元素的化学环境与组成,进一步利用XPS对聚合物进行了测试,如图3所示。在C 1s的XPS图中,284.8 eV和286.3 eV处的信号峰分别归属于碳碳单键和碳碳双键这两种碳原子间的结合方式。而在O 1s的XPS图中,出现了532.5 eV处的宽信号峰,表明了冠醚基团存在于CE-HCP-1的骨架中[19]。
|
图 3 CE-HCP-1的X射线光电子能谱 Figure 3 XPS spectra of CE-HCP-1 |
氮气等温吸附−脱附测试结果如图4(a) 所示。对结果分析得知,在P/P0<0.1阶段,氮气吸附量急剧上升,说明该材料中存在数量可观的微孔;在P/P0>0.1,氮气吸附量平缓上升,在P/P0>0.8时,氮气吸附量急剧上升。根据IUPAC对多孔材料的分类标准,可判断该曲线为典型的IV型曲线。通过BET模型对CE-HCP-1的N2等温吸附线进行计算,得出其比表面积约为127 m2/g。此外,如图4(b) 所示,根据非定域密度泛函理论分析该方法得出的样品孔径主要分布在微孔区间内,只存在少量的介孔结构。因此,这种特殊的孔道结构不仅有利于提高底物和产物的传质速率,也有利于CO2分子在孔道中的富集。
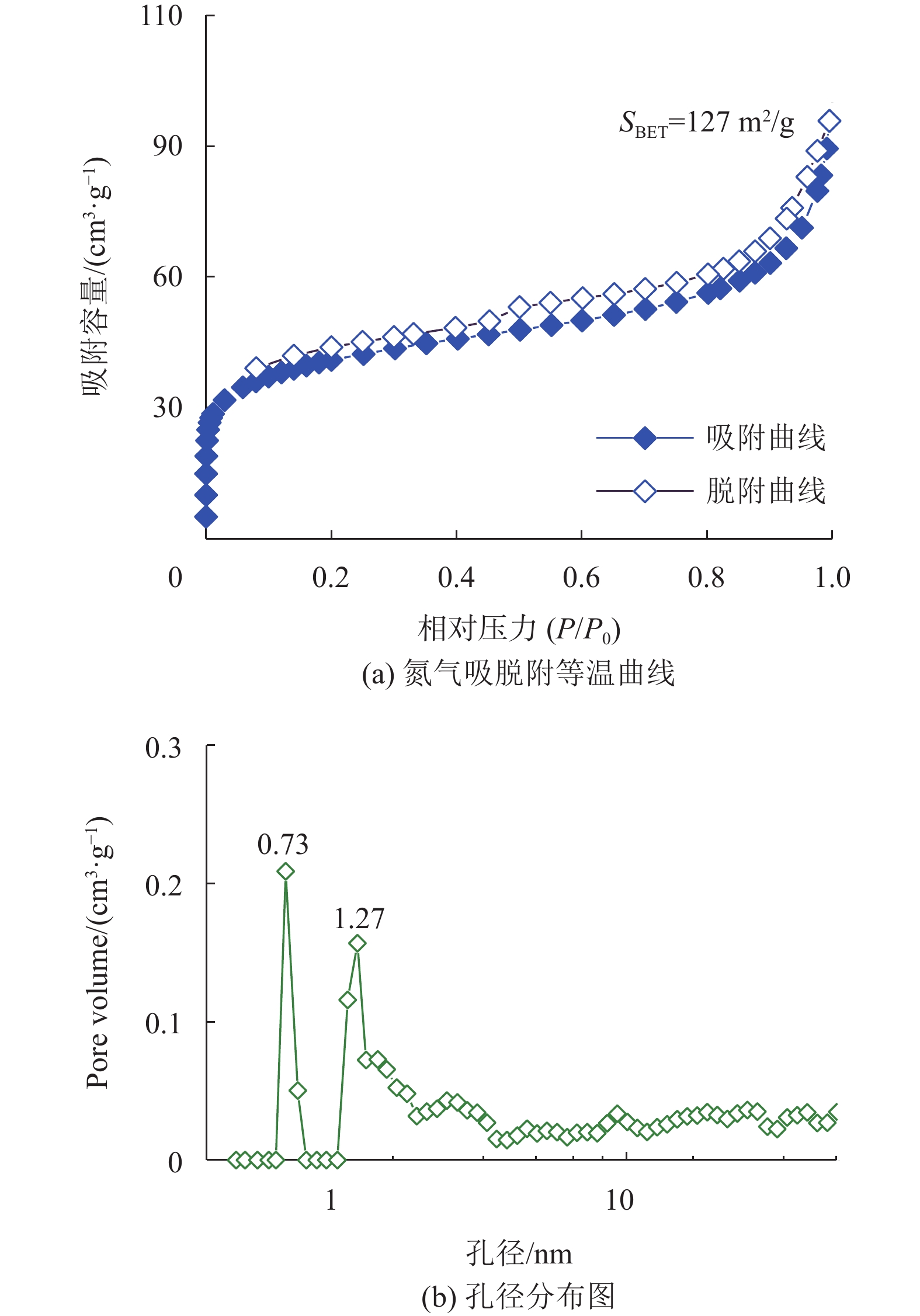
|
图 4 CE-HCP-1的氮气吸脱附等温曲线图和孔径分布图 Figure 4 N2 sorption isotherm curves and pore size distribution of CE-HCP-1 |
为了考察所制备聚合物CE-HCP-1的催化性能,以环氧氯丙烷和CO2进行环加成反应为基本模型,在无溶剂的温和条件下,对所制催化剂的催化性能进行测试,相关结果如表1所示。在100 ℃和1.0 MPa的CO2压力下,反应16 h后,不使用任何催化剂时反应无法发生(序号 1)[21]。而仅仅使用KI或CE-HCP-1作为催化剂时,环状碳酸酯的产率基本可以忽略不计(序号 2、3)[22]。而将两者结合起来组成双组分催化系统时,在相同条件下取得了接近于完全的转化,产率可达90%左右,几乎无副产物生成,产物选择性高达99%以上(序号 4)。以上结果表明,冠醚空腔与钾离子之间的络合作用可使碘离子的亲核性能大幅度地提高[23],这种相互协同催化效应是促进环氧化物开环并提高催化活性的关键[16]。
| 表 1 冠醚基超交联聚合物在CO2与环氧氯丙烷环加成反应中的催化性能 1) Table 1 Results of the cycloaddition reaction of CO2 with ECH |
另一方面,使用CE-HCP-2作为催化剂时,在相同条件下环状碳酸酯的产率只有70%,明显低于CE-HCP-1所取得的性能(序号 5)。CE-HCP-2结构缺少四苯基甲烷基团导致柔性冠醚在聚合过程中无法形成高度交联的网络,材料孔隙率很低。因此,CE-HCP-2中的冠醚很难与KI相结合,导致催化活性较低。当反应时间延长至20 h,CE-HCP-1能够将环氧氯丙烷全部转化为相应的环状碳酸酯(序号6)。当反应温度降低至80 ℃时,环氧氯丙烷需48 h才可以获得72%的产率(序号7),意味着该反应对反应温度相当敏感,提高反应温度有利于提高化学反应速率,缩短所需的反应时间。综上所述,相对于工业催化剂碘化钾所需苛刻的反应条件(200 ℃,6.0 MPa),CE-HCP-1在相对较为温和的条件下表现出优异的催化性能,主要原因可能是:(1) 冠醚与钾离子的配位作用使得碘离子亲核性提高,有效地促进了环氧化物的开环[24];(2) CE-HCP-1 具有丰富的微孔结构,有利于底物传质和CO2富集,促进反应快速高效进行,这是传统均相催化剂无法比拟的[25]。由此可见,本文所构建的双组分催化系统相对于类似的体系具有一定优势。
为了在更加温和的反应条件下进行CO2环加成转化反应,季铵盐作为另一种工业上常用的催化剂也被广泛应用[26]。考虑到CE-HCP-1特殊的三维孔道结构,有文献报道这种空腔对季铵阳离子有明显的空间限域作用[17]。本文以四丁基溴化铵(TBAB)为助催化剂,在60 ℃和1.0 MPa的条件下,进一步考察了CE-HCP-1在CO2与环氧氯丙烷环加成反应中的催化性能,如图5所示。根据该反应动力学曲线可知,当反应时间超过12 h后,环状碳酸酯的产率可达95%以上。从曲线也可以看出,随着反应时间的增加,目标产物的产率逐渐增大,基本符合一级反应动力学特征。由此可见,这种提高溴离子亲核性的策略能够促使环加成反应在更加温和的条件下进行;并且能够在底物中更加充分地扩散接触,使其能达到较好的催化性能。
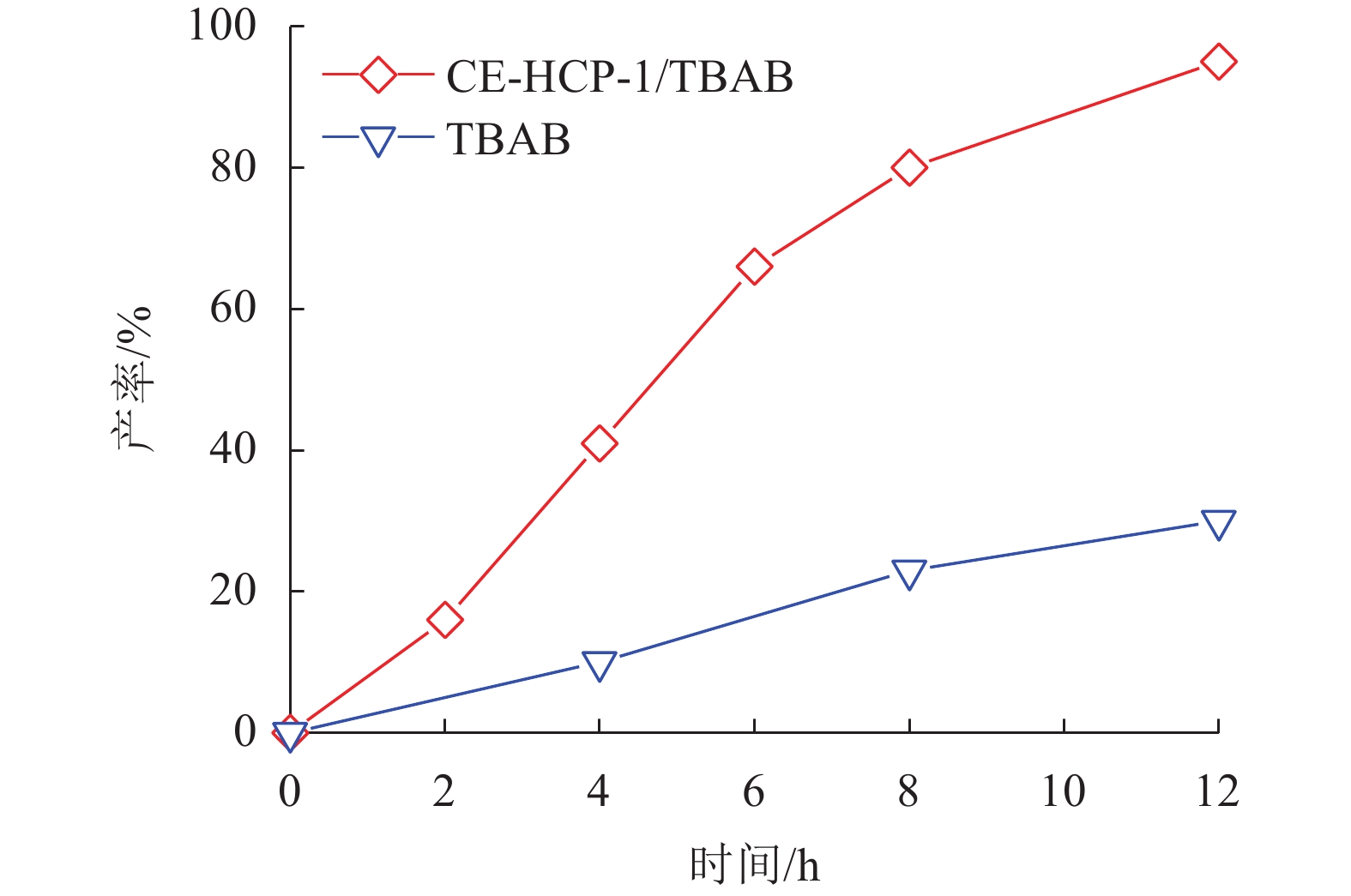
|
图 5 以TBAB为助催化剂,CE-HCP-1催化CO2与环氧氯丙烷的环加成反应动力学曲线 Figure 5 Kinetic curves for the cycloaddition reaction between CO2 and ECH over binary catalytic system (CE-HCP-1/TBAB) |
考虑到聚合物CE-HCP-1的异质性、循环使用性和易回收性(通过简单离心或过滤操作即可回收催化剂),本文进一步测试了该催化材料在CO2环加成反应中的重复使用性能。如图6所示,当使用KI作为助催化剂时,在100 ℃和1.0 MPa的反应条件下反应12 h,CE-HCP-1连续循环使用5次,环状碳酸酯的产率基本保持在75%以上,展现出良好的循环稳定性。
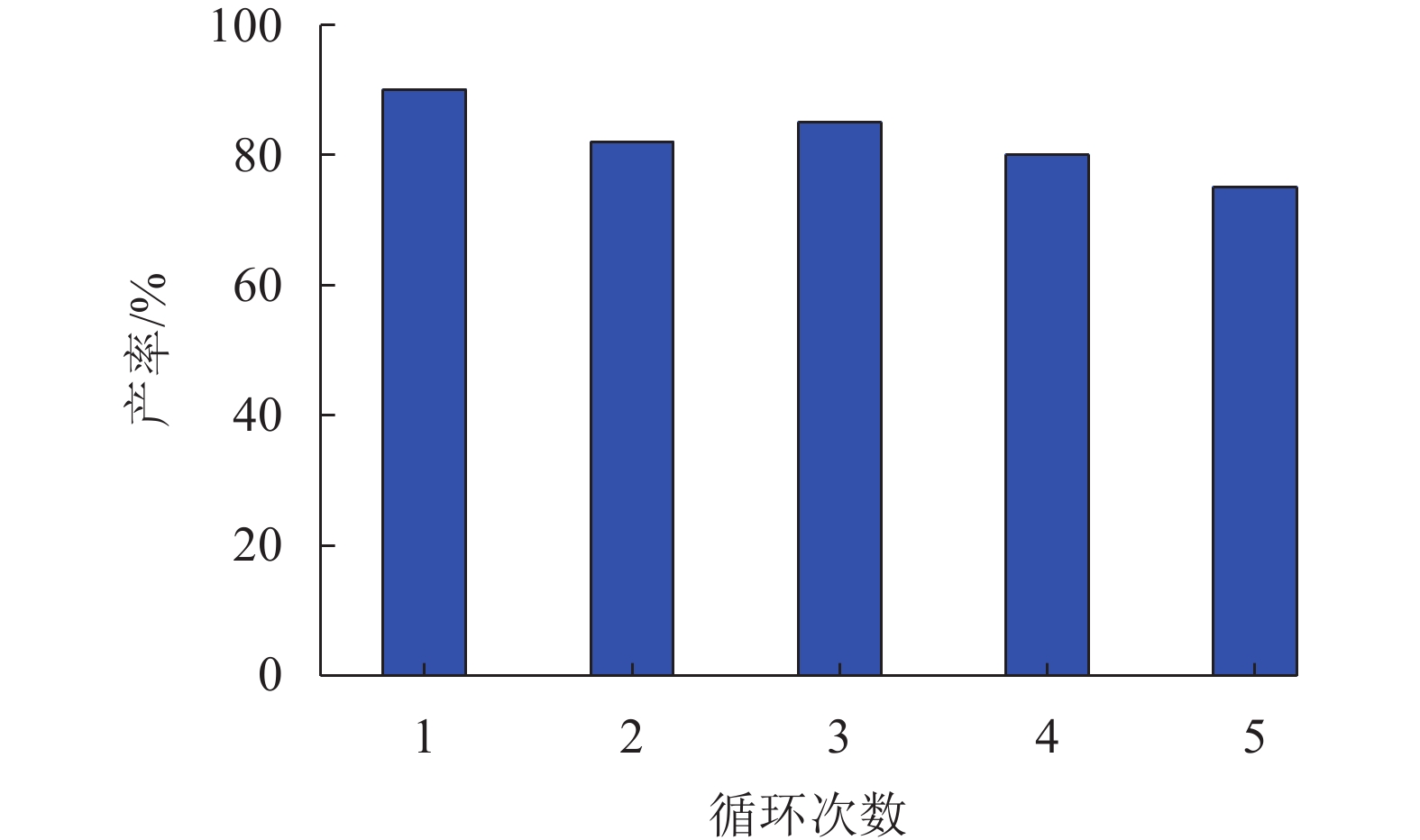
|
图 6 CE-HCP-1的重复使用性 Figure 6 Catalytic reusability of CE-HCP-1 for the cycloaddition of CO2 with ECH |
根据所组成的两类双组分协同催化体系,分别采用TBAB和KI作为助催化剂,在60 ℃和100 ℃的条件下,考察了CE-HCP-1对不同类型环氧化物(包括环氧丙烷、环氧溴丙烷、1,2-环氧丁烷、正丁基缩水甘油醚、烯丙基缩水甘油醚、氧化苯乙烯等)的催化性能,如表2所示。从表中可以看出,几乎所有选取的末端环氧化物在相对温和的条件下都能高效高选择性地转化为相应的环状碳酸酯。不同分子大小和结构的底物表现出不同的催化活性。如具有长烷基链或芳香环的底物,需要延长反应时间才能取得较高的转化率。同时,从底物的结构出发,该双组分催化体系展现出一定的官能团适用性,如碳碳双键、卤素、醚基、芳香环等。因此,催化剂CE-HCP-1组成的催化体系具有反应条件温和、易操作、较好的底物适用性等特点。
| 表 2 催化不同环氧化物与CO2反应生成环状碳酸酯的实验结果 Table 2 Results of the cycloaddition reaction of CO2 with various epoxides |
本文研究了一种在相对温和条件下生产环状碳酸酯的方法,并对其反应机理进行了简单探讨,推测出可能的反应机理[19],如图7所示。
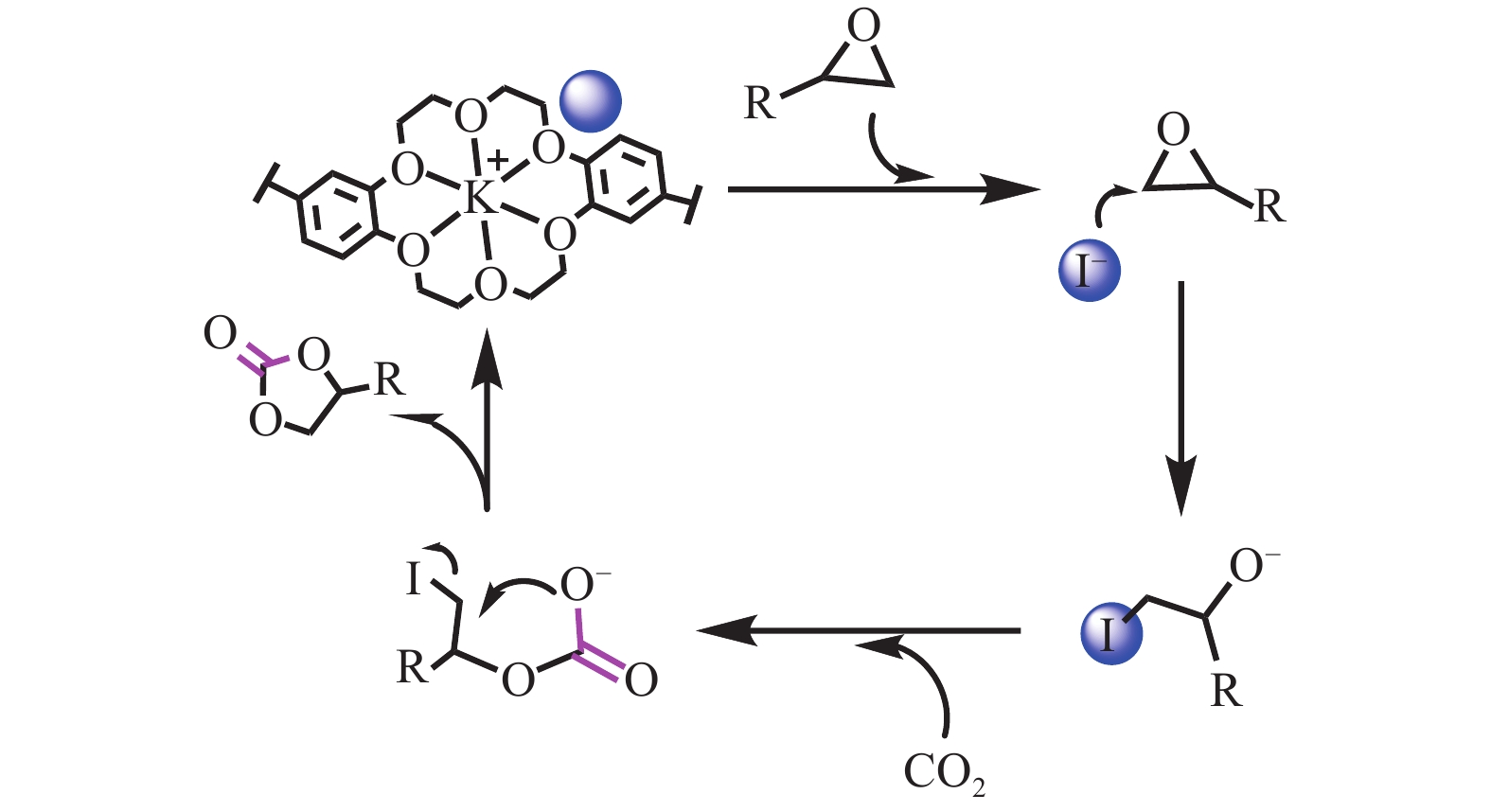
|
图 7 CE-HCP-1与KI协同催化CO2与环氧化物环加成反应的可能机理[19] Figure 7 Proposed mechanism for the cycloaddition of CO2 with epoxides over binary CE-HCP-1/KI catalytic system[19] |
以KI/CE-HCP-1双组分催化体系为例:由于冠醚空腔与钾离子的络合作用导致碘离子的亲核性增强。即活化的亲核碘离子通过亲核进攻促进环氧化物开环而得到高活性的烷氧负离子物种,而环氧化物开环步骤往往被认为是CO2环加成反应的速控步骤。然后,富集在CE-HCP-1孔道中的CO2分子快速插入到上述活性中间体,形成高活性的碳酸盐过渡物种。最后,通过分子内环闭合生成环状碳酸酯,并且实现催化剂CE-HCP-1的再生。
3 结论综上所述,以二苯并-18-冠醚-6和四苯基甲烷为单体,FDA为外交联剂,采用傅克烷基化反应设计合成了一种冠醚型超交联聚合物。采用FT-IR、TEM、XPS和氮气吸脱附实验对CE-HCP-1的结构组成、形貌等方面进行了系统表征与分析。利用冠醚空腔对钾离子的络合作用,当使用KI作为助催化剂时,所获得的CE-HCP-1催化剂在无溶剂和相对温和条件下能够催化CO2与环氧化物的环加成反应,表现出优异的催化活性和良好的催化循环稳定性。利用CE-HCP-1特殊的空间和孔道结构,当使用TBAB为助催化剂时,CE-HCP-1能够在更温和的反应条件下实现环状碳酸酯的高效合成。这种二元协同催化体系的构建为CO2环加成转化的工业催化剂开发提供了良好的契机。
| [1] |
SCOTT A. Learning to love CO2[J].
Chemical & Engineering News, 2015, 93: 10-16.
|
| [2] |
JONES W D. Carbon capture and conversion[J].
Journal of the American Chemical Society, 2020, 142: 4955-4957.
DOI: 10.1021/jacs.0c02356. |
| [3] |
高志文, 肖林飞, 陈静, 等. 二氧化碳与环氧化合物合成环状碳酸酯的研究进展[J].
催化学报, 2008, 29: 831-838.
GAO Z W, XIAO L F, CHEN J, et al. Research progress in the synthesis of cyclic carbonates from carbon dioxide and epoxides[J]. Chinese Journal of Catalysis, 2008, 29: 831-838. DOI: 10.3321/j.issn:0253-9837.2008.09.004. |
| [4] |
LUO R C, LIU X Y, CHEN M, et al. Recent advances on imidazolium-functionalized organic cationic polymers for CO2 adsorption and simultaneous conversion into cyclic carbonates[J].
ChemSusChem, 2020, 13: 3945-3966.
DOI: 10.1002/cssc.202001079. |
| [5] |
LUO R C, CHEN M, ZHOU F, et al. Synthesis of metalloporphyrin-based porous organic polymers and their functionalization for conversion of CO2 into cyclic carbonates: recent advances, opportunities and challenges[J].
Journal of Materials Chemistry A, 2021, 9: 25731-25749.
DOI: 10.1039/D1TA08146B. |
| [6] |
LIANG J, HUANG Y B, CAO R. Metal-organic frameworks and porous organic polymers for sustainable fixation of carbon dioxide into cyclic carbonates[J].
Coordination Chemistry Reviews, 2019, 378: 32-65.
DOI: 10.1016/j.ccr.2017.11.013. |
| [7] |
PAL T K, DE D, BHARADWAJ P K. Metal-organic frameworks for the chemical fixation of CO2 into cyclic carbonates[J].
Coordination Chemistry Reviews, 2020, 408: 213173-213215.
DOI: 10.1016/j.ccr.2019.213173. |
| [8] |
TAN L X, TAN B E. Hypercrosslinked porous polymer materials: design, synthesis, and applications[J].
Chemical Society Reviews, 2017, 46: 3322-3356.
DOI: 10.1039/C6CS00851H. |
| [9] |
FONTANALS N, MARCé R M, BORRULL F, et al. Hypercrosslinked materials: preparation, characterisation and applications[J].
Polymer Chemistry, 2015, 6: 7231-7244.
DOI: 10.1039/C5PY00771B. |
| [10] |
GU Y L, SON S U, LI T, et al. Low-cost hypercrosslinked polymers by direct knitting strategy for catalytic applications[J].
Advanced Functional Materials, 2021, 31: 2008265.
DOI: 10.1002/adfm.202008265. |
| [11] |
KIHARA N, HARA N, ENDO T. Catalytic activity of various salts in the reaction of 2, 3-epoxypropyl phenyl ether and carbon dioxide under atmospheric pressure[J].
The Journal of Organic Chemistry, 1993, 58: 6198-6202.
DOI: 10.1021/jo00075a011. |
| [12] |
DESENS W, KOHRT C, FRANK M, et al. Highly efficient polymer-supported catalytic system for the valorization of carbon dioxide[J].
ChemSusChem, 2015, 8: 3815-3822.
DOI: 10.1002/cssc.201501119. |
| [13] |
XU Q, AN S H, NI Z H, et al. Construction of covalent organic frameworks with crown ether struts[J].
Angewandte Chemie International Edition, 2021, 60: 9959-9963.
DOI: 10.1002/anie.202101163. |
| [14] |
SHEN J C, JIANG W L, GUO W D, et al. A rings-in-pores net: crown ether-based covalent organic frameworks for phase-transfer catalysis[J].
Chemical Communications, 2020, 56: 595-598.
DOI: 10.1039/C9CC07639E. |
| [15] |
KONG H Y, WANG T X, TAO Y, et al. Crown ether-based hypercrosslinked porous polymers for gold adsorption[J].
Separation and Purification Technology, 2022, 290: 120805.
DOI: 10.1016/j.seppur.2022.120805. |
| [16] |
HAO Y J, YAN X L, CHANG T, et al. Hydroxyl-anchored covalent organic crown-based polymers for CO2 fixation into cyclic carbonates under mild conditions[J].
Sustainable Energy & Fuels, 2022, 6: 121-127.
|
| [17] |
GU X, WANG B, PANG Y, et al. Crown ether-based covalent organic frameworks for CO2 fixation[J].
New Journal of Chemistry, 2023, 47: 2040-2044.
DOI: 10.1039/D2NJ05372A. |
| [18] |
LIU X Y, YANG Y Y, CHEN M, et al. High-surface-area metalloporphyrin-based porous ionic polymers by the direct condensation strategy for enhanced CO2 capture and catalytic conversion into cyclic carbonates[J].
ACS Applied Materials & Interfaces, 2023, 15: 1085-1096.
|
| [19] |
LIU X Y, CHEN M, XU W, et al. Potassium-ion-bound porous organic polymers having crown ether struts enable cooperative conversion of CO2 to cyclic carbonates under mild conditions[EB/OL]. Journal of Polymer Science, 2022. https://doi.org/10.1002/pol.20220638.
|
| [20] |
CHEN Y J, LUO R C, XU Q H, et al. State-of-the-art aluminum porphyrin-based heterogeneous catalysts for the chemical fixation of CO2 into cyclic carbonates at ambient conditions[J].
ChemCatChem, 2017, 9: 767-773.
DOI: 10.1002/cctc.201601578. |
| [21] |
LI Q S, YANG H, LI M Q, et al. Highly efficient solvent-free conversion of CO2 into cyclic carbonates by acrylamide-KI[J].
Industrial & Engineering Chemistry Research, 2020, 59: 8136-8144.
|
| [22] |
CHEN W, ZHONG L X, PENG X W, et al. Chemical fixation of carbon dioxide using a green and efficient catalytic system based on sugarcane bagasse-an agricultural waste[J].
ACS Sustainable Chemistry & Engineering, 2015, 3: 147-152.
|
| [23] |
KANEKO S, SHIRAKAWA S. Potassium iodide-tetraethylene glycol complex as a practical catalyst for CO2 fixation reactions with epoxides under mild conditions[J].
ACS Sustainable Chemistry & Engineering, 2017, 5: 2836-2840.
|
| [24] |
HAO Y J, YAN X L, LIU X H, et al. Urea-based covalent organic crown polymers and KI electrostatic synergy in CO2 fixation reaction: a combined experimental and theoretical study[J].
Journal of CO2 Utilization, 2022, 56: 101867.
DOI: 10.1016/j.jcou.2021.101867. |
| [25] |
SHAIKH R R, PORNPRAPROM S, D'ELIA V. Catalytic strategies for the cycloaddition of pure, diluted and waste CO2 to epoxides under ambient conditions[J].
ACS Catalysis, 2017, 8: 419-450.
|
| [26] |
LUO R C, CHEN M, LIU X Y, et al. Recent advances in CO2 capture and simultaneous conversion into cyclic carbonates over porous organic polymers having accessible metal sites[J].
Journal of Materials Chemistry A, 2020, 8: 18408-18424.
DOI: 10.1039/D0TA06142E. |
 2024, Vol. 41
2024, Vol. 41