2. 佛山沛涂科技有限公司,广东 佛山 528200;
3. 表面测量仪器公司 中国办事处,北京 101300
2. Foshan Peico Technology Co., Ltd, Foshan 528200, China;
3. China Office, Surface Measurement Systems, Beijing 101300, China
国际癌症研究所(IARC)在2006年把甲醛确定为一类致癌物. 科研工作者重点关注去除甲醛方法的研究,力求在21世纪研制出一种高效、环保、廉价的甲醛去除方法,这对改善人类生活环境,提高生活的空气质量和生活水平有着重要的意义.
近年来对于甲醛的去除技术得到了快速的发展,目前主要的去除甲醛方法有通风换气法[1]、植物净化法[2]、物理吸附法[3]、等离子技术[4]、臭氧氧化技术[5]等等,然而以上方法均存在一定的缺陷而没有被大规模推广使用,科研工作者把研究焦点放在具有廉价、快速、反应条件温和、无污染等优点的甲醛催化氧化技术上. Christoskova[6]等制备一种氧化镍催化剂,它具有高氧化活性,在室温下即能将甲醛转化为无毒的二氧化碳和水,但催化剂寿命不长. 随后Sekine等[7-8]采用活性炭和氧化锰制成的板状催化剂在室温下研究多种金属氧化物对密闭体系中甲醛的消除作用,研究发现AgO2,PdO,MnO2,TiO2,CoO等催化剂的脱除率都高于50%,其中MnO2对甲醛脱除率最高. Zhenan Han[9]研究了一种简单、经济的喷涂方法,把TiO2纳米颗粒固定到聚酯纤维低温过滤器上,由于催化剂的均匀分散和高压喷射过程中形成较强的结合涂层,相比于浸涂法而言,喷涂法所制造的样品具有更高的效率以及稳定性,在所有样品当中最高的甲醛去除率为92.86%(±2.58%). Shi等[10]通过共沉淀法合成了锰钴固溶体(Mn-CoOx),在75℃下显示出完全的HCHO转化率. Wang等[11]用简单的水浴法制备了MnOx/PET,该PET(无纺布)预先经过碱减量处理,生成物MnOx来自高锰酸根和C2O42-的反应,该复合材料对甲醛去除效率达94%. 而本文所研究的方法中锰源只来自于高锰酸钾,将锰氧化物负载PET上,且PET不需经过碱减量处理,相比于类似的报道,本文的合成方法较简单快速,并在模拟室内环境中进行甲醛催化净化实验,效果良好.
1 实验部分 1.1 试剂与药品无纺布材料,即聚对苯二甲酸乙二醇酯(PET),购自上海华东复合绝缘滤布筛网厂,厚3 mm;无水乙醇购自天津大茂化学试剂厂,高锰酸钾购自衡阳市凯信化工试剂有限公司,浓硝酸购自广州化学试剂厂,以上试剂均为分析纯.
1.2 实验步骤将PET材料裁剪成9 cm×9 cm正方形规格,用乙醇在80 ℃下水浴30 min清洗PET材料表面残留物,烘干待用. 锰氧化物采用高锰酸钾分解[12],沉积至PET材料表面.
考虑到油酸附着在产品上不易清洗的因素,实验采用硝酸代替油酸. 将经过处理的PET材料放入圆底烧瓶中,加入6.32 g KMnO4、150 ml去离子水以及14 ml浓硝酸以调节溶液pH,将混合物放进水浴锅中,在100 r/min、90 ℃的条件下反应6 h,最后的产物用去离子水洗涤3次,然后超声清洗2 min以去除容易脱落的锰氧化物,放进烘箱在60 ℃下干燥9 h.
1.3 材料表征利用日立SU8010场发射扫描电子显微镜(SEM)检测样品的表面形貌,工作电压为15 kV,样品经真空蒸涂Au导电层预处理;利用德国布鲁克D8 Advance,LynxEye阵列探测器,在电压40 kV,电流40 mA,步长0.02°,测试速度0.1 s/step,Cu Kα辐射(λ=0.154 2 nm)条件下记录制备的样品的XRD谱图. 利用DVS动态蒸气吸附分析仪测定样品比表面积与孔径分布.
1.4 催化净化甲醛的活性测试去除HCHO效果的测试于自制容积为70 cm×50 cm×70 cm (245 L)的反应器中进行,实验开始前事先滴加10 μL甲醛溶液于反应器中,等待8 h待甲醛气体浓度稳定后则开始实验. 使用大气采样器分别抽取不同时间间隔的反应器中的甲醛气体,通过AHMT分光光度法[13]测定HCHO质量浓度. 甲醛去除率计算公式为
| ${{HCHO}}{\text{去除率}} = \frac{{C{{\left( {{{HCHO}}} \right)}_0} - C{{\left( {{{HCHO}}} \right)}_t}}}{{C{{\left( {{{HCHO}}} \right)}_0}}} \times 100 \text{%}, $ |
其中C(HCHO)0甲醛初始质量浓度,C(HCHO)t为不同时间测出的甲醛质量浓度.
2 结果与讨论 2.1 催化剂的表征空白无纺布与MnO2/PET的形貌如图1所示. 由图1(a)可以看出空白无纺布为表面光滑,直径约20 μm的柱状形材料. 由图1(b)以及图1(c)可观察到锰氧化物紧密地负载到无纺布上. 锰氧化物是由薄片组成的花球状,球与球之间有一定的团聚,通过互相堆积形成疏松的多孔结构,形貌与文献[14]报道的相似.
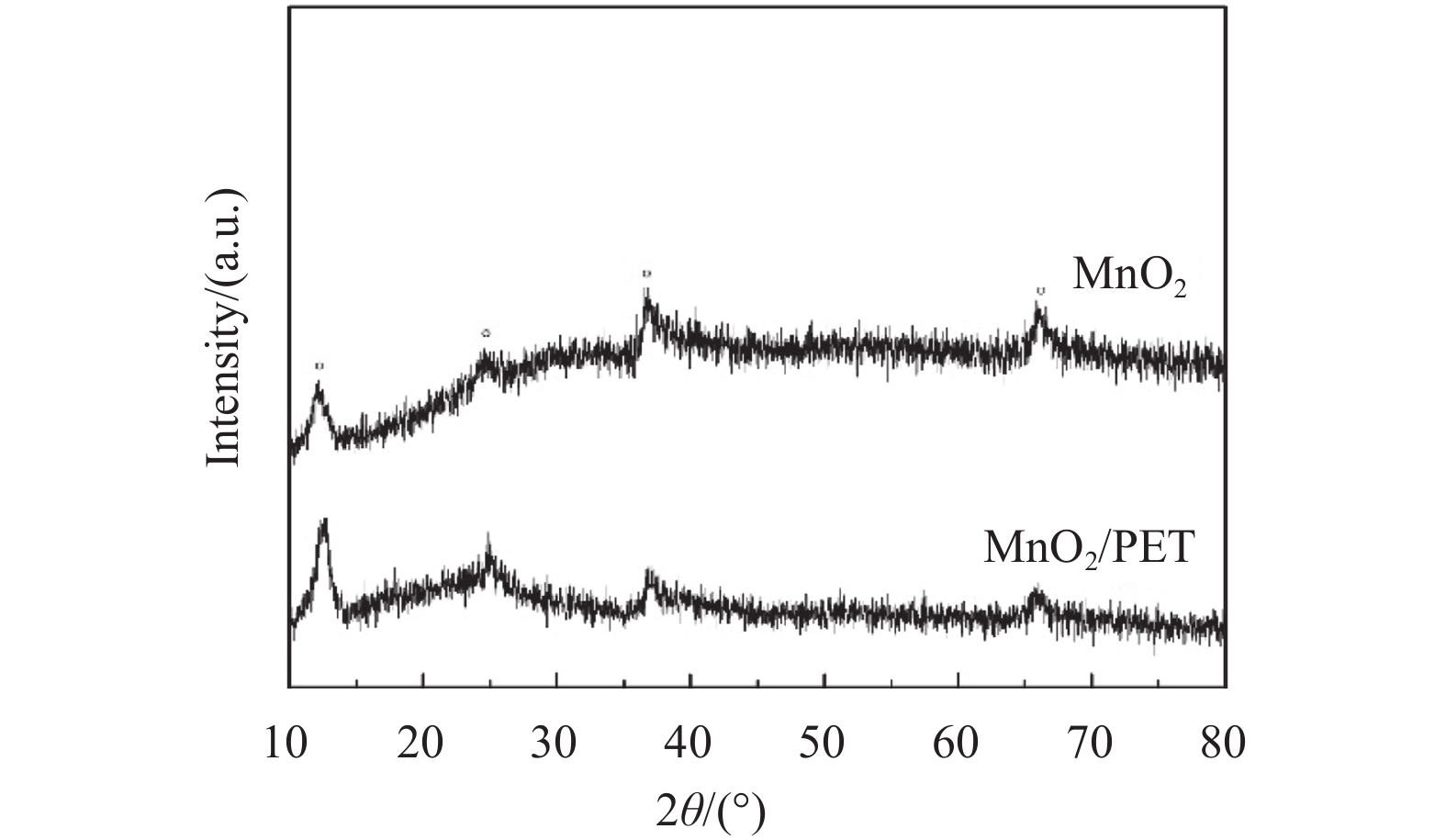
用X射线衍射(XRD)对样品进行表征,曲线在2θ为12.3°、24.6°、36.8°和66.2°出现较强的衍射峰,可分别对应于含钾离子的水钠锰矿型MnO2(JCPDS 16-0205)的特征峰,但结晶性较差. 峰形宽化主要是由于样品在合成的过程中温度相对低,造成结晶性不完整[15],表明所得产物均为小尺寸的无定型纳米颗粒,可以提供较大的比表面积. 根据布拉格方程:2dsinθ=nλ,2θ=12.3°,X射线波长n=1(一级衍射),Cu靶Ka射线(λ=0.154 nm),计算得出晶面距离d=0.72 nm,证明了合成花球状MnO2的层状结构.

|
图 1 (a)PET的SEM图像, (b-c)不同放大倍数MnO2/PET的SEM图像 Figure 1 (a) SEM image of PET, (b-c) SEM images of MnO2/PET with different magnification |
|
图 2 XRD谱图 Figure 2 XRD patterns |
表1列出了两个样品PET和MnO2/PET的BET比表面积,由表可见MnO2/PET的BET比表面积比PET高,基于二氧化锰的片状结构而使整体式催化剂有较大的比表面积.
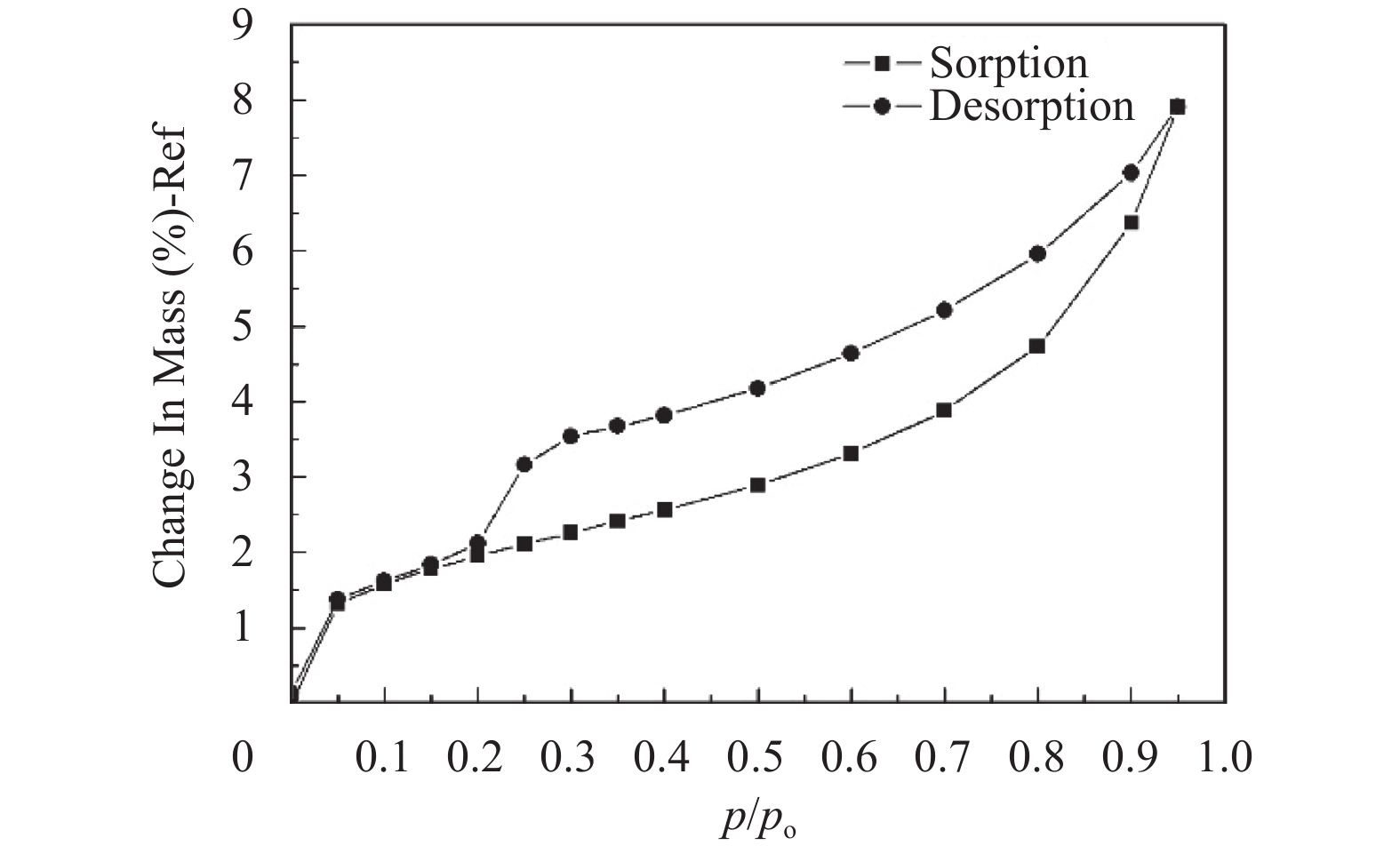
图3为MnO2/PET材料的等温吸附–脱附曲线,从等温线形状来看,属于IV型,由图可看出曲线出现吸附回滞环,其对应的是多孔吸附剂出现毛细凝聚的体系. 即中孔毛细凝聚填满后,MnO2/PET材料还有大孔径的孔以及吸附质分子相互作用加强,导致继续吸附形成多分子层,吸附等温线继续上升. 由于吸附–脱附曲线没有重合,形成了一个较大的回滞环,可知MnO2/PET材料中有大量的介孔存在,与相关报道[16]一致. 由于此类型的MnO2具有多孔大比表面积的特点,可以为催化净化甲醛提供大量的催化反应场所.
| 表 1 PET与MnO2/PET的DVS BET分析报告 Table 1 DVS BET analysis report of PET and MnO2/PET |
|
图 3 25 ℃时MnO2/PET的环己烷脱附–吸附等温曲线 Figure 3 Sorption/desorption isothermal curve for “MnO2/PET” at 25 ℃ |
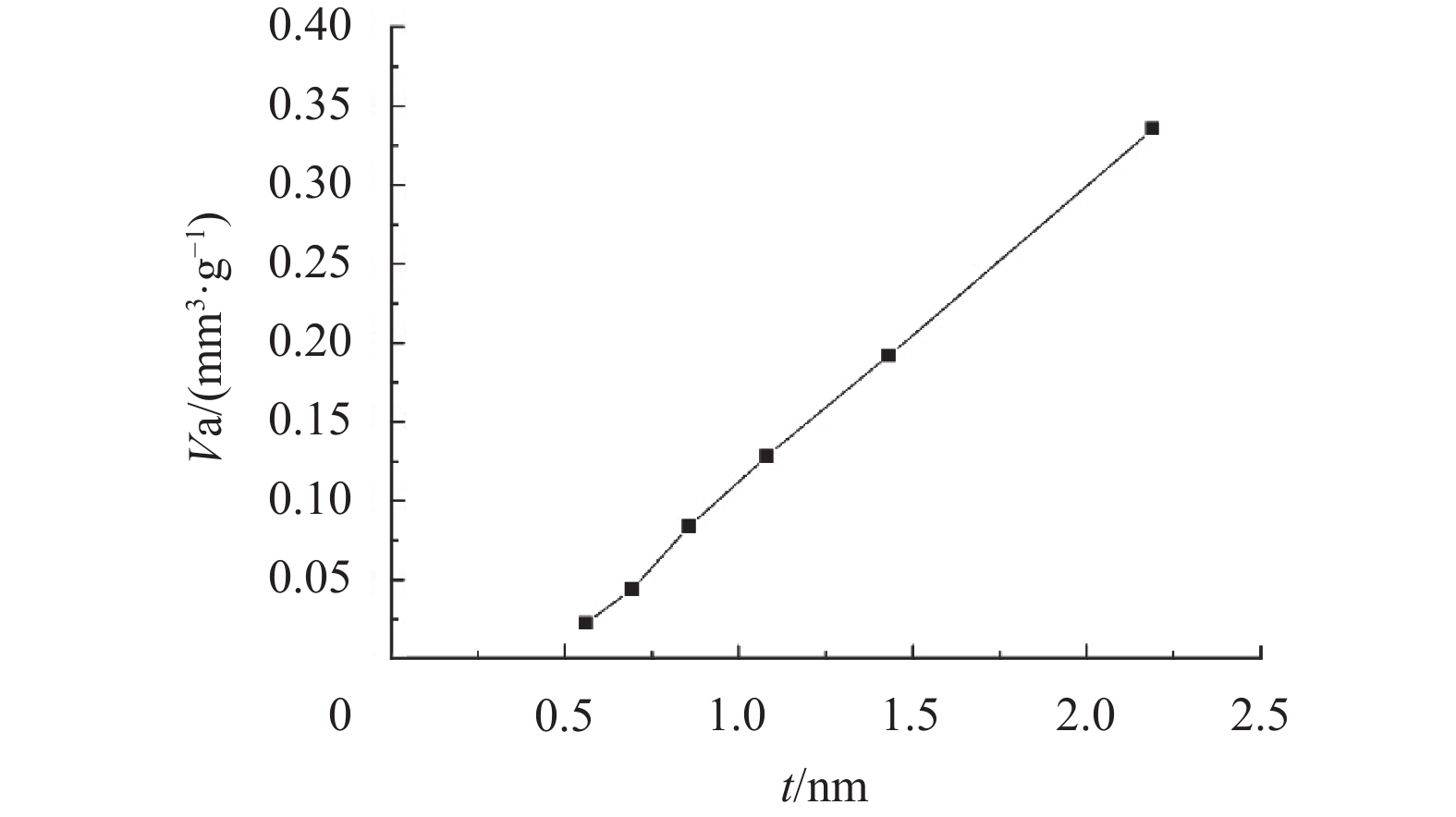
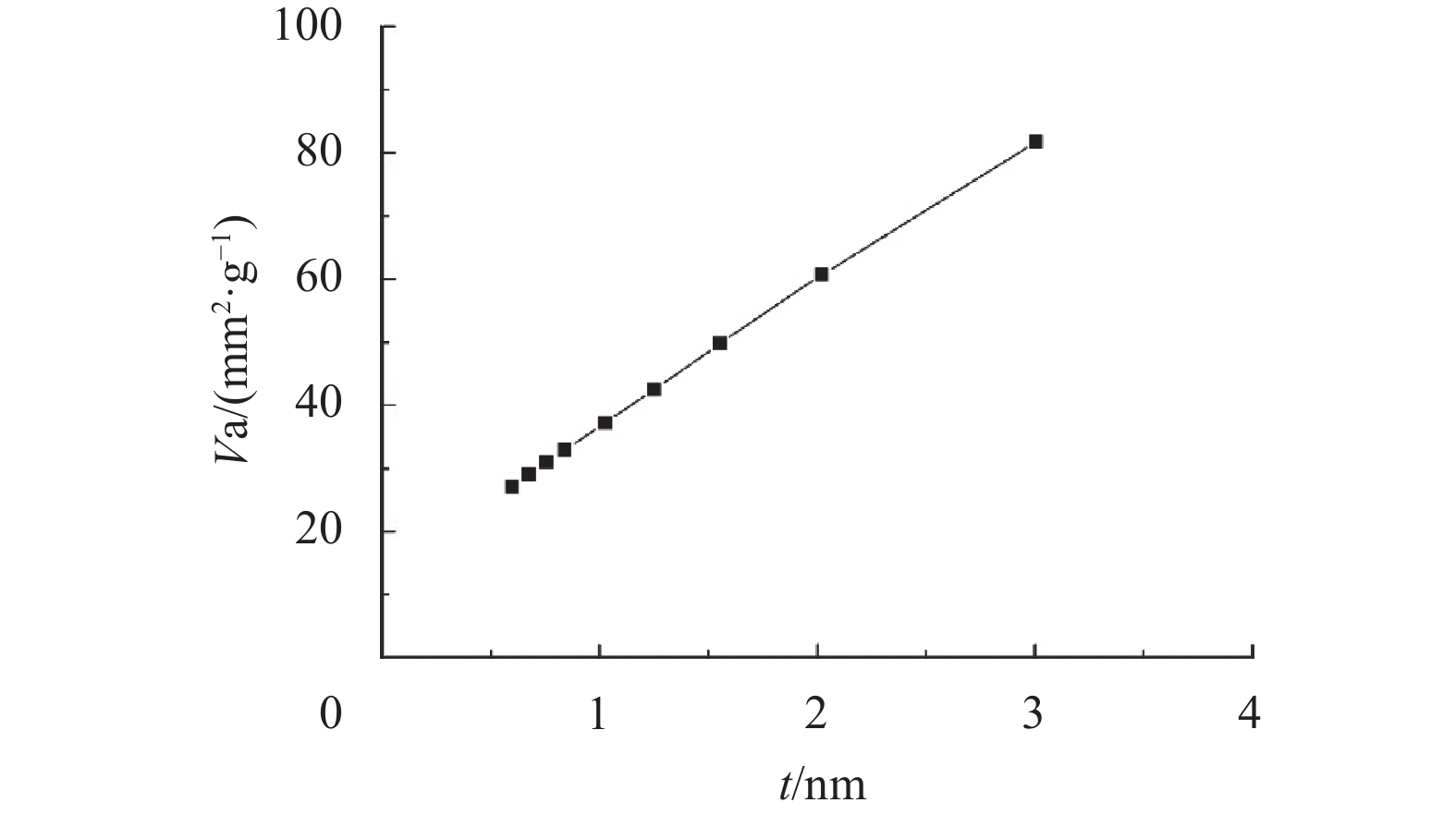
PET和MnO2/PET的中孔分析报告如图4和图5所示. 对于样品PET,最大值为2.189 nm,而样品MnO2/PET最大值则为3.008 nm. 显然,中孔浓度MnO2/PET高于PET,类似比表面积的数据,也遵循改性后的无纺布比表面积大于改性前比表面积的趋势,而MnO2/PET的孔径在0.5~3 nm之间.
|
图 4 25 ℃时PET的孔径分析 Figure 4 Mesopore analysis for PET at 25 ℃ |
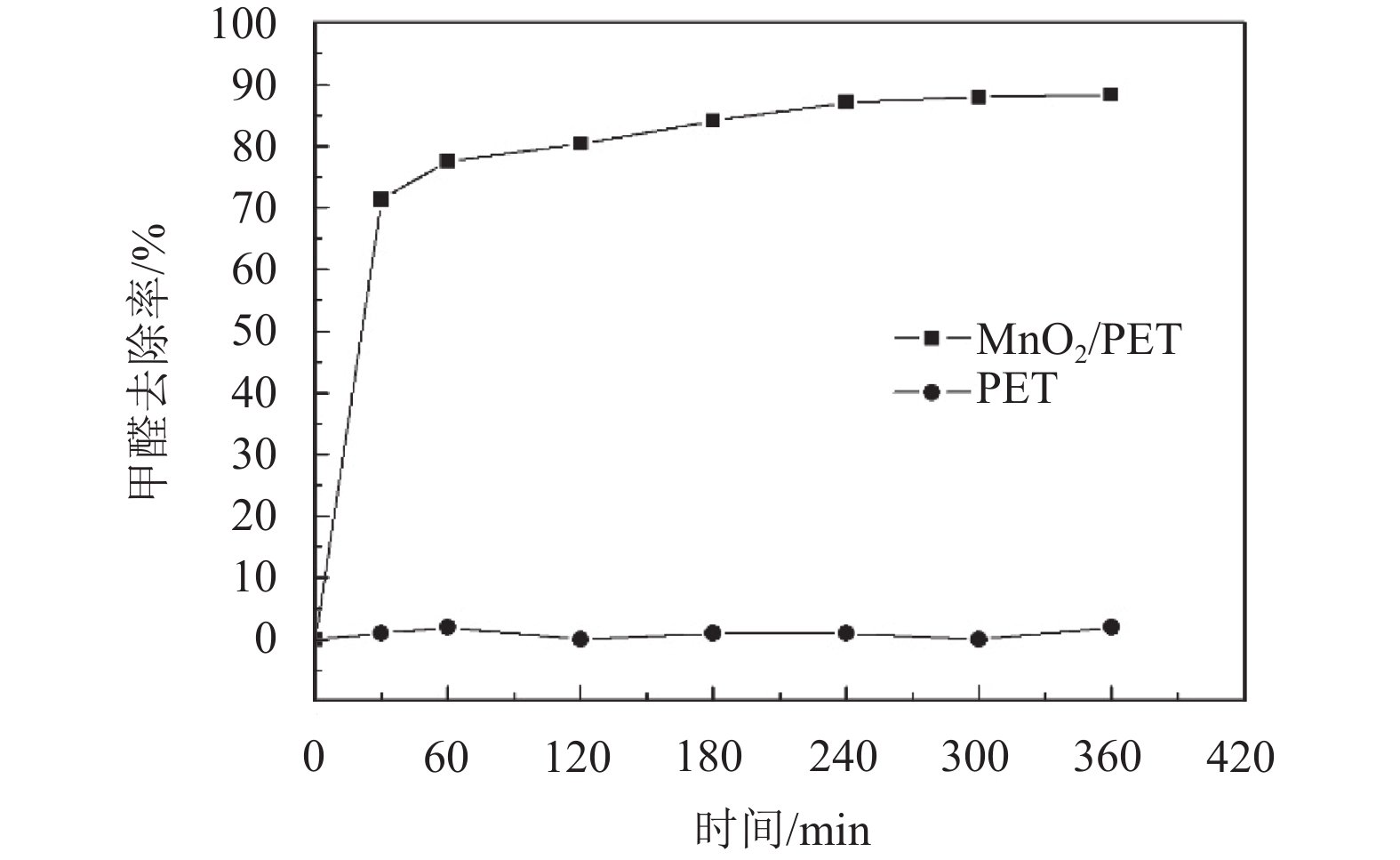
对上述方法制取的无纺布负载锰氧化物进行甲醛去除测试,作出甲醛去除曲线图. 纯的无纺布并没有去除甲醛的活性,而MnO2/PET对甲醛去除显示出了较高活性. 甲醛通过与MnO2/PET发生催化反应,在前30 min内甲醛气体质量浓度大幅度减小,由2.84 mg/m3降至0.81 mg/m3,去除率达到71.36%. 然后甲醛浓度缓慢降低,在240~360 min内甲醛浓度基本趋于稳定,最低质量浓度达到0.33 mg/m3,而去除率则达到88.29%.
|
图 5 25 ℃时MnO2/PET的孔径分析 Figure 5 Mesopore analysis for MnO2/PET at 25 ℃ |
|
图 6 PET与MnO2/PET对甲醛去除效果的对比 Figure 6 Comparison of HCHO removal by MnO2/PET and PET |
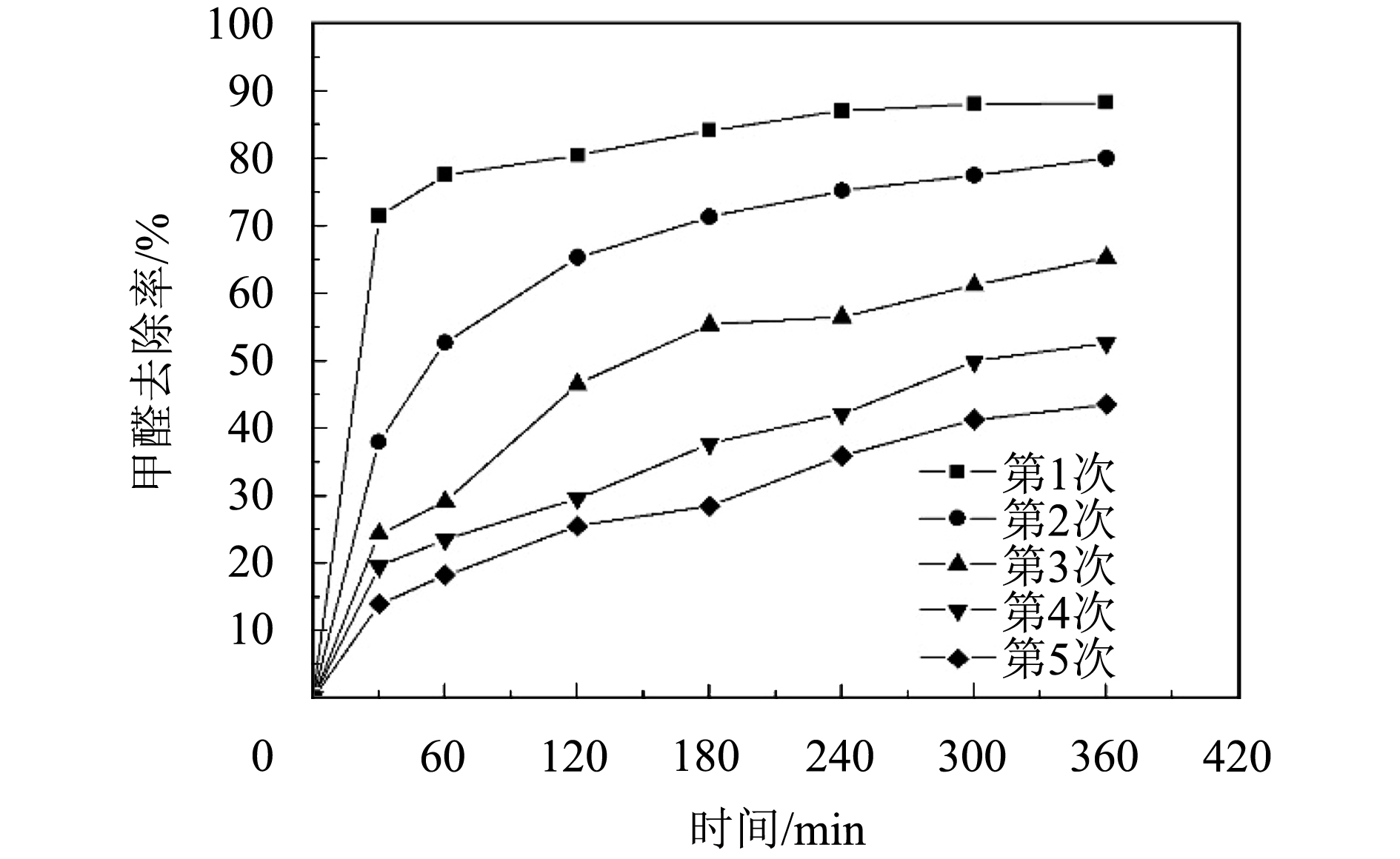
对无纺布负载锰氧化物进行多次去除甲醛性能测试,结果如图7所示. 随着实验次数的增加,无纺布负载金属氧化物发生失活,去除甲醛效果与速度有所降低. 在第5次实验过程中,甲醛去除率最高达到43.48%,但仍比文献报道的纯二氧化锰以及负载贵金属催化剂对甲醛去除效果要高. 由于甲酸盐物种的积累,引起了失活. 文献[17-18]报道,HCHO可以氧化成甲酸盐物种,甲酸盐的进一步氧化是整个催化氧化过程中的速率限制步骤. 在反应过程中还伴随着大量的物理吸附,由SEM图可见无纺布负载锰氧化物的表面存在着大量的孔道,为催化剂催化氧化甲醛提供了良好的场所,随着试验次数增多,无纺布负载锰氧化物对甲醛去除效果有所下降.
|
图 7 不同反应次数MnO2/PET对甲醛的去除效果 Figure 7 Removal efficiency of formaldehyde by different reaction times of MnO2/PET |
本文制备了无纺布负载锰氧化物整体式催化剂,原料廉价易得,实验条件简单. 在室温下有良好的甲醛去除效果,最高去除甲醛率达到88.29%. 由于催化剂多次使用较易失活,所以其应用性受到了局限,这也为今后的研究提出了新的方向.
| [1] | WARGOCKI P, BAKÓ-BIRÓ Z, CLAUSEN G, et al. Air quality in a simulated office environment as a result of reducing pollution sources and increasing ventilation[J]. Energy & Buildings, 2002, 34(8): 775-783. |
| [2] | 李庆军. 观赏植物吸收居室甲醛能力的比较[D]. 哈尔滨: 东北林业大学园林学院 2006. |
| [3] | BOONAMNUAYVITAYA V, SAE-UNG S, TANTHAPANICHAKOON W. Preparation of activated carbons from coffee residue for the adsorption of formaldehyde[J]. Separation & Purification Technology, 2005, 42(2): 159-168. |
| [4] | ZHAO D Z, LI X S, SHI C, et al. Low-concentration formaldehyde removal from air using a cycled storage–discharge (CSD) plasma catalytic process[J]. Chemical Engineering Science, 2011, 66(17): 3922-3929. DOI: 10.1016/j.ces.2011.05.019. |
| [5] |
卢敬霞, 张彭义, 何为军. 臭氧光催化降解水中甲醛的研究[J].
环境工程学报, 2010, 4(1): 27-30.
LU J X, ZHANG P Y, HE W J. Research on degradation of formaldehyde in aqueous solution by combined photocatalysis and ozonation[J]. Chinese Journal of Environmental Engineering, 2010, 4(1): 27-30. |
| [6] | CHRISTOSKOVA S G, DANOVA N, GEORGIEVA M, et al. Investigation of a nickel oxide system for heterogeneous oxidation of organic compounds[J]. Applied Catalysis A General, 1995, 128(2): 219-229. DOI: 10.1016/0926-860X(95)00013-5. |
| [7] | SEKINE Y, NISHIMURA A. Removal of formaldehyde from indoor air by passive type air-cleaning materials[J]. Atmospheric Environment, 2001, 35(11): 2001-2007. DOI: 10.1016/S1352-2310(00)00465-9. |
| [8] | SEKINE Y. Oxidative decomposition of formaldehyde by metal oxides at room temperature[J]. Atmospheric Environment, 2002, 36(35): 5543-5547. DOI: 10.1016/S1352-2310(02)00670-2. |
| [9] | HAN Z, CHANG V W C, ZHANG L, et al. Preparation of TiO2-Coated Polyester Fiber Filter by Spray-Coating and Its Photocatalytic Degradation of Gaseous Formaldehyde[J]. Aerosol & Air Quality Research, 2012, 12(6): 1327-1335. |
| [10] | SHI C, WANG Y, ZHU A, et al. MnxCo3-xO4, solid solution as high-efficient catalysts for low-temperature oxidation of formaldehyde [J]. Catalysis Communications, 2012, 28(28): 18-22. |
| [11] | WANG J, YUNUS R, LI J, et al. In situ synthesis of manganese oxides on polyester fiber for formaldehyde decomposition at room temperature[J]. Applied Surface Science, 2015, 357: 787-794. DOI: 10.1016/j.apsusc.2015.09.109. |
| [12] | ZHOU L, HE J, ZHANG J, et al. Facile in-Situ Synthesis of Manganese Dioxide Nanosheets on Cellulose Fibers and their Application in Oxidative Decomposition of Formaldehyde[J]. Journal of Physical Chemistry C, 2011, 115(34): 16873-16878. DOI: 10.1021/jp2050564. |
| [13] | 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 18204.2-2014 公共场所卫生检验方法 第2部分: 化学污染物[S]. 北京: 中国标准出版社, 2014. |
| [14] |
陶玉贵, 金成, 曹宁. 水热法仿生合成纳米二氧化锰及其形貌调控[J].
化工新型材料, 2013, 41(3): 122-124.
TAO Y G, JIN C, CAO N, et al. Hydrothermal synthesis and morphology control of nano-manganese dioxide[J]. New Chemical Materials, 2013, 41(3): 122-124. |
| [15] | ZHANG H, WANG Y, WANG C. Influence of surfactant on the capacitive performance of manganese dioxide prepared at different temperatures[J]. Energy Conversion & Management, 2013, 74(5): 286-292. |
| [16] |
曹水良, 周天祥, 莫珊珊. 介孔炭负载二氧化锰复合材料电化学的性能[J].
暨南大学学报(自然科学与医学版), 2011, 32(1): 57-60.
Cao S L, ZHOU T X, MO S S, et al. Electrochemical performance of Journal of MnO2/mesoporous carbon composite [J]. Jinan University(Natural Science & Medicine Edition), 2011, 32(1): 57-60. |
| [17] | TANG X, LI Y, HUANG X, et al. MnOx–CeO2, mixed oxide catalysts for complete oxidation of formaldehyde: Effect of preparation method and calcination temperature [J]. Applied Catalysis B Environmental, 2006, 62(3-4): 265-273. DOI: 10.1016/j.apcatb.2005.08.004. |
| [18] | CHEN B B, ZHU X B, CROCKER M, et al. FeOx-supported gold catalysts for catalytic removal of formaldehyde at room temperature [J]. Applied Catalysis B Environmental, 2014, 154-155(1): 73-81. |
 2018, Vol. 35
2018, Vol. 35

