2. 广东工业大学 环境科学与工程学院, 广东 广州 510006;
3. 北京师范大学珠海校区 环境与生态前沿交叉研究院, 广东 珠海 519087
2. School of Environmental Science and Engineering, Guangdong University of Technology, Guangzhou 510006, China;
3. Advanced Interdisciplinary Institute of Environment and Ecology, Beijing Normal University, Zhuhai 519087, China
近年来,随着工业的蓬勃发展以及人们对各类药品和产品的广泛使用,城市和工业废水中经常检测出具有生物毒性、环境持久性、生物累积性等特征的新污染物(ECs),如药物、内分泌干扰物和全氟化合物[1-2]。传统的污水处理厂采用的物理和生物水处理技术无法有效去除这些ECs。这些污染物容易随着处理后的出水和生物污泥一同进入水环境,对水生动植物和人类健康构成潜在威胁。
高级氧化技术(AOPs)能够产生强氧化性的自由基,与持久性污染物相互作用,有效地将其彻底矿化为CO2和H2O[3]。在许多废水处理设施中,AOPs已经被广泛用于生物处理的预处理单元,替代传统的三级处理设施,以提高难降解有机污染物的去除率[4]。然而,在处理实际废水中低浓度、难降解ECs(ng·L−1 ~ μg·L−1水平)时,面临一个挑战:即AOPs所产生的大部分自由基不可避免地被更高数量级的共存溶解性有机物(Dissolved Organic Matter, DOM)和无机离子(如Cl−,HCO3−等)消耗[5-6],导致水处理效率下降。为了达到预期的去除效果,通常需要投加过量的氧化剂或增加能量输入,显著提高了水处理成本,并可能引发二次污染。因此,迫切需要开发高效的选择性降解方法,以推动AOPs的进一步应用和发展[7]。
靶向电吸附−转化技术是一种将电吸附技术与电化学高级氧化技术(Electrochemical Advanced Oxidation Processes, EAOPs)相结合的选择性氧化技术[8-10]。电吸附技术能够精确识别和捕获目标污染物,随后将富集的目标污染物释放至氧化电极进行氧化处理,有效解决了AOPs去除复杂废水中ECs时因其他污染物干扰造成的高能耗和低效率的问题。本文系统性地阐述了水清洁技术中选择性氧化策略的理念,着重介绍了靶向电吸附−转化去除水体中全氟和多氟烷基物质(PFAS)的技术特点和发展现状。最后,对未来在这一领域的研究方向与趋势进行了展望。
1 选择性高级氧化策略 1.1 AOPs处理低浓度新污染物面临挑战AOPs处理化学成分复杂的实际水体中的低浓度ECs时,效率低且能耗高,这是由以下几点原因造成的。首先,AOPs产生的大部分自由基不可避免地会被浓度高于目标污染物的共存溶解有机物(如腐殖质、微生物分泌物、溶解的植物组织和动物的废弃物)和无机离子(如Cl−,
选择性高级氧化技术具有排除基质效应干扰、实现低能高效去除目标污染物等特点。实现选择性AOPs的途径可以分为两种,其技术原理如图1所示[10]:一是控制反应物的反应性,二是调整氧化剂的可及性。
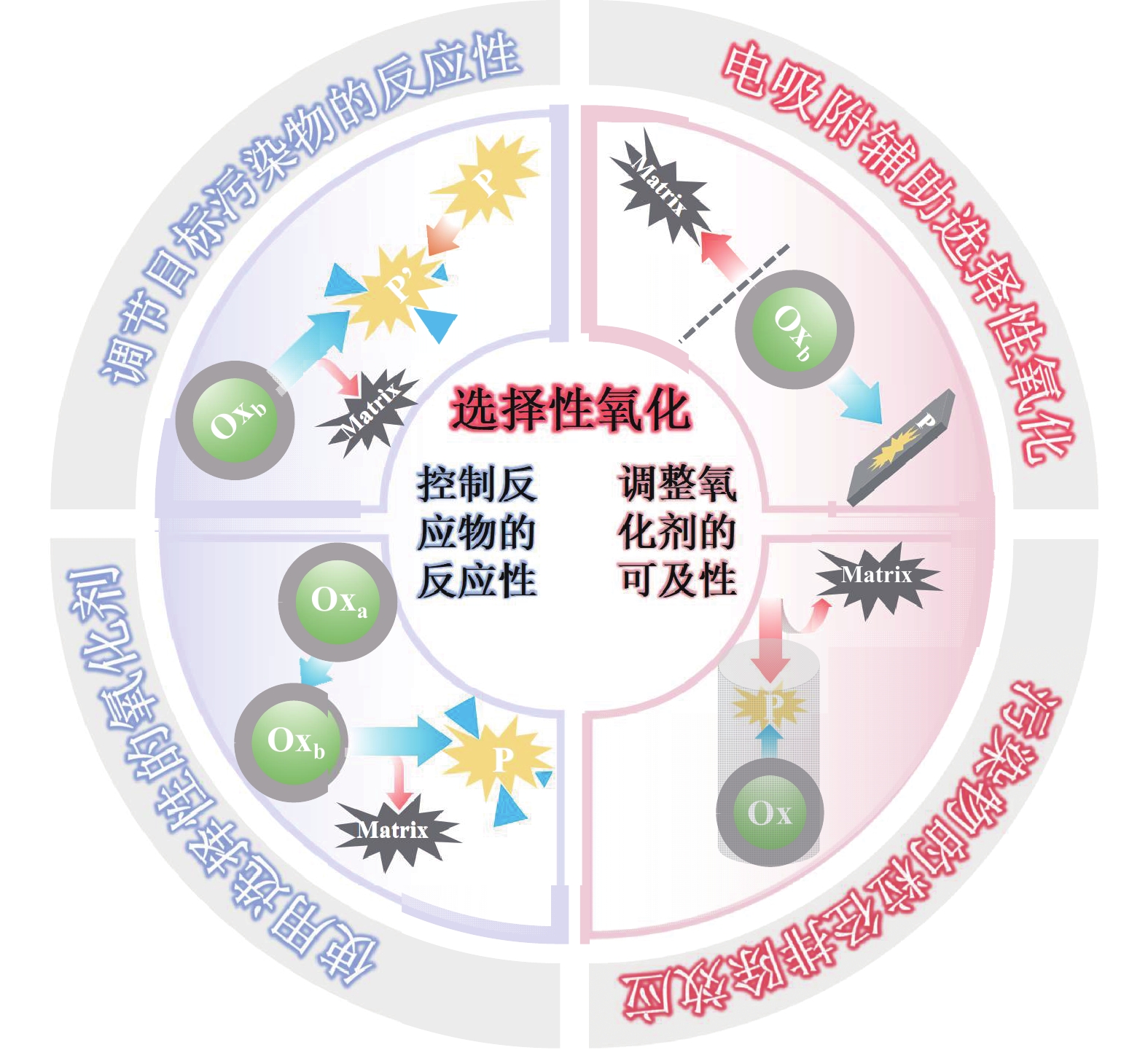
|
图 1 选择性高级氧化策略原理示意图 Figure 1 Schematic diagram of the selective advanced oxidation strategy |
控制反应物的反应性包括调节目标污染物的特性和使用具有选择性的氧化剂。调节目标污染物的特性指的是引入诱导或保护基团,调节目标污染物的化学键相互作用,从而实现目标污染物选择性氧化。例如:环境中羧酸盐,包括草酸盐、柠檬酸盐、丙二酸盐、琥珀酸盐和乙二胺四乙酸,这些化合物量子产率和/或摩尔吸收系数低,光解反应对它们没有降解效果。然而,一旦与Fe(III) 形成配合物后,这些配体在260~366 nm范围内表现出较高的摩尔吸收系数和量子产率,易发生光解反应后选择性去除[12]。使用具有选择性的氧化剂,是利用各种自由基对不同基团的反应速率不同,实现目标污染物的高效去除。例如:以酚类和芳香胺类为目标污染时,O3的选择性最高,1O2的选择性最低[13];脂肪族化合物包括烷烃、羧酸、醇和含杂原子的碳链,由于其主要结构为饱和键,对氧化剂相对惰性,HO•对其有最高的选择性[10]。
调整氧化剂的可及性的途径包括电吸附辅助选择性氧化和粒径尺寸排斥效应选择性氧化。在非均相氧化体系中,自由基存在于催化剂表面或有限的空间之内(受限于自由基的寿命)。自由基向本体溶液的扩散和污染物向界面区域的扩散存在一定的阻力,两者有效接触是实现选择性氧化的关键。粒径排除效应通过筛选特定粒径分子进行反应[14]。只有尺寸小于窗口的分子才能扩散到内部到达活性位点进行后续反应,而尺寸较大的分子则被排除在外。例如,在MIL-53(Fe)的支撑层上构建聚偏氟乙烯超滤膜进行类芬顿反应,在处理含7.8 mg∙L−1总有机碳、14 mg∙L−1悬浮物和17 mg∙L−1总氮的二级出水中,双酚S的去除率达到65%[15]。常见的电吸附辅助选择性氧化技术包括电吸附−转化和分子印记技术。其中分子印记技术制备具有目标污染物特征孔的印迹催化剂以多种类的氢键作为识别位点,进行选择性吸附和降解[16-17]。电吸附辅助选择性借助目标污染物与背景化合物在电学性质、疏水性、酸碱性质上的差异,进行特异性吸附并降解[10]。
2 靶向电吸附−转化技术的特点 2.1 靶向电吸附−转化技术的基本原理靶向电吸附−转化技术是选择性高级氧化的重要技术分支,由电吸附和电化学高级氧化组成;其中,电吸附技术精确识别和捕获目标污染物后富集释放,随后被释放的目标污染物经电化学高级氧化处理[18]。以氧化还原聚合物电极结合掺硼金刚石电极(Boron-doped Diamond, BDD)降解全氟辛酸(Perfluorooctanoic Acid, PFOA)为例,吸附−解吸−脱氟的原理如图2所示。吸附过程中,氧化还原聚合物能够在复杂水体中通过与目标污染物的特殊作用力选择性结合(例如:疏水作用力、氢键、静电相互作用力、化学键等);解吸和脱氟过程中,工作电极在电位控制下,催化剂表面的特异性基团发生变化,使得与目标污染物特异性结合的作用力变弱,吸附的污染物实现脱附,BDD氧化被释放的PFOA。
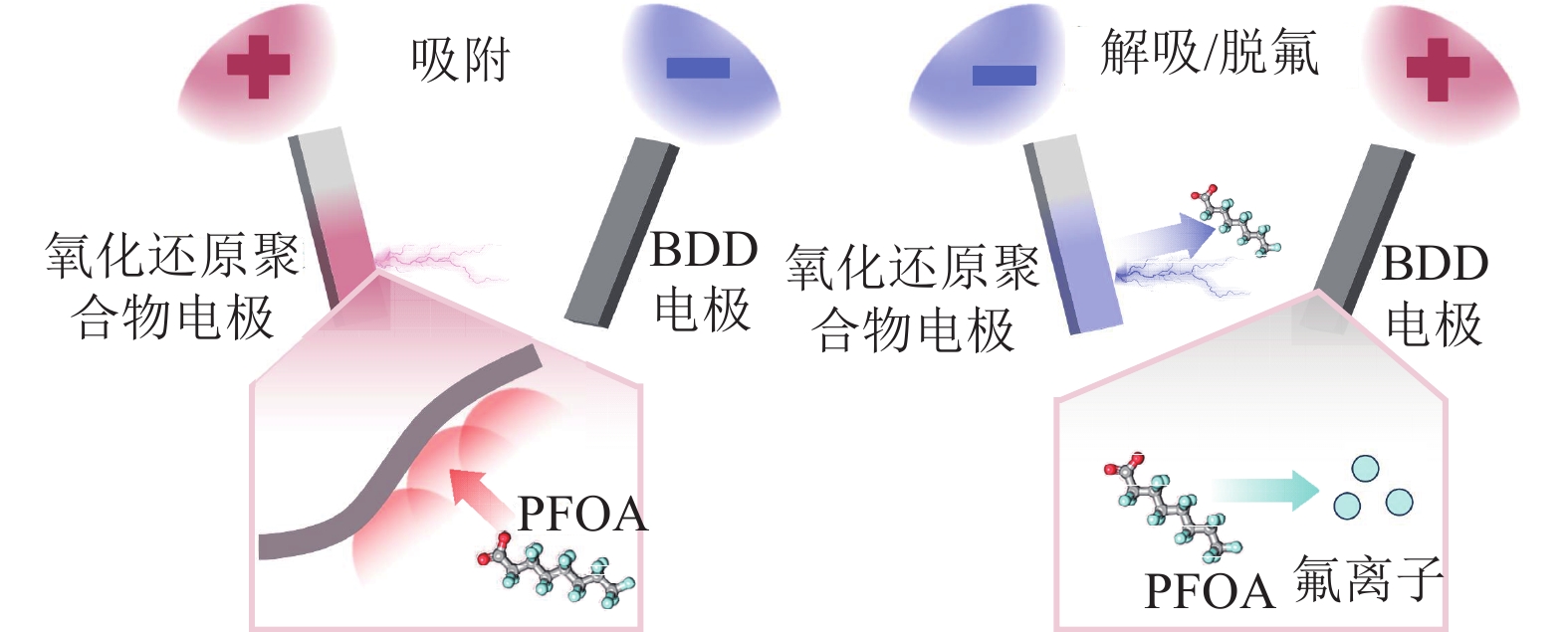
|
图 2 氧化还原聚合物电吸附剂和BDD氧化电极协同吸附−解吸−氧化PFOA Figure 2 The redox polymer electric adsorbent and the BDD oxidation electrode are synergistic in adsorption-desorption - oxidation of PFOA |
靶向电吸附−转化技术将电吸附技术和电化学高级氧化技术(EAOPs)耦合,有效解决了去除复杂废水中难降解有机物中能耗高、自由基利用率低的问题。将污染物的分离和修复集成在单个电化学装置中,使得处理设施便捷、占地面积小、技术操作简便。为了全面地分析电吸附−转化技术的特点和发展状况,将其与吸附和电化学氧化技术进行详细的工况参数对比,最后对技术的能耗进行汇总和分析。
2.2.1 与吸附技术对比分析PFAS是目前世界上发现的最难降解的新污染物之一,包括PFOA、全氟辛基磺酸(Perfluorooctane Sulphonate, PFOS)及其他众多化合物,其具有很高的生物积累能力,被列入多国重点管控新污染物清单。吸附法处理PFAS因简单、高效和成本效益高的特点而备受青睐,处理原理包括疏水相互作用、静电相互作用、孔隙填充、阳离子桥接、络合、离子交换、范德华相互作用和氢键[19]。其中,疏水相互作用发生在PFAS疏水的C-F链和吸附剂的疏水区域之间(特别是高疏水性长链PFAS);静电相互作用发生在带电吸附剂与阳离子PFAS和阴离子头基之间。例如,全氟磺酸和全氟羧酸分子的亲水头
目前常见的PFAS吸附材料有碳材料、金属氧化物、离子交换树脂、矿物材料、聚合物等。如表1所示,活性碳和树脂作为最常用的吸附剂,有着较高的吸附容量,可以有效地去除水中的PFOA和PFOS。然而,活性炭的再生和树脂的制造是昂贵的,限制了它们的大规模使用。电辅助条件下能有效提高碳材料的吸附性能。目前有关吸附的大部分研究没有关注再生性能,忽略了吸附剂的分离、收集和再生在实际生产难实现的问题[21]。报道的再生方法包括化学再生和热再生。其中,热再生技术成本高昂,需要高温(>600 ℃)才能完全分解PFAS;化学再生技术受限于对有机溶剂的需求,这使得该技术昂贵且容易造成二次污染[21]。
| 表 1 不同材料对PFAS的吸附研究 Table 1 Summary of PFAS adsorption by different materials |
靶向电吸附−转化技术拥有基于电气控制的吸附剂的再生特性,在再生过程中使用清洁的电能替代有毒、易挥发的有机溶剂。此外,耦合电化学高级氧化技术(EAOPs)对吸附的PFAS进行降解,可实现污染物的全流程处理。表1中的P(TMA51-co-TMPMA49)聚合物吸附效果与常规催化剂相当,在电势调控驱动下,再生效率最高可达80%。许多吸附剂文献综述的展望中也表现出对电驱动的电吸附解吸再生工艺的期待[19-21]。
2.2.2 与电化学高级氧化技术对比分析PFAS具有强C-F键(531.5 kJ∙mol−1)和高度稳定的螺旋结构,受到PFAS污染水体的修复和处理极具挑战性[28]。AOPs是降解PFAS的有效方法,包括光催化、超声波辐照、等离子体氧化、基于硫酸根(SO4•−)的氧化工艺和EAOPs等。EAOPs的显著优势在于室温和室温压力下实现快速完全矿化且无需化学添加剂。阳极材料在EAOPs中扮演着关键角色,常用于去除PFAS的活性材料的包括BDD、TinO2n-1以及掺杂改性后的PbO2和SnO2等,它们降解全氟化合物的性能参考表2。根据表中数据可知,金属电极面对不同质量浓度的PFOA时,去除率能达90%甚至更高。然而,目前大部分实验却只是通过模拟废水,在严格、温和且可控的环境进行反应。这些实验忽略了其中DOM和无机离子对自由基的消耗。优异的降解效果背后是高能耗且伴随着卤代消毒副产物产生的风险。
| 表 2 金属电极电化学降解PFOA效率对比 Table 2 Comparison of electrochemical PFOA degradation efficiencies using metal electrodes |
靶向电吸附−转化技术将电吸附与EAOPs技术耦合,其中电吸附技术有效降低竞争物质的干扰,提高氧化过程中自由基的利用率。该技术通过吸附的方法将目标污染物富集后,再将目标污染物解吸至氧化电极。这种方法显著提高了EAOPs的矿化效率。例如,P(TMA51-co-TMPMA49)氮氧共聚物用作吸附剂处理0.1 mmol∙L−1 PFOA和20 mmol∙L−1 Cl−的共存溶液时,PFOA的吸附分离系数高达500。在含5 mmol∙L−1 Na2CO3共存水体、自来水和市政污水二级出水等复杂水体中,当PFOA浓度为0.1 mmol·L−1时,3 h内P(TMA51-co-TMPMA49)电吸附去除率为93%,PFOA质量浓度为100 μg·L−1时,电吸附去除率为82.5%[18]。PFOA与氯化物的分离系数
| $ \eta _{{{\rm{PFOA}}}^{-}/{{{\rm{Cl}}}}^{-}}=\frac{{{q}}_{{{{\rm{PFOA}}}}^{-}/}{{q}}_{{{{\rm{Cl}}}}^{-}}}{{{(}{c}}_{{{{\rm{PFOA}}}}^{-}}{{{) }}_{{0}}{/(}{c}}_{{{{\rm{Cl}}}}^{-}}{{) }}_{{0}}} $ | (1) |
式中:
靶向电吸附−转化技术能够有效提高PFAS降解的能效。一方面,它通过降低基质效应的干扰,减少了自由基的淬灭效应。另一方面,经过富集和再释放过程后,它提高了溶液中PFAS的初始浓度。以P(TMAx-co-TMPMA1−x) -CNT电极耦合BDD电极为例,吸附和解吸的能耗为4.4×10−7 kWh∙μmol−1(根据式(2)计算)。当BDD仅用于去除PFOA,其去除效率约为85%时,能耗达5.1×10−6 kWh∙μmol−1。与现有的各种处理技术的EER进行能耗对比,结果如表3所示。表中所列的处理技术包括声溶、光解、光催化、电子束和电化学氧化,其能耗普遍高于靶向电吸附−转化技术。值得注意的是,使用BDD电极处理不同浓度的PFAS时,其能耗相差若干数量级,这也间接说明富集后处理对降低能耗的作用。此外,选择性吸附对能效的提升还取决于污染水体中各种污染物的状态和浓度。
| 表 3 文献报道的PFOS降解技术的能耗比较 Table 3 A literature report on electrochemical degradation of PFOS by metal electrode |
| $ {{E}}_{{{\rm{ER}}}}{}=\frac{{\left(\displaystyle\int {(}{{E}}_{{{\rm{w}}}}-{{}{E}}_{{{\rm{c}}}}{) }{\times}{i}{{\rm{d}}}{t}\right) }_{{{\rm{adsorb}}}}}{{{n}}_{{{\rm{adsorb}}}}}+\frac{{\left(\displaystyle\int {(}{{E}}_{{{\rm{w}}}}-{{E}}_{{{\rm{c}}}}{) }{\times}{i}{{\rm{d}}}{t}\right) }_{{{\rm{desorb}}}}}{{{n}}_{{{\rm{desorb}}}}} $ | (2) |
式中:Ew为工作电极的电势,Ec为对电极的电势,i为电路电流,n为PFAS被吸附(adsorb)或解吸(desorb)的摩尔数。
3 靶向吸附−转化技术的发展现状 3.1 核心部件——氧化还原聚合物电吸附材料是决定特定电位下选择性吸附−释放目标污染物的关键部件。目前的研究中,氧化还原聚合物是选择性吸附−解吸PFAS的高效平台。伊利诺伊大学的Su Xiao团队[18]首次成功制备了氧化还原聚合物用于靶向吸附−转化PFOA,这一方法有效降低了水体中复杂化学物质的干扰,提高了PFOA的脱氟能效。具体来说,研究团队制备了一种由4-甲基丙烯酰氧基-2,2,6,6-四甲基哌啶-1-氧基(TMA)和4-甲基丙烯酰氧基-2,2,6,6-四甲基哌啶(TMPMA)为重复单元的氮氧化物共聚物(PTMA-co-PTMPMA)用于电吸附−释放PFOA。在高分子共聚物结构中,TMPMA上的氨基(N-H)对PFAS有着高亲和力,TMA上的氮氧自由基(N-O•)可以在通电的条件下转化为带正电的铵氧离子(+N=O),它是实现电位控制下释放PFAS的关键基团,其示意图如图3(a)所示。在0.1 mmol∙L−1 PFOA和20 mmol∙L−1 Cl−共存的体系中,1.0 V vs. Ag/AgCl恒电位施加于以多壁碳纳米管为载体的P(TMA51-co-TMPMA49)-CNT工作电极后,其对PFOA吸附容量为291 mg∙g−1;随后在−1.0 V vs. Ag/AgCl电位下实现了80%的解吸的效率。根据图3(b)~(d)中聚合物电极吸附和解吸前后的微观形貌和成分分析可知,聚合物电极对PFOA有着显著吸附和释放[41]。BDD电极对解吸的PFOA矿化处理时,PFOA的去除率为100%,脱氟率为81%,脱氟的能耗为62.3 kWh∙mol−1。其整体的吸附、解吸和矿化的能耗,低于文献报道的传统电化学,微波、紫外和超声波等技术(如表3所示)。
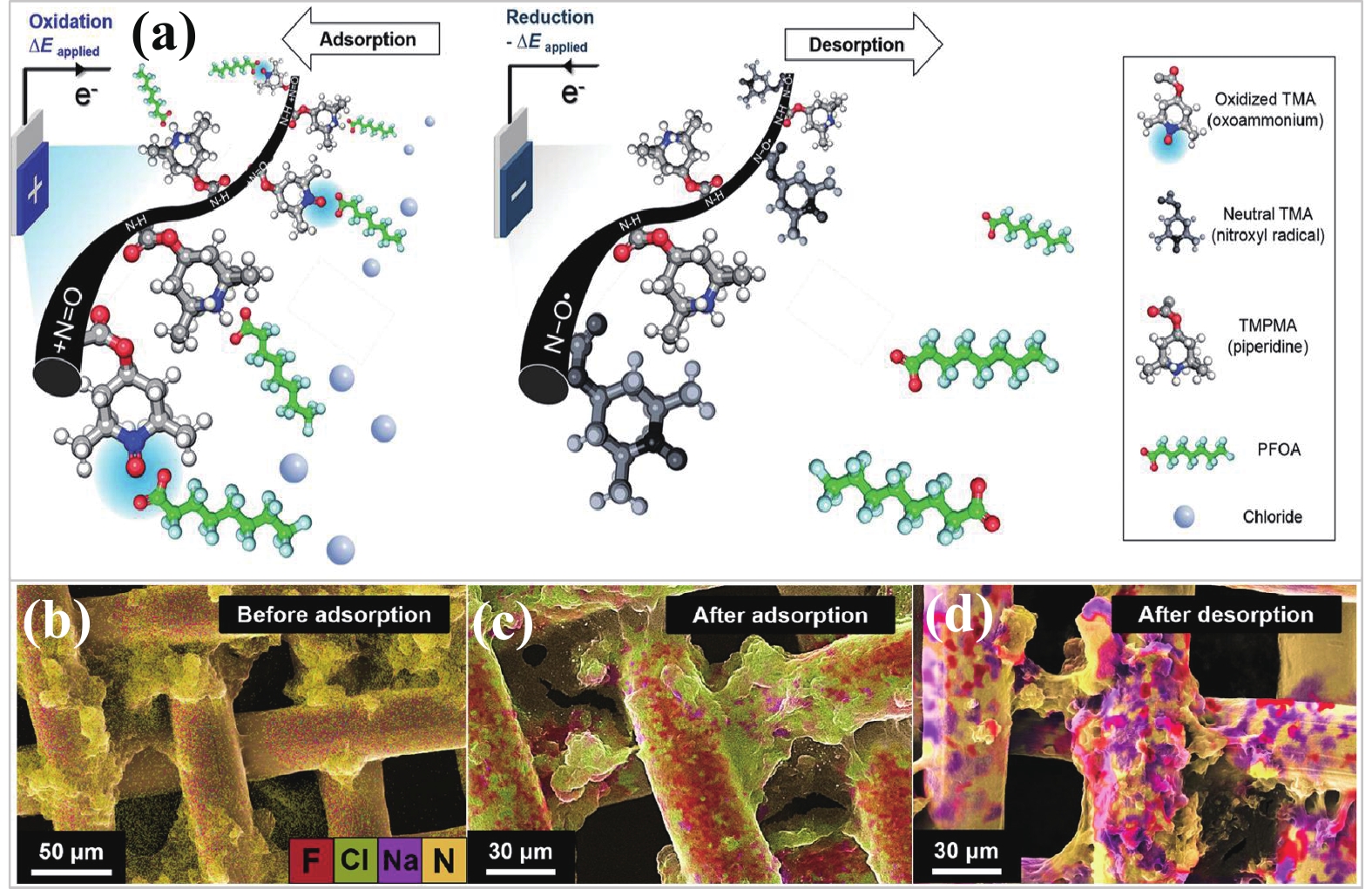
|
图 3 氮氧聚合物电化学控制捕获和释放PFOA的示意图(a)[18];氮氧聚合物电极吸附和释放PFOA前后SEM-EDS图像(b)~(d)[41];图片版权归约翰威立国际出版集团和美国化学学会所有 Figure 3 Schematic diagram of the electrochemical control of PFOA capture and release in a nitrogen oxide polymer (a) [18]; SEM-EDS images before and after adsorption and release of PFOA (b-d) [41]. Copyright © 2023 Wiley Online Library and © 2020 American Chemical Society |
此外,具有氧化还原活性的金属聚合物也表现出优异的电吸附的效果。Paola等[42]制备了5种常见的氧化还原金属聚合物,包括聚(2-(甲基丙烯酰氧基)乙基二茂铁甲酸酯)(PFcMA)、聚乙烯基二茂铁(PVF)、聚甲基丙烯酸二茂铁甲酯(PFMMA)、聚(3-二茂铁基丙基甲基丙烯酰胺)(PFPMAm)和聚二茂铁(2-(甲基丙烯酰氧基)乙基钴茂羧酸盐六氟磷酸盐)(PMAECoPF6),评估了它们作为可再生电吸附剂对PFOA的捕获和释放性能。研究表明,具有更低氧化还原电位和更高电子密度的金属聚合物对PFOA的吸收和再生效率更高。PFOA的亲和力最高的是PMAECoPF6,在0.0 V vs. Ag/AgCl的恒电压下处理0.1 mmol∙L−1 PFOA和20 mmol∙L−1 Cl−共存溶液,吸附量约为90 mg∙g−1;在−0.4 V vs. Ag/AgCl的恒电压下(电压由线性伏安法测得并确定),PFOA的再生效率大于85%。与氮氧共聚物对比,PMAECoPF6的能耗仅为3.86×10−9 kWh∙μmol−1。虽然吸附性能低,但金属聚合物的优势在于低电位下的低能耗和高再生率。
3.2 发展面临的挑战为满足业界对清洁、高效和低功耗水处理技术的要求,靶向吸附−转化技术在去除PFAS方面仍然面临着一些挑战。一方面,构建氧化还原电吸附剂仍缺乏足够的指导,降低解吸的能耗、时间以及提升对短链PFAS的吸附仍然面临挑战;另一方面,电吸附与电化学氧化装置之间的协同作用还有一定的提升空间。
3.2.1 吸附能力与再生能耗的平衡氮氧共聚物P(TMA51-co-TMPMA49)的氨基(N-H)对PFOA具有高亲和性,其吸附性能远高于金属聚合物PMAECoPF6(500 mg∙g−1 vs. 90 mg∙g−1)。氮氧共聚物的电化学高吸附性能伴随着可逆性不足会造成PFOA解吸困难。氮氧共聚物的吸附和解吸电位分别为1 V和−1 V显著高于PMAECoPF6的0和−0.4 V,对应的再生效率却更低(80% vs. 65%)。以吸附0.5 h和解吸1 h为一个循环计算,根据式(2)计算得到,PFcMA、PVF、PFMMA、PFPMAm和PMAECoPF6等金属聚合物的能耗分别为6.0×10−9,17.2×10−9,10.8×10−9,14.6×10−9和3.9×10−9 kWh∙μmol−1,吸附和解吸电位更高的氮氧共聚物P(TMA51-co-TMPMA49)的能耗为4.4×10−7 kWh∙μmol−1[18,42]。目前对聚合物的研究仅局限于基团的比例和金属的电子密度,对材料的分子形态、相互作用机理仍需要更多的研究。
3.2.2 对短链PFAS的吸附在各国政府的法规治理下,传统长链PFAS被淘汰,而短链PFAS逐渐成为替代品。与长链PFAS一样,短链PFAS在环境中也具有持久性,但其流动性和亲水性更高,因此更难从水中去除。以电吸附−解吸催化剂P(TMA51-co-TMPMA49)处理短链的PFAS为例,处理初始浓度为0.1 mol∙L−1的六氟环氧丙烷二聚酸(hexafluoropropylene oxide dimer acid, GenX)时,吸附剂的吸附率保持在80%以上,然而再生效率仅为20%。解吸过程中,氧化还原聚合物并没有发挥太大的作用,而GenX的解吸可能主要受吸附剂表面和溶液之间的浓度差驱动[43]。
氟化后的聚合物能够有效增强PFAS的亲和力,提高吸附性能,特别是对于那些疏水性较差的短链PFAS(C≤5)。例如,经过高度氟化后的多孔环糊精聚合物对PFOA的吸附能力提升了10倍以上,对初始质量浓度1 μg∙L−1的PFOA溶液的吸附率达到了95% [26]。在氮氧共聚物P(TMA-co-TMPMA)的胺基和氮氧自由基之外引入2,2,3,3,3,4,4,4-七氟甲基丙烯酸丁酯(HFBMA)作为氟化的官能团,提高了它的亲氟作用力。通过协调胺、氟化和氧化还原活性官能团的比例,实现了短链PFAS的有效吸附和解吸[41]。结果表明,(PTMPMA39-co-PTMA53-co-PHFBMA8)共聚物电极对全氟丁酸(PFBA,C=4)的吸收率最高可达205.8 mg·g−1,再生率约为100%,PTMA98-co-PHFBMA2对全氟己酸(PFHxA,C=6)的吸附率最高可达860.8 mg∙g−1,再生效率约为70%。在未来的研究中,采用不同氟化方式对吸附剂进行改性以提升短链吸附效率,例如基于分子设计的含氟基团的引入或聚合物的负载基材改性。
3.2.3 电吸附与电化学氧化技术的耦合改进靶向吸附−转化技术的设计主要聚焦于电吸附电极和氧化电极。聚合物电极负责吸附和释放,另外一个负责氧化。在较高浓度的PFAS水体中,这种配置能够起到较好的效果。然而,对于低浓度的大量水体,改进电吸附和电化学氧化的耦合可以有效提高吸附和氧化效率。此外,传统的平板模式仍存在因自由基寿命短,扩散距离有限造成的传质不佳的缺点[14]。
优化改进电吸附和电化学氧化技术的耦合装置能够解决这一问题。如图4(a)所示,在优化平板反应池的流速和电吸附电位控制后,能实现连续流吸附低浓度PFAS,单次通过处理装置后的废水符合排放标准。当达到吸附容量之后,释放富集后的PFAS至对电极高效氧化[43]。进一步地,如图4(b)所示的过滤流装置,能够有效强化电极与污染物的传质,降低自由基在水体迁移过程的消耗。此外,氧化还原聚合物电极在低电位下进行吸附,还能避免析氢反应产生气泡,导致的工作电压升高。
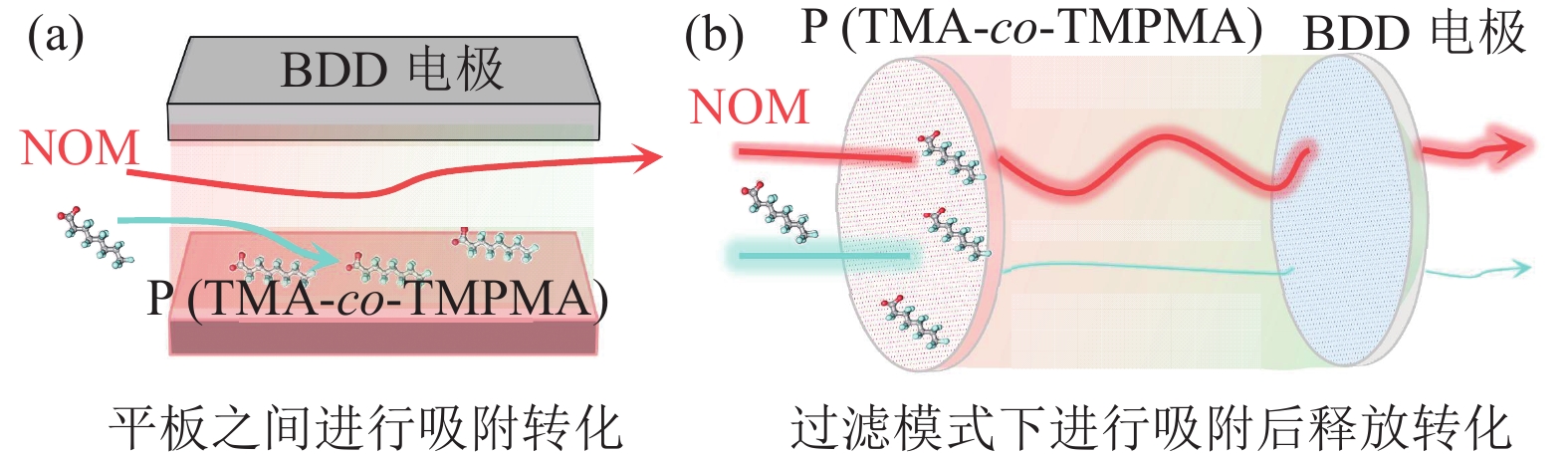
|
图 4 平板和过滤式装置示意图 Figure 4 Diagram of flow-by and flow-through device |
近年来,如何高效低耗地处理复杂水体中的新污染物已成为水清洁技术的研究热点与重点。靶向吸附−转化技术将选择性电吸附和电化学氧化结合,有效提高了对PFAS类新污染物的去除能效,被认为是一种应用前景广阔的新型水清洁技术。未来的研究需进一步关注以下几个方面:
(1) 系统性地完善具有氧化还原活性的电吸附剂的合成指引。
(2) 平衡吸附容量、解吸效率和解吸能耗之间的关系。
(3) 亟需解决如何提升对短链PFAS的吸附效率。
(4) 进一步优化电吸附与电化学氧化装置的耦合。
| [1] |
SCHWARZENBACH R P, ESCHER B I, FENNER K, et al. The challenge of micropollutants in aquatic systems[J].
Science, 2006, 313(5790): 1072-1077.
DOI: 10.1126/science.1127291. |
| [2] |
VON GUNTEN U. Oxidation processes in water treatment: are we on track?[J].
Environmental Science & Technology, 2018, 52(9): 5062-5075.
|
| [3] |
LI X, YANG B, XIAO K, et al. Targeted degradation of refractory organic compounds in wastewaters based on molecular imprinting catalysts[J].
Water Research, 2021, 203: 117541.
DOI: 10.1016/j.watres.2021.117541. |
| [4] |
MARRON E L, MITCH W A, GUNTEN U V, et al. A Tale of two treatments: the multiple barrier approach to removing chemical contaminants during potable water reuse[J].
Account of Chemical Research, 2019, 52(3): 615-622.
DOI: 10.1021/acs.accounts.8b00612. |
| [5] |
HODGES B C, CATES E L, KIM J H. Challenges and prospects of advanced oxidation water treatment processes using catalytic nanomaterials[J].
Nature Nanotechnology, 2018, 13(8): 642-650.
DOI: 10.1038/s41565-018-0216-x. |
| [6] |
BRAME J, LONG M, LI Q, et al. Trading oxidation power for efficiency: differential inhibition of photo-generated hydroxyl radicals versus singlet oxygen[J].
Water Research, 2014, 60: 259-266.
DOI: 10.1016/j.watres.2014.05.005. |
| [7] |
WANG S, LIN Y, SHAO B, et al. Selective removal of emerging organic contaminants from water using electrogenerated Fe(IV) and Fe(V) under near-neutral conditions[J].
Environmental Science & Technology, 2023, 57(25): 9332-9341.
|
| [8] |
ZHANG S, SUN M, HEDTKE T, et al. Mechanism of heterogeneous fenton reaction kinetics enhancement under nanoscale spatial confinement[J].
Environmental Science & Technology, 2020, 54(17): 10868-10875.
|
| [9] |
CHUANG Y H, CHEN S, CHINN C J, et al. Comparing the UV/monochloramine and UV/free chlorine advanced oxidation processes (AOPs) to the UV/hydrogen peroxide AOP under scenarios relevant to potable reuse[J].
Environmental Science & Technology, 2017, 51(23): 13859-13868.
|
| [10] |
YANG Z, QIAN J, SHAN C, et al. Toward selective oxidation of contaminants in aqueous systems[J].
Environmental Science & Technology, 2021, 55(21): 14494-14514.
|
| [11] |
DEWIL R, MANTZAVINOS D, POULIOS I, et al. New perspectives for advanced oxidation processes[J].
Journal of Environmental Management, 2017, 195: 93-99.
DOI: 10.1016/j.jenvman.2017.04.010. |
| [12] |
KARI F G, HILGER S, CANONICA S. Determination of the reaction quantum yield for the photochemical degradation of Fe(III) -EDTA: implications for the environmental fate of EDTA in surface waters[J].
Environmental Science & Technology, 1995, 29(4): 1008-1017.
|
| [13] |
WILKINSON F, HELMAN W P, ROSS A B. Rate constants for the decay and reactions of the lowest electronically excited singlet state of molecular oxygen in solution. an expanded and revised compilation[J].
Journal of Physical and Chemical Reference Data, 1995, 24(2): 663-677.
DOI: 10.1063/1.555965. |
| [14] |
SHIRAISHI Y, SAITO N, HIRAI T. Adsorption-driven photocatalytic activity of mesoporous titanium dioxide[J].
Journal of the American Chemical Society, 2005, 127(37): 12820-12822.
DOI: 10.1021/ja053265s. |
| [15] |
REN Y, WANG S, ZHANG J, et al. Enhancing the performance of fenton-like oxidation by a dual-layer membrane: a sequential interception-oxidation process[J].
Journal of Hazardous Materials, 2021, 402: 123766.
DOI: 10.1016/j.jhazmat.2020.123766. |
| [16] |
LI L, ZHENG X, CHI Y, et al. Molecularly imprinted carbon nanosheets supported TiO2: strong selectivity and synergic adsorption-photocatalysis for antibiotics removal
[J].
Journal of Hazardous Materials, 2020, 383: 121211.
DOI: 10.1016/j.jhazmat.2019.121211. |
| [17] |
HUO P, LU Z, LIU X, et al. Preparation photocatalyst of selected photodegradation antibiotics by molecular imprinting technology onto TiO2/fly-ash cenospheres
[J].
Chemical Engineering Journal, 2012, 189-190: 75-83.
DOI: 10.1016/j.cej.2012.02.030. |
| [18] |
KIM K, MEDINA P B, ELBERT J, et al. Molecular tuning of redox-copolymers for selective electrochemical remediation[J]. Advanced Functional Materials, 2020, 30(52) ; 2004635.
|
| [19] |
DU Z, DENG S, BEI Y, et al. Adsorption behavior and mechanism of perfluorinated compounds on various adsorbents-a review[J].
Journal of Hazardous Materials, 2014, 274: 443-454.
DOI: 10.1016/j.jhazmat.2014.04.038. |
| [20] |
WU C, KLEMES M J, TRANG B, et al. Exploring the factors that influence the adsorption of anionic PFAS on conventional and emerging adsorbents in aquatic matrices[J].
Water Research, 2020, 182: 115950.
DOI: 10.1016/j.watres.2020.115950. |
| [21] |
YU H, CHEN H, FANG B, et al. Sorptive removal of per- and polyfluoroalkyl substances from aqueous solution: enhanced adsorption, challenges and perspectives[J].
Science of the Total Environment, 2023, 861: 160647.
DOI: 10.1016/j.scitotenv.2022.160647. |
| [22] |
DENG S, NIE Y, DU Z, et al. Enhanced adsorption of perfluorooctane sulfonate and perfluorooctanoate by bamboo-derived granular activated carbon[J].
Journal of Hazardous Materials, 2015, 282: 150-157.
DOI: 10.1016/j.jhazmat.2014.03.045. |
| [23] |
WANG F, SHIH K. Adsorption of perfluorooctanesulfonate (PFOS) and perfluorooctanoate (PFOA) on alumina: influence of solution pH and cations[J].
Water Research, 2011, 45(9): 2925-2930.
DOI: 10.1016/j.watres.2011.03.007. |
| [24] |
WANG M, ORR A A, JAKUBOWSKI J M, et al. Enhanced adsorption of per-and polyfluoroalkyl substances (PFAS) by edible, nutrient-amended montmorillonite clays[J].
Water Research, 2021, 188: 116534.
DOI: 10.1016/j.watres.2020.116534. |
| [25] |
MAIMAITI A, DENG S B, MENG P P, et al. Competitive adsorption of perfluoroalkyl substances on anion exchange resins in simulated AFFF-impacted groundwater[J].
Chemical Engineering Journal, 2018, 348: 494-502.
DOI: 10.1016/j.cej.2018.05.006. |
| [26] |
XIAO L, LING Y, ALSBAIEE A, et al. Beta-cyclodextrin polymer network sequesters perfluorooctanoic acid at environmentally relevant concentrations[J].
Journal of the American Chemical Society, 2017, 139(23): 7689-7692.
DOI: 10.1021/jacs.7b02381. |
| [27] |
LI X, CHEN S, QUAN X, et al. Enhanced adsorption of PFOA and PFOS on multiwalled carbon nanotubes under electrochemical assistance[J].
Environmental Science & Technology, 2011, 45(19): 8498-8505.
|
| [28] |
LU D, SHA S, LUO J, et al. Treatment train approaches for the remediation of per-and polyfluoroalkyl substances (PFAS) : a critical review[J].
Journal of Hazardous Materials, 2020, 386: 121963.
DOI: 10.1016/j.jhazmat.2019.121963. |
| [29] |
UWAYEZU J N, CARABANTE I, LEJON T, et al. Electrochemical degradation of per-and poly-fluoroalkyl substances using boron-doped diamond electrodes[J].
Journal of Environmental Management, 2021, 290: 112573.
DOI: 10.1016/j.jenvman.2021.112573. |
| [30] |
WANG Y, LI S S, SHAO Y M, et al. Energy-efficient mineralization of perfluorooctanoic acid: biomass energy driven solar photo-electro-fenton catalysis and mechanism study[J]. Chemical Engineering Journal, 2022, 443.
|
| [31] |
WANG X, ZHUANG Y, ZHANG J, et al. Pollutant degradation behaviors in a heterogeneous Fenton system through Fe/S-doped aerogel[J].
Science of the Total Environment, 2020, 714: 136436.
DOI: 10.1016/j.scitotenv.2019.136436. |
| [32] |
LIN H, NIU J, LIANG S, et al. Development of macroporous Magnéli phase Ti4O7 ceramic materials: as an efficient anode for mineralization of poly-and perfluoroalkyl substances
[J].
Chemical Engineering Journal, 2018, 354: 1058-1067.
DOI: 10.1016/j.cej.2018.07.210. |
| [33] |
SCHAEFER C E, ANDAYA C, URTIAGA A, et al. Electrochemical treatment of perfluorooctanoic acid (PFOA) and perfluorooctane sulfonic acid (PFOS) in groundwater impacted by aqueous film forming foams (AFFFs)[J].
Journal of Hazardous Materials, 2015, 295: 170-175.
DOI: 10.1016/j.jhazmat.2015.04.024. |
| [34] |
VECITIS C D, PARK H, CHENG J, et al. Kinetics and mechanism of the sonolytic conversion of the aqueous perfluorinated surfactants, perfluorooctanoate (PFOA) , and perfluorooctane sulfonate (PFOS) into inorganic products[J].
Journal of Physical Chemistry A, 2008, 112(18): 4261-4270.
DOI: 10.1021/jp801081y. |
| [35] |
JAMES W R, SIDNELL T, ROSS I, et al. Ultrasonic degradation of perfluorooctane sulfonic acid (PFOS) correlated with sonochemical and sonoluminescence characterisation[J].
Ultrason Sonochem, 2020, 68: 105196.
DOI: 10.1016/j.ultsonch.2020.105196. |
| [36] |
JIN L, ZHANG P. Photochemical decomposition of perfluorooctane sulfonate (PFOS) in an anoxic alkaline solution by 185nm vacuum ultraviolet[J].
Chemical Engineering Journal, 2015, 280: 241-247.
DOI: 10.1016/j.cej.2015.06.022. |
| [37] |
GU P F, ZHANG C J, SUN Z Y, et al. Enhanced photoreductive degradation of perfluorooctanesulfonate by UV irradiation in the presence of ethylenediaminetetraacetic acid[J].
Chemical Engineering Journal, 2020, 379: 1385-8947.
|
| [38] |
KIM T H, LEE S H, KIM H Y, et al. Decomposition of perfluorooctane sulfonate (PFOS) using a hybrid process with electron beam and chemical oxidants[J].
Chemical Engineering Journal, 2019, 361: 1363-1370.
DOI: 10.1016/j.cej.2018.10.195. |
| [39] |
YANG S S, FERNANDO S, HOLSEN T M, et al. Inhibition of perchlorate formation during the electrochemical oxidation of perfluoroalkyl acid in groundwater[J].
Environmental Science & Technology Letters, 2019, 6(12): 775-780.
|
| [40] |
WANG L, LU J, LI L, et al. Effects of chloride on electrochemical degradation of perfluorooctanesulfonate by Magneli phase Ti4O7 and boron doped diamond anodes
[J].
Water Research, 2020, 170: 115254.
DOI: 10.1016/j.watres.2019.115254. |
| [41] |
ROMAN S A, YIN S, ELBERT J, et al. Imparting selective fluorophilic interactions in redox copolymers for the electrochemically mediated capture of short-chain perfluoroalkyl substances[J].
Journal of the American Chemical Society, 2023, 145(17): 9508-9519.
DOI: 10.1021/jacs.2c10963. |
| [42] |
BALDAGUEZ M P, ARDILA C V, HARTMANN F, et al. Investigating the electrochemically driven capture and release of long-chain PFAS by redox metallopolymer sorbents[J].
ACS Applied Materials & Interfaces, 2023, 15(18): 22112-22122.
|
| [43] |
BALDAGUEZ M P, COTTY S, KIM K, et al. Emerging investigator series: electrochemically-mediated remediation of GenX using redox-copolymers[J].
Environmental Science:Water Research & Technology, 2021, 7(12): 2231-2240.
|
 2023, Vol. 40
2023, Vol. 40

