2. 华南师范大学 化学学院,广东 广州 510006
2. School of Chemistry, South China Normal University, Guangzhou 510006, China
LiCoO2是锂离子电池中应用最广泛的正极材料之一,该材料具有高达274 mAh/g的理论比容量,然而在充电截止电压4.2 V (vs. Li/Li+) 的情况下,只能发挥一半的比容量,约140 mAh/g[1-2]。研究表明,LiCoO2正极材料比容量的提高可以通过提高电池的充电截止电压来实现[3]。将LiCoO2充电截止电压提高到4.5 V,比容量可达到180 mAh/g[4]。然而,当截止电压高于4.2 V 时,以碳酸酯和六氟磷酸锂组成的商业电解液会在LiCoO2表面发生分解,生成大量高阻抗物质LiF和不规则聚合物在LiCoO2表面富集[5-6];除此外,生成的HF会导致材料表面的钴离子溶出[7]。目前,开发适配的电解液添加剂改善LiCoO2与电解液界面稳定性,是提高锂离子电池电化学性能最经济有效的方法之一[8]。
研究发现,腈类正极成膜添加剂(包含氰基和氰氧基)能改善高电压钴酸锂电池性能,作用主要在于抑制高电压下钴酸锂与电解液界面发生的电解液分解以及钴离子的溶出[9-10]。杨雪蕊等[4]报道含有两个氰基的辛二腈(Suberonitrile, SUN)和含有三个氰基的1,3,6-已烷三腈(1,3,6-hexanetricarbonitrile, HTCN)均能提高30 ℃和55 ℃下4.6 V LiCoO2的循环性能,而且两者对比,含有三个氰基的HTCN性能更为优异。从该结果可推测,氰基个数越多,性能改善越好。洪坤光等[11]报道含两个氰氧基的添加剂乙二醇双(丙腈)醚(Ethylene glycol bis(propionitrile) ether, DENE)能改善4.45 V LiCoO2 /石墨软包电池的循环性能。基于上述研究基础,本文设计了含有3个氰氧基的添加剂TPPN,用于高电压4.55 V LiCoO2 /石墨软包电池,以期改善电池的循环性能,并研究该添加剂在LiCoO2正极上的作用机理。
1 实验与计算 1.1 电解液配制以碳酸甲乙酯(Ethyl Methyl Carbonate, EMC, 广州天赐材料产,99.99%)、碳酸乙烯酯(Ethylene Carbonate, EC, 广州天赐材料产,99.99%)、氟代碳酸乙烯酯(Fluoroethylene Carbonate, FEC, 广州天赐材料产,99.99%)为溶剂,LiPF6(广州天赐材料产,99.95%)为电解质,质量比为55:22:8:15,在25 ℃下配成实验用的电解液,命名为STD。以TPPN(阿拉丁产,97%)为添加剂,按质量分数为1%、2%和3%在充满高纯氩气的手套箱中加入STD电解液,分别命名为1%TPPN、2%TPPN、3%TPPN。控制手套箱中水和氧气的质量分数均小于10−7。
1.2 电池制备在手套箱中,按3.5 g/1000 mAh的用量,向钴酸锂/石墨软包装电池(056467型)(1600 mAh,天赐公司电池制备线产,用于评测添加剂性能)中分别注入上述配方的电解液。
1.3 电化学测试25 ℃循环测试:该测试在CT-3008W型充放电测试柜(深圳新威产)中进行。首先是活化电池,将电池以0.1 C的电流在25℃充电6 h,再将其置于DF411SC 型精密恒温箱 (日本雅马拓产) 以45℃老化2 d,完成活化。然后,以1.0 C的电流在25 ℃下进行循环测试,电压为3.00~4.55 V。
交流阻抗谱测试(Electrochemical Impedance Spectroscopy, EIS):该测试在Solartron 1455A型多通道测试仪(英国Solartron公司产)中进行,测试频率为105~10−2 Hz,交流振幅为10 mV,测试电压为4.55 V。
线性伏安扫描测试(Linear Sweep Voltammetry, LSV):该测试在Solartron 1455A型多通道测试仪(英国Solartron公司产)中进行,扫描速度为0.1 mV·s−1,扫描电压范围为3.0~7.0 V。该装置用铂电极作为工作电极,锂片作为参比辅助电极。
1.4 电极表面分析将未循环的和循环后的软包装电池放电至1.6 V,在手套箱内拆解,将拆出来LiCoO2正极用碳酸二甲酯(Dimethyl Carbonate,DMC,广州天赐材料产,99.99%)清洗3次,去除表面残余的锂盐和溶剂。在室温、氩气保护下干燥 12 h。采用SU8010扫描电子显微镜(SEM,日本日立公司产,工作电压为5 kV)和JEM-2100透射电子显微镜(TEM,日本电子公司产,测试加速电压为200 kV)对正极进行形貌观察,确定电解液的分解情况。采用Thermo K-Alpha+型X射线光电子能谱仪(XPS,美国赛默飞世尔科技公司产),以单色Al Kα(1486.8 eV)为辐射源,测试管电压为15 kV,管电流为10 mA,检测循环后电池正极表面的氮含量和负极表面的钴含量。采用Empyrean型X射线衍射仪(XRD,荷兰帕纳科公司产),以Cu靶Kα射线为辐射源,检测循环前后电池正极材料的结构变化。
1.5 理论计算理论计算在Gaussian 09软件包中完成[12]。所有结构采用密度泛函理论方法中的B3LYP/6-311++G(d)基组[13],在液态下优化得到。考虑溶剂化效应对反应的影响,对液态环境的模拟通过采用连续极化介质模型(Polarized Continuum Models, PCM)方法完成,采用的介电常数为20.5,接近于实验中常用的线状碳酸酯与环状碳酸酯体积比例为7:3的电解液的介电常数。利用自然键轨道理论计算了自然布居分析(Natural Population Analysis, NPA)原子电荷分布。EC、EMC、TPPN与钴离子的结合能的计算公式[14]为:
| $ E_{{\rm{b}}}({\rm{EC}}+{\rm{Co}}^{3+})= [E ({\rm{EC}}+{\rm{Co}}^{3+}) -E ({\rm{EC}}) - E ({\rm{Co}}^{3+}) ]\text{,} $ |
| $ E_{{\rm{b}}}({\rm{EMC}}+{\rm{Co}}^{3+}) = [E ({\rm{EMC}}+{\rm{Co}}^{3+}) -E ({\rm{EMC}}) - E ({\rm{Co}}^{3+}) ]\text{,} $ |
| $ E_{{\rm{b}}}({\rm{TPPN}} + {\rm{Co}}^{3+}) = [E ({\rm{TPPN}} + {\rm{Co}}^{3+}) - E ({\rm{TPPN}}) - E ({\rm{Co}}^{3+}) ]。$ |
其中,Eb(EC+Co3+)代表EC与Co3+的结合能,Eb(EMC+Co3+)代表EMC与Co3+的结合能,Eb(TPPN+Co3+)代表TPPN与Co3+的结合能,E (EC+Co3+) 代表EC与钴离子络合物的能量,E (EMC+Co3+) 代表EMC与钴离子络合物的能量,E (TPPN+Co3+) 代表TPPN与钴离子络合物的能量,E (EC) 代表EC分子的能量,E (EMC) 代表EMC分子的能量,E (TPPN) 代表TPPN分子的能量,E (Co3+) 代表Co3+的能量,单位为kJ·mol−1。
氧化电势为[15]:
| $ E_{{\rm{ox}}} ({\rm{Li}}^+/{\rm{Li}}) = [G({\rm{M}}^+) – G({\rm{M}}) ]/F–1.4 \;{\rm{V}} $ |
式中:G(M)和G(M+)是298.15 K下络合物M以及其氧化态M+的吉布斯自由能值。F是法拉第常数,1.4 V是指该氧化电势是相对于Li+/Li的。
2 结果与讨论 2.1 TPPN对4.55 V钴酸锂/石墨软包电池循环性能的影响图1(a)是LiCoO2/石墨软包电池在不同电解液中的循环性能图,用以探究添加剂TPPN的影响。从图中看出,当 LiCoO2/石墨软包电池在25℃、3.00~4.55 V(vs. Li+/Li)范围内以1C/1C的电流进行充放电时,STD电池体系的初始容量为1463.8 mAh,其容量在循环过程中迅速衰减,循环900周后,降低到128.6 mAh/g,容量保持率仅为8.7%。这主要归因于高电压条件下电池中LiCoO2界面上发生电解液分解和HF腐蚀导致的结构破坏[4]。当加入不同质量分数添加剂TPPN后,其初始容量分别为1520.0、1618.0、1592.3 mAh,容量均较STD电池体系有所提高。而且电池的循环性能得到显著的提高,含有质量比为1%,2%和3%TPPN的电池经过900次循环后,容量保持率分别是71.9%、86.4%和85.7%,均表现出优秀的循环性能。可以发现,进一步增加TPPN质量分数至3%时,电池的放电容量却有所降低。推测过量的TPPN在LiCoO2电极表面上会形成较厚的界面膜,降低离子迁移率,影响容量的发挥[4]。因此,可得出TPPN的最佳质量分数为2%,2%TPPN后续作为TPPN的电解液研究体系。含STD电解液和含2%TPPN电解液的LiCoO2/石墨软包电池,简称STD和2%TPPN电池体系。在25℃,3.00~4.55 V的电位范围以1 C/1 C的电流进行充放电时,STD和2%TPPN电池体系循环过程中的库伦效率如图1(b) 所示。随着循环的进行,与2%TPPN电池体系相比,STD电池体系库仑效率偏低且不稳定。相似的结果在放电中压中出现,如图1(c),对比STD电池体系出现电压衰退,2%TPPN电池体系的放电中压一直稳定在3.78 V。图1(d~e)分别展现STD和2%TPPN电池体系选定圈数(5、50、100、300、700、900圈)的充放电曲线。随着循环的进行,与2%TPPN电池体系相比,STD电池体系出现了很大的电极极化。基于这些结果,本文推测 TPPN 可以提高电池的稳定性的原因是TPPN能优先氧化,在钴酸锂材料表面成膜,该膜俗称CEI(Cathode Electrolyte Interphase)膜,从而保护正极材料结构,抑制电解液分解[16]。
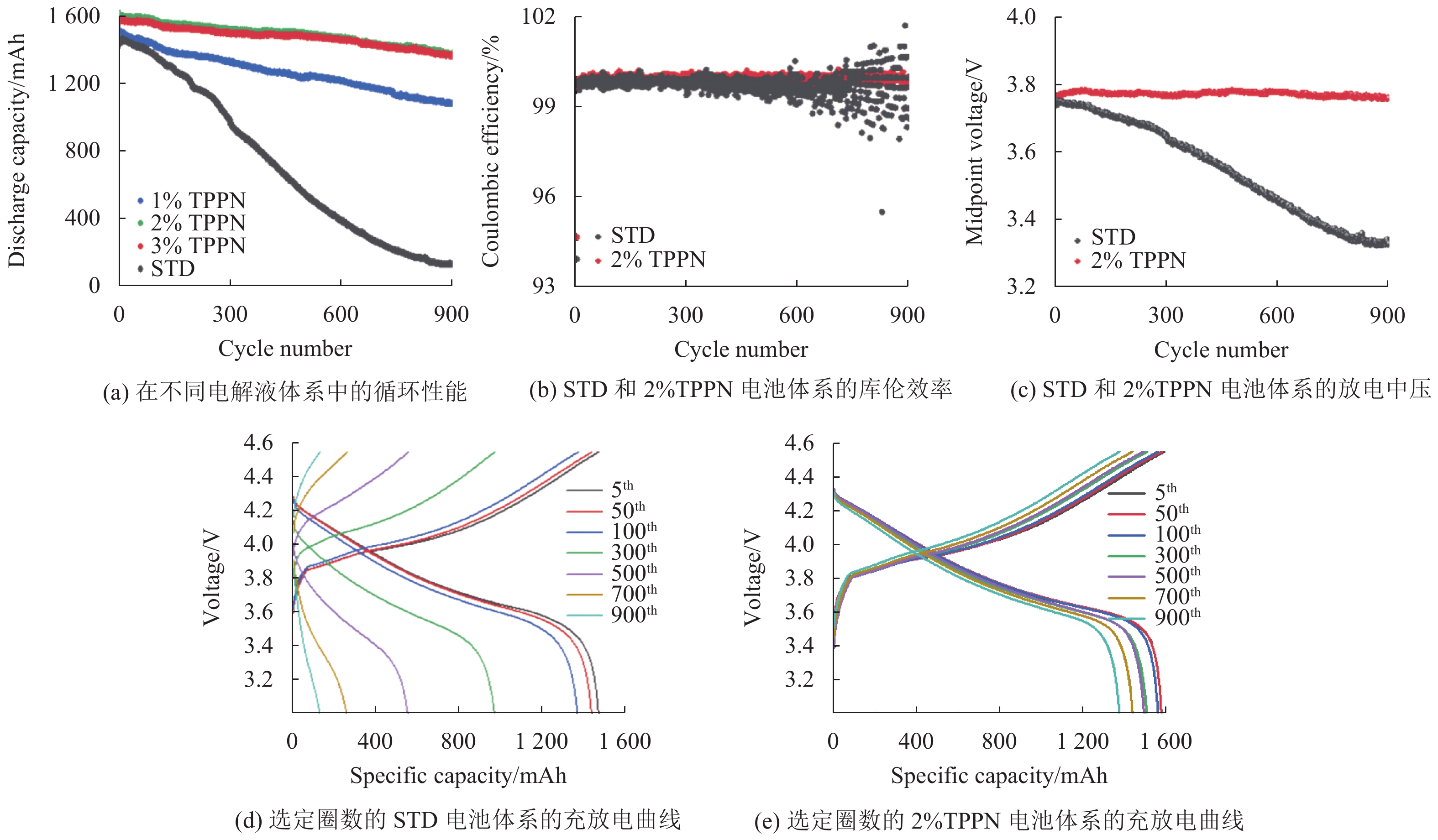
|
图 1 LiCoO2/石墨软包电池的电化学性能 Figure 1 Electrochemical performance of LiCoO2/graphite pouch cells |
通过4.55 V满电状态的LiCoO2/石墨软包电池直流电阻和EIS交流阻抗谱测试,探讨TPPN对LiCoO2/石墨软包电池电极界面的影响。图2(a~b)为在25℃,3.00~4.55 V的电位范围以1 C/1 C的电流进行充放电时,STD和2%TPPN电池体系在循环900圈过程中的充、放电直流内阻。从图2(a~b)可看出,STD电池体系中的充、放电内阻在循环过程中不断增大,而2%TPPN电池体系的充放电内阻却能在循环过程中保持稳定。如图2(c~d)所示,25℃下,对 STD和2%TPPN电池体系活化和循环900圈后的电化学阻抗谱(EIS)进行测试和拟合,拟合的电路图同时也嵌入图2c中。等效电路图包括了表面膜电阻(Rf),传荷电阻(Rct)和Warburg电阻(Wf)[17-19]。Rf反映了电极/电解质界面间的电阻,即Li+通过电极界面层迁移的阻抗;Rct反映了充电过程嵌脱锂时的阻抗;Wf则代表了Li+扩散阻抗。表1列出了STD和2%TPPN电池体系活化和循环后的电化学阻抗拟合结果,可以得出:活化后,含2%TPPN的电池体系Rf阻抗数值(0.0141 Ω)稍小于STD电池体系Rf阻抗数值(0.0151 Ω),表明在电池中加入TPPN能减低Li+传输的阻抗,即提高了倍率性能;循环后,2%TPPN的电池体系Rf阻抗增加幅度(0.0042 Ω)远小于STD电池体系Rf阻抗增加幅度(0.0117 Ω),STD电池体系的显著增加,这是由于电解液分解而导致的界面厚度增加所致。同样的,活化后,含2%TPPN的电池体系Rct阻抗数值(0.0209 Ω)稍小于STD电池体系Rct阻抗数值(0.0228Ω);循环后,2%TPPN的电池体系Rct阻抗增加幅度(0.0133 Ω)远小于STD体系Rct阻抗增加幅度(0.0358 Ω)。这说明TPPN能优化界面的成分,让其形成的界面膜具有低阻抗和高稳定性的特点,这与图1(a)的结果相吻合。
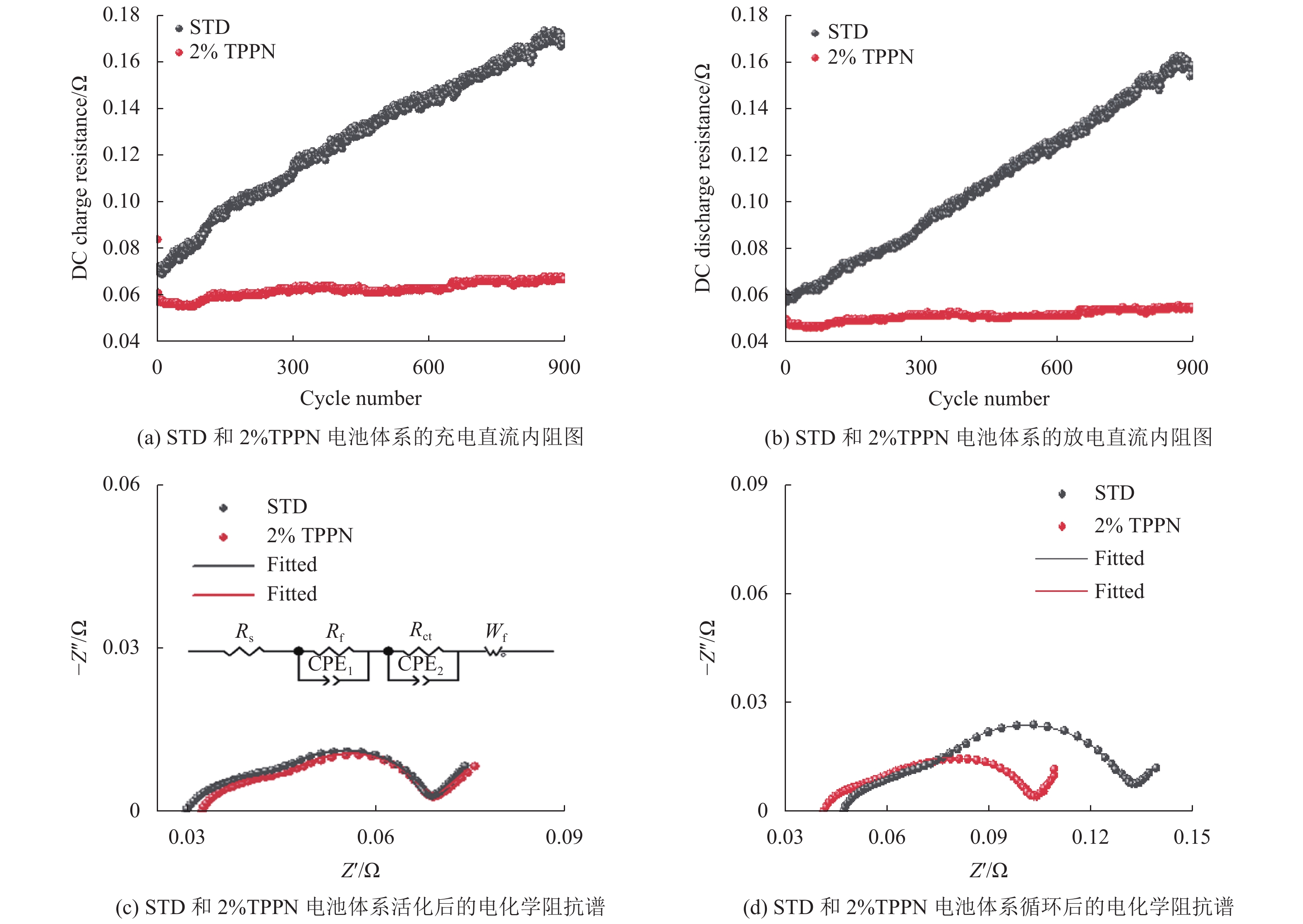
|
图 2 STD和2%TPPN电池体系的内阻和界面阻抗 Figure 2 Internal resistance and EIS for STD and 2%TPPN cell system |
| 表 1 STD和2%TPPN电池体系的电化学阻抗拟合结果 Table 1 Fitting results of Rf and Rct by equivalent circuit for STD and 2%TPPN cell system |
为了研究TPPN的氧化稳定性,与电解液中的溶剂EC、EMC作对比。本文计算了EC、EMC、TPPN单分子及其与PF6−络合物的氧化电势,如图3所示。图中,灰色球代表C原子,红色球代表O原子,白色球代表H原子,绿色球代表F原子,黄色球代表P原子,蓝色球代表N原子,图8~图11球状模型中亦同。结果表明,单分子的氧化电势的高低顺序为 EC>EMC>TPPN,单分子+PF6−络合物的氧化电势的高低顺序为 EMC+PF6−>EC+PF6−>TPPN+PF6−。由此可知,无论是单分子状态还是与锂盐阴离子的络合状态,TPPN都会优先于EC和EMC发生氧化分解反应,且在TPPN体系的氧化反应中,没有HF产生[7]。然后,本文对溶剂分子EC、EMC、TPPN进行结构优化,计算分子最高占据分子轨道(Highest Occupied Molecular Orbital, HOMO)值,由高到低顺序为TPPN(−7.58 eV) >EMC(−8.40 eV) >EC(−8.73 eV) ,根据分子前线轨道理论可知,HOMO值越大越容易失去电子,氧化活性越大,因此TPPN的HOMO值最大,氧化稳定性最弱,最易氧化[20]。与此同时,本文从使用STD和2%TPPN电解液的LSV结果可得知(如图4所示),TPPN优先STD发生氧化,这与理论计算的结果相吻合;而且氧化后,2%TPPN体系在5 V电压下的电流要明显低于STD体系,这表明了TPPN氧化后会在铂电极表面形成界面膜,抑制电解液的分解[20]。
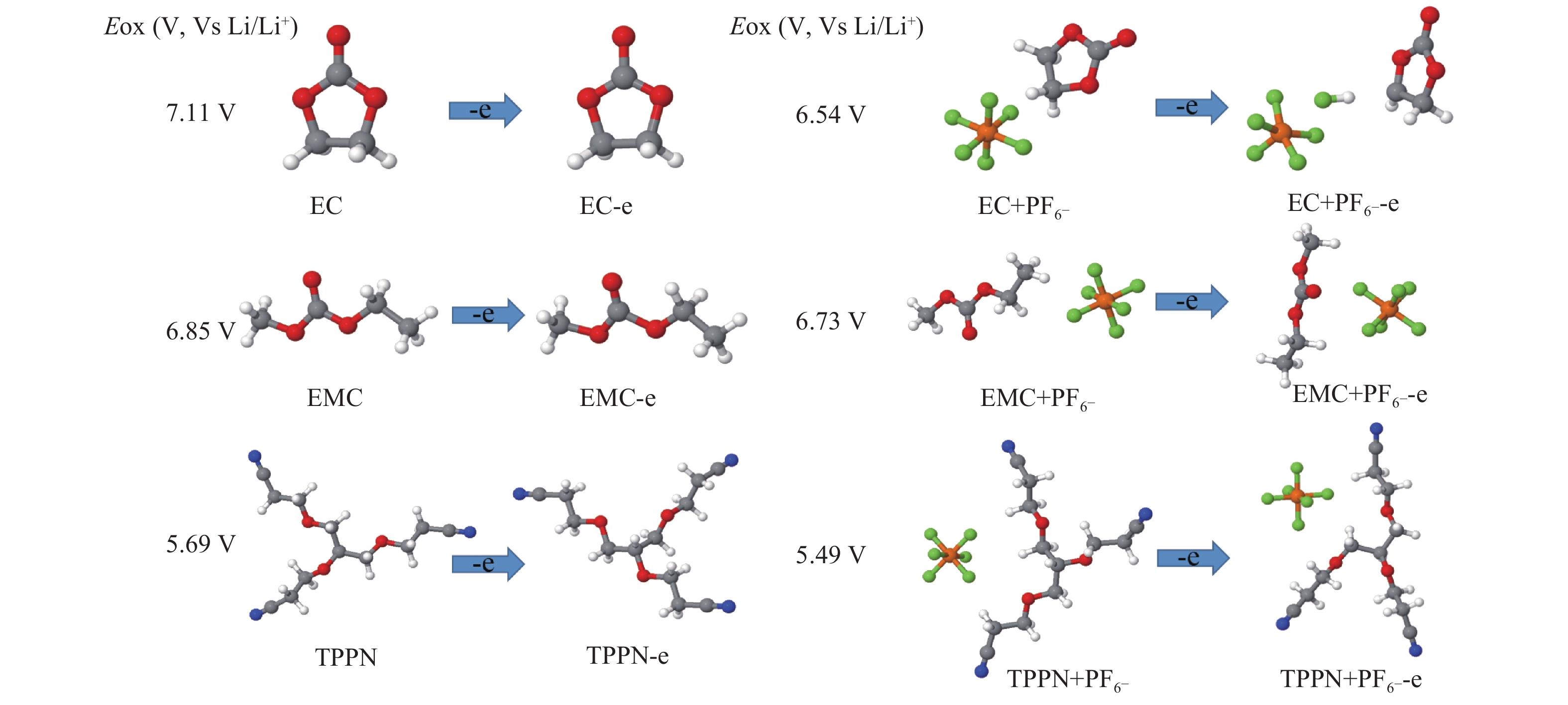
|
图 3 EC、EMC、TPPN及其与PF6−阴离子形成的团簇的最佳结构和计算的氧化电位(V vs Li/Li+) Figure 3 Optimized structures and calculated oxidation potential (in V vs. Li/Li+) of EC, EMC and TPPN molecular and corresponding anion-solvent clusters before and after oxidation |
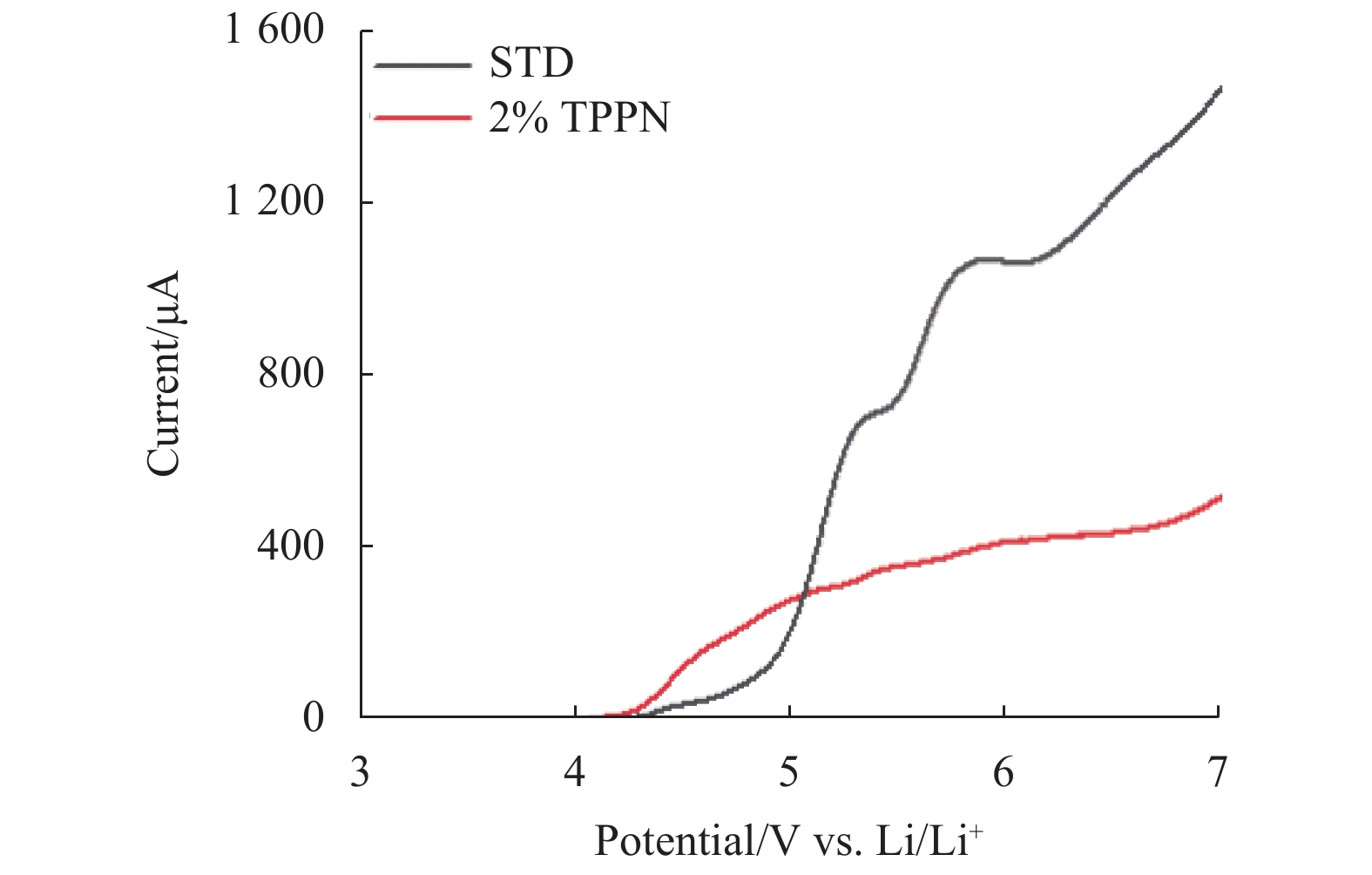
|
图 4 STD体系和2%TPPN电池体系的线性扫描伏安图 Figure 4 LSV curves for STD and 2% TPPN cell system. |
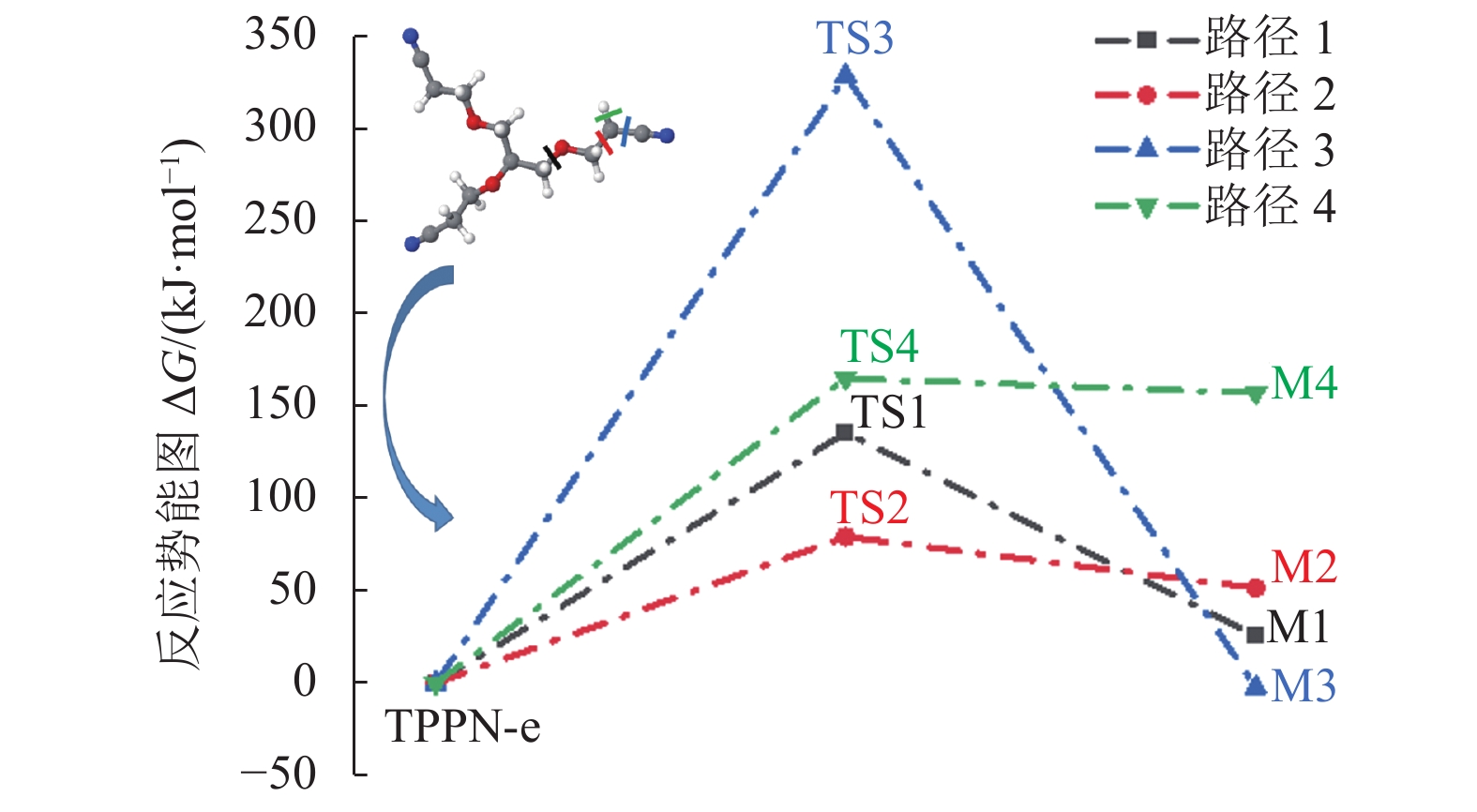
|
图 9 TPPN-e的可能分解路径及相应的反应能垒 Figure 9 Possible decomposition pathways, corresponding reaction free energies of transition states and products of oxidized TPPN |
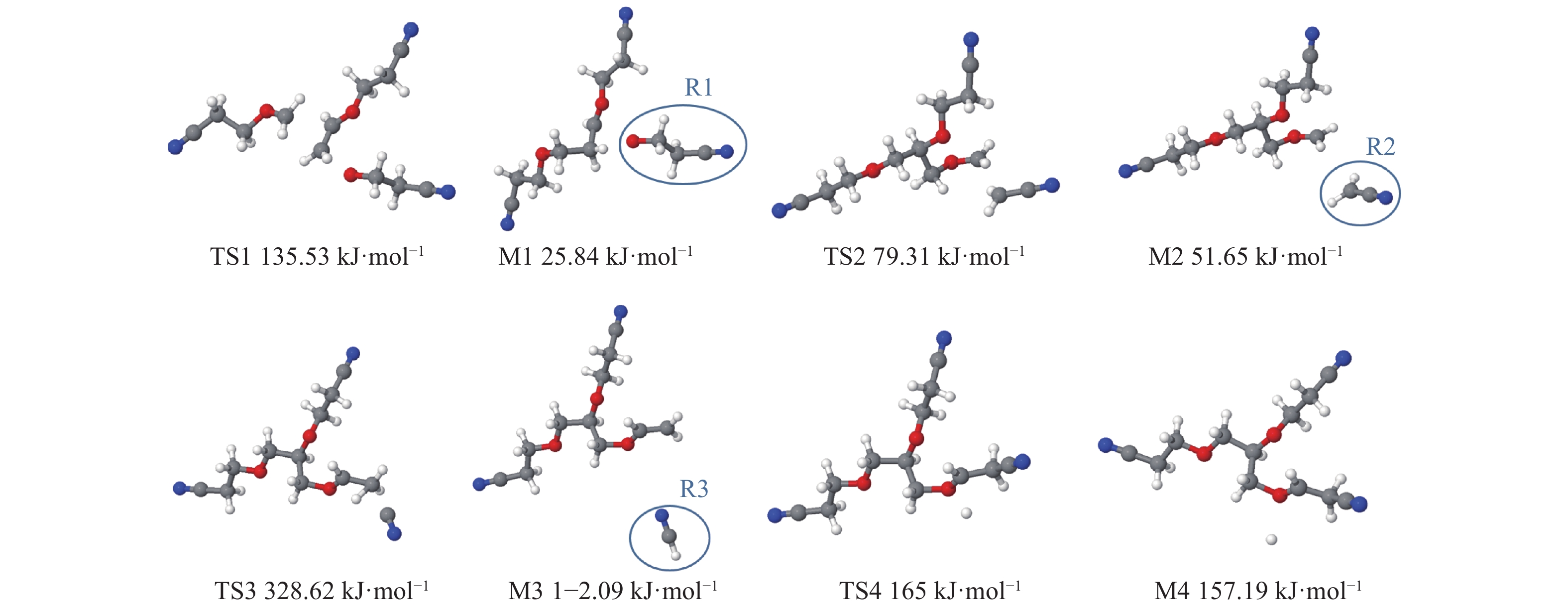
|
图 10 TPPN-e氧化分解反应的过渡态及产物结构和能量 Figure 10 Optimized geometric structure and energy of transition states and products of oxidized TPPN |
在25℃,3.00~4.55 V电位范围内,以1C/1C倍率充放电循环900圈前后的LiCoO2电极的形貌如图5所示。与未循环LiCoO2电极(见图5(a)和(d))光滑和干净的表面相比,循环后的STD电池体系的LiCoO2(见图5(b)和(e))表面出现了大量厚且不规则的界面层,同时存在一些裂纹。这主要是由LiCoO2电极表面结构的不可逆降解和电解液分解产物的沉积所致[4]。而循环后的2%TPPN电池体系的LiCoO2在SEM图(见图5(c))上,与未循环的LiCoO2作对比,并没有看出明显区别,而从TEM图(见图5(f))上可看出,TPPN添加剂可以帮助调控,在LiCoO2表面形成一层大概10 nm的规整CEI膜。这说明了TPPN的加入能有效抑制电解液在钴酸锂表面的分解,进而提升电解液的电化学性能。

|
图 5 未循环的LiCoO2以及在STD和2%TPPN电池体系循环后的LiCoO2的SEM和TEM图像 Figure 5 SEM and TEM images of fresh LiCoO2 and the cycled LiCoO2 in STD, 2%TPPN cell system |
未循环的LiCoO2及STD、2%TPPN电池体系在25℃,3.00~4.55 V电位范围,以1C/1C倍率充放电循环900圈后的LiCoO2的XRD谱图,如图6所示。与未循环的LiCoO2相比,STD和2%TPPN电池体系循环后的LiCoO2峰强度以及结构均有变化,但STD电池体系的变化程度要大于2%TPPN电池体系,STD样品的003峰往低角度发生明显的偏移,这说明了TPPN能有效抑制循环过程中LiCoO2的破坏,形成的CEI膜可以有效保护结构和界面的稳定性[4]。
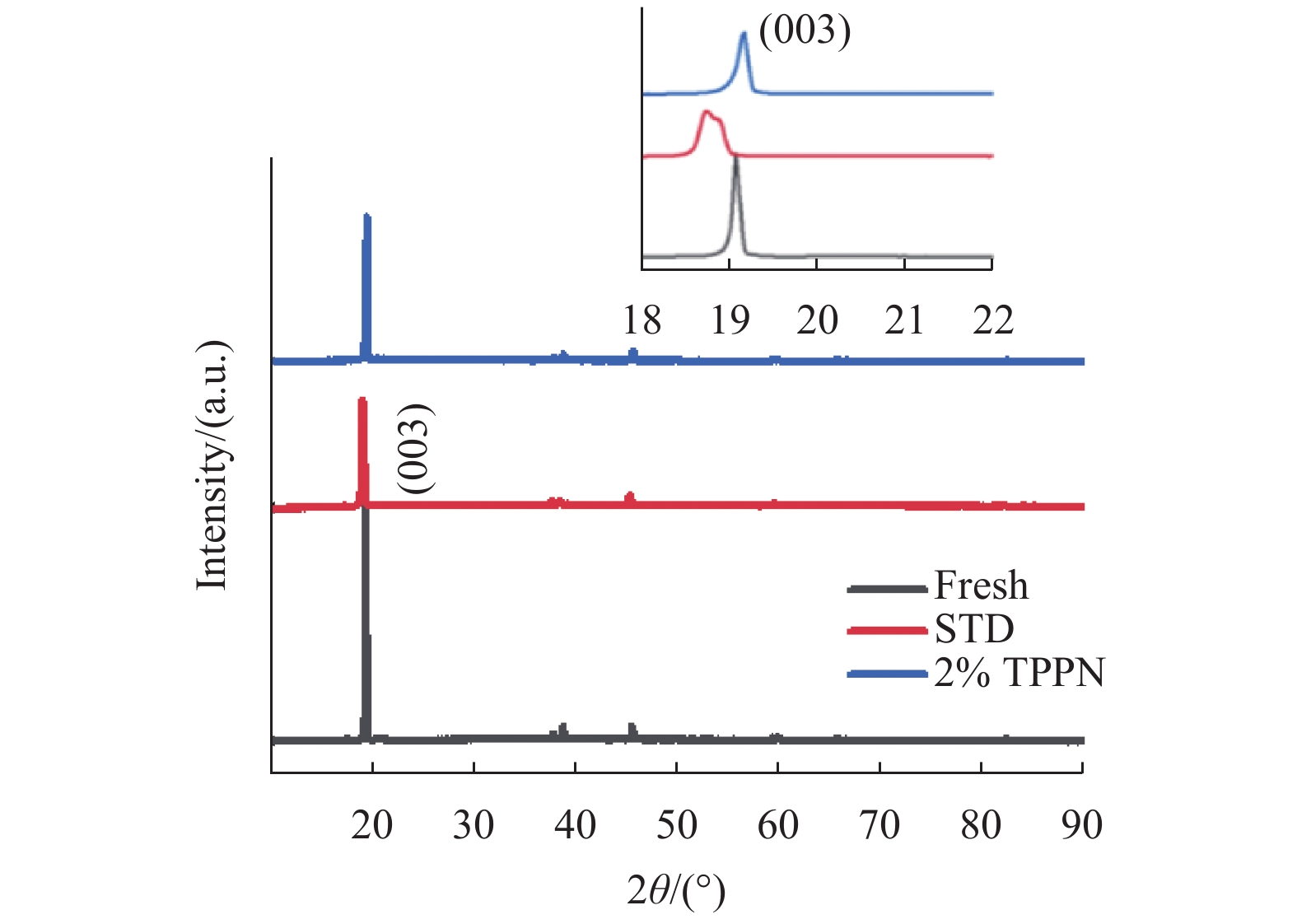
|
图 6 未循环的LiCoO2及STD、2%TPPN电池体系循环后的LiCoO2的XRD谱图 Figure 6 XRD patterns of fresh LiCoO2 and the cycled LiCoO2 in STD, 2%TPPN cell system |
为了分析形成的界面层的成分并了解它们对电化学性能的影响,对STD、2%TPPN电池体系循环900圈后的LiCoO2电极上的N 1s和石墨上的Co 2p XPS谱进行测试,如图7所示。结果表明,在STD电池体系中LiCoO2表面的N 1s谱中没有峰强度,而在2%TPPN电池体系中谱图有明显峰强度,可以检测出C-N基团对应的峰,证明TPPN添加剂分解生成含C-N基团的物质,即在LiCoO2表面形成了含有C-N基团的界面膜。对比STD电池体系在石墨中的Co 2p谱中有较强的峰强度,2%TPPN电池体系的峰强度较弱,这证明了XRD的结果,TPPN的成膜维持了正极LiCoO2的结构并降低了钴离子从正极表面往电解液的溶出,从而减少Co在石墨上的沉积[4]。沉积在石墨负极表面的钴容易阻塞负极的微孔,造成它的嵌锂性能下降,而且当钴沉积在铜箔和负极石墨的界面上时,容易产生脱粉现象,造成容量的衰减。
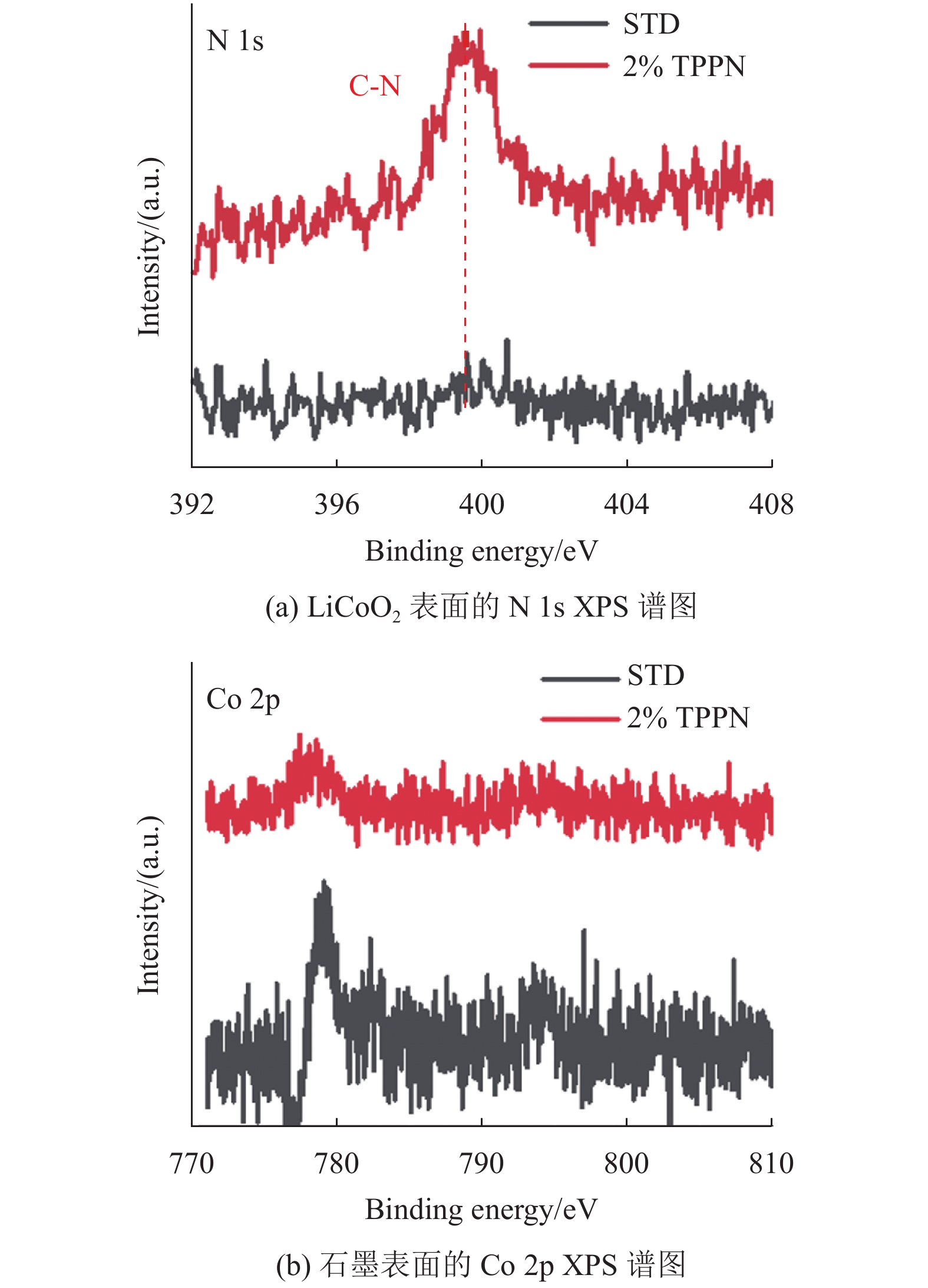
|
图 7 STD和2%TPPN电池体系循环后的XPS谱图 Figure 7 XPS spectra for STD and 2% TPPN cell system |
为了进一步探讨TPPN对抑制钴离子析出的作用,本文通过密度泛函理论计算EC、EMC和TPPN与正极LiCoO2表面的CO3+的络合结构及结合能,如如图8所示。EC、EMC和TPPN与CO3+的结合能分别为−373.01,−402.56和−609.05 kJ·mol−1,由此可知,TPPN与钴离子的结合能更强,更容易与钴离子结合,从而抑制钴离子从正极LiCoO2表面析出,有利于形成稳定的CEI膜。这与上文XRD和XPS的结果相吻合。
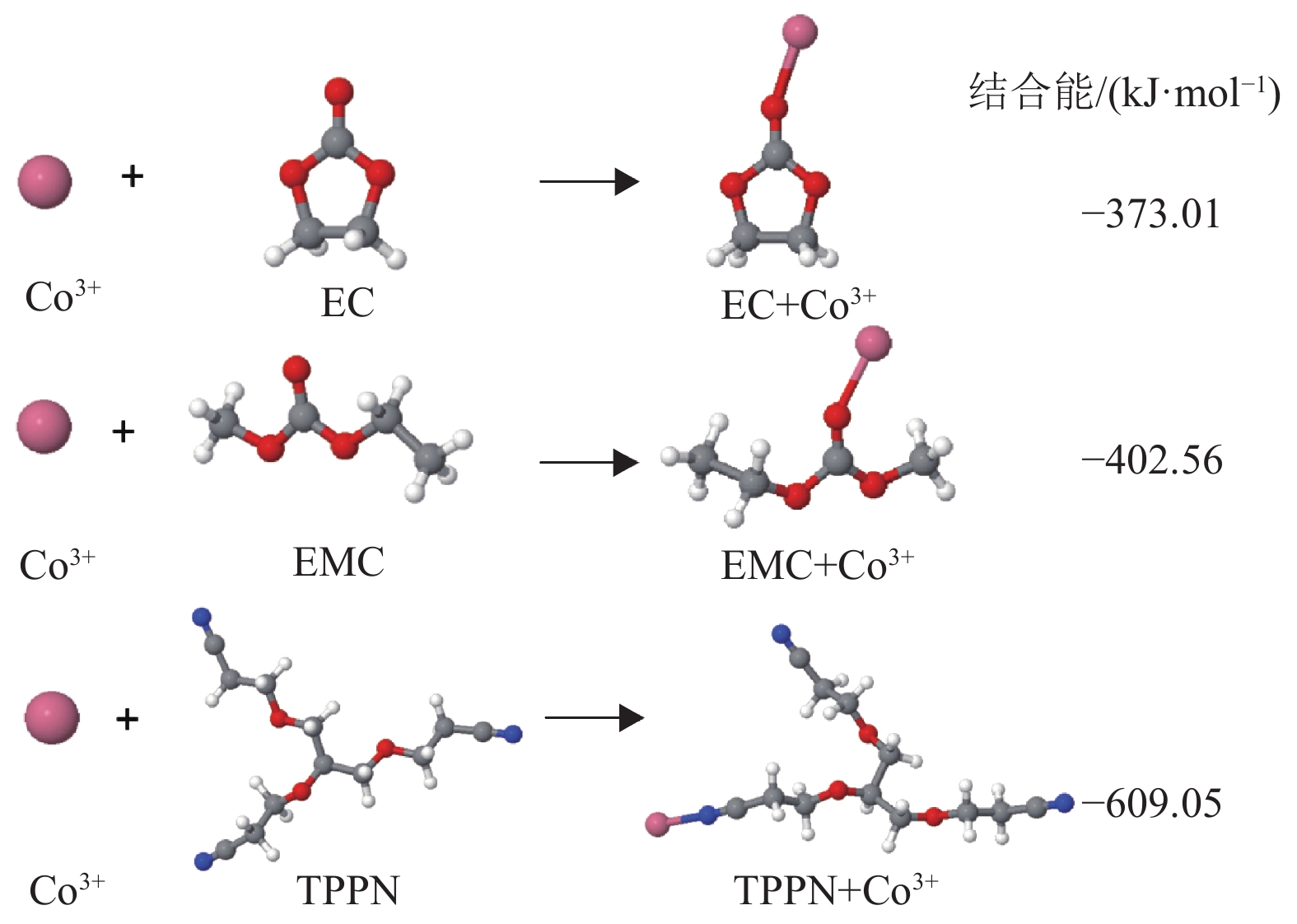
|
图 8 EC、EMC、TPPN与钴离子结合时的产物结构和结合能 Figure 8 Optimized geometric structure and binding energy of EC, EMC, and TPPN when combining with CO3+ |
为了进一步分析TPPN在正极表面氧化分解的机理,基于密度泛函理论分析了TPPN的氧化分解反应可能产生的过渡态和产物。如图9所示,TPPN氧化态(即TPPN-e) 的结构通过断裂不同的键可能有4种分解路径,图10列出了氧化分解反应中过渡态和初产物的优化结构和能量。为了确定过渡态的结构,进行了频率分析和内禀反应坐标(Intrinsic Reaction Coordinate,IRC)计算。每个过渡态只有一个虚频率,由此确认其对应的几何结构为过渡态的结构。而IRC计算结果可以显示出与该过渡态相对应的反应物和产物结构,可再次确认该过渡态结构的准确性。
如图9所示,断裂TPPN-e的C-O键,分解遵循路径1进行;断裂C-C键,分解路径为2和3;断裂C-H键,分解路径为4。路径1经过反应过渡态TS1得出反应初产物M1,路径2~4同理。从动力学角度分析,过渡态的能垒越低,反应越容易发生。4条路径的反应过渡态能量从高到低的排列顺序为:路径3(328.62 kJ·mol−1)>路径4(165 kJ·mol−1)>路径1(135.53 kJ·mol−1)>路径2(79.31 kJ·mol−1),所以,路径2最容易发生,路径3最难发生。如图10所示,不同路径对应的过渡态和产物结构各不相同,路径1、2、3的初产物中均断裂出自由基。对初产物进行了NPA电荷分析,结果得出,自由基R1、R2和R3所带电荷均为0。因此,本文讨论了自由基终止反应,即R1、R2、R3可能发生的聚合反应,如图11所示。3组反应均为放热反应,说明从热力学角度上看该二聚合反应是容易发生的。但R1和R3的二聚合反应难以形成聚合物,只有R2可以通过二聚合反应生成丁二腈,而丁二腈可以继续在电解液中反应,产生含有C-N基团的聚合物膜,对正极材料产生保护作用,与上文XPS的结果相吻合[21]。
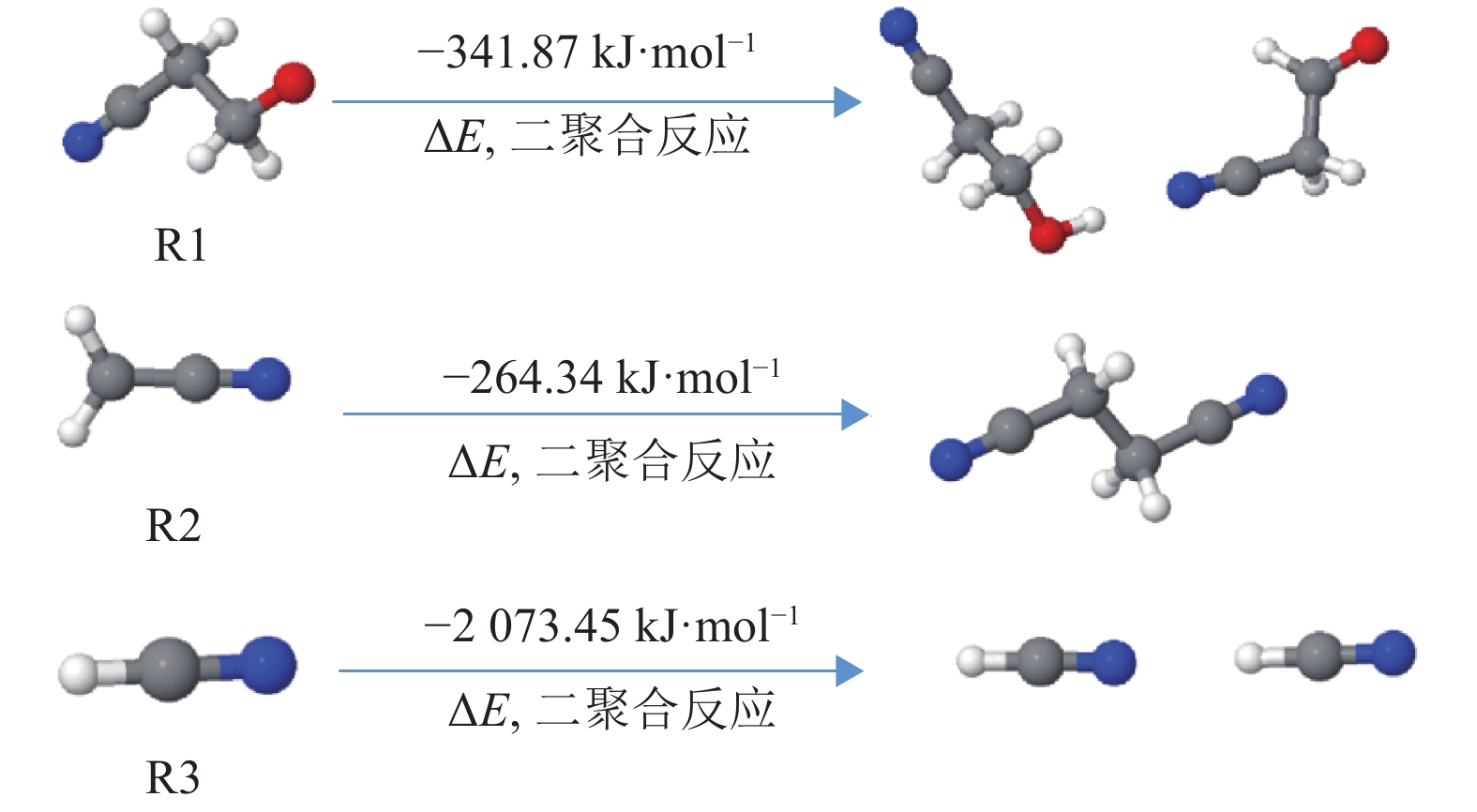
|
图 11 自由基终止反应的结构和反应能量 Figure 11 Optimized geometric structure and reaction energy of radical terminal reaction |
在4.55V高电压钴酸锂/石墨软包电池中,TPPN的加入能有效提高电池的容量发挥和循环性能。经过对TPPN不同添加量的筛选,其在该电池体系的最佳质量分数为2%,过多的量虽对循环性能没有影响,但会对容量发挥有负面影响,推测原因是过量的TPPN在LiCoO2电极表面上会形成较厚的界面膜,降低离子迁移率,影响容量的发挥。从电池充放电直流内阻和交流阻抗数据可得知,TPPN的加入对两者的改善是有正面影响。通过理论计算、线性扫描、X射线衍射谱、X射线光电子能谱、扫描电镜和透射电镜分析了TPPN的作用机理,分析结果表明:TPPN比电解液溶剂成分EC、EMC更容易氧化,氧化后在LiCoO2表面上形成含有C-N基团的CEI膜,该膜具有低阻抗和高稳定性质,能有效抑制电解液分解和钴离子的溶出。
| [1] |
LI B, XIA D G. Anionic redox in rechargeable lithium batteries[J].
Advanced Materials, 2017, 29(28): 1701054.
|
| [2] |
SUN Z Y, ZHOU H B, LUO X H, et al. Design of a novel electrolyte additive for high voltage LiCoO2 cathode lithium-ion batteries: lithium 4-benzonitrile trimethyl borate
[J].
Journal of Power Sources, 2021, 503: 230033.
DOI: 10.1016/j.jpowsour.2021.230033. |
| [3] |
WANG L L, CHEN B B, MA J, et al. Reviving lithium cobalt oxide-based lithium secondary batteries-toward a higher energy density[J].
Chemical Society Reviews, 2018, 47: 6505-6602.
DOI: 10.1039/C8CS00322J. |
| [4] |
YANG X R, LIN M, ZHENG G R, et al. Enabling stable high-voltage LiCoO2 operation by using synergetic interfacial modification strategy
[J].
Advanced Functional Materials, 2020, 30(43): 2004664.
DOI: 10.1002/adfm.202004664. |
| [5] |
LI W D, DOLOCAN A, OH P, et al. Dynamic behaviour of interphases and its implication on high-energy-density cathode materials in lithium-ion batteries[J].
Nature Communications, 2017, 8: 14589.
DOI: 10.1038/ncomms14589. |
| [6] |
XU K. Electrolytes and interphases in Li-ion batteries and beyond[J].
Chemical Reviews, 2014, 114(23): 11503-11618.
DOI: 10.1021/cr500003w. |
| [7] |
LI J H, XING L D, CHEN J W, et al. Improving high voltage interfacial and structural stability of layered lithium-rich oxide cathode by using a boracic electrolyte additive[J].
Journal of The Electrochemical Society, 2016, 163: A2258-A2264.
DOI: 10.1149/2.0631610jes. |
| [8] |
ZHENG X W, WANG X S, CAI X, et al. Constructing a protective interface film on layered lithium-rich cathode using an electrolyte additive with special molecule structure[J].
ACS Applied Materials & Interfaces, 2016, 8: 30116-30125.
|
| [9] |
ZHOU S Y, HONG S G, YU L, et al. Effect of adiponitrile on performance of high-voltage Li-ion battery[J].
Battery Bimonthly, 2016, 46(3): 137-139.
|
| [10] |
HAN J G, KIM K, CHOI N S. Scavenging materials to stabilize LiPF6-containing carbonate-based electrolytes for Li-ion batteries
[J].
Advanced Materials, 2019, 31(20): 1804822.
DOI: 10.1002/adma.201804822. |
| [11] |
HONG K G, ZHOU S Y, YU L, et al. Effect of ethylene glycol bis(propionitrile) ether on high-voltage Li-ion battery[J].
Battery Bimonthly, 2017, 47(1): 35-38.
|
| [12] |
FRISH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 09[Z]. Revision A. Gaussian, Inc., Wallingford, CT, 2009.
|
| [13] |
WANG Y T, XING L D, LI W S, et al. Why do sulfone-based electrolytes show stability at high voltages? Insight from density functional theory[J].
The Journal of Physical Chemistry Letters, 2013, 4: 3992-3999.
DOI: 10.1021/jz401726p. |
| [14] |
YE C C, TU W Q, YIN L M, et al. Converting detrimental HF in electrolytes into a highly fluorinated interphase on cathodes[J].
Journal of Materials Chemistry A, 2018, 6: 17642-17652.
DOI: 10.1039/C8TA06150E. |
| [15] |
TRASATTI S. The absolute electrode potential: an explanatory note[J].
Pure and Applied Chemistry, 1986, 58: 955-966.
DOI: 10.1351/pac198658070955. |
| [16] |
WU S P, LIN Y L, XING L D, et al. Stabilizing LiCoO2/graphite at high voltages with an electrolyte additive
[J].
ACS Applied Materials & Interfaces, 2019, 11: 17940-17951.
|
| [17] |
WANG K, XING L D, ZHU Y M, et al. A comparative study of Si-containing electrolyte additives for lithium ion battery: which one is better and why is it better[J].
Journal of Power Sources, 2017, 342: 677-684.
DOI: 10.1016/j.jpowsour.2016.12.112. |
| [18] |
MOMMA T, MATSUNAGA M, MUKOYAMA D, et al. Ac impedance analysis of lithium ion battery under temperature control[J].
Journal of Power Sources, 2012, 216: 304-307.
DOI: 10.1016/j.jpowsour.2012.05.095. |
| [19] |
LIAO X L, HUANG Q M, MAI S W, et al. Understanding self-discharge mechanism of layered nickel cobalt manganese oxide at high potential[J].
Journal of Power Sources, 2015, 286: 551-556.
DOI: 10.1016/j.jpowsour.2015.04.032. |
| [20] |
LIAO B, LI H Y, XU M Q, et al. Designing low impedance interface films simultaneously on anode and cathode for high energy batteries[J].
Advanced Energy Materials, 2018, 8: 1800802.
DOI: 10.1002/aenm.201800802. |
| [21] |
LI T T, LIN J L, XING L D, et al. Insight into the contribution of nitriles as electrolyte additives to the improved performances of the LiCoO2 cathode[J]. The Journal of Physical Chemistry Letters, 2022, 13: 8801-8807.
|
 2023, Vol. 40
2023, Vol. 40

