2. 广东一方制药有限公司 广东省中药配方颗粒企业重点实验室,广东 佛山 528244
2. Guangdong Key Laboratory of Traditional Chinese Medicine Formula Granule, Guangdong Yifang Pharmaceutical Co., Ltd., Foshan 528244, China
2020年《全球癌症统计报告》表明,原发性肝癌的发病率排名第六,死亡率排名第三,严重影响了人们的生活质量[1-2]。中医药治疗肿瘤历史悠久、疗效独特,是我国肝癌患者综合治疗方案的重要组成部分之一。传统中医药学与现代术疗、化疗等西医疗法相结合,能够起到减轻症状,增效减毒,增强免疫的效果,提高患者的生存率及生活质量[3-4]。
百合地黄汤为中药经典名方之一,出自汉代张仲景《金匮要略方论•百合狐惑阴阳毒病证治篇》[5-6],含“百合七枚(擘),生地黄汁一升”,始载用于“百合病,不经吐、下、发汗,病形如初者”。百合归心、肺经,具有养阴润肺,清心安神之功效,地黄归心经、肝经、肾经,有清热凉血,生津可治阴虚发热等功效。现代药理学研究发现,百合地黄汤高剂量组对肝癌H22荷瘤小鼠有抑瘤作用,且抑瘤作用呈剂量依赖关系[7]。百合地黄汤加黄芪能降低肝癌小鼠PCNA蛋白及Cyclin D1蛋白的表达,可抑制肝肿瘤和Lewis肺细胞增殖,有较好的抗肺肿瘤转移作用[8]。目前对百合地黄汤抗癌作用报道较少,有待深入研究。
现代信息的发展有助于对中国传统中医药领域进行抗肿瘤药物的数据挖掘。网络药理学[9-13]是多向药理学、计算生物学、大数据分析等学科融合而成的,体现了中医整体观、辨证论治、方剂配伍的理论,为从生物学分子网络的结构和功能来认知中药药性提供了方法学契机和有力工具。本文通过网络药理学构建多层网络,预测百合地黄汤抗肝癌信号通路和作用机制,以期推动其在在肿瘤防治方面的认识。
1 材料与方法 1.1 百合地黄汤化学成分的收集利用文献和TCMSP中药系统药理分析平台[14](
借助SwissTargetPrediction数据库[17](
为了在蛋白水平上进一步了解百合地黄汤与疾病靶点的作用机制,将百合地黄汤抗肝癌的潜在作用靶点输入到STRING数据库(
以百合地黄汤化学成分、作用靶点为数据来源,采用Cytoscape 3.7.2软件构建“药物−化学成分−作用靶点”网络。网络中的节点为药物、化学成分、作用靶点。将百合地黄汤的潜在抗肝癌靶点与化合物做映射,获得活性化合物。在Cytoscape 3.7.2软件中建立“药物−活性成分−抗肝癌靶点”网络图,借助network analysis进行拓扑学分析,获得每个化学成分的自由度,从而得出百合地黄汤抗肝癌的核心成分。
1.5 GO富集分析和KEGG通路富集分析为了进一步了解上述选择的核心基因的功能及其在信号通路中的作用,将筛选的百合地黄汤抗肝癌的潜在作用靶点导入David数据库[22](
在Pubchem数据库中下载百合地黄汤抗肝癌的核心成分的3D分子结构,在PDB数据库(
经过数据库、文献查询,查找出百合地黄汤中共含有化合物131个。为了更全面地筛选活性成分,将收集到的百合地黄汤中所有化合物进行分析考察。表1展示了部分百合地黄汤化合物的GI值、Lipinski值、OB值。
| 表 1 百合地黄汤部分化合物信息 Table 1 Information of some compounds of Baihe Dihuang Decoction |
经SwissTargetPrediction数据库预测,得到百合作用靶点711个,地黄作用靶点454个,核查数据后删除重复项,共得到药物靶点360个。在OMIM、GeneCards数据库中,经筛选共得到肝癌相关靶点488个。将360个药物靶点与488个疾病靶点导入在线韦恩图网站,得到58个交集基因(见图1)。这58个交集基因即为百合地黄汤抗肝癌作用靶点,其中百合、地黄、肝癌都对应的靶点有MMP2、KDR、EGFR、ALK、IL2、LGALS3、CDK1、PPARG、ABCB1、STAT3、F2、CA9、ESR1、HRAS、AR、ESR2和MMP9。
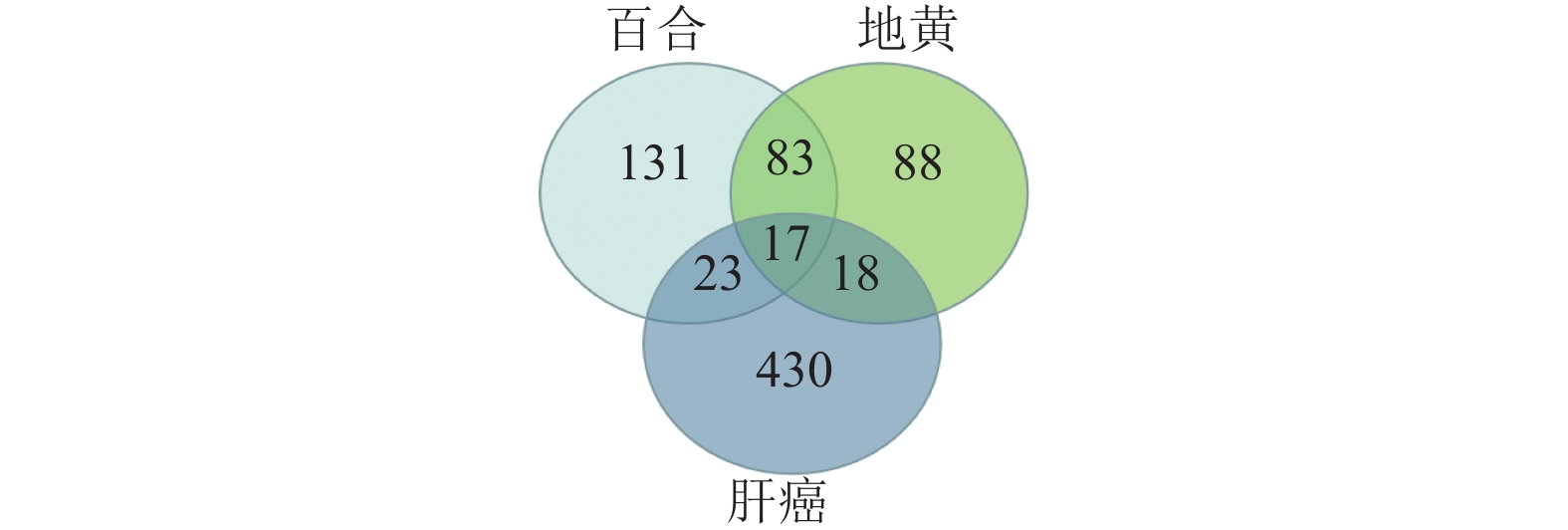
|
图 1 百合地黄汤与肝癌对应靶点匹配韦恩图 Figure 1 Venn diagram of Baihe Dihuang Decoction and corresponding targets of HCC |
由肝癌相关基因与药物靶点基因映射筛选出共同靶点58个,构建的PPI网络包括58个节点,821条边,见图2。图中节点的大小依自由度而设定,节点之间的关系强弱由边的线条粗细表示,边的线条越粗则两蛋白的Combine score(连接分数)值越高。采用Cytoscape 3.7.2软件进行网络拓扑学分析,结果表明,间距中心度、自由度及紧密中心度大于均值(间距中心度为0.009,自由度为28.31,紧密中心度为0.68)的关键节点有15个,占总节点数的25%。表2展示了百合地黄汤抗肝癌靶点蛋白质相互作用靶点自由度值排名,其中CASP3、VEGFA、STAT3与其他靶点的连接最多,节点最大,这说明它们与其他靶点蛋白相互作用更强,在该网络中发挥了关键作用。

|
图 2 百合地黄汤抗肝癌靶点蛋白质相互作用图 Figure 2 Anti-HCC target protein interaction diagram of Baihe Dihuang Decoction |
| 表 2 百合地黄汤抗肝癌靶点蛋白质相互作用靶点自由度值排名 Table 2 Ranking of the degree of target protein interaction of Baihe Dihuang Decoction against HCC |
百合地黄汤药物−化学成分−作用靶点网络图见图3,共有499个节点和1319条边,包括131个化合物节点,平均自由度是5.286。其中“BH”红色三角节点代表百合药物,“DH”红色三角节点代表地黄药物,“DH+数字”蓝色椭圆节点代表地黄化学成分,“BH+数字”紫色椭圆节点代表百合化学成分,绿色椭圆节点代表作用靶点。由图3可知,同一活性成分可以作用于不同靶标,同一靶标也可对应不同活性成分,体现出百合地黄汤抗肝癌具有多成分、多靶标的特点。进一步分析发现,百合地黄汤抗肝癌的靶点可以映射到87个化合物,这87个化合物即为百合地黄汤抗肝癌活性化合物。“药物−活性成分−抗肝癌靶点”网络图见图4,“BH”红色椭圆节点代表百合药物,“DH”红色椭圆节点代表地黄药物,“BH+数字”椭圆蓝色节点代表百合活性成分,“DH+数字”紫色椭圆节点代表地黄活性成分,绿色椭圆节点代表抗肝癌靶点。边线代表药物−活性成分、活性成分−抗肝癌靶点的相互关联。网络拓扑学分析得到了各个节点之间的自由度,表3展示了“药物−活性成分−抗肝癌靶点”网络图中活性成分与靶点的自由度排名前10的活性成分,经统计自由度值较高的活性成分有山奈酚、百合皂苷、百合苷C、26-O-β-D-glucopyranosylnuatigenin-3-O-α-L-rhamnopyranosyl(1→2)-o-[β-D-glucopyranosyl(1→4)]-β-D-glucopyranoside_qt。

|
图 3 百合地黄汤药物−化学成分−作用靶点网络图 Figure 3 Network diagram of drug-chemical composition-targets of Baihe Dihuang Decoction |
| 表 3 百合地黄汤药物−活性成分−抗肝癌靶点网络自由度值排名 Table 3 Ranking of degree value of drug-active ingredient-anti-HCC target network of Baihe Dihuang Decoction |

|
图 4 百合地黄汤药物−活性成分−抗肝癌靶点网络图 Figure 4 Network diagram of drug-active ingredient-anti-HCC targets of Baihe Dihuang Decoction |
对百合地黄汤抗肝癌作用所涉及的58个蛋白靶点进行GO功能富集分析和KEGG信号通路富集分析,以P<0.05为筛选条件,得到富集基因数量较多的GO功能和信号通路。在KEGG富集分析中共涉及91条富集通路,包括了癌症蛋白多糖、癌症通路、PI3K-Akt信号通路、VEGF信号通路、癌症的中心代谢、胰细胞、肾癌、Rap1信号通路、H1F信号通路等。GO功能富集分析中确定了388个GO条目。生物过程相关的条目286个,涉及药物反应、细胞增殖及调控、蛋白质磷酸化、基因表达及调控、细胞迁移调控、信号传导等。分子功能方面相关的条目68个,涉及蛋白质结合、蛋白络氨酸激酶活性、蛋白激酶活性、ATP结合酶活性、相同蛋白质结合、类固醇激素受体、转录因子结合等。细胞组成相关的条目34个,涉及细胞器、质膜、突触等方面。图5列出了GO功能富集分析的前24个条目,图6列出了信号通路富集分析的前15个条目。

|
图 5 百合地黄汤百合地黄汤抗肝癌GO功能富集分析 Figure 5 GO function enrichment analysis of anti-HCC targets of Baihe Dihuang Decoction |

|
图 6 百合地黄汤抗肝癌靶点的信号通路富集 Figure 6 Enrichment diagram of anti-HCC signal pathway of Baihe Dihuang Decoction |
根据上述筛选得到的87个活性成分,选取活性成分中自由度值前4的化合物(山奈酚、百合皂苷、百合苷C、26-O-β-D-glucopyranosylnuatigenin-3-O-α-L-rhamnopyranosyl(1→4)-o- [β-D-glucopyranosyl(1→4)]-β-D-glucopyranoside_qt)与位于前3位的核心基因(STAT3、CASP3、VEGFA)使用AutoDock Vina软件进行分子对接,获得活性化合物与靶标相互作用的最小结合能。分子对接结果见表4,结合能都小于−5 kJ·mol−1,可见百合地黄汤与这3个肝癌蛋白靶点具有较好的亲和性,图7展示了活性化合物与对接结合能最低的靶点的分子对接情况。
| 表 4 分子对接结果 Table 4 Molecular docking results |

|
图 7 百合地黄汤中活性成分与关键靶点的分子对接图 Figure 7 Molecular docking diagram of active components and key targets in Baihe Dihuang Decoction |
本文进行了百合地黄汤中抗肝癌主要活性成分及潜在作用机制的探讨。百合地黄汤中含有131种化合物成分。在前期摸索中,采用文献报道常用筛选标准(OB≥30%,DL≥0.18)对化学成分进行筛选[24],仅得到8个化合物,其中大部分含有较高药理活性的化合物如百合皂苷、百合苷C、梓醇、毛蕊花糖苷、梓醇、齐墩果酸等被筛除掉了。鉴于该标准的局限性,笔者综合考量,将百合地黄汤的化合物都进行分析。本文经网络药理学的方法筛选得到了87个活性成分及58个抗肝癌作用靶点,其中山奈酚、百合皂苷、百合苷C、26-O-β-D-glucopyranosylnuatigenin-3-O-α-L-rhamnopyranosyl(1→2)-o-[β-D-glucopyranosyl(1→4)]-β-D-glucopyranoside_qt等活性成分对应靶点较多,大多为皂苷类化合物。中药皂苷类成分可通过抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制侵袭转移、抑制肿瘤血管新生、逆转肿瘤多药耐药、调节机体免疫、诱导肿瘤细胞自噬死亡等机制发挥抗肿瘤作用[25-27]。现代药理研究表明,山奈酚通过调控环氧合酶-2的转录、抑制P-糖蛋白的功能和表达、抑制白细胞介素-4抗细胞增殖来诱导细胞凋亡、干预细胞信号转导和增强抑癌基因活性及抑制癌基因表达[28]。
PPI网络显示百合地黄汤潜在作用的关键靶点有STAT3、CASP3、VEGFA。STAT3在细胞恶变过程中起关键性作用,肿瘤的增殖、细胞凋亡抑制、侵袭和转移、新血管生成以及肿瘤干细胞的自我更新和分化会导致其高表达从而减缓细胞恶变[29-31]。CASP3是与免疫细胞凋亡密切相关的半胱氨酸天蛋白酶,能促进免疫细胞发挥作用[32]。Folkman[33]提出了肿瘤性血管生成理论,肿瘤的发生和发展依赖于肿瘤血管的生成。VEGFA是血管内皮生长因子的一种,可以通过与VEGFA2(血管内皮生长因子受体)结合,影响血管内皮细胞增殖、存活、迁移及血管通透性,进而抑制肿瘤细胞的增殖[34]。
信号通路富集表明百合地黄汤主要是调控癌症蛋白聚糖、VEGF信号通路和PI3K-Akt通路而抑制肿瘤细胞增殖、促进肿瘤细胞凋亡等发挥抗肝癌作用。现代药理研究表明[27],肝癌发展进程受多条信号通路传导调控,中医药可同时干预多条信号通路,多靶点的调控转导因子表达,从而抑制、杀伤肿瘤细胞,改善症状和体征,发挥防治肝癌的作用。肿瘤微环境中的许多蛋白聚糖(PGs)已被证明是关键的大分子,这些大分子有助于各种类型的癌症的生物学发展,包括增殖、黏附、血管生成和转移,从而影响肿瘤的进展,通过调节细胞增殖和凋亡、调节转录等功能来治疗癌症[35]。Napoleone Ferrara等[36]研究发现,VEGF通过与肝癌细胞表面的结合,激活Akt激酶的相关信号通路而促进肿瘤细胞的迁移。Zou Y等[37]研究证明在多种肿瘤干细胞中,PI3K-Akt信号通路的激活发挥重要作用,抑制PI3K-Akt信号的激活可以抑制肿瘤干细胞的自我更新,并减少肿瘤干细胞的比例。由此预测,百合地黄汤通过以上通路抑制肿瘤细胞增殖,防治肿瘤细胞复发转移,同时调节机体免疫功能,提高机体免疫细胞杀伤肿瘤细胞的能力。分子对接结果显示,百合地黄汤的4个核心活性成分与肝癌的3个核心靶点(STAT3、CASP3、VEGFA)具有良好亲和活性。
综上所述,本文以百合地黄汤主要活性成分为研究对象,通过网络药理学技术分析了其潜在的抗肝癌靶点及信号通路,并结合分子对接方法验证了百合地黄汤主要活性成分能与肝癌靶点发生相互作用。初步揭示了百合地黄汤抗肝癌作用具有多靶点、多通路的治疗特点,为后续深入验证百合地黄汤抗肝癌的作用机制提供了方向与参考。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].
A Cancer Journal for Clinicians, 2021, 71(3): 209-249.
DOI: 10.3322/caac.21660. |
| [2] |
孟唤男, 赵丽, 刘柳, 等. 中西医结合防治原发性肝癌研究进展[J].
中医药学报, 2021, 49(2): 115-119.
MENG H N, ZHAO L, LIU L, et al. Research progress on prevention and treatment of primary liver cancer by traditional Chinese and western medicine[J]. Acta Chinese Medicine and Pharmacology, 2021, 49(2): 115-119. |
| [3] |
赵智强, 吴勉华, 赵延华. 论恶性肿瘤中医辨治体系的建立[J].
中医杂志, 2015, 56(11): 906-908.
ZHAO Z Q, WU M H, ZHAO Y H. Establishing the system of TCM syndrome differentiation and treatment in malignant tumors[J]. Journal of Traditional Chinese Medicine, 2015, 56(11): 906-908. |
| [4] |
中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗规范(2019年版)[J].
中国实用外科杂志, 2020, 40(2): 121-138.
Bureau of Medical Administration, Nationsl Health Commission of the People’s Republic of China. Standardization for diagnosis and treatment of primary hepatic carcinom (2019 edition)[J]. Chinese Journal of Practical Surgery, 2020, 40(2): 121-138. |
| [5] |
张仲景. 新编金匮要略方论[M]. 北京: 商务印书馆, 1955: 46-47.
|
| [6] |
范希然, 李多多, 许刚, 等. 百合地黄汤的历史沿革研究[J].
世界中医药, 2020, 15(23): 3660-3664.
FAN X R, LI D D, XU G, et al. Study on the historical evolution of Baihe Dihuang Decoction[J]. World Chinese Medicine, 2020, 15(23): 3660-3664. |
| [7] |
包素珍, 郑小伟, 宋 红, 等. 百合地黄汤对肝癌H22荷瘤小鼠抑瘤作用的实验研究
[J].
中国中医药科技, 2006, 13(5): 332.
|
| [8] |
黄建波, 郑小伟, 包素珍. 加味百合地黄汤对Lewis肺癌小鼠抗肿瘤转移作用机制的研究[J].
现代中西医结合杂志, 2006, 15(23): 3187-3189.
HUANG J B, ZHENG X W, BAO S Z. Anti tumor metastasis action mechanism study of Baihe Dihuang Decoction with additives on mice with Lewis lung cancer[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2006, 15(23): 3187-3189. |
| [9] |
王伯阳, 刘天龙, 刘晶, 等. 基于网络药理学筛选的黄芪香草酸对心肌重构的保护作用研究[J].
中国中药杂志, 2020, 45(2): 367-373.
WANG B Y, LIU T L, LIU J, et al. Study on protective effect of vanillic acid from Astragalus membranaceus on hypertensive cardiac remodeling based on network pharmacology screen[J]. China Journal of Chinese Materia Medica, 2020, 45(2): 367-373. |
| [10] |
罗虹, 刘博文, 杨慧, 等. 基于网络药理学及活性成分测定的六味地黄系列制剂质量研究[J].
中草药, 2020, 51(21): 5462-5477.
LUO H, LIU B W, YANG H, et al. Quality study on Liuwei Dihuang series preparations via network pharmacology and active ingredient determination[J]. Chinese Traditional and Herbal Drugs, 2020, 51(21): 5462-5477. |
| [11] |
罗雪菲, 王伟, 赵晓芳, 等. 基于网络药理学探讨桃莲绞复方增强全成分肿瘤细胞疫苗抗结直肠癌作用分子机制[J].
中草药, 2021, 52(2): 459-468.
LUO X F, WANG W, ZHAO X F, et al. Molecular mechanism of Tao-lian-jiao Formula (TLF) to enhance anti-colorectaltumor activity of whole tumor cell vaccine based on network pharmacology[J]. Chinese Traditional and Herbal Drugs, 2021, 52(2): 459-468. |
| [12] |
任艳, 邓燕君, 马焓彬, 等. 网络药理学在中药领域的研究进展及面临的挑战[J].
中草药, 2020, 51(18): 4789-4797.
REN Y, DENG Y J, MA H B, et al. Research progress and challenges of network pharmacology in field of traditional Chinese medicine[J]. Chinese Traditional and Herbal Drugs, 2020, 51(18): 4789-4797. |
| [13] |
孟凡翠, 汤立达. 中药网络药理学研究中存在的问题与发展展望[J].
中草药, 2020, 51(8): 2232-2237.
MENG F C, TANG L D. Challenges and prospect in research of Chinese materia medica network pharmacology[J]. Chinese Traditional and Herbal Drugs, 2020, 51(8): 2232-2237. DOI: 10.7501/j.issn.0253-2670.2020.08.034. |
| [14] |
RU J, LI P, WANG J, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J].
Journal of Cheminformatics, 2014, 6(1): 13.
DOI: 10.1186/1758-2946-6-13. |
| [15] |
WANG Y, XIAO J, SUZEK T O, et al. PubChem's BioAssay database[J].
Nucleic Acids Research, 2012, 40(D1): 400-412.
DOI: 10.1093/nar/gkr1132. |
| [16] |
DAINA A, MICHIELIN O, ZOETE V. SwissADME: a free web tool to evaluate pharmacokinetics, drug-likeness and medicinal chemistry friendliness of small molecules[J]. Scientific Reports, 2017, 7, 42717.
|
| [17] |
GFELLER D, GROSDIDIER A, WIRTH M, et al. SwissTarget Prediction: a web server for target prediction of bioactive small molecules[J].
Nucleic Acids Research, 2014, 42(W1): W32-W38.
|
| [18] |
RENDE D, BAYSAL N, KIRDAR B. Integration of cardiovascular disease protein interaction network and OMIM database[J].
New Biotechnology, 2009, 25: S345.
|
| [19] |
MICHAEL R, VERED C, JAIME P, et al. Gene Cards: integrating information about genes, proteins and diseases[J].
Trends in Genetics, 1997, 13(4): 163.
DOI: 10.1016/S0168-9525(97)01103-7. |
| [20] |
罗静初. UniProt蛋白质数据库简介[J].
生物信息学, 2019, 17(3): 131-144.
LUO J C. A brief introduction to UniProt[J]. Chinese Journal of Bioinformatics, 2019, 17(3): 131-144. |
| [21] |
SHANNON P. Cytoscape: a software environment for integrated models of biomolecular interaction networks[J].
Genome Research, 2003, 13(11): 2498-2504.
DOI: 10.1101/gr.1239303. |
| [22] |
DENNIS G, SHERMAN B T, HOSACK D A, et al. DAVID: database for annotation, visualization, and integrated discovery[J].
Genome Biology, 2003, 4: P3(2003).
|
| [23] |
OLEG T, ARTHUR J. AutoDock Vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading[J].
Journal of Computational Chemistry, 2010, 31(2): 455-461.
|
| [24] |
赵蕾, 武嫣斐, 高耀, 等. 基于网络药理学的百合地黄汤干预心理亚健康作用机制研究[J].
药学学报, 2017, 52(1): 99-105.
ZHAO L, WU Y F, GAO Y, et al. Intervention mechanism of psychological sub-health by Baihe Dihuang Tang based on network pharmacology[J]. Acta Pharmaceutica Sinica, 2017, 52(1): 99-105. |
| [25] |
梁爱华, 薛宝云, 王金华, 等. 鲜地黄与干地黄止血和免疫作用比较研究[J].
中国中药杂志, 1999, 24(11): 663-666.
LIANG A H, XUE B Y, WANG J H, et al. A study on hemostatic and immunological actions of fresh and dry Dihuang[J]. China Journal of Chinese Materia Medica, 1999, 24(11): 663-666. |
| [26] |
LI H J, LI H Y. Ginsenoside-Rg5 inhibits growth and metastasis of ovarian carcinoma via suppressing expression of fibroblast growth factor-8b (FGF8b)[J].
Journal of King Saud University Science, 2020, 32(1): 1162-1167.
DOI: 10.1016/j.jksus.2019.11.001. |
| [27] |
申宏, 马佳乐, 赵智圆, 等. 中医药干预相关信号通路防治肝癌研究进展[J].
国际中医中药杂志, 2021, 43(1): 93-97.
SHEN H, MA J L, ZHAO Z Y, et al. Research progress on the prevention and treatment of liver cancer intervened by Traditional Chinese Medicine on related signaling pathway[J]. International Journal of Traditional Chinese Medicine, 2021, 43(1): 93-97. |
| [28] |
雷晓青, 陈鳌, 刘毅, 等. 山萘酚药理作用的研究进展[J].
微量元素与健康研究, 2017, 34(2): 61-62.
|
| [29] |
YUAN J, ZHANG F, NIU R. Multiple regulation pathways and pivotal biological functions of STAT3 in cancer[J].
Science Reports, 2015, 5: 17663.
|
| [30] |
YU H, LEE H, HERRMANN A, et al. Revisiting STAT3 signaling in cancer: new and unexpected biological functions[J].
Nature Reviews Cancer, 2014, 14(11): 736-746.
DOI: 10.1038/nrc3818. |
| [31] |
GEIGER J, GRANDIS J, BAUMAN J. The STAT3 pathway as a therapeutic target in head and neck cancer: barriers and innovations[J].
Oral Oncology, 2016, 56: 84-92.
DOI: 10.1016/j.oraloncology.2015.11.022. |
| [32] |
ARMAN K, ERGUN S, TEMIZ E, et al. The interrelationship between HER2 and CASP3/8 with apoptosis in different cancer cell lines
[J].
Molecular Biology Reports, 2014, 41(12): 8031-8036.
DOI: 10.1007/s11033-014-3700-x. |
| [33] |
FOLKMAN J. Tumor angiogenesis: therapeutic implications[J].
The New England Journal of Medicine, 1971, 285(21): 1182-1186.
DOI: 10.1056/NEJM197111182852108. |
| [34] |
李晓蕊, 郭青龙, 卢娜. VEGFA/VEGFR2作用于血管内皮细胞途径及其抑制剂研究进展[J].
药物生物技术, 2016, 23(3): 274-278.
LI X R, GUO Q L, LU N. Researching progress in the pathway acting on vascular endothelial cells of VEGFR2 and its signaling inhibitors[J]. Pharmaceutical Biotechnology, 2016, 23(3): 274-278. |
| [35] |
BOURGUIGNON L. Hyaluronan-mediated CD44 activation of RhoGTPase signaling and cytoskeleton function promotes tumor progression[J].
Seminars in Cancer Biology, 2008, 18(4): 251-259.
DOI: 10.1016/j.semcancer.2008.03.007. |
| [36] |
NAPOLEONE F, HANS-PETER G, JENNIFER L. The biology of VEGF and its receptors[J].
Nature Medicine, 2003, 9(6): 669-676.
DOI: 10.1038/nm0603-669. |
| [37] |
ZOU Y, LEI W, SU S, et al. Chlamydia trachomatis plasmid-encoded protein Pgp3 inhibits apoptosis via the PI3K-AKT-mediated MDM2-p53 axis
[J].
Molecular and Cellular Biochemistry, 2019, 452(1-2): 167-176.
DOI: 10.1007/s11010-018-3422-9. |
 2022, Vol. 39
2022, Vol. 39

