2. 广东工业大学 生物医药学院,广东 广州 510006;
3. 澳宝化妆品(惠州)有限公司,广东 惠州 516255
2. School of Biomedical and Pharmaceutical Sciences, Guangdong University of Technology, Guangzhou 510006, China;
3. Opal Cosmetics (Huizhou) Co.Ltd., Huizhou 516255, China
头皮屑是一种常见问题,典型的头皮屑是指头皮上或头发里出现薄片状皮屑,且大多情况下伴有明显的瘙痒。各种内在和环境因素,如皮脂分泌、马拉色菌定植、个体易感性以及这些因素之间的相互作用,都是导致产生头皮屑的原因[1-3]。
马拉色菌是一种寄生于人和动物皮肤表面的嗜脂性真菌,能够分泌多种具有广谱活性的脂肪酶,将皮脂中的甘油三酯水解成脂肪酸。由于马拉色菌缺少Δ9去饱和酶,只能代谢饱和脂肪酸并由此产生促炎性不饱和脂肪酸的聚集,刺激皮肤屏障进而引起角质层脱落,因此一直认为该菌是头皮屑及脂溢性皮炎的病原菌[4-5]。
去除头皮屑需要抑制马拉色菌的过度增殖,抑制马拉色菌的传统去屑剂主要有酮康唑、氯咪巴唑、ZPT、OCT等[6]。酮康唑对马拉色菌相关感染的治疗效果不佳,复发率较高,临床安全性较低,我国已禁止其在化妆品中使用。氯咪巴唑长期使用会产生一定程度的耐受性,且唑类杀菌剂对藻类、鱼类等水生生物有毒害作用。ZPT有较强的脱脂作用,但因其难以溶解,配制去屑产品时必须保证其不发生沉淀[7-9]。植物成分是合成药物的可行替代品,在过去的几十年里,化妆品中天然产物的使用急剧增加[10],人们对含有植物成分的化妆品的认知和需求正在上升。因此,开发具有副作用小、环保、来源广并且适合长期及预防性应用的植物来源去屑成分具有重要意义。
丁香酚主要来源于丁香挥发油等富含丁香酚的精油,具有抗菌、抗炎、镇痛、抗氧化和抗癌等药理活性,在医药、农业、香料、香精、化妆品等多个行业得到应用[11]。目前已有研究发现丁香精油对马拉色菌有较好的抑菌活性[12-13],但尚未应用于去屑,丁香酚与传统去屑剂的相互作用和对表皮角质形成细胞的毒性尚不明确,对马拉色菌的作用机制也未见报道。为了研究丁香酚与传统去屑剂的相互作用和安全性,以及对马拉色菌的作用机制,本文通过体外药敏实验评价了丁香酚及其联用传统去屑剂对糠秕马拉色菌(Malassezia furfur,M. furfur)的抑菌活性,用MTT法评价了对HaCaT细胞的毒性,并通过SEM和TEM初步研究了丁香酚对于糠秕马拉色菌的作用机制,为丁香酚在去屑产品中的应用提供了理论依据。
1 材料与方法 1.1 材料与设备丁香酚,上海麦克林生化科技有限公司,纯度99%;酮康唑,上海阿拉丁生化科技股份有限公司,纯度98%;ZPT,上海麦克林生化科技有限公司,纯度96%;OCT,氯咪巴唑,上海阿拉丁生化科技股份有限公司,纯度98%;改良Dixon培养基 (mDixon),青岛海博生物技术有限公司;DMEM(高糖)培养液,胎牛血清,胰蛋白酶,双抗(青霉素-链霉素),PBS缓冲液,美国Gibco;MTT,上海阿拉丁生化科技股份有限公司;2.5%戊二醛固定液,北京索莱宝科技有限公司。
糠秕马拉色菌 (ATCC 44344)购于广东省微生物菌种保藏中心。
人永生化表皮角质形成细胞(Immortal Keratinocytes,HaCaT),购于上海中乔新舟生物科技有限公司。
生化培养箱,上海一恒科学仪器有限公司;CO2培养箱,赛默飞世尔科技有限公司;超净工作台,苏州净化设备有限公司;多功能酶标仪,德国Berthold公司;光学显微镜,明美光电技术有限公司;离心机,湖南湘仪实验室仪器开发有限公司;聚焦离子束场发射扫描电子显微镜(LYRA 3 XMU),捷克Tescan;透射电子显微镜(Tecnai Spirit),美国FEI公司。
1.2 实验方法 1.2.1 溶液配制将丁香酚、酮康唑、OCT、氯咪巴唑用95%乙醇溶解,分别配至400,10,40,40 mg/mL;将ZPT用95%乙醇分散至20 mg/mL,超声分散,使用前振荡均匀。MTT用PBS溶解配至5 mg/mL,置于–20 ℃冰箱中备用。
1.2.2 最低抑菌浓度 (MIC) 和最低杀菌浓度 (MFC) 的测定将马拉色菌冻干粉活化,在32 ℃培养72 h后,用接种环挑取若干菌落至无菌生理盐水,吹吸数次,将浊度调整至麦氏1#比浊管,经平板计数其菌液浓度为(2~4)×106 CFU/mL,将菌悬液用mDixon培养基稀释100倍。将丁香酚、酮康唑、ZPT、OCT、氯咪巴唑用无菌培养基稀释至实验浓度,备用。
参照NCCLS提出的标准(M27-A3方案),采用微量稀释法在96孔板的1~11列分别加入100 µL无菌培养基,将稀释后的丁香酚、酮康唑、ZPT、OCT、氯咪巴唑取100 µL加至第1列,倍比稀释至第10列,1~11列每孔加入100 µL菌液,第 11列设生长对照,第12列加入200 µL培养基作为空白对照。32 ℃培养72 h后,测600 nm波长处的光密度(Optical Density,OD)值,计算每孔的抑制率,取抑制率≥80%的孔的最低药物浓度作为该药的MIC。抑制率计算公式为
| $ {\text{抑制率}}(\text{%} ) = \frac{{{\text{生长对照组}}{\rm{O}}{{\rm{D}}_{600}} - {\text{实验组}}{\rm{O}}{{\rm{D}}_{600}}}}{{{\text{生长对照组}}{\rm{O}}{{\rm{D}}_{600}} - {\text{空白组}}{\rm{O}}{{\rm{D}}_{600}}}} \times 100\text{%} $ |
取孔内培养液涂布平板,培养3 d后无菌生长的平板对应的最低药物浓度作为MFC。
1.2.3 联合抑菌指数值测定丁香酚与酮康唑、ZPT、OCT、氯咪巴唑的相互作用按照棋盘微量稀释法进行测定[14]。根据各去屑剂的MIC值将其连续稀释后分别加至96孔板,然后将连续稀释的丁香酚加入各板,最后将稀释后的菌悬液加入孔板使其终浓度为(1~2)×104 CFU/mL。将孔板置于32 ℃培养箱培养3 d后,用酶标仪测600 nm波长处的OD值。实验重复3次。
实验结果以联合抑菌指数 (Fractional Inhibitory Concentration, FIC) 来评价两者的联合效应。
| $ {\rm{FIC}}=\frac{{\rm{MIC}}_{{{\rm{A}}}{\text{联用}}}}{{\rm{MIC_A}}}+\frac{{\rm{MIC}}_{{{\rm{B}}}{\text{联用}}}}{{\rm{MIC_B}}}$ |
A和B分别为丁香酚和传统去屑剂,MICA和MICB分别为A和B单用时的MIC值。MICA联用是A和B联用时A的MIC值,MICB联用是A和B联用时B的MIC值。当FIC≤0.5时为协同作用;0.5<FIC≤1时为相加作用;1<FIC≤2时为无关作用;当FIC>2时为拮抗作用。
1.2.4 细胞毒性实验取对数生长期的HaCaT细胞用DMEM完全培养基调整至1×105个/mL,并以100 µL每孔接种至96孔板,置于37 ℃,体积分数为5%的CO2培养箱中培养24 h。弃去培养基,用DMEM完全培养基将丁香酚稀释至实验浓度,取100 µL加至每孔,每组药物设5个复孔,同时设控制组和空白组。分别培养12,24,36和48 h,弃去上清液,每孔加入0.5 mg/mL的MTT 100 µL,继续培养4 h后弃去上清液,每孔加入DMSO 150 µL,用酶标仪测490 nm处的OD值。
细胞活力计算公式为
| $ {\text{细胞活力}}(\text{%} ) = \frac{{{\text{实验组}}{\rm{O}}{{\rm{D}}_{490}} - {\text{空白组}}{\rm{O}}{{\rm{D}}_{490}}}}{{{\text{控制组}}{\rm{O}}{{\rm{D}}_{490}} - {\text{空白组}}{\rm{O}}{{\rm{D}}_{490}}}} \times 100\text{%} $ |
将M. furfur传代2次后,转移到无菌生理盐水中,用mDixon培养基稀释至(2~4)×105 CFU/mL。将黏附载玻片切割成边长5 mm大小正方形,酒精清洗后干燥,并放入24孔板中,每孔加1 mL稀释好的含菌培养液,32 ℃培养24 h后,将载玻片转移到加药培养基中继续培养48 h。取出载玻片,用生理盐水冲洗,2.5%戊二醛固定,经30%,50%,70%,90%,100%乙醇梯度脱水,每次5 min,用100%乙醇再处理20 min,冷冻干燥。喷金5 min,将载玻片黏附于样品台上,在加速电压为5 kV的扫描电子显微镜下观察。
将M. furfur菌悬液用mDixon培养基稀释至 (2~4)×105 CFU/mL,32 ℃摇床培养24 h后,加入丁香酚至MIC浓度,并设酮康唑对照组和空白组,继续培养48 h后,以3000 r/min离心,用PBS漂洗,分别用2.5%戊二醛和1%锇酸溶液固定,后经30%,50%,70%,90%,100%乙醇梯度脱水,再用100%乙醇处理20 min。用包埋剂与丙酮的混合液(V包埋剂/V丙酮=1/1)处理样品1 h,再用包埋剂与丙酮的混合液(V包埋剂/V丙酮=3/1)处理样品3 h。将经过渗透处理的样品包埋起来,70 ℃加热过夜,即得到包埋好的样品。样品在超薄切片机中切片,切片经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液各染色10 min,用加速电压为80 kV的透射电镜观察。
2 结果与讨论 2.1 药敏试验丁香酚、酮康唑、ZPT、OCT、氯咪巴唑对M. furfur的抗菌活性结果见表1。丁香酚的MIC为312.50 μg/mL,MFC为625.00 μg/mL,酮康唑、ZPT和氯咪巴唑表现出较强的抗菌活性。
| 表 1 各药物单独用药对糠秕马拉色菌的MIC和MFC Table 1 MIC and MFC of each drug against M. furfur |
确定了各药物的MIC后,对二元组合的潜在协同作用进行了测试,结果如表2所示。丁香酚与酮康唑联合用药时,FIC值为0.50,表现为协同作用;与ZPT联用时,FIC值为0.75,表现为相加作用;与OCT联用时,FIC值为1.00,表现为相加作用;与氯咪巴唑联用时,FIC值为0.75,表现为相加作用。各药物的联用MIC值相比于MIC值降低了50%~75%,这说明在联合用药时,降低各药物的浓度可以达到相同的抑菌效果。
| 表 2 丁香酚与各药物联合用药对糠秕马拉色菌的FIC Table 2 The FIC of eugenol combined with each drug against M. furfur |
丁香酚对HaCaT细胞增殖的影响如图1所示,在31.25~500 μg/mL剂量范围内培养12, 24, 36, 48 h,随作用时间的延长,HaCaT细胞的存活率呈现浓度−时间依赖关系。丁香酚作用12 h,随丁香酚浓度增加至250 μg/mL,细胞增殖未受到明显的影响,浓度大于250 μg/mL时,细胞存活率骤减;丁香酚分别作用24,36,48 h时,细胞存活率随浓度增大不断降低;在相同的丁香酚浓度下,随着作用时间的延长,细胞存活率降低;分别作用24,36,48 h时,细胞存活率差异不明显。通过双因素方差分析,P<0.01,浓度和作用时间对细胞存活率有非常显著(**)的影响。
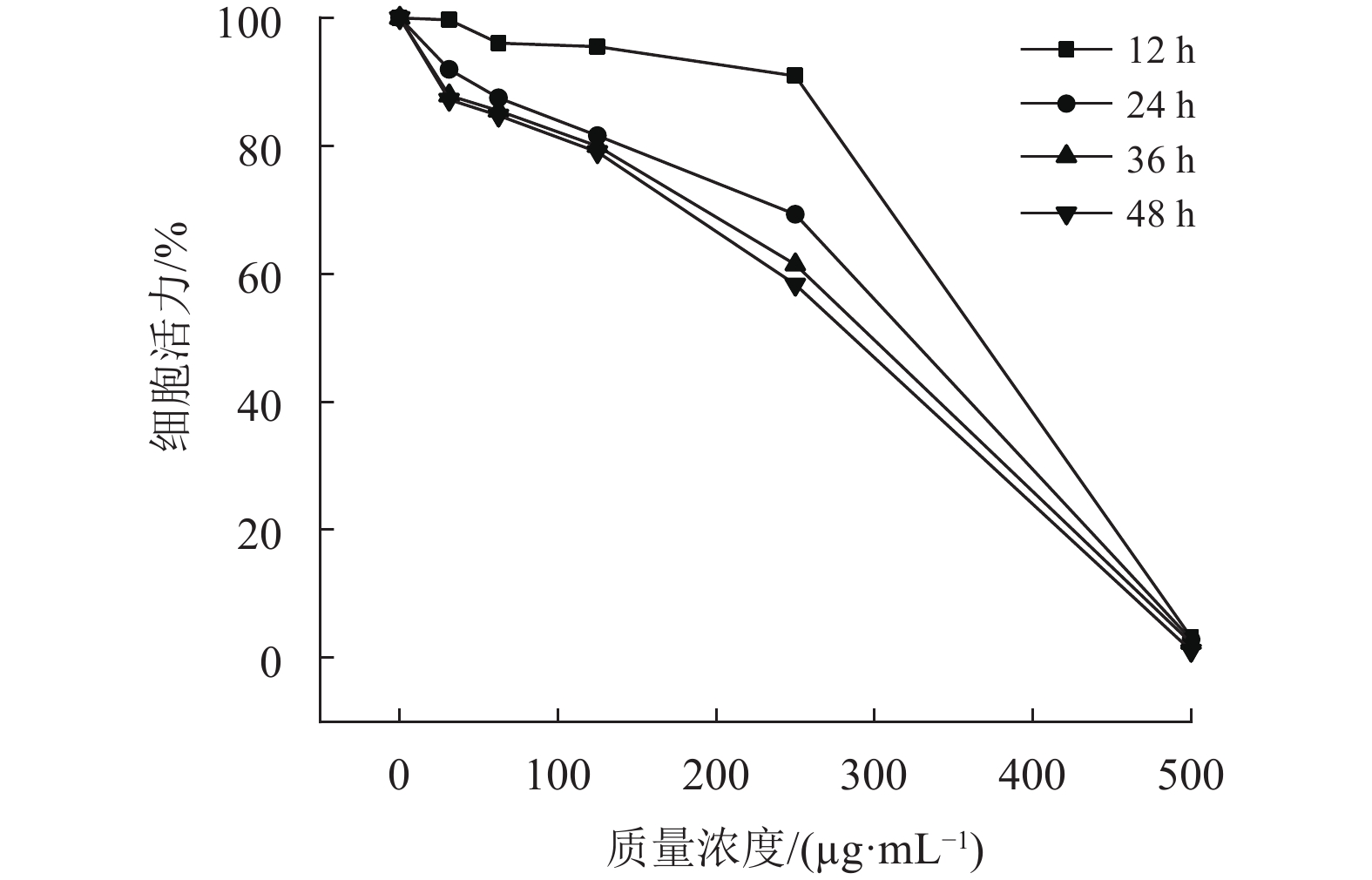
|
图 1 丁香酚对HaCaT细胞增殖的影响 Figure 1 Effect of eugenol on proliferation of HaCaT cells |
同时评价了酮康唑、ZPT、OCT、氯咪巴唑对HaCaT细胞的毒性。分别作用24 h后,细胞活力与药物浓度的关系如图2所示。

|
图 2 酮康唑、ZPT、OCT、氯咪巴唑对HaCaT细胞增殖的影响 Figure 2 Effect of ketoconazole, ZPT, OCT and climbazole on proliferation of HaCaT cells |
用SPSS Statistics进行Probit分析,计算得到各药物对HaCaT细胞的半抑制浓度IC50,如表3所示。结果显示,丁香酚的IC50为320.93 μg/mL,与其他传统去屑剂相比,在细胞水平上有较高的安全性。
| 表 3 丁香酚和各传统去屑剂对HaCaT细胞的IC50值 Table 3 IC50 values of eugenol and traditional antidandruff agents on HaCaT cells |
根据药敏实验和细胞毒性的结果,丁香酚(MIC: 312.5 μg/mL, IC50: 320.93 μg/mL)与ZPT (MIC: 7.50 μg/mL,IC50: 0.662 μg/mL)、OCT (MIC:62.50 μg/mL, IC50: 33.10 μg/mL)相比,安全窗口较大。酮康唑由于长期使用会引起断发等副作用已禁止用于洗发水,氯咪巴唑由于易产生耐药性和环境污染问题也较少使用[7-8]。本研究发现丁香酚有效抑菌浓度值高于传统传统去屑剂,但与传统去屑剂联用时可将各药物的有效浓度降低50%~75%,因此可以通过联用来提高抑菌效果,降低细胞毒性和副作用。
2.3 SEM和TEM对细胞形态的观察图3是经MIC浓度的丁香酚处理后的M. furfur细胞和酮康唑对照组以及正常细胞的SEM图。图3(a)是不加药物的空白对照组,可见较厚的细胞外基质组成的生物膜结构覆盖在细胞上,细胞完整,表面平滑。图3(b)是经过MIC浓度的酮康唑处理的细胞,可见细胞发生皱缩,生物膜明显减少。图3(c)是经MIC浓度的丁香酚处理的细胞,细胞出现皱缩和塌陷,芽孢断裂,细胞破损,生物膜的合成明显减少。
图4是M. furfur细胞的TEM图。图4(a)是正常细胞,细胞壁厚度均一,细胞核呈圆形,核膜清晰,粗面内质网表面可见核糖体附着,脂滴相对较多。图4(b)是MIC浓度的酮康唑处理48 h后的细胞,可见其细胞膜破损、溶解,胞内基质游离。细胞核呈不规则形,线粒体重度肿胀,膜溶解、消失,其内基质变淡;液泡膜溶解。图4(c)是MIC浓度的丁香酚处理48 h后的细胞,细胞壁局部破损,胞内膜结构消失,溶解,细胞膜凹陷,局部质壁分离。细胞核呈不规则形,染色质溶解,核膜模糊;线粒体肿胀,膜结构模糊,其内基质变淡;粗面内质网轻度扩张,脱颗粒,脂滴减少。

|
图 3 M. furfur细胞的SEM图像 Figure 3 SEM images of M. furfur cells |

|
图 4 M. furfur细胞的TEM图像 Figure 4 TEM images of M. furfur cells |
已有研究表明丁香酚对真菌的抑菌机理与破坏细胞壁、细胞膜的完整性和通透性有关。Cai R等[15]认为丁香酚破坏鲁氏酵母细胞膜的完整性和通透性,对细胞壁和细胞膜造成不可逆损伤。de Oliveira Pereira等[16]认为丁香酚作用于红色毛癣菌的机制涉及抑制麦角甾醇的合成,由于麦角甾醇是真菌细胞膜的重要组成部分,低麦角甾醇含量干扰细胞膜的完整性和功能。Darvishi[17]等通过研究发现,丁香酚干扰了酿酒酵母细胞质膜的两种通透酶,Tat1p和Gap1p,它们都参与通过酵母细胞质膜的芳香族化合物和支链氨基酸的双重转运。但是迄今为止还未见丁香酚与M. furfur作用机制的研究报道,根据SEM和TEM测试结果,丁香酚会破坏M. furfur细胞壁,使其凹陷、皱缩,并且破坏细胞内膜结构,使细胞膜凹陷,发生质壁分离,引起核膜和线粒体膜的溶解。可以看出,丁香酚对M. furfur的抗真菌活性是通过破坏细胞壁结构和细胞内膜结构实现的,其与化学去屑剂的协同作用可能由于对M. furfur细胞壁、细胞膜的破坏而加速了化学去屑剂的作用。丁香酚对M. furfur的进一步作用机制有待于更深入的研究。
3 结论(1) 本文通过体外药敏实验研究了丁香酚对糠秕马拉色菌的抑菌活性,其MIC值为312.50 μg/mL,MFC值为625.00 μg/mL。通过棋盘微量稀释法药敏实验评价了丁香酚联用传统去屑剂的相互作用,丁香酚与酮康唑联合使用对马拉色菌有协同作用,与ZPT、OCT、氯咪巴唑联用有相加作用。联合使用可以将各药物的最低有效浓度降低50%~75%。
(2) 通过对HaCaT细胞毒性实验,计算丁香酚的IC50为320.93 μg/mL,在细胞水平上安全性高于传统去屑剂,与传统传统去屑剂联用可提高抑菌能力,降低细胞毒性。
(3) 通过SEM和TEM的观察,丁香酚会破坏M. furfur细胞壁,使其凹陷、皱缩,并且破坏细胞内膜结构,使细胞膜凹陷,发生质壁分离,引起核膜和线粒体膜的溶解。
| [1] |
XU J, SAUNDERS C W, HU P, et al. Dandruff-associated Malassezia genomes reveal convergent and divergent virulence traits shared with plant and human fungal pathogens
[J].
Proceedings of the National Academy of Sciences, 2007, 104(47): 18730-18735.
DOI: 10.1073/pnas.0706756104. |
| [2] |
HARADA K, SAITO M, SUGITA T, et al. Malassezia species and their associated skin diseases
[J].
The Journal of Dermatology, 2015, 42(3): 250-257.
DOI: 10.1111/1346-8138.12700. |
| [3] |
WHITE T C, FINDLEY K, DAWSON T L, et al. Fungi on the skin: dermatophytes and Malassezia
[J].
Cold Spring Harbor Perspectives in Medicine, 2014, 4(8): a019802.
DOI: 10.1101/cshperspect.a019802. |
| [4] |
GRICE E A, DAWSON T L. Host–microbe interactions: Malassezia and human skin
[J].
Current Opinion in Microbiology, 2017, 40: 81-87.
DOI: 10.1016/j.mib.2017.10.024. |
| [5] |
CLAVAUD C, JOURDAIN R, BAR-HEN A, et al. Dandruff is associated with disequilibrium in the proportion of the major bacterial and fungal populations colonizing the scalp[J].
PloS One, 2013, 8(3): e58203.
DOI: 10.1371/journal.pone.0058203. |
| [6] |
SCHWARTZ J R, VALENZUELA M, MIDHA S. Shampoos for normal scalp hygiene and dandruff [M]. Hoboken: Wiley-Black Well, 2010.
|
| [7] |
ANGIOLELLA L, CARRADORI S, MACCALLINI C, et al. Targeting Malassezia species for novel synthetic and natural antidandruff agents
[J].
Current Medicinal Chemistry, 2017, 24(22): 2392-2412.
|
| [8] |
CHEN Z F, YING G G. Occurrence, fate and ecological risk of five typical azole fungicides as therapeutic and personal care products in the environment: a review[J].
Environment International, 2015, 84: 142-153.
DOI: 10.1016/j.envint.2015.07.022. |
| [9] |
成秋桂, 罗佩玲, 卢珊. 去屑产品的新方向[J].
日用化学品科学, 2017, 40(3): 23-25.
CHENG Q G, LUO P L, LU S. New directions of anti-dandruff products[J]. Detergent & Cosmetics, 2017, 40(3): 23-25. |
| [10] |
CHANDRANI D, LUBAINA S Z, SOOSAMMA M. A review of antifungal effect of plant extract vs chemical substances against Malassezia spp
[J].
International Journal of Pharma and Bio Sciences, 2012, 3(3): 773-780.
|
| [11] |
KAMATOU G P, VERMAAK I, VILJOEN A M. Eugenol—from the remote Maluku Islands to the international market place: a review of a remarkable and versatile molecule[J].
Molecules, 2012, 17(6): 6953-6981.
DOI: 10.3390/molecules17066953. |
| [12] |
VÁCZI P, ČONKOVÁ E, MARCINČÁKOVÁ D, et al. Antifungal effect of selected essential oils on Malassezia pachydermatis growth
[J].
Folia Veterinaria, 2018, 62(2): 67-72.
DOI: 10.2478/fv-2018-0018. |
| [13] |
SHAHI S K, SHAHI M P, PRAKASH D. Syzygium aromaticum: potent antidandruff agent with thermo-tolerance, quick killing action and long shelf life
[J].
Indo American Journal of Pharmaceutical Research, 2015, 5(2): 795-802.
|
| [14] |
ESSID R, HAMMAMI M, GHARBI D, et al. Antifungal mechanism of the combination of Cinnamomum verum and Pelargonium graveolens essential oils with fluconazole against pathogenic Candida strains
[J].
Applied Microbiology and Biotechnology, 2017, 101(18): 6993-7006.
DOI: 10.1007/s00253-017-8442-y. |
| [15] |
CAI R, HU M, ZHANG Y, et al. Antifungal activity and mechanism of citral, limonene and eugenol against Zygosaccharomyces rouxii
[J].
LWT-Food Science and Technology, 2019, 106: 50-56.
DOI: 10.1016/j.lwt.2019.02.059. |
| [16] |
DE OLIVEIRA PEREIRA F, MENDES J M, DE OLIVEIRA LIMA E. Investigation on mechanism of antifungal activity of eugenol against Trichophyton rubrum
[J].
Medical Mycology, 2013, 51(5): 507-513.
DOI: 10.3109/13693786.2012.742966. |
| [17] |
DARVISHI E, OMIDI M, BUSHEHRI A A S, et al. The antifungal eugenol perturbs dual aromatic and branched-chain amino acid permeases in the cytoplasmic membrane of yeast[J].
PloS One, 2013, 8(10): e76028.
DOI: 10.1371/journal.pone.0076028. |
 2021, Vol. 38
2021, Vol. 38

