2. 东莞华南设计创新院,广东 东莞 523808
2. Dongguan South China Design and Innovation Institute, Dongguan 523808, China
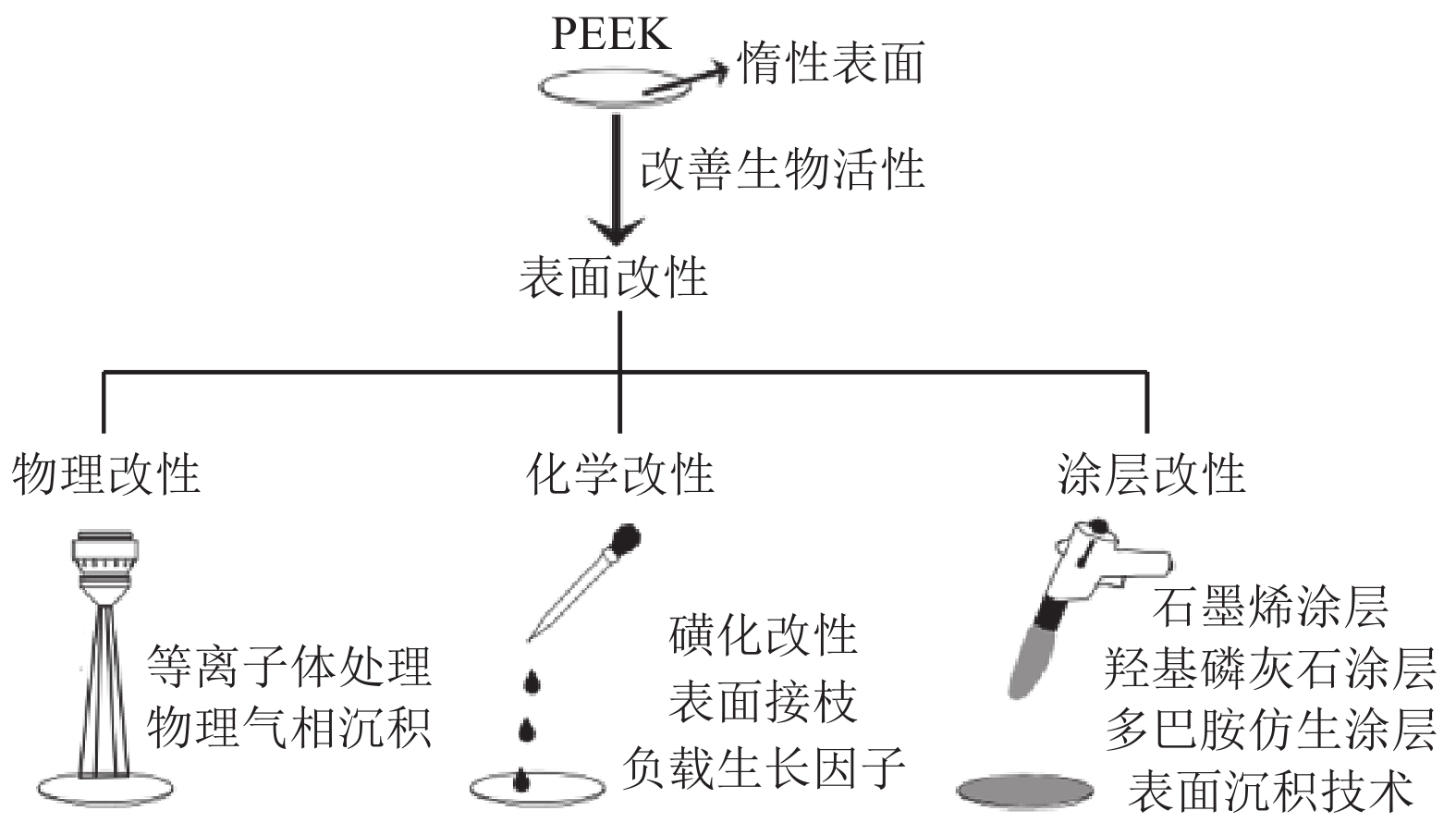
聚醚醚酮(Polyetheretherketone , PEEK)是一种新型半晶态芳香族热塑性高分子材料。1978年,英国科学家采用碱金属碳酸盐作催化剂,以二苯砜作溶剂,通过4,4’-二氟二苯甲酮与对苯二酚进行缩合反应制得。随后PEEK被美国食品和药物管理局(Food and Drug Administration, FDA)批准,用于制造骨科植入体[1]。20世纪90年代末,PEEK成为替代金属植入物部件的重要高性能热塑性塑料候选材料,尤其是在矫形外科和创伤应用[2-4]。随着碳纤维增强聚醚醚酮(CFR-PEEK)的出现,这种新型复合材料被开发用于人工髋关节的骨折固定和股骨假体[5]。近年来PEEK作为修复骨缺损的生物材料引起了科学家们的兴趣[6]。与传统生物陶瓷材料不锈钢、钛及其合金金属种植体等相比,PEEK具有弹性模量更接近皮质骨,良好的生物相容性以及摩擦系数小,加工方法多样灵活,耐化学腐蚀,天然辐射透明度和与磁共振成像(Magnetic Resonance Imaging, MRI)兼容等优点[7-9]。但其作为植入物的缺点是表面惰性,导致细胞和骨结合能力差,并且抗菌性能欠佳,严重阻碍了其广泛的临床应用[10]。目前,表面改性方法可有效改善PEEK材料的生物活性,增强其抗菌、骨整合性能[11]。本文通过物理改性、化学改性以及涂层改性3个方面来介绍表面改性方法(如图1所示),并分析了不同改性技术对于提高生物相容性的帮助,最后展望了骨植入PEEK材料在医学领域的发展前景。
|
图 1 改善PEEK材料生物活性的表面改性方法[11] Figure 1 Surface modification to improve the biological activity of PEEK[11] |
通过改变PEEK材料表面的微纳结构或沉积一些活性物质而不改变与其相关的表面的化学性质,是PEEK材料表面改性最常用且易操作的一种表面改性方法。目前聚醚醚酮表面物理改性主要采用等离子体处理、物理气相沉积来提高PEEK材料生物活性。
1.1 等离子体处理等离子体是一种电离气体,可以在含有低压气体混合物的封闭反应堆系统中通过电磁波激发产生。以这种方式生成的活性粒子可以与放置在反应器中的生物材料的表面相互作用,在表面引入特定官能团。长期以来,PEEK材料一直采用等离子体改性的方法[12]。Ha等[13]采用N2/O2低压等离子体处理PEEK,以提高PEEK的生物活性。成骨细胞系(MC3T3-E1)的细胞实验表明,低压等离子体处理过的PEEK对细胞活力没有不利影响。在钙磷饱和溶液中浸泡24 d后,等离子体处理PEEK表面形成了厚度达50 μm的含碳酸盐磷酸钙层。与未经处理的PEEK相比,经等离子体处理的PEEK经磷酸钙包覆后,细胞活力显著提高,且有利于骨−种植体界面的结合。Awaja等[14-15]用CH4/O2混合等离子体对PEEK表面进行改性。他们发现,与未处理的样品相比,用CH4/O2气体处理的表面黏结强度显著提高。他们使用CH4/O2混合气体的等离子体浸没离子注入和沉积(Plasma Immersion Ion Implantation and Deposition, PIII&D)技术,检测到在PEEK上沉积了具有高表面能的富氧纳米薄膜,这大大提高了细胞黏附性。他们还发现,细胞黏附力与水接触角、表面能的极性成分以及PEEK表面的氧浓度之间有很强的相关性。Althaus等[16]使用O2/Ar或NH4等离子体处理PEEK表面,生成纳米结构基底,与原始PEEK相比,脂肪间充质干细胞广泛黏附、增殖和成骨分化。且观察到50 W处理PEEK的矿化度比10 W增加了一倍,表明成骨分化依赖于等离子体功率。
可见,通过等离子体处理,在PEEK材料表面可以引入−NH3、−OH和−COOH等活性官能团活化材料表面,进而增加其表面的浸润性并且促进细胞黏附。同时这些活性官能团有利于一些生物活性分子的附着和黏附,甚至还能够和其他物质通过接枝和聚合等方法结合,在PEEK材料表面生成生物涂层,使其具有良好的生物相容性。
1.2 物理气相沉积物理气相沉积(Physical Vapour Deposition,PVD)技术是在真空条件下,将材料源气化成气态原子、分子或部分电离成离子,并通过低压气体(或等离子体)在衬底表面沉积特定功能薄膜的技术。Yu等[17]采用气相沉积法在PEEK基体上制备了纯镁,最适衬底温度为230 ℃、PEEK上的镁涂层在Hank的溶液中至少能维持14 d。镁包覆PEEK具有优良的抗菌性能,抗菌率达99%。Kratochvíl等[18]研究了在PEEK基底上沉积的抗菌Cu/C:F纳米复合材料。采用物理气相沉积法制备纳米复合材料,用气体聚集源制备纳米铜颗粒,射频溅射聚四氟乙烯进行包覆。研究发现,以适量的Cu纳米粒子和C:F势垒厚度形成的纳米复合材料对大肠杆菌(E.coli)具有很强的抗菌作用,对MG63细胞没有任何伤害。
物理气相沉积技术可以在PEEK基体上沉积多种生物相容性膜,例如金属膜、陶瓷、半导体和聚合物膜等。同时物理气相沉积技术工艺过程简单,对环境友好,无污染,耗材少,成膜均匀致密,与PEEK基体的结合力强,用于PEEK表面改性有较好的应用前景。
2 表面化学改性PEEK材料表面化学改性通过引入不同的分子链或增加表面活性基团,来改善材料表面的生物活性。PEEK的化学性质十分稳定,除了浓硫酸外,PEEK几乎耐受其他任何化学药品。目前PEEK表面化学改性主要从磺化改性、表面接枝和负载生长因子3个方面来改善PEEK生物活性问题。
2.1 磺化改性磺化反应是一种亲电取代反应,它使用浓硫酸将磺酸盐基团连接到PEEK结构中的芳环上[19]。Zhao等[20]首次发现利用浓硫酸对PEEK的腐蚀作用,在PEEK样品上形成了三维多孔网络,所制备的微/纳米孔PEEK在体外能显著促进MC3T3-E1前成骨细胞的初始黏附、增殖和成骨分化等功能,并能显著增强体内骨整合和骨种植结合强度。但是,磺化作用容易产生大量的含硫基团,研究证明会对人体细胞和组织有负面影响。Ouyang等[21]用浓硫酸对PEEK进行磺化处理,在其表面形成三维网络,并对其进行不同时间的水热处理得到不同浓度硫含量的样品,如图2所示。硫含量最小的样品SPW120在体外对大鼠骨髓间充质干细胞(Rat Bone Marrow Mesenchymal Stem Cells, rBMSCs)的增殖和成骨分化表现出增强作用。所有磺化样品对金黄色葡萄球菌(S. aureus)和大肠杆菌(E.coli)均表现出良好的抗菌性能,特别是对S. aureus具有良好的抗菌性能。

|
图 2 不同硫浓度的磺化PEEK的表面形貌和电子能谱[21] Figure 2 SEM and EDS of sulfonated PEEK with different sulfur concentrations[21] |
可见,磺化是在PEEK材料表面制备三维多孔结构的一种有效方法,通过浸泡条件的控制,可使这些孔达到微/纳米级,这非常有利于细胞黏附及生长。磺化还在PEEK表面及孔洞中生成磺酸基团,虽然可能对人体细胞和组织有一定负面作用,但磺化PEEK表面还是增强了成骨细胞的增值和分化能力,同时表现出优良的杀菌性能。另外,可以通过还原反应在磺化PEEK 材料表面及孔洞中生成丰富的羟基官能团,使细胞能够很好地黏附、增殖并向成骨细胞方向分化,表现出了良好的生物活性。
2.2 表面接枝表面接枝法是通过各种手段在材料表面产生自由基,自由基再进一步与改性单体或功能基团反应,从而达到改性的目的。
Zheng等[22]通过紫外引发乙烯基膦酸接枝聚合,将磷酸基团引入PEEK表面,如图3所示。实验结果表明,磷酸基团改性后增加表面亲水性。体外细胞相容性、碱性磷酸酶活性、细胞外基质矿化和实时PCR分析实验显示MC3T3-E1成骨细胞在磷酸化PEEK表面的黏附、扩散、增殖和成骨分化增强。通过组织学分析对兔胫骨近端缺损模型进行活体生物学评价,证实PEEK表面磷酸化可改善骨与种植体的界面接触。
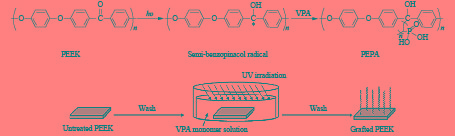
Fristrup等[23]用硼氢化钠对PEEK进行预处理,得到含羟基的活性表面,羟基被转化为溴异丁酸原子转移自由基聚合的起始位点,随后,在水溶液中接枝聚乙二醇(见图4)。实验结果表明,改性后的PEEK具有优良的亲水性,并且更有利于金属离子在表面的沉积。
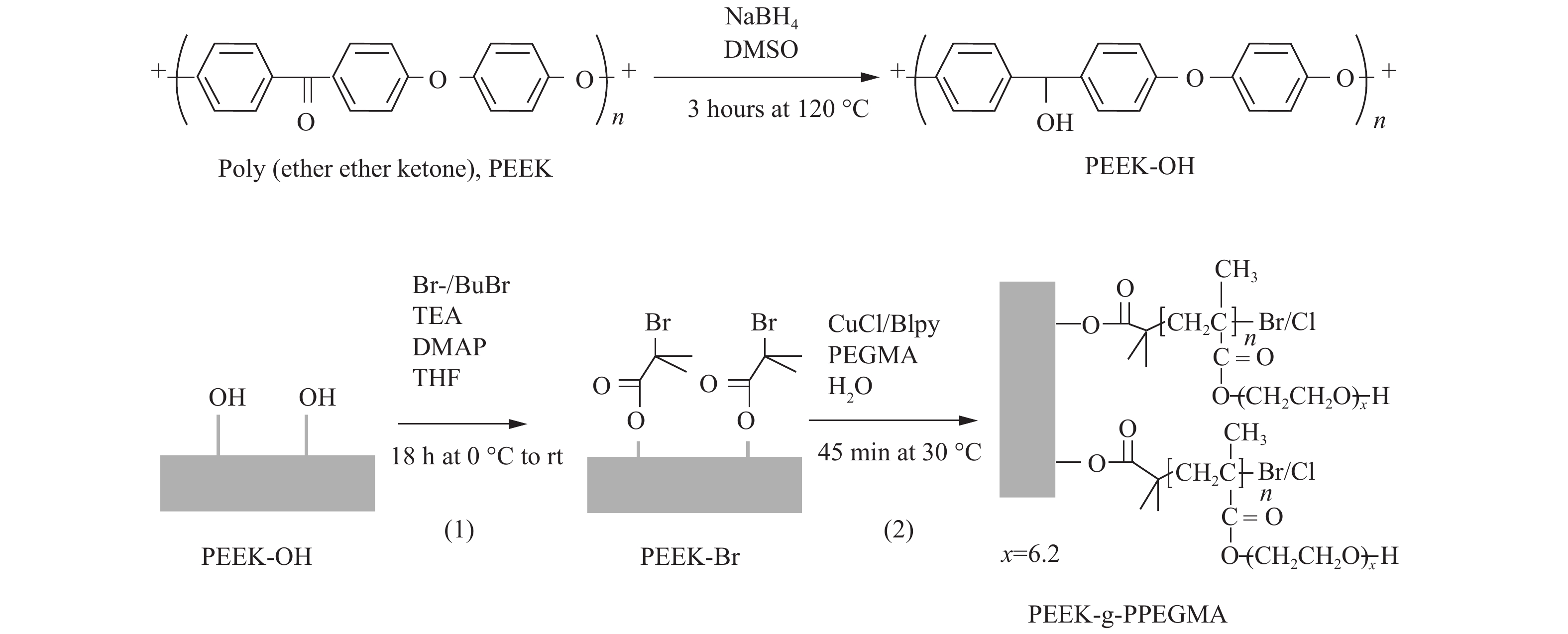
|
图 4 NaBH4活化PEEK表面后接PPEGMA[23] Figure 4 Surface activation of PEEK films via NaBH4treatment and grafting of PPEGMA brushes from the PEEK films[23] |
可见,表面接枝可以通过化学反应或能量辐射等方法在PEEK材料表面引入活性基团,进而进行接枝聚合,或者直接在PEEK表面接枝功能性物质,使其表现出了良好的生物活性及其他性能。因为功能活性基团或功能性物质多以化学键与PEEK表面键合,在应用中比较稳定,不易脱落,非常适于骨移植体表面的改性。
2.3 负载生长因子在骨移植材料表面负载有益于成骨细胞增殖及分化的生长因子也是常见的方法。骨形态发生蛋白(Bone Morphogenetic Protein, BMP)因其具有诱导成骨潜能细胞的作用而常被负载。其中BMP-2是BMP家族中最具潜力的促进成骨分化的生长因子。Sun等[24]采用冷冻干燥技术将BMP-2固定在磺化聚醚醚酮(SPEEK)上,SPEEK的三维网络结构使BMP-2的释放得到了可控、持久的释放。体外细胞实验表明,BMP-2固定化样品显著增强rBMSCs的初始黏附和扩散。此外,胶原分泌、细胞外基质矿化和碱性磷酸酶活性也得到改善,BMP-2固定化样品极大地促进了rBMSCs的成骨分化。Nisarg等[25]采用逐层自组装的方法,在PEEK表面构建BMP-2和羟基磷灰石(Hydroxylapatite, HA)共混改性,解决了负载 BMP-2早期“突释”问题,实现了BMP-2的有效控释。
可见,生长因子可以采用多孔结构、自组装、沉积和纳米微球等多种方法负载于PEEK材料表面,通过诱导成骨潜能细胞,在骨骼或骨骼外转化形成软骨和骨组织。
3 表面涂层改性利用生物相容性涂层对PEEK进行表面改性是一种很有前途的方法,它可以赋予PEEK生物活性,改善移植物与组织的相互作用。到目前为止,许多材料被用作涂层材料,如HA、石墨烯、氧化石墨烯(Graphene Oxide, GO)和聚多巴胺(Polydopamine, PDA)仿生涂层等。此外本文还介绍了一些制备涂层的表面沉积技术,如等离子体浸没离子注入(Plasma Immersion Ion Implantation, PIII)、电子束蒸镀技术(Electron Beam Evaporation, EBE)、磁控溅射技术(Magnetron Sputtering Technique, MST)等。
3.1 羟基磷灰石涂层羟基磷灰石(HA)可以通过骨传导机制促进新骨的生长,而不会引起任何局部或全身毒性、炎症或异物反应,常被用作骨和牙周缺损的替代物、牙槽嵴、中耳植入物、药物递送剂、骨植入物上的生物活性涂层[26]。Lee等[27]通过冷喷涂技术在PEEK表面制备了均匀分布的磷灰石涂层,涂层与PEEK基体结合牢固,材料无变形。比较涂层改性与未改性PEEK材料的体外生物活性研究结果表明,磷灰石涂层促进了PEEK材料表面人骨髓间充质干细胞的分化和增殖, 体内实验表明磷灰石改性增强了PEEK材料与骨组织的整合强度,促进了与周围髂骨的融合。
Dong等[28]通过两步水热处理制备了一种HA和Ni元素双功能化sPEEK多孔植入材料(见图5),实现了Ni2+和Ca2+离子的不同传递方式协调骨再生过程中的成骨和血管生成这两个耦合过程,并证明适当的Ni2+给药可以有效地促进HUVECs的增殖、迁移、成管和血管生成相关基因的表达,从而增强种植体的血管化,具有促进MC3T3-E1细胞成骨分化、快速诱导骨和血管再生的强大能力,显著提高了生物惰性植入物的成骨固定能力。

|
图 5 不同生物功能sPEEK样品的表面形貌[28] Figure 5 Surface morphologies of sPEEK samples with different biological functions[28] |
在PEEK表面制备HA涂层或HA复合涂层的方法很多,包括等离子喷涂法、磁控溅射法、电泳沉积法、溶胶−凝胶法和仿生溶液法等。HA涂层或HA复合涂层可引导新骨的生长,为新骨的形成提供生理支架作用,并与骨组织紧密结合,大大提高了PEEK表面的生物活性和生物相容性。
3.2 石墨烯涂层石墨烯是一种单原子厚的二维六角形蜂窝状结构,由sp2杂化碳原子从其母体材料石墨中分离而来。石墨烯家族(Graphene Families, GFs)包括少层石墨烯、石墨烯带(点)、氧化石墨烯(Graphene Oxide, GO)、石墨烯纳米片以及还原氧化石墨烯(Reducing Graphene Oxide, rGO)等。近年来,石墨烯及其衍生物在生物和医学上的应用越来越受到人们的关注,大量研究致力于探索GFs的抗菌活性和组织工程应用[29]。Yan等[30]从催化金属膜中将石墨烯稳定地包覆在CFR-PEEK表面。石墨烯的修饰可显著促进BMSCs细胞增殖,并加速诱导分化为成骨细胞系。实验表明石墨烯修饰的CFR-PEEK种植体周围形成的新骨多于CFR-PEEK种植体。该文作者还在兔的体内建立了关节外骨移植愈合模型。Ouyang等[31]利用PEEK与氧化石墨烯(GO)的π-π相互作用,提出制备GO涂层改性磺化聚醚醚酮(SPEEK)的方法,如图6所示。抗菌试验表明,GO-SPEEK对E.coli具有良好的抑制作用。与PEEK组和SPEEK组相比,GO-SPEEK基质能显著促进成骨样MG-63细胞的增殖和成骨分化。Ouyang等[32]还以多巴胺为辅助在磺化PEEK构建氧化石墨烯(GO)和地塞米松(Dex)脂质体多孔涂层。研究结果表明,GO和Dex在样品表面得到了成功的包覆。体外细胞贴壁、生长、分化和磷灰石沉积实验均表明,与原磺化PEEK相比,GO和Dex包覆的基质能显著促进MC3T3细胞的增殖和成骨分化。此外,它在体外对E.coli和S. aureus表现出良好的抗菌活性。
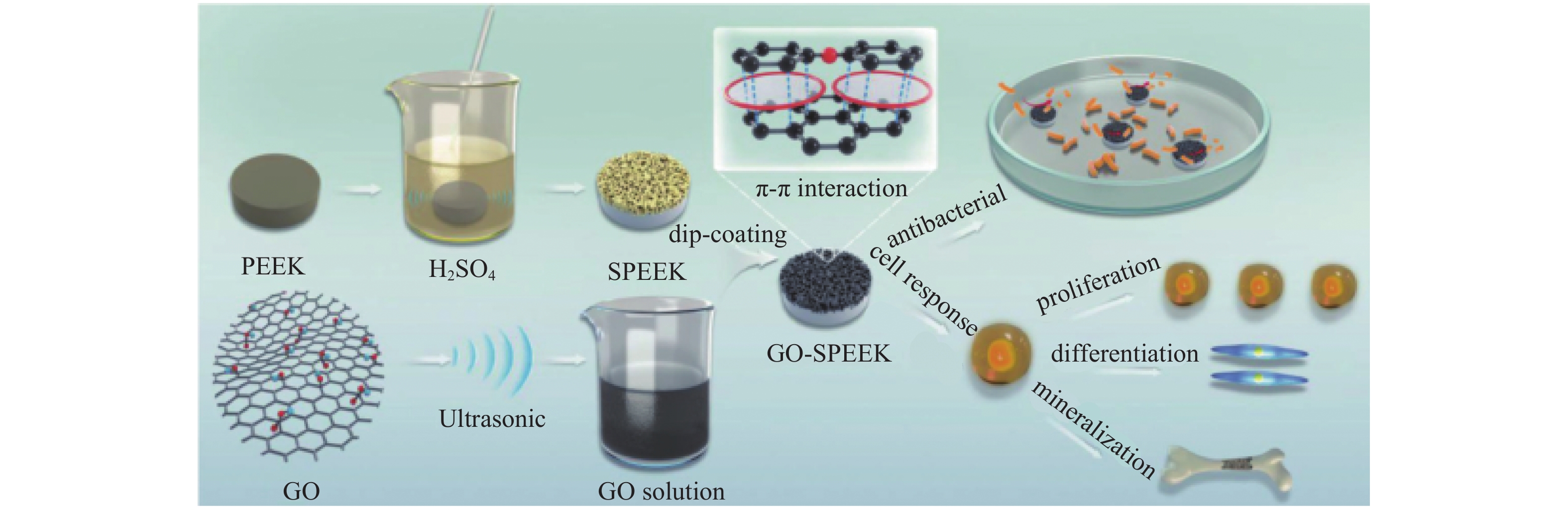
|
图 6 氧化石墨烯涂层改性磺化PEEK流程及应用[31] Figure 6 Process and application of modified sulfonated polyether ether ketone with GO coating[31] |
可见,将石墨烯及其衍生物应用于PEEK材料表面涂层,能显著提高PEEK的生物相容性,促进间充质细胞黏附、增殖及成骨分化,同时还能起到杀菌的作用。其中氧化石墨烯因其带有羧基和羟基等活性基团,更易于与其他物质发生反应,具有开发多种功能的可能性。
3.3 多巴胺仿生涂层多巴胺在碱性介质中自聚,可在材料表面形成一层均匀的聚多巴胺(PDA)仿生涂层。Giwan等[33]首先将PEEK浸入多巴胺的碱性溶液中,反应一段时间后在材料表面形成一层均匀的PDA薄膜,然后利用PDA的活性基团在材料表面接枝了一层胶原分子。体外实验表明,复合涂层改性促进了PEEK表面细胞的黏附、增殖与成骨分化,改善了PEEK的生物活性。Xu等[34]利用PDA涂层将含地塞米松/米诺环素(Dex/Mino)的脂质体固定在PEEK表面(见图7)。研究结果表明,开发的Dex/Mino脂质体修饰PEEK具有增强的抗菌、抗炎和骨整合能力,有很大的潜力作为骨科/牙科植入材料进行临床应用。Zhu等[35]利用PDA表面的亚氨基活性基团将三肽Arg−Gly−Asp(RGD)整合到磺化PEEK表面,并通过细胞增殖,实时逆转录聚合酶链反应分析,茜素红染色,免疫细胞化学染色和浸泡模拟体液等方面研究了表面特征(物理化学和生物性质)及成骨分化能力。总的来说,与PEEK对照组相比,改性PEEK在体外促进细胞增殖、成骨分化和骨样磷灰石形成的能力显著提高。这些结果表明,PEEK表面改性可以提高PEEK的生物活性和生物相容性,并诱导骨分化。
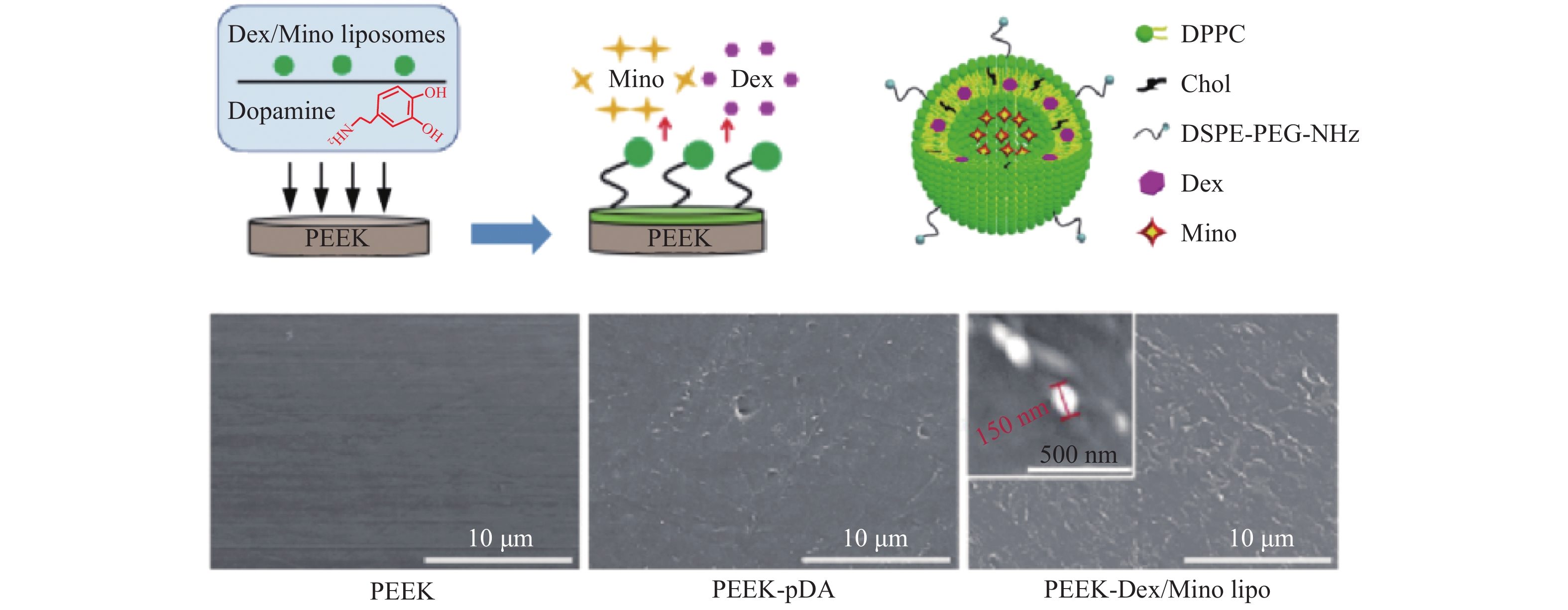
|
图 7 含地塞米松/米诺环素(Dex/Mino)的脂质体固定在PEEK表面的示意图及SEM图[34] Figure 7 Schematic illustration and SEM images of liposomes containing dexamethasone/minocycline (Dex/Mino) were fixed on PEEK surface[34] |
Zhang等[36]将掺锂二氧化硅纳米球和PDA复合生物活性复合材料涂覆在PEEK表面(LP-PEEK),并在体外和体内评价了复合材料的生物性能。结果表明,生物活性提高的LP-PEEK在模拟体液中比PDA包覆的PEEK(PPEEK)和PEEK显著促进磷灰石矿化。与PPEEK和PEEK相比,LP-PEEK对rBMSCs反应有明显的刺激作用。此外,与PPEEK和PEEK相比,LP-PEEK显著促进体内骨组织的反应。这可能是由于LP-PEEK表面复合生物活性涂层而导致细胞和骨组织反应的改善。
可见,在PEEK材料表面包覆PDA仿生涂层可以有效提高其生物相容性。由于PDA涂层表面富含−NH2或−COOH等活性基团,可作为二次接枝的平台,在材料表面引入生物活性分子或其他功能物质,进一步改善材料的生物相容性或赋予材料其他性能。
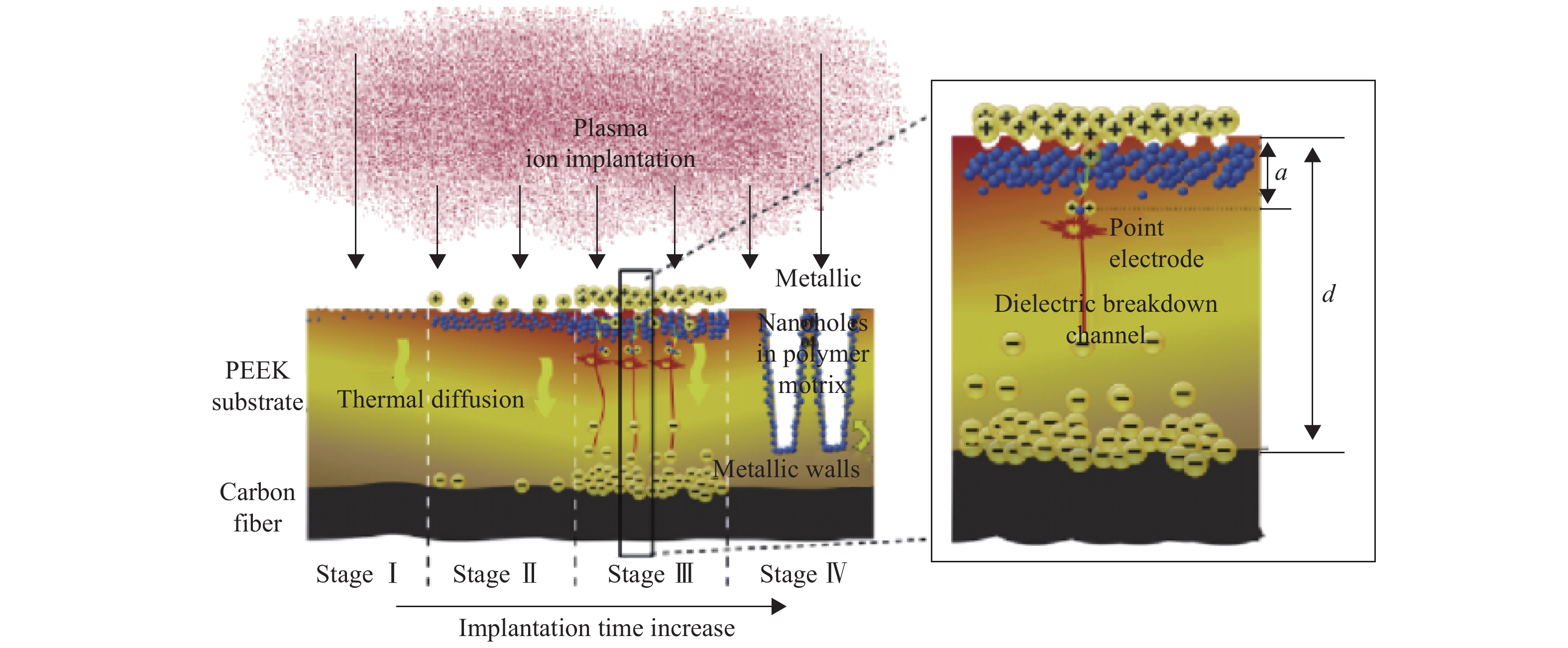
3.4 表面沉积技术 3.4.1 等离子体浸没离子注入等离子体浸没离子注入(PIII)是一种非视线的表面改性方法,在微电子、航空航天、精密制造、生物医学等领域有着广泛的应用。通过引入不同的元素和官能团,可以选择性地调整表面特性,如细胞相容性、抗菌活性和机械性能。此外,在适当的条件下,可以选择性地形成不同尺寸的独特结构[37],如图8所示。
Wang等[38]采用了钛等离子体浸没离子注入技术对CFR-PEEK表面进行修饰,构建了一个独特的多层TiO2纳米结构,纳米尺度的表面可以极大地影响人牙龈成纤维细胞的细胞外基质合成,调节整合素的表达,同时对变形链球菌(S. mutans)、核梭杆菌(F. nucleatum )和人牙龈卟啉单胞菌(P. gingivalis)有着稳定的抗菌活性。Chen等[8]通过在PEEK表面等离子体注入氩气,然后经过氢氟酸处理,前者的纳米表面与后者引入氢元素协同作用,氟化PEEK与初始PEEK相比,能增强细胞黏附、细胞扩散、增殖和碱性磷酸酶活性,并且含氟PEEK表面对P. gingivalis有良好的抑菌作用,为牙科移植材料提供了良好的选择。Wang等[39]采用水蒸气为等离子体源,氩为电离辅助气体,采用PIII技术对PEEK表面进行了改性。在PEEK样品上培养MC3T3-E1和rBMSCs细胞。结果表明,水PIII改性PEEK表面形成了羟基和“撕裂结构”。与纯PEEK相比,水PIII处理的PEEK更有利于成骨细胞的黏附、扩散和增殖,碱性磷酸酶活性所指示的早期成骨分化也被上调。Lu等[40]通过采用双锌氧等离子体浸没离子注入对CFR-PEEK表面进行了改性,研究结果发现,Zn/O-CFRPEEK复合材料的MC3T3-E1细胞的黏附和增殖得到明显促进,而rBMSCs在复合材料结构表面的骨分化得到增强。
Lu等[41]利用钙等离子体浸没离子注入将钙引入PEEK表面。结果表明,PEEK表面形成了不同钙含量的改性层。水接触角测量显示,两种Ca-PIII处理表面的疏水性都在增加。体外细胞黏附、活性测定、碱性磷酸酶活性和胶原分泌分析显示,rBMSCs在Ca-PIII处理表面的黏附、增殖和成骨分化均有改善。结果表明,钙掺入可以制备成骨活性增强的PEEK表面。
Gan等[42]通过氮气等离子体浸没离子注入成功将氮官能团引入PEEK表面。生物评价和抗菌实验结果表明,N2-PIII处理能显著提高PEEK的生物活性,样品对S. aureus表现出一定的抗菌性能。细胞实验证明,柱状结构比颗粒状结构更有利于细胞的成骨分化。
3.4.2 电子束蒸镀电子束蒸镀(EBE)技术是在电磁场的配合下,精准地实现高能电子轰击坩埚内靶材,使之融化进而沉积在基材上。Wen等[9]首次尝试电子束蒸镀技术在生物惰性PEEK表面涂覆一层高纯度生物活性硅酸盐涂层。研究结果表面,合适的沉积时间具有良好的成骨诱导潜力,Micro-CT、荧光标记和组织学的体内实验结果表明,蒸镀时间8 min组能更好地促进骨质疏松动物模型的骨整合。
3.4.3 磁控溅射磁控溅射技术(MST)是在电场作用下氩离子加速飞向阴极靶材,并且以足够高的能量轰击靶材表面,使靶材发生溅射。在溅射粒子中,中性的靶原子或分子沉积在基体表面形成薄膜。在构建生物功能涂层中,常用的是金属靶材,如Ag、Cu、Mg和Zn等。大多数金属离子会具有多种抗菌机制[43],其主要的抗菌机理包括活性氧(Reactive Oxide Species, ROS)导致细菌氧化损伤,破坏细菌壁和质膜结构,影响细菌膜的正常功能,破坏细菌 DNA结构,破坏细菌蛋白质活性以及特殊酶的结构等(见图9)。Liu等[44]通过磁控溅射技术在PEEK表面成功地制备了致密均匀的纳米银(Ag)修饰层。改性PEEK植入物表现出增强的抗菌活性和细菌黏附能力,而不表现出细胞毒性。Liu等[45]通过特定的磁控溅射技术将铜(Cu)纳米粒子固定在磺化聚醚醚酮(SPEEK)表面。体外抗菌和免疫学实验表明,Cu掺杂的SPEEK可以通过“陷阱杀灭”和“接触杀灭”相结合的方式对耐甲氧西林金黄色葡萄糖球菌(Methicillin-resistant Staphylococcus Aureus, MRSA)产生理想的杀菌效果,在含Cu纳米粒子的SPEEK上培养的巨噬细胞可被激活并极化为促炎表型,同时提高MRSA的吞噬能力。进一步的体内植入相关感染模型证明了Cu纳米粒子修饰的SPEEK具有优越的抗菌活性。
可见,通过多种表面沉积技术不仅可以在PEEK表面引入Zn、Ca、Ag、Cu、Mg等元素和活性官能团,还能形成生物活性涂层,赋予PEEK生物相容性及抗菌活性等性能。
4 结论与展望近十年来,PEEK基植入物表面改性的研究取得了许多进展,包括从简单的物理改性、化学改性到涂层改性。虽然很多表面处理方法进入临床是有希望的,但还存在一些挑战,特别是植入期间和植入后的磨损,长期储存的表面稳定性以及灭菌效果需要进行评估,以确保表面处理在整个生命周期内不会退化或磨损正常组织。另外还需进一步的体内试验,来验证植入体在不伤害成骨细胞的前提下的抵御细菌的能力,并且表面处理对骨整合的细胞机制的影响需要进一步的研究,以揭示PEEK植入体在植入体内时每一阶段身体所做出的反应。
| [1] |
BUCK E, LI H, CERRUTI M. Surface modification strategies to improve the osseointegration of poly(etheretherketone) and its composites[J].
Macromolecular Bioscience, 2019, 20(2): 1900271.
|
| [2] |
MISHRA S, CHOWDHARY R. PEEK materials as an alternative to titanium in dental implants: a systematic review[J].
Clinical Implant Dentistry and Related Research, 2019, 21(1): 208-222.
DOI: 10.1111/cid.12706. |
| [3] |
KURTZ S M, DEVINE J N. PEEK biomaterials in trauma, orthopedic, and spinal implants[J].
Biomaterials, 2007, 28(32): 4845-4869.
DOI: 10.1016/j.biomaterials.2007.07.013. |
| [4] |
PARK H, LEE J, MOON S, et al. The efficacy of the synthetic interbody cage and grafton for anterior cervical fusion[J].
Spine (Phila Pa 1976), 2009, 34(17): E591-E595.
DOI: 10.1097/BRS.0b013e3181ab8b9a. |
| [5] |
KOH Y, PARK K, LEE J, et al. Total knee arthroplasty application of polyetheretherketone and carbon-fiber-reinforced polyetheretherketone: a review[J].
Materials Science and Engineering: C, 2019, 100: 70-81.
DOI: 10.1016/j.msec.2019.02.082. |
| [6] |
TOTH J M, WANG M, ESTES B T, et al. Polyetheretherketone as a biomaterial for spinal applications[J].
Biomaterials, 2006, 27(3): 324-334.
DOI: 10.1016/j.biomaterials.2005.07.011. |
| [7] |
LU T, WEN J, QIAN S, et al. Enhanced osteointegration on tantalum-implanted polyetheretherketone surface with bone-like elastic modulus[J].
Biomaterials, 2015, 51: 173-183.
DOI: 10.1016/j.biomaterials.2015.02.018. |
| [8] |
CHEN M, OUYANG L, LU T, et al. Enhanced bioactivity and bacteriostasis of surface fluorinated polyetheretherketone[J].
ACS Applied Materials & Interfaces, 2017, 9(20): 16824-16833.
|
| [9] |
WEN J, LU T, WANG X, et al. In vitro and in vivo evaluation of silicate-coated polyetheretherketone fabricated by electron beam evaporation[J].
ACS Applied Materials & Interfaces, 2016, 8(21): 13197-13206.
|
| [10] |
ALOTAIBI N, NAUDI K, CONWAY D, et al. The current state of PEEK implant osseointegration and future perspectives: a systematic review[J].
European Cells and Materials, 2020, 40: 1-20.
DOI: 10.22203/eCM.v040a01. |
| [11] |
MA R, TANG T. Current strategies to improve the bioactivity of PEEK[J].
International Journal of Molecular Sciences, 2014, 15(4): 5426-5445.
DOI: 10.3390/ijms15045426. |
| [12] |
BRIEM D, STRAMETZ S, SCHRÖODER K, et al. Response of primary fibroblasts and osteoblasts to plasma treated polyetheretherketone (PEEK) surfaces[J].
Journal of Materials Science: Materials in Medicine, 2005, 16(7): 671-677.
DOI: 10.1007/s10856-005-2539-z. |
| [13] |
HA S W, KIRCH M, BIRCHLER F, et al. Surface activation of polyetheretherketone (PEEK) and formation of calcium phosphate coatings by precipitation[J].
Journal of Materials Science: Materials in Medicine, 1997, 8(11): 683-690.
DOI: 10.1023/A:1018535923173. |
| [14] |
AWAJA F, ZHANG S, JAMES N, et al. Enhanced autohesive bonding of polyetheretherketone (PEEK) for biomedical applications using a methane/oxygen plasma treatment[J].
Plasma Processes and Polymers, 2010, 7(12): 1010-1021.
DOI: 10.1002/ppap.201000072. |
| [15] |
AWAJA F, BAX D V, ZHANG S, et al. Cell adhesion to PEEK treated by plasma immersion ion implantation and deposition for active medical implants[J].
Plasma Processes and Polymers, 2012, 9(4): 355-362.
DOI: 10.1002/ppap.201100034. |
| [16] |
WASER-ALTHAUS J, SALAMON A, WASER M, et al. Differentiation of human mesenchymal stem cells on plasma-treated polyetheretherketone[J].
Journal of Materials Science: Materials in Medicine, 2014, 25(2): 515-525.
DOI: 10.1007/s10856-013-5072-5. |
| [17] |
YU X, IBRAHIM M, LIU Z, et al. Biofunctional Mg coating on PEEK for improving bioactivity[J].
Bioactive Materials, 2018, 3(2): 139-143.
DOI: 10.1016/j.bioactmat.2018.01.007. |
| [18] |
KRATOCHVÍL J, ŠTĚRBA J, LIESKOVSKÁ J, et al. Antibacterial effect of Cu/C:F nanocomposites deposited on PEEK substrates[J].
Materials Letters, 2018, 230: 96-99.
DOI: 10.1016/j.matlet.2018.07.082. |
| [19] |
HUANG R Y M, SHAO P, BURNS C M, et al. Sulfonation of poly(ether ether ketone)(PEEK): kinetic study and characterization[J].
Journal of Applied Polymer Science, 2001, 82(11): 2651-2660.
DOI: 10.1002/app.2118. |
| [20] |
ZHAO Y, WONG H M, WANG W, et al. Cytocompatibility, osseointegration, and bioactivity of three-dimensional porous and nanostructured network on polyetheretherketone[J].
Biomaterials, 2013, 34(37): 9264-9277.
DOI: 10.1016/j.biomaterials.2013.08.071. |
| [21] |
OUYANG L, ZHAO Y, JIN G, et al. Influence of sulfur content on bone formation and antibacterial ability of sulfonated PEEK[J].
Biomaterials, 2016, 83: 115-126.
DOI: 10.1016/j.biomaterials.2016.01.017. |
| [22] |
ZHENG Y, LIU L, XIAO L, et al. Enhanced osteogenic activity of phosphorylated polyetheretherketone via surface-initiated grafting polymerization of vinylphosphonic acid[J].
Colloids and Surfaces B: Biointerfaces, 2019, 173: 591-598.
DOI: 10.1016/j.colsurfb.2018.10.031. |
| [23] |
FRISTRUP C J, JANKOVA K, HVILSTED S. Hydrophilization of poly(ether ether ketone) films by surface-initiated atom transfer radical polymerization[J].
Polymer Chemistry, 2010, 1(10): 1696.
DOI: 10.1039/c0py00142b. |
| [24] |
SUN Z, OUYANG L, MA X, et al. Controllable and durable release of BMP-2-loaded 3D porous sulfonated polyetheretherketone (PEEK) for osteogenic activity enhancement[J].
Colloids Surf B Biointerfaces, 2018, 171: 668-674.
DOI: 10.1016/j.colsurfb.2018.08.012. |
| [25] |
SHAH N J, HYDER M N, MOSKOWITZ J S, et al. Surface-mediated bone tissue morphogenesis from tunable nanolayered implant coatings[J].
Sci Transl Med, 2013, 5(191): 183r-191r.
|
| [26] |
SADAT-SHOJAI M, KHORASANI M, DINPANAH-KHOSHDARGI E, et al. Synthesis methods for nanosized hydroxyapatite with diverse structures[J].
Acta Biomaterialia, 2013, 9(8): 7591-7621.
DOI: 10.1016/j.actbio.2013.04.012. |
| [27] |
LEE J H, JANG H L, LEE K M, et al. In vitro and in vivo evaluation of the bioactivity of hydroxyapatite-coated polyetheretherketone biocomposites created by cold spray technology[J].
Acta Biomaterialia, 2013, 9(4): 6177-6187.
DOI: 10.1016/j.actbio.2012.11.030. |
| [28] |
DONG T, DUAN C, WANG S, et al. Multifunctional surface with enhanced angiogenesis for improving long-term osteogenic fixation of poly(ether ether ketone) implants[J].
ACS Applied Materials & Interfaces, 2020, 12(13): 14971-14982.
|
| [29] |
QIU J, GENG H, WANG D, et al. Layer-number dependent antibacterial and osteogenic behaviors of graphene oxide electrophoretic deposited on titanium[J].
ACS Applied Materials & Interfaces, 2017, 9(14): 12253-12263.
|
| [30] |
YAN J, WANG C, LI K, et al. Enhancement of surface bioactivity on carbon fiber-reinforced polyether ether ketone via graphene modification[J].
International Journal of Nanomedicine, 2018, 13: 3425-3440.
|
| [31] |
OUYANG L, DENG Y, YANG L, et al. Graphene-oxide-decorated microporous polyetheretherketone with superior antibacterial capability and in vitro osteogenesis for orthopedic implant[J].
Macromolecular Bioscience, 2018, 18(6): 1800036.
DOI: 10.1002/mabi.201800036. |
| [32] |
OUYANG L, QI M, WANG S, et al. Osteogenesis and antibacterial activity of graphene oxide and dexamethasone coatings on porous polyetheretherketone via polydopamine-assisted chemistry[J].
Coatings, 2018, 8(6): 203.
DOI: 10.3390/coatings8060203. |
| [33] |
KWON G, KIM H, GUPTA K C, et al. Enhanced tissue compatibility of polyetheretherketone disks by dopamine-mediated protein immobilization[J].
Macromolecular Research, 2018, 26(2): 128-138.
DOI: 10.1007/s13233-018-6018-z. |
| [34] |
XU X, LI Y, WANG L, et al. Triple-functional polyetheretherketone surface with enhanced bacteriostasis and anti-inflammatory and osseointegrative properties for implant application[J].
Biomaterials, 2019, 212: 98-114.
DOI: 10.1016/j.biomaterials.2019.05.014. |
| [35] |
ZHU Y, CAO Z, PENG Y, et al. Facile surface modification method for synergistically enhancing the biocompatibility and bioactivity of poly(ether ether ketone) that induced osteodifferentiation[J].
ACS Applied Materials & Interfaces, 2019, 11(31): 27503-27511.
|
| [36] |
ZHANG J, CAI L, WANG T, et al. Lithium doped silica nanospheres/poly(dopamine) composite coating on polyetheretherketone to stimulate cell responses, improve bone formation and osseointegration[J].
Nanomedicine: Nanotechnology, Biology and Medicine, 2018, 14(3): 965-976.
DOI: 10.1016/j.nano.2018.01.017. |
| [37] |
LU T, LIU X, QIAN S, et al. Multilevel surface engineering of nanostructured TiO2 on carbon-fiber-reinforced polyetheretherketone
[J].
Biomaterials, 2014, 35(22): 5731-5740.
DOI: 10.1016/j.biomaterials.2014.04.003. |
| [38] |
WANG X, LU T, WEN J, et al. Selective responses of human gingival fibroblasts and bacteria on carbon fiber reinforced polyetheretherketone with multilevel nanostructured TiO2[J].
Biomaterials, 2016, 83: 207-218.
DOI: 10.1016/j.biomaterials.2016.01.001. |
| [39] |
WANG H, LU T, MENG F, et al. Enhanced osteoblast responses to poly ether ether ketone surface modified by water plasma immersion ion implantation[J].
Colloids and Surfaces B: Biointerfaces, 2014, 117: 89-97.
DOI: 10.1016/j.colsurfb.2014.02.019. |
| [40] |
LU T, LI J, QIAN S, et al. Enhanced osteogenic and selective antibacterial activities on micro-/nano-structured carbon fiber reinforced polyetheretherketone[J].
Journal of Materials Chemistry B, 2016, 4(17): 2944-2953.
DOI: 10.1039/C6TB00268D. |
| [41] |
LU T, QIAN S, MENG F, et al. Enhanced osteogenic activity of poly ether ether ketone using calcium plasma immersion ion implantation[J].
Colloids and Surfaces B: Biointerfaces, 2016, 142: 192-198.
DOI: 10.1016/j.colsurfb.2016.02.056. |
| [42] |
GAN K, LIU H, JIANG L, et al. Bioactivity and antibacterial effect of nitrogen plasma immersion ion implantation on polyetheretherketone[J].
Dental Materials, 2016, 32(11): e263-e274.
DOI: 10.1016/j.dental.2016.08.215. |
| [43] |
WYSZOGRODZKA G, MARSZALEK B, GIL B, et al. Metal-organic frameworks: mechanisms of antibacterial action and potential applications[J].
Drug Discov Today, 2016, 21(6): 1009-1018.
DOI: 10.1016/j.drudis.2016.04.009. |
| [44] |
LIU X, GAN K, LIU H, et al. Antibacterial properties of nano-silver coated PEEK prepared through magnetron sputtering[J].
Dental Materials, 2017, 33(9): e348-e360.
DOI: 10.1016/j.dental.2017.06.014. |
| [45] |
LIU W, LI J, CHENG M, et al. A surface-engineered polyetheretherketone biomaterial implant with direct and immunoregulatory antibacterial activity against methicillin-resistant staphylococcus aureus[J].
Biomaterials, 2019, 208: 8-20.
DOI: 10.1016/j.biomaterials.2019.04.008. |
 2021, Vol. 38
2021, Vol. 38