化学药物治疗法(化疗法)是一种通过化学药物干扰细胞分裂、代谢等机制从而抑制癌细胞快速增殖的治疗方法,其作为一种全身性的治疗手段,不仅对早期癌症具有显著的癌细胞抑制增长作用,而且对晚期转移性肿瘤也有不错的治疗效果[1]。然而,化疗法存在着抗癌药物溶解性差、毒副作用大、无靶向选择性、药代动力学过程不可控制等缺点,影响其在临床上癌症的治疗效果[2-3]。
为了提高化疗法的治疗效果,降低抗癌药物的毒副作用,刺激响应型聚合物胶束受到越来越多科研人员的关注,如pH响应型[4-6]、温度响应型[7-8]和还原响应型[9-10]等。其中,pH响应型聚合物胶束可根据人体正常组织(pH=7.4)和肿瘤组织(pH=5.0)微环境pH值的差异,实现对抗癌药物的可控释放,具有巨大的应用前景[11]。通过引入聚碱可构筑pH响应型聚合物胶束,在中性和酸性条件下聚碱发生负电荷(疏水性)到正电荷(亲水性)的转变,可有效控制释放抗癌药物[12-14]。通过酸不稳定性化学键连接疏水和亲水嵌段,也可制备pH响应型聚合物胶束用于疏水性抗癌药物的递送,在中性条件下,载药胶束可保持稳定,而在酸性环境下,酸不稳定性化学键断裂导致聚合物胶束裂解,从而达到药物控制释放的目的[4, 15]。
然而,pH响应型聚合物胶束的研究和发展依然存在几大亟待解决的问题,如聚合物胶束在人体血液循环中稳定性不足,对抗癌药物的包裹能力较低以及载药胶束在肿瘤组织中积累效率低等[4, 9]。在前期的研究中,多臂星状聚合物纳米载药胶束显示出良好的应用性能,尤其是以刚性、大体积结构单元为核构筑的星状聚合物胶束,具有较高的稳定性和载药能力,例如金刚烷基聚合物胶束的临界胶束浓度(CMC=0.0050 mg/mL)和载药量(LC=10.39%)均优于季戊四醇基聚合物胶束(CMC=0.0087 mg/mL、LC=8.94%)[10]。
为了进一步提高pH响应型聚合物胶束的稳定性和载药量,本文基于金刚烷基合成了四臂星状pH响应型聚合物金刚烷-[聚(乳酸-共-羟基乙酸)-聚甲基丙烯酸二乙氨基乙酯-聚(乙二醇)单甲醚]4(4sAd-PLGA-D-P),并制备其自组装胶束用于抗癌药物的可控递送。分别选用具有良好生物相容性的聚(乳酸-共-羟基乙酸)(PLGA)和聚(乙二醇)单甲醚(mPEG)作为聚合物的疏水嵌段和亲水嵌段[16]。由于聚甲基丙烯酸二乙氨基乙酯(PDEAEMA)具有良好的pH响应性能,根据环境中pH值从中性降低至酸性可发生疏水性到亲水性的转变,对疏水性药物可进行响应性释放[17]。通过改变聚合物中pH响应单元PDEAEMA的链段长度,探究其对聚合物胶束性能的影响规律。
1 实验部分 1.1 原料与试剂D,L-丙交酯(ω=98%)、乙交酯(ω=98%)、溴化亚铜(ω=99%):分析纯,Sigma-Aldrich公司;2-溴异丁酰溴(ω=98%)、DEAEMA(ω=99%)、盐酸阿霉素(DOX·HCl,ω=98%)、4-二甲基氨基吡啶(ω=99%):分析纯,上海阿拉丁生化科技股份有限公司;炔基化聚乙二醇单甲醚(Mn=2 000):分析纯,上海爱纯生物科技有限公司;1,3,5,7-四羟基金刚烷由实验室自制[5]。
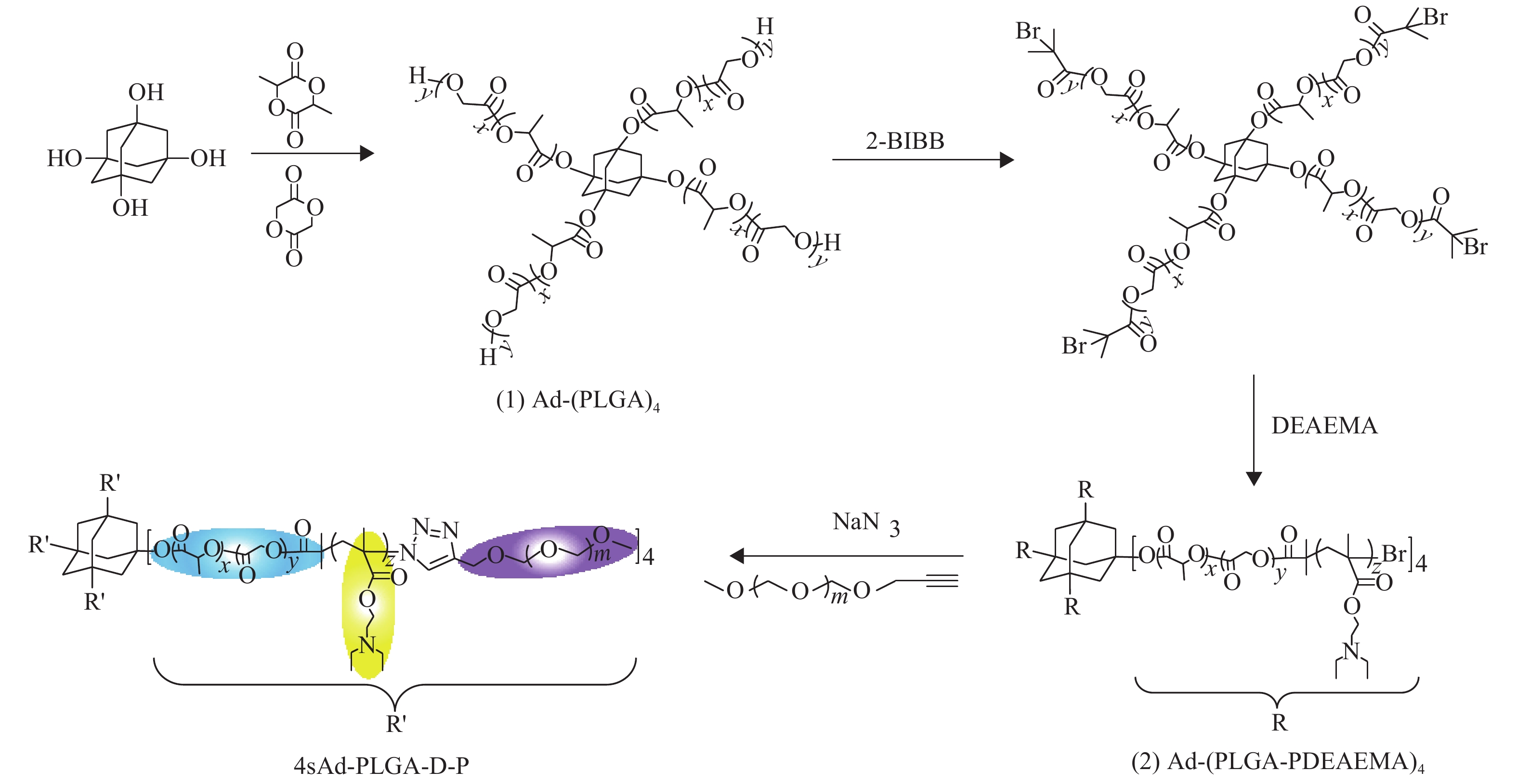
1.2 两亲性聚合物的合成以1,3,5,7-四羟基金刚烷为引发剂,分别以PLGA、PDEAEMA及mPEG为疏水链段、pH响应链段及亲水链段,结合开环聚合反应、原子转移自由基反应以及点击化学中的铜(I)催化叠氮-炔环加成反应(CuAAC)合成聚合物4sAd-PLGA-D-P,其具体合成路线和方案如图1所示。
|
图 1 聚合物4sAd-PLGA-D-P的合成路线 Figure 1 Synthetic route of 4sAd-PLGA-D-P |
将1,3,5,7-四羟基金刚烷(0.10 g,0.5 mmol)、乙交酯(1.45 g,12.5 mmol)、D,L-丙交酯(5.40 g,37.5 mmol)和辛酸亚锡(68.5 mg,质量分数为1%)加入100 mL干燥Schlenk瓶中,在氩气氛围下,反应体系保持130 °C反应8 h。反应结束后加入50 mL二氯甲烷(CH2Cl2)溶解粗产物,除去不溶固体,用冰正己烷沉淀产物,经真空干燥24 h得白色固体产品Ad-PLGA4(5.02 g,Mn, GPC=11 657,产率为86.2%)。将Ad-PLGA4(5.83 g,0.5 mmol)溶于CH2Cl2(50 mL)和三乙胺(TEA,0.81 g,8.0 mmol)并转移至100 mL干燥Schlenk瓶。往反应体系加入2-溴异丁酰溴(1.84 g,8.0 mmol),在冰水浴中先反应2 h,再在室温下继续反应24 h。依次用稀盐酸溶液(1 mol/L)、饱和NaHCO3溶液和去离子水各洗涤3次,有机相用无水MgSO4干燥过夜后旋蒸浓缩,用冰正己烷沉淀产物,经真空干燥24 h得淡黄色固体Ad-(PLGA-Br)4(4.75 g,产率为81.5%)。
将Ad-(PLGA-Br)4(5.99 g,0.5 mmol)、DEAEMA(5.56 g,30.0 mmol)和PMDETA(34.7 mg,0.2 mmol)溶于50 mL无水四氢呋喃(THF)中,并转移至150 mL干燥Schlenk瓶,随后加入溴化亚铜(29.3 mg,0.2 mmol)。在氩气保护下,反应体系于65 °C反应24 h。反应溶液通过中性氧化铝柱除去铜盐催化剂,洗脱液经浓缩后缓慢滴至过量的冰正己烷中沉淀,通过离心收集沉淀物,经真空干燥24 h得淡黄色块状固体Ad-(PLGA-PDEAEMA)4(7.25 g,Mn, GPC=19 437,产率:74.6%)。
往100 mL单口烧瓶中加入Ad-(PLGA-PDEAEMA)4(3.89 g,0.2 mmol)、叠氮化钠(130 mg,2 mmol)和溶剂N,N′-二甲基甲酰胺(DMF,50 mL)。反应体系置于60 °C下反应48 h,将反应溶液逐滴加至过量的冰去离子水中,通过离心收集固体沉淀物Ad-(PLGA-PDEAEMA-N3)4。将Ad-(PLGA-PDEAEMA-N3)4(1.94 g,0.1 mmol)、炔基化mPEG(1.2 g,0.6 mmol)、2,2′-联吡啶(9.4 mg,0.06 mmol)溶于50mL DMF,并转移至150 mL干燥Schlenk瓶,迅速加入溴化亚铜(8.6 mg,0.06 mmol)。在氩气的保护下,反应体系保持60 °C反应48 h。将反应液转移到透析袋中(截留分子量为7500 Da),用去离子水透析72 h除去未反应原料和残留的铜盐。取透析袋中清液,冷冻干燥48 h,得白色粉末目标聚合物4sAd-PLGA-D-P(1.89 g,产率为70.1%)。
1.3 聚合物胶束及载药胶束的制备采用溶剂挥发法制备聚合物胶束[18],将20 mg聚合物溶于10 mL丙酮,然后滴至20 mL去离子水中,室温下搅拌24 h使丙酮完全挥发,通过0.45 μm滤头过滤可获得聚合物胶束溶液。
选用DOX为模型药物,采用透析法制备载药胶束,将DOX·HCl(50 mg)溶于10 mL二甲基亚砜(DMSO),再加入TEA(0.10 mL),搅拌4 h获得DOX碱溶液。将聚合物(100 mg)溶于20 mL DMSO,然后将聚合物溶液与DOX碱溶液混合,搅拌过夜。将混合液转移至透析袋中(截留分子量为3500 Da),并用去离子水透析48 h。透析液通过0.45 μm滤头过滤后,通过冷冻干燥获得载药胶束固体粉末。
1.4 测试与表征 1.4.1 样品表征采用核磁共振波谱仪(美国Bruker公司 AVANVE III 400 MHz型)表征聚合物的核磁共振氢谱(1H NMR)和核磁共振碳谱(13C NMR),溶剂为DMF-d7;采用凝胶渗透色谱仪(美国Waters公司 1515/2414型)测定聚合物的数均分子量(Mn)及分子量分布(Mw/Mn),流动相为THF,流速1 mL/min。
1.4.2 聚合物胶束表征采用动态光散射仪(美国Brookhaven公司)测定聚合物胶束的粒径及粒径分布。样品的形貌表征采用透射电子显微镜(日本Hitachi公司,HT7700型号),操作电压为120 kV。
1.4.3 临界胶束浓度(CMC)测定采用芘荧光探针法测定聚合物胶束的CMC值。将0.1 mL芘-丙酮溶液(6×10–5 mol/L)加入10 mL的棕色容量瓶,避光静置过夜待丙酮完全挥发。将聚合物溶液(浓度范围0.0001~0.1000 mg/mL)加入容量瓶中,用去离子水将各容量瓶定容,混合均匀后在室温下避光平衡24 h。利用荧光光谱仪(美国HORIBA Jobin Yvon公司,FluoroMax-4型)测定样品溶液在300~350 nm波长范围内的激发光谱。其中,发射波长为373 nm,狭缝为5 nm。将样品溶液在335 nm和332 nm处的激发光谱强度比值(I335/I332)与聚合物胶束溶液的浓度对数作图。
1.4.4 聚合物胶束载药性能称量4.0 mg载药胶束溶于10 mL DMSO中,采用紫外−可见分光光度计(美国PerkinElmer公司,Lambda 950型)测定样品在480 nm处的紫外吸收强度,根据紫外吸收强度与DOX浓度的标准曲线方程、式(1)和式(2)可计算聚合物胶束对DOX的载药量(LC)和包封率(EE)[19]。
| $ {\rm{LC}}=\frac{{\text{载药胶束负载}}{\rm{DOX}}{\text{质量}}}{{\text{载药胶束总质量}}}\times 100\text{%} $ | (1) |
| $ {\rm{EE}}=\frac{{\text{载药胶束负载}}{\rm{DOX}}{\text{质量}}}{{\text{DOX投料量}}}\times 100\text{%} $ | (2) |
选取pH=7.4和5.0作为体外释放介质评价载药胶束的药物释放。分别取10 mL载药胶束(1 mg/mL)溶液转移至2组透析袋(截留分子量为3500 Da),再分别置于40 mL磷酸盐缓冲液(pH=7.4)或乙酸盐缓冲液(pH=5.0)中,保持在37 °C恒温及100 r/min转速下进行体外释放实验。隔一定时间抽取4 mL透析袋外溶液,标记保存待测,同时往释放容器中补给4 mL相应的新鲜透析溶液。测定所收集的各组透析液在480 nm处的紫外吸收强度,可得待测溶液中DOX的浓度,再通过式(3)计算DOX累计释放量Er(%)。每组实验进行3次平行实验,实验结果取其算术平均值。
| ${E_{\rm{r}}} = \frac{{{V_{\rm{e}}}\displaystyle\sum\limits_1^{n - 1} {{C_i} + {V_0}{C_n}} }}{{{m_{{\rm{DOX}}}}}} \times 100\text{%} $ | (3) |
Ve表示透析介质替换体积(4 mL);n表示置换透析介质次数;Ci表示第i次取样时透析介质的浓度;V0表示透析介质总体积(50 mL);mDOX表示载药胶束中DOX的质量。
1.4.6 抗癌药物释放机制模型采用Ritger-Peppas释放模型(见式(4))模拟载药胶束的药物释放机制[20]。
| $\frac{{{M_t}}}{{{M_\infty }}} = k{t^n} \Leftrightarrow \lg \left(\frac{{{M_t}}}{{{M_\infty }}}\right) = n\lg t + \lg k$ | (4) |
Mt和M∞分别表示t时刻(h)和无穷时刻DOX的累计释放量;k为常数,与药物的释放速率相关;n为释放级数,反映药物的释放机制。对于球形的颗粒,n<0.43为扩散−侵蚀作用共同控制;n=0.43为Fickian扩散机制;0.43<n<0.85为扩散−溶胀共同控制的反常传输机制;n=0.85为非Fickian扩散机制。
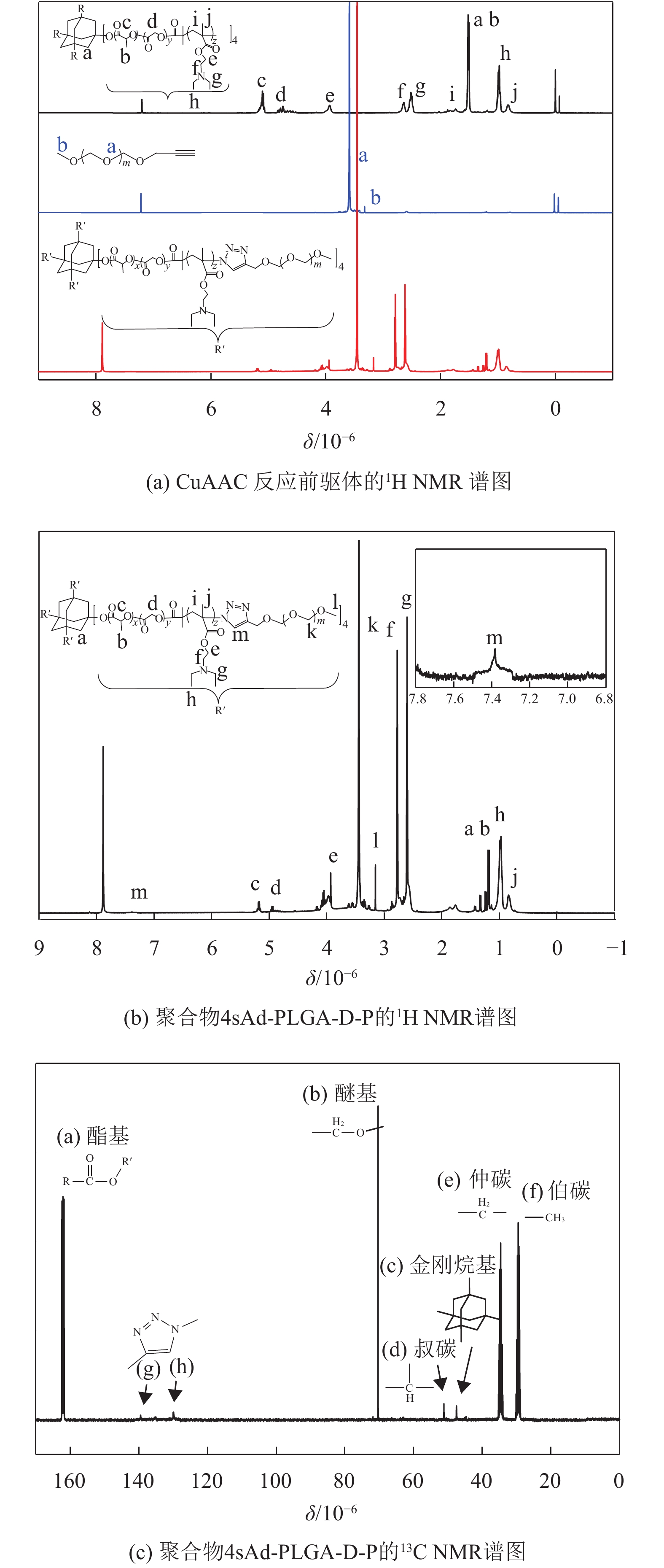
2 结果与讨论 2.1 聚合物的结构表征分别采用1H NMR和13C NMR表征聚合物的分子结构及组成。结合CuAAC反应前驱体的1H NMR谱图和聚合物的1H NMR图谱(见图2(a)),图2(b)表示各组信号峰的归属。在δ=1.25×10–6(b峰,宽重叠峰)、δ=4.99×10–6(d峰,两重峰)和δ=5.27×10–6(c峰,四重峰)处的信号峰分别为疏水链段PLGA上—CH3、—CH2—和—CH—的氢质子峰。金刚烷结构上—CH2—信号峰在δ=1.25×10–6(a峰,宽重叠峰)处,与PLGA结构中的—CH3吸收峰重叠。PDEAEMA链段中处于O原子和N原子间的—CH2CH2—信号峰在δ=2.92×10–6(f峰,三重峰)和δ=4.09×10–6(e峰,三重峰)处,而末端—CH3和—CH2—的信号峰在δ=1.10×10–6(h峰,两重峰)和δ=2.74×10–6(g峰,四重峰)处。此外,在δ=3.58×10–6(k峰,单峰)处有一组强信号峰,为mPEG主链的—CH2—氢质子峰。δ=7.38×10–6(m峰,单峰)处的一组弱质子峰是聚合物结构上1,4-二取代-1,2,3-三咪环的—CH—吸收峰,证明CuAAC反应的成功进行。
|
图 2 CuAAC反应前驱体(a)和聚合物4sAd-PLGA-D-P(b)的1H NMR谱图;聚合物4sAd-PLGA-D-P的13C NMR谱图(c) Figure 2 1H NMR spectra of the precursor (a) and 4sAd-PLGA-D-P (b), 13C NMR spectrum of 4sAd-PLGA-D-P (c) |
图2(c)为聚合物4sAd-PLGA-D-P的13C NMR谱图。δ=161.7×10–6(a峰)处的信号峰为聚合物结构中酯基的碳吸收峰;δ=70.2×10–6(b峰)处的信号峰属于醚基的碳吸收峰;δ=47.6×10–6(c峰)处的信号峰为金刚烷基团上的季碳吸收峰;δ=50.7×10–6(d峰)、δ=34.4×10–6(e峰)、δ=29.6×10–6(f峰)处的信号峰分别属于聚合物结构中的叔碳、仲碳和伯碳吸收峰;1,4-二取代-1,2,3-三唑环环上不饱和双键上碳的吸收峰在δ=129.8×10–6(h峰)和δ=140.3×10–6(g峰)处,强度较弱。结合聚合物的1H NMR和13C NMR图谱,表明聚合物4sAd-PLGA-D-P已成功合成。
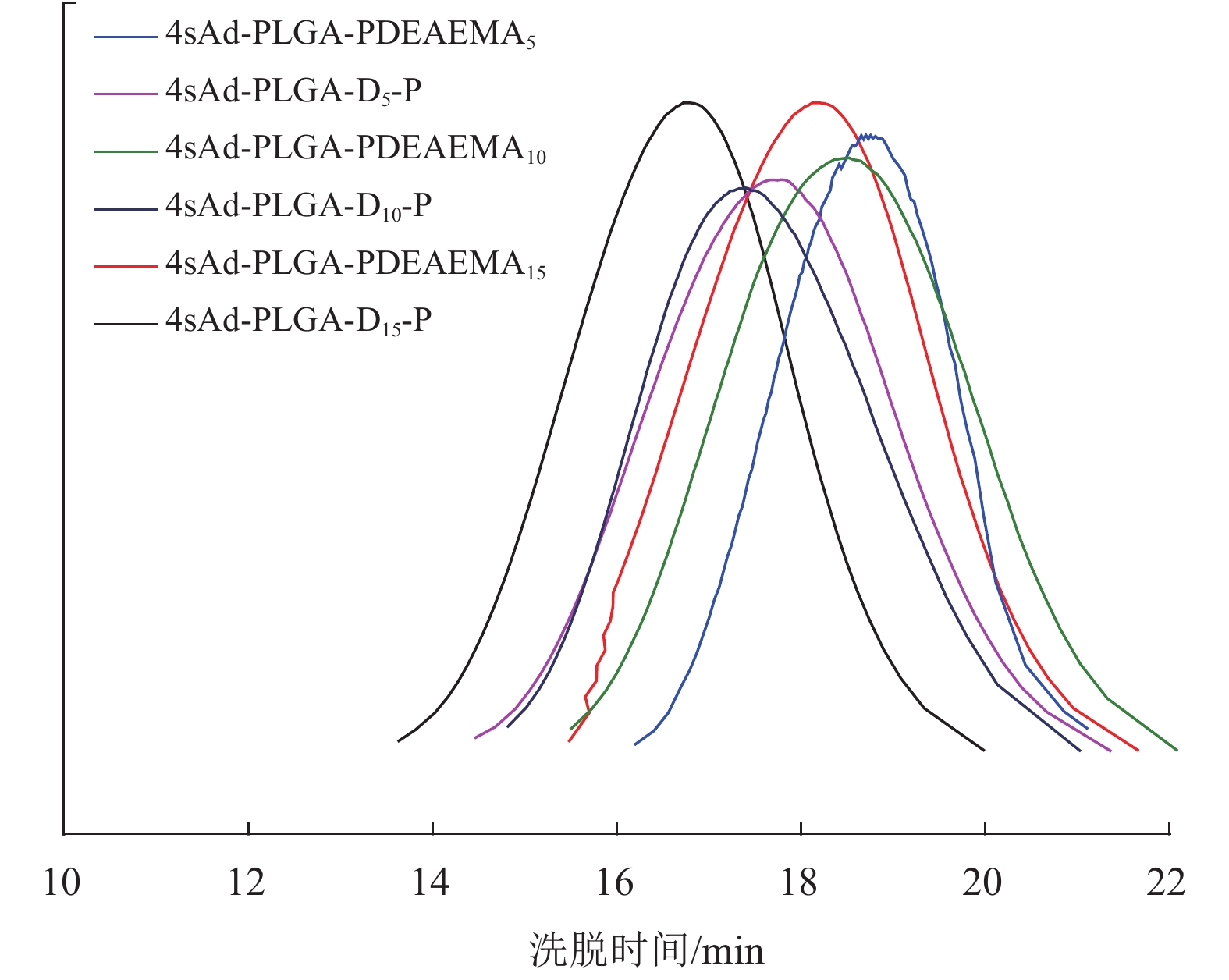
通过GPC表征聚合物4sAd-PLGA-D-P的分子量及分子量分布,结果见图3和表1。由图3可知,聚合物的分子量分布呈现对称的单峰分布,且结合表1中由GPC获得的目标聚合物分子量与理论分子量相差不大,分子量分布较窄(Mw/Mn<1.50),表明聚合反应具有良好的可控性。对比目标产物及前驱体的数均分子量,相差7 565~7 841 g/mol,说明聚(乙二醇)单甲醚(Mn=2 000)通过点击化学CuAAC反应能较好地分别接到4sAd-PLGA-PDEAEMA四臂上。
|
图 3 聚合物的GPC洗脱曲线 Figure 3 GPC traces of polymers |
| 表 1 聚合物4sAd-PLGA-D-P的分子量及其分子量分布 Table 1 Molecular weight and molecular weight distribution of 4sAd-PLGA-D-P |
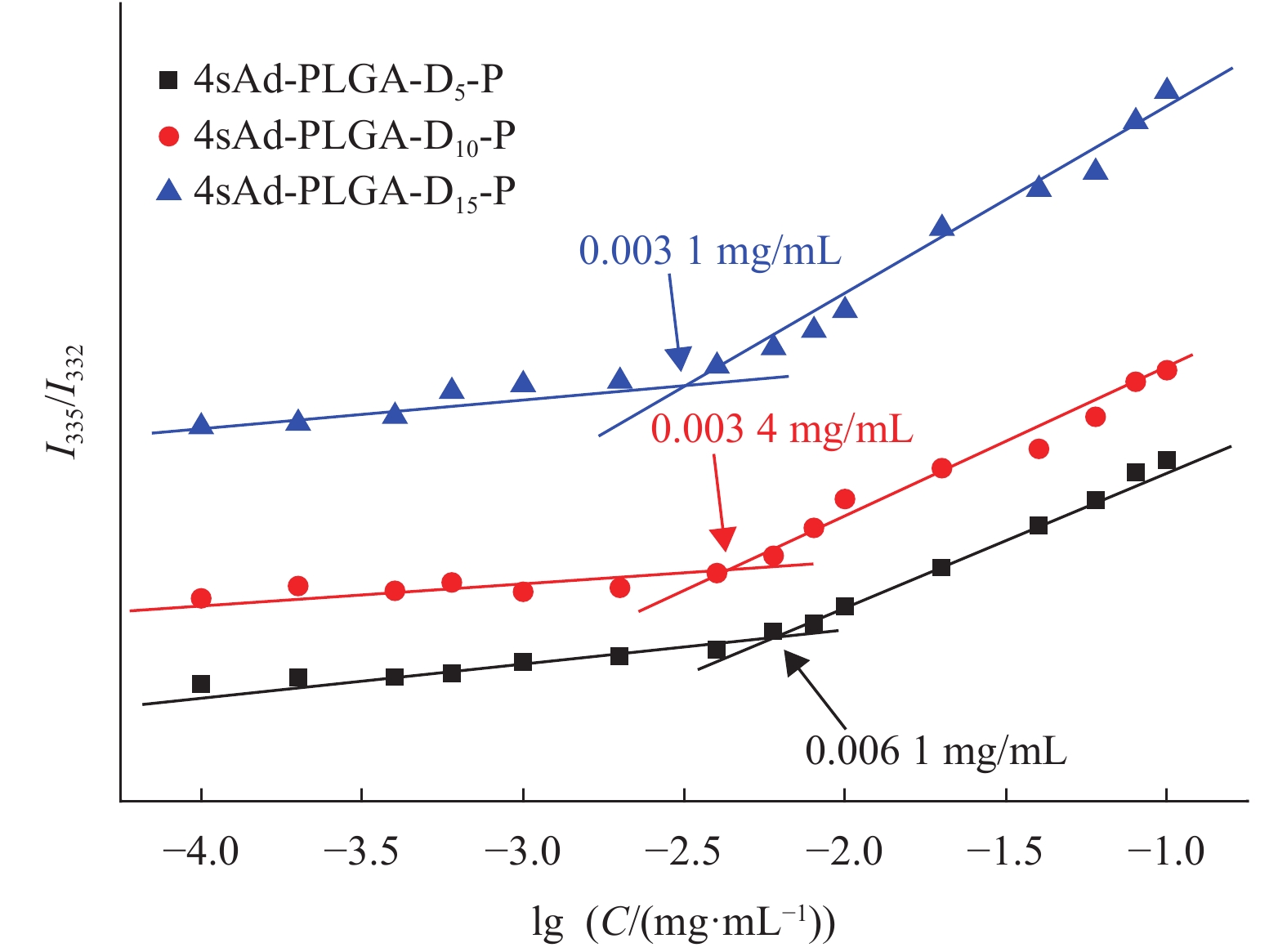
CMC值是评价聚合物胶束稳定性的一个非常重要的参数[17]。对于药物递送系统,CMC值越低,在血液循环中热力学稳定性越高,可避免由于药物递送系统不稳定造成的抗癌药物突释或提前释放[21]。从图4可看出,3种聚合物胶束均具有较低的CMC值,表现出较高的稳定性。通过对比发现,PDEAEMA的链段长度越长,相应的聚合物胶束CMC值越低,如Ad-PLGA-D15-P (0.0031 mg/mL)<Ad-PLGA-D10-P (0.0034 mg/mL)<Ad-PLGA-D5-P (0.0061 mg/mL)。这是由于在中性条件下,PDEAEMA呈现疏水性,而聚合物胶束结构中疏水性嵌段越长,有利于其降低CMC值,因此,聚合物胶束的CMC值随着PDEAEMA链段长度的增加而降低。
|
图 4 荧光激发光强度比I335/I332与聚合物胶束浓度对数关系图 Figure 4 Relationship between the intensity ratio I335/I332 and the logarithm of concentrations. |
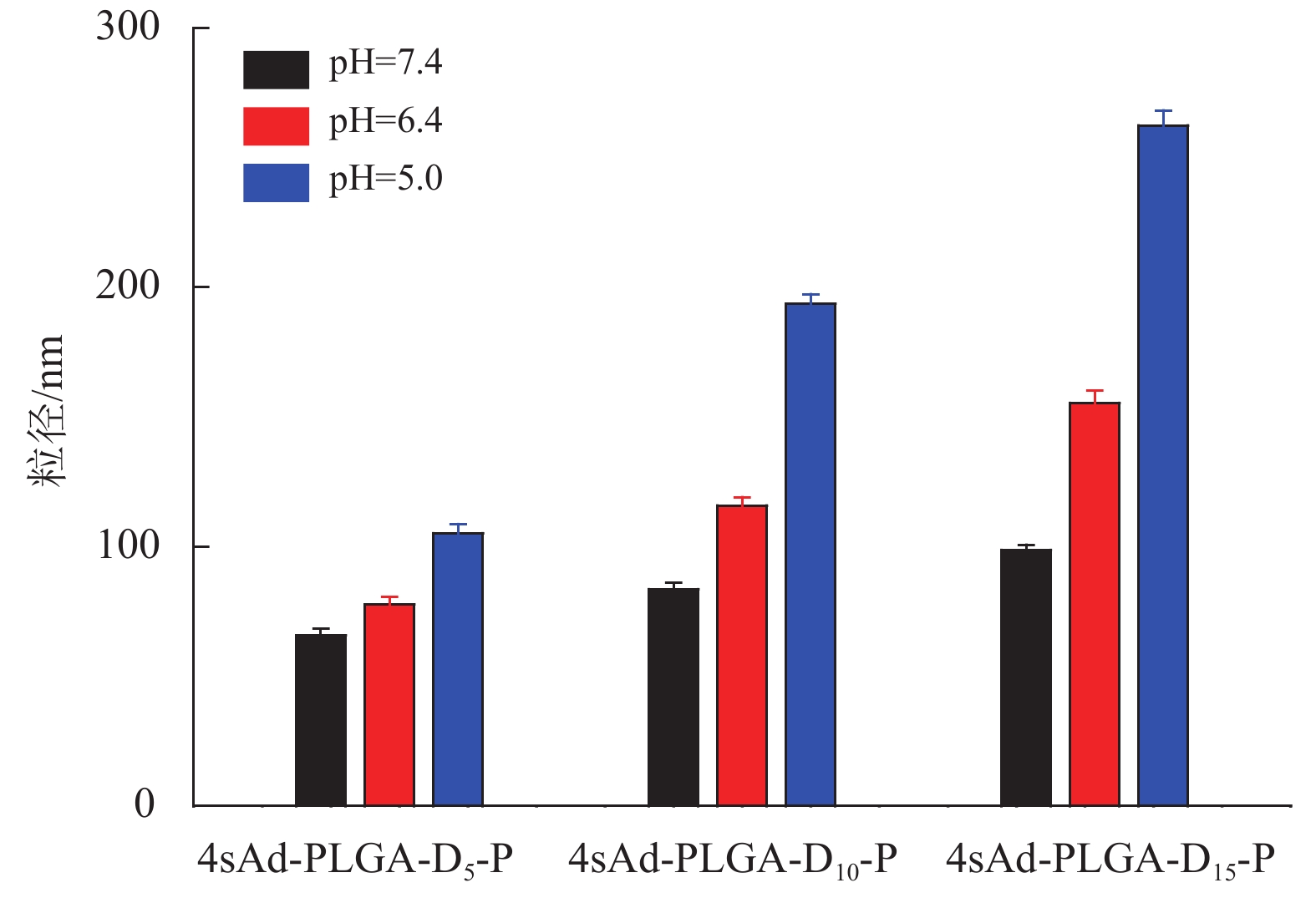
图5表示聚合物胶束在不同pH值水溶液介质中的粒径变化趋势。当pH值从7.4降低到5.0时,3种聚合物胶束的粒径均明显增大,表明聚合物胶束4sAd-PLGA-D-P具有显著的pH响应性能。这是因为PDEAEMA在中性条件下呈现疏水性,而在酸性条件下其侧链上的叔氨基发生质子化作用,PDEAEMA从疏水性向亲水性转变并延伸到水溶液中,导致聚合物胶束发生溶胀。此外,聚合物胶束中PDEAEMA链段越长,其粒径随pH值降低而增大越明显,如当pH值从7.4降低至5.0,聚合物胶束的粒径变化4sAd-PLGA-D15-P(+163.8 nm)>4sAd-PLGA-D10-P(+110 nm)>4sAd-PLGA-D5-P(+39.4 nm),表明PDEAEMA链段越长的聚合物胶束具有更好的pH响应性。图6为聚合物胶束4sAd-PLGA-D15-P分别在pH=7.4和pH=5.0条件下的TEM图,从TEM图中能更为直观地看出聚合物胶束具有pH响应性能,其粒径随着pH值的降低而增大,且在胶束外层还发现一定程度的溶胀现象。
|
图 5 pH值对聚合物胶束粒径的影响 Figure 5 Effects of pH on the particle size of polymeric micelles |

|
图 6 聚合物胶束4sAd-PLGA-D15-P在不同pH下的TEM图 Figure 6 TEM images for 4sAd-PLGA-D15-P micelle with different PH values |
以DOX为模型药物,探究聚合物胶束对抗癌药物的载药性能,采用DLS测定包载DOX后载药胶束粒径的变化情况,如表2所示。与空白聚合物胶束相比,包载DOX后载药胶束的粒径均增大。载药胶束DOX@4sAd-PLGA-D5-P和DOX@4sAd-PLGA-D10-P的粒径分别为102.9 nm和156.6 nm,粒径小于200 nm有利于载药胶束在肿瘤组织中滞留和积累(增强渗透和保留机制,EPR)[22]。但对于载药胶束DOX@4sAd-PLGA-D15-P,粒径稍大于200 nm(215.5 nm)。此外,载药胶束DOX@4sAd-PLGA-D5-P、DOX@4sAd-PLGA-D10-P和DOX@4sAd-PLGA-D15-P 的载药量分别为15.5%、22.8%和24.8%,均具有较好的载药性能,优于多数已报道的同类型四臂星状聚合物,如(聚己内酯)3-(聚甲基丙烯酸二乙氨基乙酯-b-聚乙二醇甲基丙烯酸酯)3(12.8%~19.6%)[23]、聚(乙二醇)单甲醚-b-聚β氨基酯-b-聚乳酸(16.4%)[12]等。这是由于刚性大体积分子(金刚烷基)有利于支撑聚合物骨架为药物包裹提供大的内部空间[10, 24]。聚合物胶束中pH响应嵌段PDEAEMA的链段越长,其载药性能越好,表明越长的PDEAEMA链段越有利于疏水性抗癌药物的增溶和包载作用。
| 表 2 载DOX聚合物胶束的载药量、包封率和有效粒径 Table 2 Drug loading capacity, encapsulation efficiency and particle size of DOX-loaded micelles |
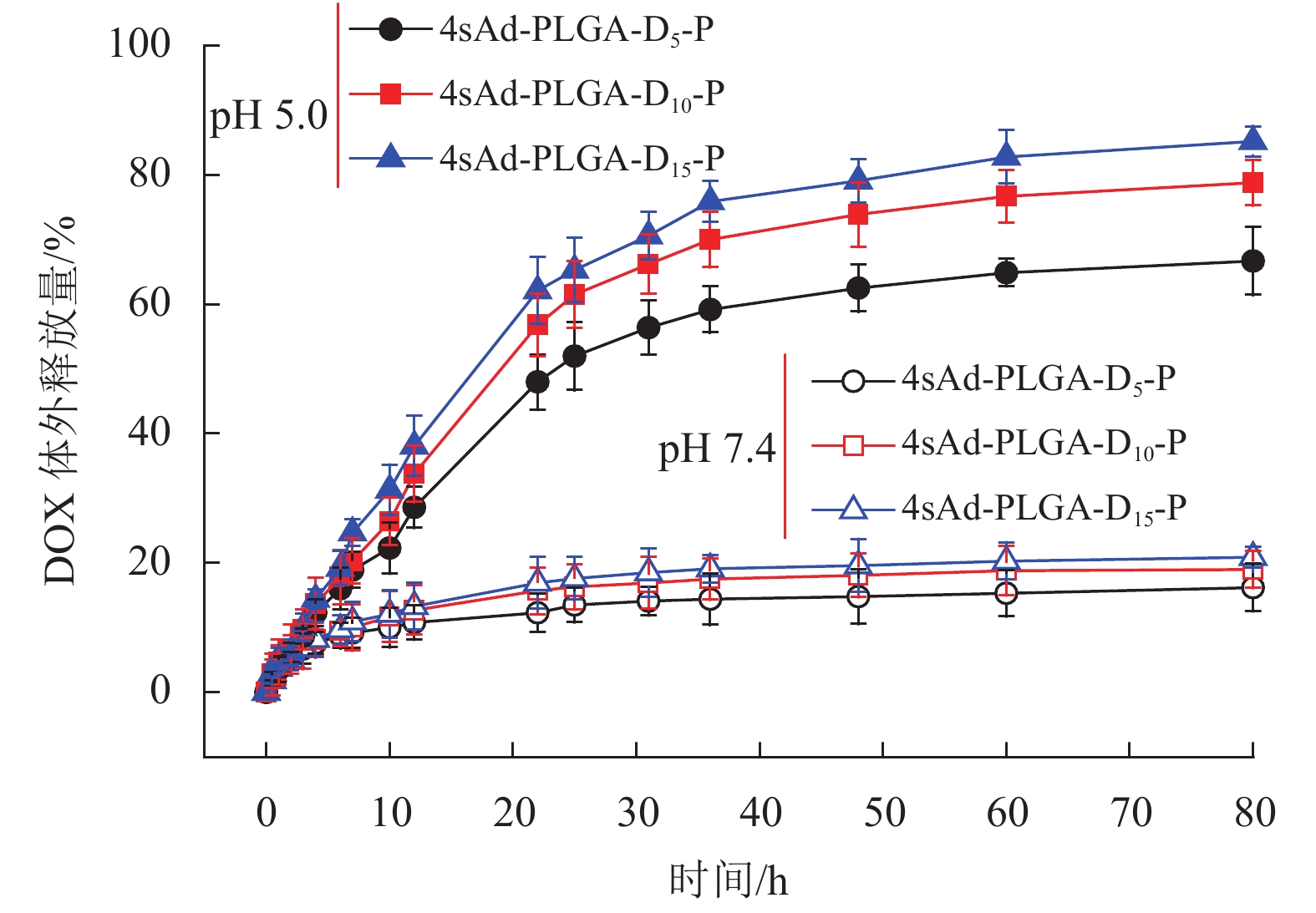
图7表示载药胶束在不同pH条件下的药物释放行为。在pH为7.4环境中,载药胶束DOX@4sAd-PLGA-D5-P、DOX@4sAd-PLGA-D10-P和DOX@4sAd-PLGA-D15-P在80 h内的DOX累计释放量仅为16.2%、19.0%和20.9%,而当pH值降低至5.0时,载药胶束释放DOX的速率显著加快,在80 h内DOX的累计释放量可分别高达66.7%,78.8%和85.2%,说明载药胶束具有明显的pH响应性能和药物控释性能。此外,PDEAEMA链段长度越长,相应的载药胶束的DOX释放量越多,DOX释放速率越快,表明较长的PDEAEMA链段有利于聚合物胶束的pH响应性能和药物控释性能。
|
图 7 载DOX聚合物胶束在不同pH条件下的DOX体外释放曲线 Figure 7 In vitro DOX release profiles of DOX-loaded micelles at different pH |
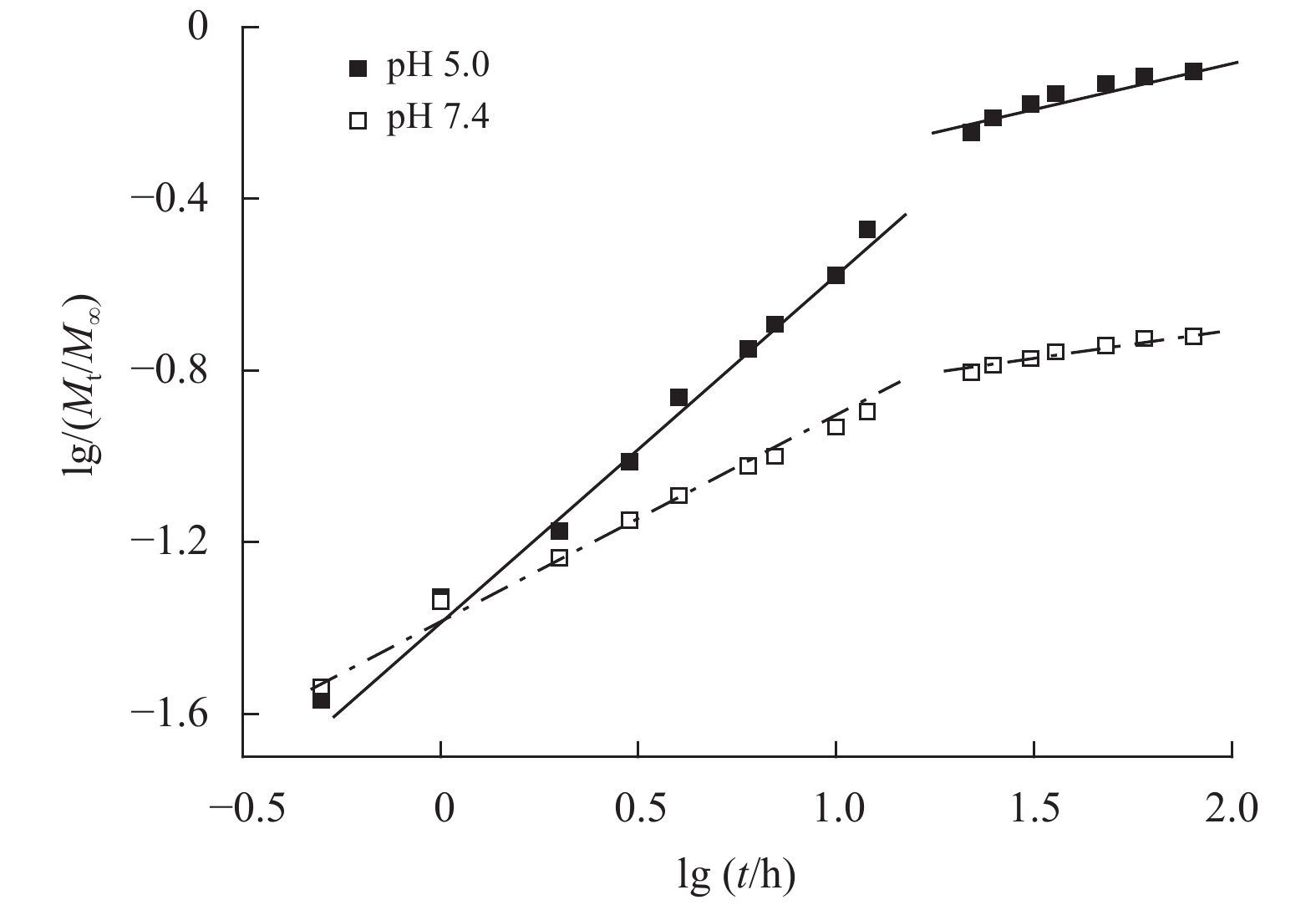
探究药物从药物递送系统中释放的过程及机制,对聚合物胶束的设计及制备具有十分重要的意义。基于Ritger-Peppas模型,对载药胶束DOX@4sAd-PLGA-D10-P的DOX释放曲线分两个阶段(0~12 h和12~80 h)进行拟合,拟合曲线见图8,拟合参数释放级数n、常数k和相关系数R2列于表3。从表3中R2可知,载药胶束在2阶段的药物释放都表现出良好的线形关系。当pH=7.4时,聚合胶束两个阶段的n值均低于0.43,说明其药物释放行为主要受扩散−侵蚀作用共同控制。当pH=5.0时,0~12 h阶段的n值为0.783 3,载药胶束的药物释放行为属于扩散−溶胀共同控制的反常传输机制,这也是由于PDEAEMA侧链叔氨基发生质子化,胶束发生溶胀行为,而在12~80 h阶段的n值小于0.43,载药胶束的释放行为主要受扩散−侵蚀作用共同控制。总体而言,载药胶束的释放行为受环境pH值的影响,在前12 h阶段,随着环境pH值的下降,载药胶束结构慢慢溶胀,其释放行为从扩散−侵蚀作用共同控制转变为扩散−溶胀共同控制的反常传输机制,而在12~80 h阶段,载药胶束的释放机制均表现为扩散−侵蚀作用共同控制。
|
图 8 载药胶束释放量的lg (Mt/M∞)对释放时间对数的拟合曲线 Figure 8 Fitting plots of lg (Mt/M∞) against lg t for DOX release data of DOX-loaded micelles |
| 表 3 DOX体外释放数据的拟合参数 Table 3 Fitting parameters of DOX release data |
结合开环聚合反应、原子转移自由基反应和点击化学CuAAC反应,合成了3种含不同比例PDEAEMA链段的聚合物4sAd-PLGA-D5-P、4sAd-PLGA-D10-P和4sAd-PLGA-D15-P,聚合物分子量为25498~30218,分子量分布窄(Mw/Mn<1.50)。该聚合物在水溶液中可自组装形成聚合物胶束,由于金刚烷基团的引入,聚合物胶束具有较好的稳定性(CMC=0.003 1~0.006 1 mg/mL)和载药性能(DOX载药量高达24.8%)。由于PDEAEMA在酸性条件下发生质子化作用,聚合物胶束表现出明显的pH响应性,当pH=7.4时,载药胶束在80 h内的DOX累计释放量仅为16.2%~24.8%,而当pH=5.0时载药胶束的DOX累计释放量明显增加,可达66.7%~85.2%,说明聚合物胶束对DOX具有可控的释放性能,可避免药物在人体血液循环过程中的突释,提高药物的生物利用率。因此,pH响应型聚合物胶束4sAd-PLGA-D-P可作为抗癌药物递送的潜在载体。
| [1] |
SHI J, KANTOFF P W, WOOSTER R, et al. Cancer nanomedicine: progress, challenges and opportunities[J].
Nature Reviews Cancer, 2017, 17: 20-37.
DOI: 10.1038/nrc.2016.108. |
| [2] |
WICKI A, WITZIGMANN D, BALASUBRAMANIAN V, et al. Nanomedicine in cancer therapy: challenges, opportunities, and clinical applications[J].
Journal of Control Release, 2015, 200: 138-57.
DOI: 10.1016/j.jconrel.2014.12.030. |
| [3] |
LI Y, LU H, LIANG S, et al. Dual stable nanomedicines prepared by cisplatin-crosslinked camptothecin prodrug micelles for effective drug delivery[J].
ACS Applied Materials & Interfaces, 2019, 11(23): 20649-20659.
|
| [4] |
CHEN Z, LIU W, ZHAO L, et al. Acid-labile degradation of injectable fiber fragments to release bioreducible micelles for targeted cancer therapy[J].
Biomacromolecules, 2018, 19: 1100-1110.
DOI: 10.1021/acs.biomac.7b01696. |
| [5] |
羊惠燕, 郭建维. 星状pH响应聚合物及其自组装胶束研究[J].
广东工业大学学报, 2019, 36(1): 81-86.
YANG H Y, GUO J W. A study of star pH-responsive polymer and its self-assembled micelles[J]. Journal of Guangdong University of Technology, 2019, 36(1): 81-86. DOI: 10.12052/gdutxb.180056. |
| [6] |
FENG J J, WEN W Q, JIA Y G, et al. pH-responsive micelles assembled by three-armed degradable block copolymers with a cholic acid core for drug controlled-release[J].
Polymers, 2019, 11(3): 511.
DOI: 10.3390/polym11030511. |
| [7] |
SONG X, WEN Y T, ZHU J L, et al. Thermoresponsive delivery of paclitaxel by β-cyclodextrin-based poly(N-isopropylacrylamide) star polymer via inclusion complexation
[J].
Biomacromolecules, 2016, 12: 2957-3963.
|
| [8] |
SONG X, ZHU J L, WEN Y T, et al. Thermoresponsive supramolecular micellar drug delivery system based on star-linear pseudo-block polymer consisting of β-cyclodextrin-poly (N-isopropylacrylamide) and adamantyl-poly(ethylene glycol)
[J].
Journal of Colloid and Interface Science, 2017, 490: 372-379.
DOI: 10.1016/j.jcis.2016.11.056. |
| [9] |
SHI X, HOU M, MA X, et al. Starburst diblock polyprodrugs: reduction-responsive unimolecular micelles with high drug loading and robust micellar stability for programmed delivery of anticancer drugs[J].
Biomacromolecules, 2019, 20: 1190-1202.
DOI: 10.1021/acs.biomac.8b01566. |
| [10] |
LI M, GUO J W, WEN W Q, et al. Biodegradable redox-sensitive star polymer nanomicelles for enhancing doxorubicin delivery[J].
Nanomaterials, 2019, 9(4): 547.
DOI: 10.3390/nano9040547. |
| [11] |
QU J, PENG S, WANG R, et al. Stepwise pH-sensitive and biodegradable polypeptide hybrid micelles for enhanced cellular internalization and efficient nuclear drug delivery[J].
Colloids and Surfaces B Biointerfaces, 2019, 181: 315-324.
|
| [12] |
XU Z, XUE P, GAO Y E, et al. pH-responsive polymeric micelles based on poly (ethyleneglycol)-b-poly(2-(diisopropylamino) ethyl methacrylate) block copolymer for enhanced intracellular release of anticancer drugs
[J].
Journal of Colloid and Interface Science, 2017, 490: 511-519.
DOI: 10.1016/j.jcis.2016.11.091. |
| [13] |
LIN W J, YAO N, QIAN L, et al. pH-responsive unimolecular micelle-gold nanoparticles-drug nanohybrid system for cancer theranostics[J].
Acta Biomaterialia, 2017, 58: 455-465.
DOI: 10.1016/j.actbio.2017.06.003. |
| [14] |
GUO X, SHI C L, YANG G. Dual-responsive polymer micelles for target-cell-specific anticancer drug delivery[J].
Chemistry of Materials, 2014, 26: 4405-4418.
DOI: 10.1021/cm5012718. |
| [15] |
MAO J, YANG L, WU T, et al. A simple dual-pH responsive prodrug-based polymeric micelles for drug delivery[J].
ACS Applied Materials & Interfaces, 2016, 8: 17109-17117.
|
| [16] |
ENGLERT J C, BRENDEL T C, MAJDANSKI T, et al. Pharmapolymers in the 21st century: synthetic polymers in drug delivery applications
[J].
Progress in Polymer Science, 2018, 87: 107-164.
DOI: 10.1016/j.progpolymsci.2018.07.005. |
| [17] |
WANG G, ZHANG L. Synthesis, self-assembly and pH sensitivity of PDEAEMA–PEG–PDEAEMA triblock copolymer micelles for drug delivery[J].
Reactive & Functional Polymers, 2016, 107: 1-10.
|
| [18] |
YANG C F, XIAO J Y, XIAO W, et al. Fabrication of PDEAEMA-based pH-responsive mixed micelles for application in controlled doxorubicin release[J].
RSC Advances, 2017, 7(44): 27564-27573.
DOI: 10.1039/C7RA04358A. |
| [19] |
YU L, XIE M, LI Z, et al. Facile construction of near-monodisperse and dual responsive polycarbonate mixed micelles with the ability of pH-induced charge reversal for intracellular delivery of antitumor drugs[J].
Journal of Materials Chemistry B, 2016, 4: 6081-6093.
DOI: 10.1039/C6TB01865C. |
| [20] |
冯静洁. 基于胆酸的两亲嵌段聚合物及其作为pH响应药物递送体系的研究[D]. 广州: 广东工业大学, 2019.
|
| [21] |
XIONG X B, BINKHATHLAN Z, MOLAVI O, et al. Amphiphilic block co-polymers: Preparation and application in nanodrug and gene delivery[J].
Acta Biomaterialia, 2012, 8(6): 2017-2033.
DOI: 10.1016/j.actbio.2012.03.006. |
| [22] |
KOBAYASHI H, WATANABE R, CHOYKE P L. Improving conventional enhanced permeability and retention (EPR) effects; what is the appropriate target?[J].
Theranostics, 2013, 4(1): 81-89.
|
| [23] |
LIN W J, NIE S, ZHONG Q, et al. Amphiphilic miktoarm star copolymer (PCL)3-(PDEAEMA-b-PPEGMA)3 as pH-sensitive micelles in the delivery of anticancer drug
[J].
Journal of Material Chemistry B, 2014, 2(25): 4008-4020.
DOI: 10.1039/c3tb21694b. |
| [24] |
SHANG Y Q, ZHENG N, WANG Z G. Tetraphenylsilane-cored star-shaped polymer micelles with pH/redox dual response and active targeting function for drug-controlled release[J].
Biomacromolecules, 2019, 20(12): 4602-4610.
DOI: 10.1021/acs.biomac.9b01472. |
 2021, Vol. 38
2021, Vol. 38

