目前随着社会进步以及老年人口比例和数量不断增多,中枢神经系统退行性疾病已成为影响人类人口健康水平和生活质量的重大社会问题。中枢神经系统退行性疾病是指一组由慢性进行性的中枢神经组织退行性变性而产生的疾病的总称。在病理上有脑或脊髓发生神经元退行变性、丢失。主要疾病包括帕金森病(Parkinson’s Disease,PD)、阿尔茨海默病(Alzheimer’s Disease,AD)、亨廷顿病(Huntington Disease,HD)、肌萎缩侧索硬化症(Amyotrophic Lateral Sclerosis,ALS)等[1]。研究表明,神经炎症贯穿神经退行性疾病的整个发病过程。在正常的生理状态下,神经炎症会有助于神经系统损伤的修复,而当炎症反应过度时,反而会造成细胞的损伤。细胞损伤时又会诱发炎症因子的释放,形成恶性循环,加速神经退行性疾病的恶化[2]。神经炎症和中枢神经系统退行性疾病密切相关,因此神经炎症的成像对认知、治疗中枢神经系统退行性疾病具有重要意义。
神经炎症的检测离不开活体成像技术,活体成像技术是指应用影像学方法,对活体生物进行组织、细胞和分子水平的定性和定量研究。活体成像技术主要分为可见光成像(Optical Imaging)、核素成像、核磁共振成像(Magnetic Resonance Imaging,MRI)、计算机断层摄影(Computed Tomography,CT)成像和超声(ultrasound)成像5大类[3]。
可见光成像有低能量、无辐射、对信号检测灵敏度高,可以实时监测标记活体生物的优势,被广泛应用到监控转基因的表达、感染的进展、肿瘤的生长和转移、病毒感染和药学研究中[4]。几种荧光显微镜技术已用于体外、体内细胞的观察,如多光子显微技术、激光显微共聚焦技术等。正电子发射断层成像技术(Positron Emission Tomography,PET)和单光子发射计算机断层成像术 (Single Photon Emission Computed Tomography,SPECT)是核医学常用的2种显像技术[5]。PET除了具有无创伤、可持续观察的优点外,还具有下列显著的优势:(1)标记的广泛性,有关生命活动的小分子、小分子药物、配体、抗体等都可以被标记;(2)绝对定量;(3)具有很高的灵敏度;(4)可获得断层及三维信息,实现较精确的定位;(5)小动物PET、SPECT可以动态地获得秒数量级的动力学资料;(6)可推广到人体[6]。其他的成像技术,如CT、MRI和超声等,虽然有较高的空间分辨率,但它们的缺点是直到组织结构出现了变化才能检测到疾病,对疾病的敏感性较低,疾病通常到了中晚期才能发现;可见光成像、核素成像则能通过分子和细胞的变化来检测到疾病,在疾病组织结构变化之前就可以通过核素成像被检测到,但这些技术也存在一些不足,如空间分辨率较低,结构信息不足等问题[7]。
1 神经炎症的标志物当神经炎症发生的时候,小胶质细胞会出现异常活化。研究表明,18KDa转运蛋白(Translocator Protein ,TSPO)、活性氧(Reactive Oxygen Species,ROS)、基质金属蛋白酶(Matrix Metalloproteinase ,MMPs)、大麻素2受体(Cannabinoid Receptor Type2,CB2)等在静息小胶质细胞中的表达很低,而在活化的小胶质细胞中却呈现高表达,这使得它们成为反映小胶质细胞活化的一种敏感而特异的定量指标[8]。在神经炎症的分子影像学研究中,以TSPO的研究最为广泛和深入。TSPO即外周苯二氮卓受体(PBR)第一亚单位,是一种18kDa疏水蛋白,主要定位于线粒体外膜,它的一个重要作用是促进胆固醇转运和新陈代谢[9]。TSPO在正常脑组织中表达水平很低,当小胶质细胞激活时,TSPO表达明显增加,是反映小胶质细胞活化的敏感的生物指标[10]。这一特性决定了其可作为检测神经炎症的靶点。近年来,研究还发现CB2、MMPs等也可以作为核素显像的靶点,但针对这些靶点的分子成像技术还有待进一步开发[11]。
2 TSPO特异性配体TSPO特异性配体主要有以下几类:异喹啉类(PK11195)、吲哚草酰胺类(IND-18)、苯氧苯基乙酰胺类(PBR28)、咪啶并吡啶类(CLINDE)、吡唑并吡啶类(VUIIS1008)、2-芳基-8-氧化嘌啉类(AC-5216),其中PK11195被公认为TSPO配体的“金标准”。但它仍存在脑渗透能力低和动力学行为高度可变等不足[12]。出于这些原因,人们后续不断开发了具有更高的亲和力、适宜的亲脂性,以及更为合适的动力学行为的TSPO配体及探针。
2.1 异喹啉类[1-(2-氯苯)-N-甲基-N-异丙基-3-异奎宁羰酰](PK11195),是第一个被证实对TSPO有高亲和性的非苯并二氮卓类化合物。鼠肾膜和(3H)PK11195的亲和性研究显示,PK11195对(3H)PK11195的Ki值为9.3 nmol/L[13]。11C-PK11195是TPSO的第一代放射性配体,其结构式如图1所示。在20世纪80年代,11C-PK11195被用作正电子发射断层扫描(PET)示踪剂以标记人和小鼠模型中的神经炎症。研究表明,虽然11C-PK11195成像提供了大量小胶质细胞活化的信息,但由于11C-PK11195的信噪比和特异性较低,且半衰期较短(20 min),11C-PK1195并不是很理想的PET示踪剂[14]。接下来,Bornhop的研究小组通过己二胺间隔物将PK11195的类似物与Lissamine-Rhodamine B染料缀合得到荧光探针(Liss-ConPK11195)[15]。乳腺癌细胞和C6胶质瘤细胞的结合研究显示Liss-ConPK11195能特异性结合TSPO。虽然在MS,AD和PD等神经系统退行性疾病中,血脑屏障受损,但至少还有部分能起作用,由于荧光探针的高分子量和高氢键电位,仍不能穿过血脑屏障。为了开发动力学行为更为合适的TSPO配体,许多构象限制的PK11195衍生物被合成出来。初步的研究显示化合物VC195与PK11195相比有更高的脑渗透性和专一性[16]。但活体评价后发现,这些衍生物并没有改进亲和性和动力学行为,因此很快被淘汰。为了获得更好的特异性结合,CiroMilite等[17]又报告了一系列喹唑啉-2-甲酰胺衍生物的研究。化合物ER176(N,N-二正己基-4-苯基喹唑啉-2-甲酰胺)是该系列中最有效的配体,其Ki值为0.7 nmol/L。尽管在结构上与异喹啉甲酰胺PK11195相似,但这些喹唑啉衍生物具有更好的药效性,与异喹啉甲酰胺有相当的亲脂性,但有更高的亲水性及水溶性。随后该课题组又开发评估了具有高特异性和有吸引力的光谱性质的新型荧光探针(化合物2,见图1)标记TSPO配体的可行性,与核素标记相比,掺入荧光探针的配体更安全、快速且更便宜地实现对TSPO成像。对生物靶标高的结合亲和力不是开发有效药理学工具和药物的唯一要求,新的证据表明,表征配体结合性能的关键因素之一是停留时间(Residence Time,RT),即配体与其靶标相互作用的时间。ER176的荧光探针的RT值为(53±7) min,表明其具有良好的药物代谢动力学特征[18]。随后评估探针在人胶质母细胞瘤细胞系U343中特异性标记TSPO的能力,探针在3 μmol/L的时候能被清晰检测到,因此,ER176探针能在U343胶质瘤细胞中特异性标记线粒体水平的TSPO。

|
图 1 异喹啉类配体及探针 Figure 1 Isoquinoline ligands and probes |
有一类采用Fischer吲哚合成法的TSPO配体,命名为2-芳基-3-吲哚乙酰胺(FGIN-1)。这些衍生物能增强类固醇的生成,而且对TSPO有极高的选择性,对甘氨酸、谷氨酸、5-羟色胺和γ-氨基丁酸等相关受体亲和性很低[19]。这类先导化合物是N,N-二正己基-2-(4-氟苯基)吲哚-3-酰胺(FGIN-1-27,见图2),对TSPO有极高的亲和性(Ki=5.0 nmol/L,用(3H)PK11195取代研究)。这类化合物的配体都比PK11195的亲脂性要高,因此,这也会影响体内代谢。Kozikowski等[20]完成了与TSPO配体连接的TSPO荧光探针的第一个实例,合成了荧光探针(化合物3,见图2),其中吲哚乙酰胺部分(即TSPO配体FGIN-1-27)通过己二胺间隔物与7-硝基苯并呋咱(NBD)染料连接。所得探针在纳摩尔水平显示出结合亲和力,并且非常接近于表征的C6-2B大鼠神经胶质瘤细胞中的PK11195的结合亲和力。已证实化合物3在受检细胞的细胞质上产生强烈的荧光斑,与TSPO的线粒体定位一致。但由于探针3的高分子量,应该不能穿过血脑屏障。在FGIN-1衍生物成功开发成为高亲和性TSPO配体之后,一系列类似物被合成出来,包括吲哚草酰胺衍生物。这类新配体大多数对TSPO显示高亲和性,其Ki值在纳摩尔和亚纳摩尔范围。这类配体中亲和性最高的是IND-18,其Ki值是0.37 nmol/L(同样条件下PK11195是9.3 nmol/L)[21],Sabrina Taliani等[22]开发了新的荧光分子探针(化合物4,见图2),能有效地区分中枢苯甲二氮卓受体,是TSPO的特异性荧光探针,有着不错的亲和力(Ki=(12±1) nmol/L)。荧光显微镜检测结果显示,探针在C6胶质瘤细胞中特异性标记了线粒体水平的TSPO。

|
图 2 吲哚草酰胺类配体及探针 Figure 2 Valeric acid amide ligands and probes |
两种苯氧苯基-乙酰胺衍生物,N-(4-氯-2-苯氧苯基)-N-(2-异丙氧苄基)乙酰胺(DAA1097,见图3)和N-(2,5-二甲氧苄基)-N-(5-氟-2-苯氧苯基)乙酰胺(DAA1106,见图3),通过打开Ro5-4864安定环产生[23]。这些配体对TSPO都有极高的选择性和亲和性,对其他神经递质、离子通道、转运体和第二信使等类型配体只有微弱的亲和性。DAA1097和DAA1106显示出抑制(3H)PK11195结合到鼠脑的线粒体IC50值分别为0.92和0.28 nmol/L(同样条件下,PK11195的IC50=1.12 nmol/L。在一项独立研究中,DAA1106在猴脑和鼠脑线粒体中评价,结果表明该配体无种属依赖性,对猴脑和鼠脑均有高的亲和性,Ki值分别为0.188和0.043 nmol/L[24]。使用3种不同的神经炎症模型直接比较脂多糖(LPS)和6-羟基多巴胺的内部纹理损伤以及创伤性脑损伤(TBI)模型,阻塞研究的结果发现差异,这表明与DAA1106相比,PK11195并未完全取代[11C]DAA1106[25]。在随后的工作中,同一研究小组通过不同的二胺间隔物(3~9个碳连接子)将DAA1106的类似物与IRDye800CW(NIR荧光染料)和Lissamine-Rhodamine B缀合,评估了间隔物长度对TSPO亲和力的影响,并且发现NIR6T和Liss6T(化合物5和6,见图3)以己二胺为间隔物有着最佳的亲和力。NIR6T和Liss6T在纳摩尔范围内显示对TSPO的结合亲和力(IC50为0.24和0.0051 μmol/L),并用于C6大鼠神经胶质瘤细胞和MDA-MB-231乳腺癌细胞的FM成像研究。与NIR6T和Liss6T一起温育的这些细胞通过FM研究显示在线粒体水平上两种药物的积累,而与游离染料(IRDye800CW酸和Lissamine-Rhodamine B磺酰氯)温育时,没有显示明显的荧光[26]。因此NIR6T和Liss6T可以被认为是FM用于TSPO成像的有前途的药物。在人类受试者研究中,[11C]DAA1106的动力学性质并不理想,随后有人尝试从芳氧基苯胺类中开发出更适宜的脑渗透性TSPO配体,合成并评估了N-(2-甲氧基苄基)-N-(4-苯氧基吡啶-3-基)乙酰胺(PBR28)。在猴脑研究中表明,[11C]PBR28有着更低的亲脂性、更有利的体内动力学,以及更高的特异性结合[27]。随后在人类受试者研究中,用[11C]PBR28验证阿尔茨海默病患者TSPO结合是否升高,TSPO结合是否与神经心理测量、灰质体积等相关。结果显示,通过增加[11C]PBR28与TSPO的结合表明神经炎症发生在轻度认知障碍转变为阿尔茨海默病后,并随着疾病进展而恶化[28]。

|
图 3 苯氧苯基乙酰胺类配体及探针 Figure 3 Phenoxyphenylacetamide ligands and probes |
咪唑并吡啶类的阿吡坦(Alpidem,见图4),其对PBR和CBR都有纳摩尔亲和性,Ki分别为0.5~7 nmol/L和1~28 nmol/L[29]。这一系列的先导化合物,N,N-二-正-丙基-2-(4-氯苯基)-6,8-二氯咪唑并吡啶-3-乙酰胺(CB34,见图4)同(3 H)PK11195一起竞争结合小鼠大脑皮层的膜蛋白,显示的IC50值为1.05 nmol/L(同样的评价中PK11195为IC50=1.43 nmol/L)[30]。通过碘苯基团取代一系列6-氯的咪唑并吡啶进行放射性标记,其中一种化合物[123I]CLINDE(见图4)用于实验性自身免疫性脑脊髓炎(EAE)大鼠的脊髓切片的离体放射自显影[31]。[123I]CLINDE在脊髓中的摄取随着疾病的严重程度增大而增加。放射性的空间分布与使用免疫组织化学检测的浸润巨噬细胞的水平一致,并且PK11195预处理可以抑制摄取的增加。后续研究结果表明,[123I]CLINDE评估GL26小鼠胶质瘤的SPECT成像的可行性,并强调了其临床胶质瘤SPECT成像的潜力[32]。

|
图 4 咪唑并吡啶类配体及探针 Figure 4 Imidazopyridine ligands and probes |
吡唑并吡啶源于咪唑并吡啶,因此结构上和阿吡坦相似,然而吡唑并吡啶类比阿吡坦对TSPO显示出高的亲和性和选择性[33]。这类中有潜力的配体为(N,N-二乙基-I-(2-(4-甲氧苯基)-5,7-二甲基-吡唑并吡啶乙酰胺(DPA-713,见图5),对TSPO的亲和力Ki达到4.7 nmol/L。DPA-713被合成出来后,紧接着在狒狒脑中进行核素标记,结果表明,狒狒中[11C]DPA-713的积累代表了与PBR的选择性结合[34]。这些特殊的体内结合特性表明[11C]DPA-713可用于在疾病状态下对TSPO成像。在此基础上开发了新的TSPO配体[18F]DPA-714(见图5),与[11C]DPA-713相比,小鼠体内代谢更慢一些,小鼠癌症和炎症的外周病变的PET成像未显示显著的病变−背景信号比率[35]。另一个课题组,在改进工作中合成另一个高效的TSPO配体(VUIIS1008,见图5),亲和力与DPA-714相比提高了36倍[36]。为了使其可视化、更经济和方便,开发了一系列具有附加FITC的新TSPO探针,通过常规光学测量和显微镜可以直接检测。最佳候选探针(化合物7,见图5)具有优异的TSPO亲和力(Ki=0.31 nmol/L)和可忽略的中心苯并二氮杂受体(CBR)活性,表现出合适的体外成像和高的靶标特异性。这是目前已报告的TSPO荧光探针的最高亲和力。在细胞成像中,进一步证实化合物7与TSPO配体PK11195结合相同的结合位点[37]。然而它们在人类体内的量化还会受到多个复杂的因素影响[38]。

|
图 5 吡唑并吡啶类配体及探针 Figure 5 Pyrazolopyridine ligands and probes |
2-芳基-8-氧化嘌啉衍生物(AOP,见图6),其典型代表是AC-5216(见图6)[39],在体外结合试验中,大鼠全脑的Ki=0.297 nmol/L、大鼠胶质细胞的IC50=3.04 nmol/L、人类胶质细胞IC50=2.73 nmol/L,对不同来源的TSPO结合能力虽有不同,但无物种依赖性[40]。进一步研究表明,AC-5216可通过刺激TSPO,增加神经甾体孕酮的合成而产生抗焦虑作用,同时没有催眠、健忘等副作用。更令人兴奋的是,AC-5216没有明显停药反弹症状,因此,AC-5216在治疗焦虑和抑郁方面是最有前景的化合物[41]。
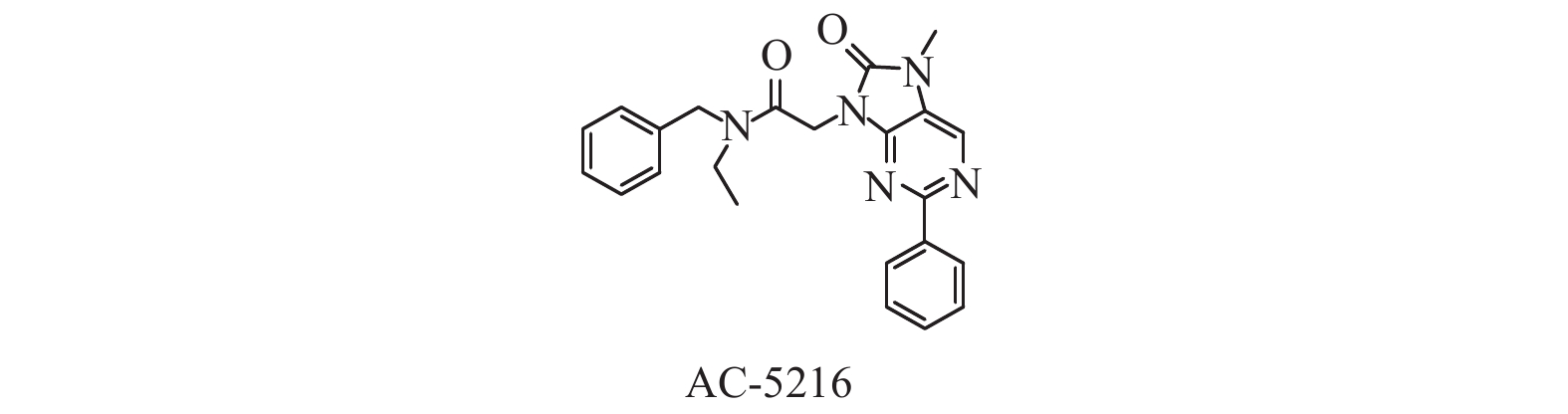
|
图 6 2-芳基-8-氧化嘌啉类配体 Figure 6 2-aryl-8-oxo porphyrin ligand |
中枢神经系统退行性疾病是当前世界上最难攻克的疾病之一,它的发病机制尚未明确,但都有一个共同的特点,伴随着神经炎症的发生。因此,神经炎症的可视化就显得尤为重要。在神经炎症的众多靶点中,TSPO的研究最为广泛与深入。本文介绍了TSPO的一些重要配体与分子探针,其中PK11195不仅作为TSPO配体的金标准,而且在抗炎症和增加中枢神经系统中神经甾体方面也有一定作用。当然,由于其活体内高亲脂性和非专一性亲和性等缺点,严重制限了PK11195的用途。吲哚草酰胺、咪唑并吡啶、苯氧苯基乙酰胺、2-芳基-8-氧化嘌啉衍生物和吡唑并吡啶类是有希望的配体,这5类配体显示出血脑屏障可渗透性、体内高的亲和性、专一性,符合活体动物脑部TSPO成像的先提条件。目前已有不少关于TSPO核素成像的文献报道,为神经炎症活体成像提供了一定的理论依据,但是基于TSPO的近红外荧光探针却未见报道,近红外探针有更好的穿透性,还具有避免体内自发荧光的干扰,更好的成像效果、更低的成本等优势,因此基于TSPO靶点的近红外荧光探针是我们日后研究的重点。TSPO作为公认的小胶质细胞活化的指标,是检测神经炎症的重要靶点之一,然而TSPO也并非检测神经炎症的唯一指标,除此之外还有MMPs[42]、CB2[43]、ROS[44]、COX2[45]、MPO[46]等靶点,在小胶质细胞活化时呈现高表达。也有研究者开发了基于这些靶点的核素探针,为神经炎症的检测扩宽了思路,对后人开发新颖的分子探针有重要的借鉴意义。
| [1] |
FREEMAN J M, MCKHANN G M. Degenerative disease of the central nervous system[J].
Advances in Pediatrics, 1969, 16(1): 121-127.
|
| [2] |
CHECK E. Nerve inflammation halts trial for Alzheimer's drug[J].
Nature, 2002, 415(6871): 462-469.
|
| [3] |
李冬梅, 万春丽, 李继承. 小动物活体成像技术研究进展[J].
中国生物医学工程学报, 2009, 28(6): 916-921.
LI D M, WAN C L, LI J C. Development of small living animal imaging technology[J]. Chinese Journal of Biomedical Engineering, 2009, 28(6): 916-921. DOI: 10.3969/j.issn.0258-8021.2009.06.021. |
| [4] |
朱淼鑫, 姚明. 小动物活体成像技术的应用[J].
中国比较医学杂志, 2011, 21(3): 1-5.
ZHU M X, YAO M. In vivo imaging technology in small animal[J]. Chinese Journal of Comparative Medicine, 2011, 21(3): 1-5. DOI: 10.3969/j.issn.1671.7856.2011.03.001. |
| [5] |
周伟, 尹端沚, 汪勇先. 小动物PET[J].
核技术, 2006, 29(3): 207-213.
ZHOU W, YI D Z, WANG Y X. Small animal PET[J]. Nuclear Techniques, 2006, 29(3): 207-213. DOI: 10.3321/j.issn:0253-3219.2006.03.011. |
| [6] |
HAGOOLY A, ROSSIN R, WELCH M J. Small molecule receptors as imaging targets[J].
Handbook of Experimental Pharmacology, 2008, 185(2): 93-102.
|
| [7] |
FRANC B L, ACTON P D, MARI C, et al. Small-animal SPECT and SPECT/CT: important tools for preclinical investigation[J].
Journal of Nuclear Medicine, 2008, 49(10): 1651-1663.
DOI: 10.2967/jnumed.108.055442. |
| [8] |
LEE H, VILLACRESES N E, RAPOPORT S I, et al. In vivo imaging detects a transient increase in brain arachidonic acid metabolism: a potential marker of neuroinflammation[J].
Journal of Neurochemistry, 2010, 91(4): 936-945.
|
| [9] |
ALAM MM, LEE J, LEE S Y. Recent progress in the development of TSPO PET ligands for neuroinflammation imaging in neurological diseases[J].
Nuclear Medicine & Molecular Imaging, 2017, 51(4): 1-14.
|
| [10] |
VASSILIOS P, LAURENT L. Translocator protein (18 kDa) TSPO: an emerging therapeutic target in neurotrauma[J].
Experimental neurology, 2009, 219(1): 283-294.
|
| [11] |
HERMANN S, STARSICHOVA A, WASCHKAUB, et al. Non-FDG imaging of atherosclerosis: will imaging of MMPs assess plaque vulnerability[J].
Journal of nuclear cardiology, 2012, 19(3): 609-617.
DOI: 10.1007/s12350-012-9553-6. |
| [12] |
TURKHEIMER F E, EDISON P, PAVESE N, et al. Reference and target region modeling of [11C]-(R)-PK11195 brain studies
[J].
Journal of Nuclear Medicine, 2007, 48(1): 158-167.
|
| [13] |
KUMAR A, MUZIK O, SHANDAL V, et al. Evaluation of age-related changes in translocator protein (TSPO) in human brain using 11 C-[R]-PK11195 PET[J].
Journal of Neuroinflammation, 2012, 9(1): 232-235.
|
| [14] |
AURELIJA J. Kinetic analysis and test-retest variability of the radioligand[C] (R)-PK11195 binding to TSPO in the human brain-a PET study in control subjects[J].
Ejnmmi Research, 2012, 2(1): 11-15.
DOI: 10.1186/2191-219X-2-11. |
| [15] |
MANNING H C, SMITH S M, SEXTON M, et al. A peripheral benzodiazepine receptor targeted agent for in vitro imaging and screening[J].
Bioconjugate Chemistry, 2006, 17(3): 735-740.
DOI: 10.1021/bc060020b. |
| [16] |
MATARRESE M, MORESCO R M, CAPPELLI A, et al. Labeling and evaluation of N-[11C]methylated quinoline-2-carboxamides as potential radioligands for visualization of peripheral benzodiazepine receptors
[J].
Journal of Medicinal Chemistry, 2001, 44(4): 579-585.
DOI: 10.1021/jm001004h. |
| [17] |
ZANOTTIF P, ZHANG Y, JENKO K J, et al. Synthesis and evaluation of translocator 18 kDaprotein (TSPO) positron emissiontomography (PET) radioligands with low binding sensitivity to human single nucleotide polymorphism rs6971[J].
ACS Chemical Neuroscience, 2014, 5(10): 963-971.
DOI: 10.1021/cn500138n. |
| [18] |
MILITE C, BARRESI E, DA P E, et al. Exploiting the 4-phenylquinazoline scaffold for the development of high affinity fluorescent probes for the translocator protein (TSPO)[J].
Journal of Medicinal Chemistry, 2017, 11(5): 283-289.
|
| [19] |
ROMEO E, AUTA J, KOZIKOWSKI A P, et al. 2-Aryl-3-indoleacetamides (FGIN-1): a new class of potent and specific ligands for the mitochondrial DBI receptor (MDR)[J].
Journal of Pharmacology & Experimental Therapeutics, 1992, 262(3): 971-985.
|
| [20] |
KOZIKOWSKI A P, KOTOULA M, MA D, et al. Synthesis and biology of a 7-nitro-2,1,3-benzoxadiazol-4-yl derivative of 2-phenylindole-3-acetamide: a fluorescent probe for the peripheral-type benzodiazepine receptor[J].
Journal of Medicinal Chemistry, 1997, 40(16): 2435-2439.
DOI: 10.1021/jm970220w. |
| [21] |
PRIMOFIORE G, SETTIMO F D, TALIANI S, et al. N, N-Dialkyl-2-phenylindol-3-ylglyoxylamides, a new class of potent and selective ligands at the peripheral renzodiazepine receptor[J].
Journal of Medicinal Chemistry, 2004, 47(7): 1852-1855.
DOI: 10.1021/jm030973k. |
| [22] |
TALIANI S, SIMORINI F, SERGIANNI V, et al. New fluorescent 2-phenylindolglyoxylamide derivatives as probes targeting the peripheral-type benzodiazepine receptor? Design, synthesis, and biological evaluation[J].
Journal of Medicinal Chemistry, 2007, 50(2): 404-407.
DOI: 10.1021/jm061137o. |
| [23] |
OKUBO T, YOSHIKAWA R, CHAKI S, et al. Design, synthesis and structure–affinity relationships of aryloxyanilide derivatives as novel peripheral benzodiazepine receptor ligands[J].
Bioorganic & Medicinal Chemistry, 2004, 12(2): 423-438.
|
| [24] |
PROBST K C, IZQUIERDO D, BIRD J. Strategy for improved[C]DAA1106 radiosynthesis and in vivo peripheral benzodiazepine receptor imaging using microPET, evaluation of[C]DAA1106[J].
Nuclear Medicine & Biology, 2007, 34(4): 439-446.
|
| [25] |
MAEDA J, SUHARA T, ZHANG M R, et al. Novel peripheral benzodiazepine receptor ligand[11C]DAA1106 for PET: an imaging tool for glial cells in the brain
[J].
Synapse, 2004, 52(4): 283-291.
DOI: 10.1002/syn.20027. |
| [26] |
LAQUINTANA V, DENORA N, LOPEDOTA A, et al. N-Benzyl-2-(6,8-dichloro-2-(4-chlorophenyl)imidazo[1,2-a]pyridin-3-yl)-N-(6-(7-nitrobenzo[c][1,2,5]oxadiazol-4-ylamino) hexyl) acetamide as a new fluorescentprobe for peripheral benzodiazepine receptor and microglial cell visualization[J].
Bioconjugate Chemistry, 2007, 18(5): 1397-1407.
DOI: 10.1021/bc060393c. |
| [27] |
BROWN A K, FUJITA M, FUJIMURA Y, et al. Radiation dosimetry and biodistribution in monkey and man of[11C]-PBR28: A PET radioligand to image inflammation
[J].
Journal of Nuclear Medicine, 2007, 48(12): 2072-2079.
DOI: 10.2967/jnumed.107.044842. |
| [28] |
AKSHAY N, MATTIA V, XU X. Test-retest analysis of a non-invasive method of quantifying[11C]-PBR28 binding in Alzheimer’s disease
[J].
Ejnmmi Research, 2016, 6(1): 72-79.
DOI: 10.1186/s13550-016-0226-3. |
| [29] |
SELLERI S, BRUNI F, COSTAGLI C, et al. 2-Arylpyrazolo[1,5-a] pyrimidin-3-yl acetamides. New potent and selective peripheral benzodiazepine receptor ligands[J].
Bioorganic & Medicinal Chemistry, 2001, 9(10): 2661-2671.
|
| [30] |
LATROFA A, TRAPANI G, FRANCO M, et al. Synthesis of the[3H] labelled potent and selective peripheral benzodiazepine receptor ligand CB 34
[J].
Journal of Labelled Compounds & Radiopharmaceuticals, 2001, 44(7): 521-528.
|
| [31] |
MATTNER F, KATSIFIS A, STAYKOVA M, et al. Evaluation of a radiolabelled peripheral benzodiazepine receptor ligand in the central nervous system inflammation of experimental autoimmune encephalomyelitis: a possible probe for imaging multiple sclerosis[J].
European Journal of Nuclear Medicine & Molecular Imaging, 2005, 32(5): 557-563.
|
| [32] |
JENSEN P, FENG L, LAW I, et al. TSPO imaging in glioblastoma multiforme: A direct comparison between[123I]-CLINDE SPECT, [18F]-FET PET, and gadolinium-enhanced MR imaging
[J].
Journal of Nuclear Medicine Official Publication Society of Nuclear Medicine, 2015, 56(9): 1386-1390.
|
| [33] |
FOSS C A, HARPER J S, WANG H, et al. Noninvasive molecular imaging of tuberculosis-associated inflammation with radioiodinated DPA-713[J].
Journal of Infectious Diseases, 2013, 208(12): 2067-2074.
DOI: 10.1093/infdis/jit331. |
| [34] |
JAMES M L, FULTON RR, VERCOULLIE J, et al. DPA-714, a new translocator protein-specific ligand: synthesis, radiofluorination, and pharmacologic characterization[J].
Journal of Nuclear Medicine Official Publication Society of Nuclear Medicine, 2008, 49(5): 814-822.
|
| [35] |
SARDAML, ALSACJM, BOISGARD R, et al. Comparison of 18F-fluoro-deoxy-glucose, 18F-fluoro-methyl-choline, and[18F]-DPA714 for positron-emission tomography imaging of leukocyte accumulation in the aortic wall of experimental abdominal aneurysms
[J].
Journal of Vascular Surgery, 2012, 56(3): 765-773.
DOI: 10.1016/j.jvs.2012.01.069. |
| [36] |
TANG D, MCKINLEY E T, HIGHT M R, et al. Synthesis and structure–activity relationships of 5,6,7-substituted pyrazolopyrimidines: discovery of a novel TSPO PET ligand for cancer imaging[J].
Journal of Medicinal Chemistry, 2013, 56(8): 165-173.
|
| [37] |
LI J, SMITH J A, DAWSON E S, et al. Optimized translocator protein ligand for optical molecular imaging and screening[J].
Bioconjugate Chemistry, 2017, 28(4): 1016-1023.
DOI: 10.1021/acs.bioconjchem.6b00711. |
| [38] |
ENDRES C J, POMPER M G, JAMES M, et al. Initial evaluation of[11C]-DPA-713, a novel TSPO PET ligand, in humans
[J].
Journal of Nuclear Medicine, 2009, 50(8): 1276-1282.
DOI: 10.2967/jnumed.109.062265. |
| [39] |
KITA A, KOHAYAKAWA H, KINOSHITA T, et al. Antianxiety and antidepressant-like effects of AC-5216, a novel mitochondrial benzodiazepine receptor ligand[J].
British Journal of Pharmacology, 2004, 142(7): 1059-1072.
DOI: 10.1038/sj.bjp.0705681. |
| [40] |
ZHANG M R, KUMATA K, MAEDA J, et al. [11C]-AC-5216: A novel PET ligand for peripheral benzodiazepine receptors in the primate brain
[J].
Journal of Nuclear Medicine, 2007, 48(11): 1853-1861.
DOI: 10.2967/jnumed.107.043505. |
| [41] |
RUPPRECHT R, RAMMES G, ESER D, et al. Translocator protein (18 kD) as target for anxiolytics without benzodiazepine-like side effects[J].
Science, 2009, 325(5939): 490-493.
DOI: 10.1126/science.1175055. |
| [42] |
WAGNER S, BREYHOLZ H J, HÖLTKE C, et al. A new 18F-labelled derivative of the MMP inhibitor CGS 27023A for PET: radiosynthesis and initial small-animal PET studies
[J].
Applied Radiation & Isotopes Including Data Instrumentation & Methods for Use in Agriculture Industry & Medicine, 2009, 67(4): 606-610.
|
| [43] |
HAIDER A, SPINELLI F, HERDE A M, et al. Evaluation of 4-oxo-quinoline-based CB2 PET radioligands in R6/2 chorea huntington mouse model and human ALS spinal cord tissue[J].
European Journal of Medicinal Chemistry, 2018, 14(5): 746-752.
|
| [44] |
CHU W, CHEPETAN A, ZHOU D, et al. Development of a PET radiotracer for noninvasive imaging of the reactive oxygen species, superoxide, in vivo[J].
Organic & Biomolecular Chemistry, 2014, 12(25): 4421-4431.
|
| [45] |
PRABHAKARAN J, MAJO V J, SIMPSON N R, et al. Synthesis of[11C] celecoxib: a potential PET probe for imaging COX‐2 expression
[J].
Journal of Labelled Compounds & Radiopharmaceuticals, 2005, 48(12): 887-895.
|
| [46] |
BRECKWOLDT M O, CHEN J W, STANGENBERG L, et al. Tracking the inflammatory response in stroke in vivo by sensing the enzyme myeloperoxidase[J].
Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(47): 185-189.
|
 2020, Vol. 37
2020, Vol. 37

