2. 广东工业大学 轻工化工学院,广东 广州 510006
2. School of Chemical Engineering and Light Industry, Guangdong University of Technology, Guangzhou 510006, China
亚甲基蓝作为一种常见的水体污染物,其带来的环境污染问题越来越严重.因此,制备一种高效去除亚甲基蓝的催化剂显得尤为必要.二氧化锰作为一种多功能的过渡金属氧化物,由于其特殊的物理化学性质被广泛应用于催化领域.
锰的化合物价格低廉并且无毒,锰的化合物一般有+2,+3和+4价,一般+4价的二氧化锰是最为常见的锰氧化合物.锰氧化合物的晶型结构很多,已知结构的锰氧化合物就多达30多种,但它们的组成结构单元均为[MnO6]八面体.
MnO2存在多种晶型,例如α-,β-,γ-,δ-和ε-形式,基本单元锰氧八面体的连接方式不同[1-2],各自具有独特的性质,被广泛应用在催化剂[3-5]、磁性材料[6-8]、Li/MnO2电池[9]、电极材料[10]、超级电容器[11-13]、水处理[14-15]等领域.
合成ε-MnO2的报道仍然较少[16].Dandan Han[17]等人在室温下通过温和的化学方法制备了中空的ε-MnO2微球,实验结果表明中空ε-MnO2微球作为电极材料在高性能超级电容器领域具有潜在的应用价值.Fengjuan Shi等[18]利用水热法制备了花状六方ε-MnO2,其比表面积为30m2/g,在229℃下对甲苯的催化转化率高达90%.Yankuan Liu等[8]通过热分解Mn(NO3)2可控地合成出超顺磁性的ε-MnO2纳米线,在磁性材料领域具有广阔的应用前景.Peng Yu等[19]通过溶剂热法,以Mn(NO3)2和C2H5NO2为原料合成了ε-MnO2纳米颗粒,将其应用于超级电容器,比电容量相当高.
到目前为止,对亚甲基蓝的脱色研究仍然较少.Cao等[15]制备的核壳结构γ-MnO2/α-MnO2材料对亚甲基蓝的脱色率仅为85%,脱色率不高;而Cheng等[20]制备的β-MnO2材料对亚甲基蓝的脱色率为90%,脱色率有所提高,但反应条件较为苛刻.本文采用卵状MnCO3前驱体焙烧制得的卵状ε-MnO2,在室温条件下对亚甲基蓝的降解具有较高活性,脱色率达92%,不仅反应条件温和,同时脱色率更高.
1 实验部分 1.1 材料与仪器试剂:高锰酸钾、葡萄糖、酒石酸、亚甲基蓝、过氧化氢,以上试剂均为分析纯.
仪器:磁力搅拌器,离心机,反应釜,烘箱,马弗炉,扫描电子显微镜(型号:FEI Quanta 650,配备英国Oxford instrument INCA350 X-Max50能谱仪),X射线衍射分析仪(型号:Ultima Ⅲ,生产厂家:日本理学公司),紫外可见分光光度计(型号:UV-2800A,生产厂家:日本日立公司),比表面测定仪(型号:ASAP-2020,生产厂家:日本日立公司).
1.2 测试条件X射线衍射分析:CuKα辐射,波长λ为0.1542 nm,管电压40 kV,管电流40 mA,扫描步长0.02°/min,扫描角度范围10°~80°,扫描速度4°/min.
紫外分析:测试范围为800~400 nm-1,扫描精度为1 nm.
1.3 卵状ε-MnO2的合成往反应釜中加入2 mmol高锰酸钾、3 mmol葡萄糖、1 mmol酒石酸,磁力搅拌至澄清,然后将反应釜置于烘箱中,180℃下反应8 h,收集黑褐色沉淀,用无水乙醇和去离子水各洗涤3次,最后将产物于烘箱中烘干.
将卵状MnCO3前驱体在马弗炉中于500℃下焙烧8 h得到卵状ε-MnO2.
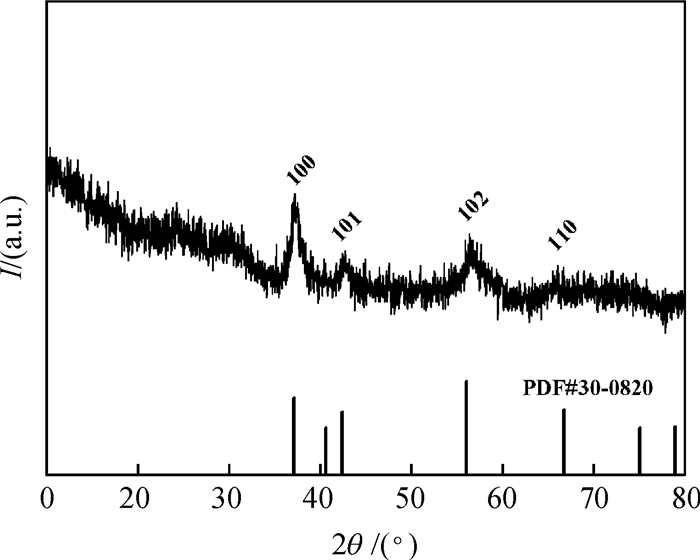
2 结果与讨论 2.1 X射线衍射分析由图 1可知,MnCO3经过焙烧后出现ε-MnO2的4个强的特征衍射峰,分别对应(100)、(101)、(102) 和(110) 晶面,与PDF卡片30-0820吻合,证明该物质确实为ε-MnO2.
|
图 1 卵状ε-MnO2的XRD图谱 Figure 1 XRD pattern of ellipsoid-like ε-MnO2 |
由图 2可知,本文通过简单的前驱体焙烧法制备出了卵状ε-MnO2,该卵状ε-MnO2形貌规整,粒度均匀,卵状ε-MnO2的粒径约为2 μm.比表面积测试结果显示,该卵状ε-MnO2的比表面积为88 m2/g.

|
图 2 卵状ε-MnO2扫描电镜照片 Figure 2 SEM of ellipsoid-like ε-MnO2 |
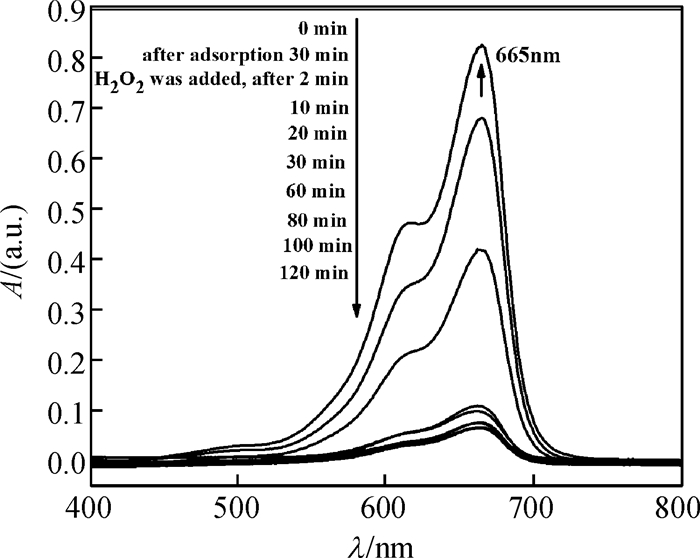
在250 mL烧杯中加入90 mL质量浓度为10 mg/L的亚甲基蓝溶液,取第一个样;再加入10 mg催化剂,在磁力搅拌器上搅拌吸附30 min,取第二个样;往烧杯中加入10 mL H2O2后开始计时,2 min时取第三个样,然后在10 min,20 min,30 min等时间各取一次样,最后测样品的紫外光谱.
以亚甲基蓝的最大特征吸收峰λmax=665 nm的强度变化来判断溶液浓度的变化,由图 3可知,加入卵状ε-MnO2吸附30 min后对亚甲基蓝的脱色率仅为17.4%,脱色效果不明显;当加入H2O2后,仅2 min,脱色率为49.5%,λmax=662 nm;10 min后脱色率为86.6%,亚甲基蓝的特征吸收峰强度迅速减弱,同时最大吸收峰发生蓝移,吸收峰变宽,证明催化降解过程的发生.亚甲基蓝分子和H2O2吸附到催化剂表面,接着H2O2在催化剂表面分解产生· OH,·OH自由基进攻亚甲基蓝分子,降解成CO2、H2O和其他小分子,与文献[3-4]报道的相似.随着催化降解时间的延长,在2~100 min时间段,由于亚甲基蓝发生降解,导致最大吸收峰发生蓝移,λmax从665 nm移向662 nm和663 nm,吸收峰逐渐变宽;在120 min时,λmax红移回665 nm,说明催化降解过程趋于终止.
|
图 3 卵状ε-MnO2不同作用时间下亚甲基蓝的紫外光谱 Figure 3 UV-Vis spectrogram of methylene blue with different acting time by ellipsoid-like ε-MnO2 |
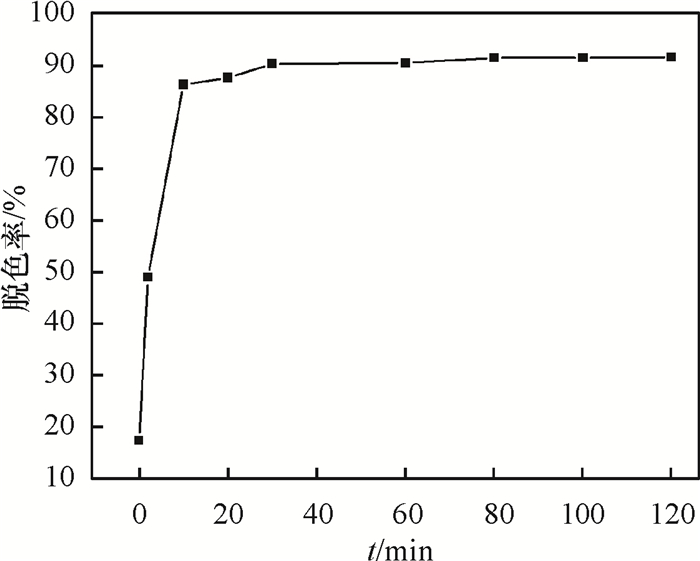
由图 4可知,120 min时卵状ε-MnO2对亚甲基蓝的脱色率可高达92%,说明卵状ε-MnO2对亚甲基蓝具有显著的催化降解效果.
|
图 4 卵状ε-MnO2不同作用时间下对亚甲基蓝的脱色率 Figure 4 Degree of decoloration of methylene blue with different acting time by ellipsoid-like ε-MnO2 |
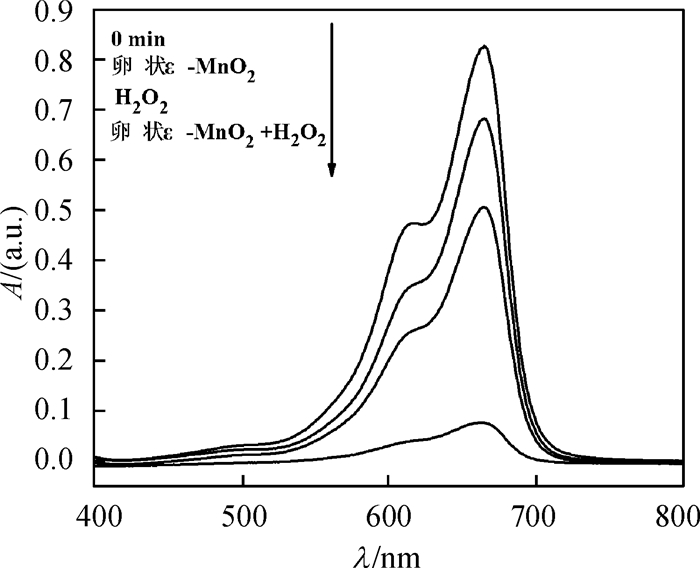
由图 5可知,只加入催化剂ε-MnO2时仅发生物理吸附,脱色率仅为17.7%;只加入氧化剂H2O2,但不加入催化剂时,脱色率为38.8%,亚甲基蓝发生少量降解,但脱色效果不明显;而当同时加入催化剂卵状ε-MnO2和氧化剂H2O2时,脱色率高达91%,亚甲基蓝在催化剂的作用下发生大量氧化降解,脱色效果很明显.
|
图 5 不同物质作用30 min时亚甲基蓝的紫外光谱 Figure 5 UV-Vis spectrogram of methylene blue with different reactants by 30 min |
在卵状ε-MnO2对亚甲基蓝的脱色过程中,包含吸附和催化降解两种过程,其中催化降解是主要的.吸附的原理是ε-MnO2在接近中性的溶液中表面富含羟基[21],表面带负电的羟基和亚甲基蓝带正电的基团(R-S+)之间具有强静电吸引;另一种除去亚甲基蓝的机理是ε-MnO2表面的羟基和亚甲基蓝的N原子间形成了氢键.ε-MnO2具有很高的比表面积,在某种程度上加强了对溶剂的截留和隔离,有利于亚甲基蓝分子更有效地运输到主要的活性部位,因此增强了样品的吸附能力[21].催化降解的原理是亚甲基蓝分子可能经历了吸附→氧化→脱附过程[4, 21],首先亚甲基蓝分子和H2O2吸附到催化剂表面,接着H2O2在催化剂表面分解产生·OH,·HOO,·
本文采用水热法可控地制备了卵状MnCO3,通过简单的焙烧MnCO3前驱体制得了卵状ε-MnO2.制得的卵状ε-MnO2催化剂的比表面积为88 m2/g.将制得的卵状ε-MnO2催化剂应用于亚甲基蓝的催化降解,室温条件下,在H2O2存在下,卵状ε-MnO2对亚甲基蓝的脱色率为92%,表现出在室温下催化降解亚甲基蓝的高催化活性.
| [1] | LI S H, LIU Q H, QI L, et al. Progress in research on manganese dioxide electrode materials for electrochemical capacitors[J]. Chin J Anal Chem, 2012, 40(3): 339-346. DOI: 10.1016/S1872-2040(11)60534-3. |
| [2] | WANG H E, QIAN D. Synthesis and electrochemical properties of α-MnO2 microspheres[J]. Mater Chem Phys, 2008, 109(2-3): 399-403. DOI: 10.1016/j.matchemphys.2007.12.008. |
| [3] | CUI H J, HUANG H Z, FU M L, et al. Facile synthesis and catalytic properties of single crystalline β-MnO2 nanorods[J]. Catal Commun, 2011, 12(14): 1339-1343. DOI: 10.1016/j.catcom.2011.05.013. |
| [4] | YU C, LI G., WEI L, et al. Fabrication, characterization of β-MnO2 microrod catalysts and their performance in rapid degradation of dyes of high concentration[J]. Catal Today, 2014, 224(1): 154-162. |
| [5] |
符志伟, 程高, 林婷, 等. 二氧化锰制备及催化燃烧甲苯性能研究[J].
广东工业大学学报, 2016, 33(2): 85-90.
FU Z W, CHENG G, LIN T, et al. The preparation of MnQ2 and application in catalytic combustion of toluene[J]. Journd of Guangdong Universiy of Technology, 2016, 33(2): 85-90. |
| [6] | AN K, PARK M, YU J H. Synthesis of uniformly sized manganese oxide nanocrystals with various sizes and shapes and characterization of their T1 magnetic resonance relaxivity[J]. Eur J Inorg Chem, 2012, 12(3): 2148-2155. |
| [7] | GE J C, ZHUO L, YANG F, et al. One-dimensional hierarchical layered KxMnO2(x < 0.3) nanoarchitectures: Synthesis, characterization, and their magnetic properties[J]. J Phys Chem B, 2006, 110(36): 17854-17859. DOI: 10.1021/jp0631127. |
| [8] | LIU Y, WANG H, ZHU Y C, et al. Pyrolysis synthesis of magnetic ε-and β-MnO2 nanostructures and the polymorph discrimination[J]. Solid State Communications, 2009, 149(37-38): 1514-1518. DOI: 10.1016/j.ssc.2009.06.008. |
| [9] | ARMSTRONG A R, BRUCE P G. Synthesis of layered LiMnO2 as an electrode for rechargeable lithium batteries[J]. Nature, 1996, 381(4): 499-500. |
| [10] | WARD C B, WALKER A I. The production of alkaline grade EMD at Australian manganese company limited[J]. Prog Batt Batt Mater, 1992, 11(1): 40-45. |
| [11] | WANG G, ZHANG L, ZHANG J J. A review of electrode materials for electrochemical supercapacitors[J]. Chem Soc Rev, 2012, 41(2): 797-828. DOI: 10.1039/C1CS15060J. |
| [12] | BOCK D C, MARSCHILOK A C, TAKEUCHI K J, et al. Batteries used to power implantable biomedical devices[J]. Electrochim Acta, 2012, 84(1): 155-164. |
| [13] | RUSI, MAJID S R. Controllable synthesis of flower-like α-MnO2 as electrode for pseudocapacitor application[J]. Solid State Ionics, 2014, 262(2): 220-225. |
| [14] | FEI J B, CUI Y, YAN X H, et al. Controlled preparation of MnO2 hierarchical hollow nanostructures and their application in water treatment[J]. Adv Mater, 2008, 20(3): 452-456. DOI: 10.1002/(ISSN)1521-4095. |
| [15] | CAO J, MAO Q H, SHI L, et al. Fabrication of γ-MnO2/α-MnO2 hollow core/shell structures and their application to water treatment[J]. J Mater Chem, 2011, 21(40): 16210-16215. DOI: 10.1039/c1jm10862j. |
| [16] | DING Y S, SHEN X F, GOMEZ S, et al. Hydrothermal growth of manganese dioxide into three-dimensional hierarchical nanoarchitectures[J]. Adv Funct Mater, 2006, 16(4): 549-555. DOI: 10.1002/(ISSN)1616-3028. |
| [17] | HAN D D, JING X Y, XU P C, et al. Facile synthesis of hierarchical hollow ε-MnO2 spheres and their application in supercapacitor electrodes[J]. Journal of Solid State Chemistry, 2014, 218(2): 178-183. |
| [18] | SHI F J, WANG F, DAI H X, et al. Rod-, flower-, and dumbbell-like MnO2: Highly active catalysts for the combustion of toluene[J]. Applied Catalysis A:General, 2012, 433(1): 206-213. |
| [19] | YU P, ZHANG X, CHEN Y, et al. Self-template route to MnO2 hollow structures for supercapacitors[J]. Materials Letters, 2010, 64(13): 1480-1482. DOI: 10.1016/j.matlet.2010.03.067. |
| [20] | CHENG G, YU L, LIN T, et al. A facile one-pot hydrothermal synthesis of β-MnO2 nanopincers and their catalytic degradation of methylene blue[J]. Journal of Solid State Chemistry, 2014, 217(1): 57-63. |
| [21] | CHEN H M, CHU P K, HE J H, et al. Porous magnetic manganese oxide nanostructures: Synthesis and their application in water treatment[J]. J Colloid Interface Sci, 2011, 359(1): 68-74. DOI: 10.1016/j.jcis.2011.03.089. |
| [22] | ZHANG W, YANG Z, WANG X, et al. Large-scale synthesis of β-MnO2 nanorods and their rapid and efficient catalytic oxidation of methylene blue dye[J]. Catal Commun, 2006, 7(6): 408-412. DOI: 10.1016/j.catcom.2005.12.008. |
 2016, Vol. 33
2016, Vol. 33