2. 中国科学院深圳先进技术研究院,广东 深圳 518055
2. Shenzhen Institute of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, China
近年来,干细胞治疗被广泛地应用于各种疾病的治疗[1-2],尤其是在心脑血管病[3]和神经退行性等疾病[4-5]领域治疗效果较为显著.其中间充质干细胞以其具有弱免疫原性和分化能力强等优点而备受关注[6-8].在临床细胞治疗中,通常直接将功能性细胞注入患者体内病灶或待修复处进行治疗.但其注射点的正确与否难以准确判断,从而导致后续对该细胞在体内的分布和扩散动态无法进行有效地观测.因此,临床治疗中亟需研发一种无创伤和可视性好的方法,以便对植入细胞进行体内示踪与治疗评价.
分子影像学是利用医学影像技术对活体内参与生理或病理过程的分子进行无创性的实时成像观察.因而,该技术为疾病的早期诊断提供了可靠的临床分析,由于该技术以人体内特定的分子为成像对比标准,从而使得对生物体内环境和疾病发展过程的研究更加微观和深入[9].目前,磁共振成像(magnetic resonance imaging, MRI)和近红外荧光成像(near-infrared fluorescence, NIRF)技术被广泛应用于细胞标记和示踪的分子影像[10-11].其中MRI技术可借助造影剂观察到活体内分子的变化,具有空间分辨率高、无辐射、对活体副作用小以及可准确提供动物三维解剖结构、代谢及血流灌注信息等优势[12].然而,目前多数荧光标记物受自身波长限制,信号和组织穿透力均较弱,且易受生物体自发荧光背景信号影响,很难获得理想的活体追踪效果.相比MRI,NIRF的检测波长介于700~1 000 nm之间,在此波段范围内生物体自身组织的吸收较弱,其在生物组织的穿透深度可深达4~10 cm,这使得NIRF成为光学像中较为理想的成像方法之一[13].
综上所述,若能将MRI造影剂——超顺磁氧化铁(superparamagnetic iron oxide, SPIO)纳米粒子和NIRF造影剂IR-780分子有机结合起来,形成一种基于MRI和NIRF成像的双模造影剂,将在治疗性的细胞成像与示踪上显示出卓越的应用前景[14-15].本研究开展了MRI和NIRF双模态造影剂的研究,制备了硬脂酸(stearic acid, st)修饰的聚乙烯亚胺(polyethylenimine, PEI)双亲分子(stPEI),通过亲疏水自组装包裹疏水的SPIO和IR-780,制备了双模态造影剂stPEI-SPIO/ IR-780,并将其用于对大鼠骨髓间充质干细胞(rat bone stem cell, RBMSC)的标记和活体体内外双模态成像检测.
1 材料与方法 1.1 双模态造影剂的合成及表征 1.1.1 SPIO的合成实验采用热分解法合成SPIO纳米颗粒.参照文献[16]方法,8 nm SPIO纳米颗粒合成步骤如下:氩气保护下,将乙酰丙酮铁(Ⅲ) (2 mmol)、1, 2-十六烷二醇(10 mmol)、油酸(6 mmol)和9-十八烯胺(12 mmol)分别溶解于苄醚(20 mL)中,置于无水、无氧环境中加热至300 ℃回流1 h,用乙醇沉淀后重新分散到正己烷中即得到SPIO纳米颗粒.
1.1.2 stPEI-SPIO/IR-780的合成由于疏水的SPIO纳米颗粒和IR-780无法直接用于生物体,需对其进行包裹修饰后才可以实现生物应用,本文采用硬脂酸修饰的聚乙烯亚胺(stPEI)对其修饰包裹.首先合成stPEI,参照文献[17]方法:氩气保护下,1, 1′-羰基二咪唑(CDI)溶于无水氯仿中,然后加入硬脂酸,室温下活化硬脂酸羧基2 h, 将活化硬脂酸加入PEI中,室温反应24 h生成stPEI,用冰乙醚沉淀提纯,将stPEI (20 mg)、SPIO (10 mg)和IR-780 (20 mg)置于氯仿溶液中混合,在超声下逐滴加入超纯水体系中,摇床摇24 h,旋蒸10 min,得终产物stPEI-SPIO/IR-780.
1.1.3 样品测试采用TEM完成材料粒径、分散度的表征,测试电压为200 kV, 放大倍率为25 000倍.采用动态光散射系统(Dynamic Light Scattering, DLS; Zetasizer Nano system,马尔文,美国)对其粒径进行测量,测量参数:温度为25℃,SPIO和stPEI-SPIO/IR-780合成中光子计数率(kCPS)分别为237.8和120.7.应用临床MRI对弛豫率进行检测,用小动物三维成像系统(IVIS, Xenogen,CA,美国)对其光学成像能力进行测定.纳米材料的自旋-自旋弛豫时间(T2) 用临床3T的磁共振(MR)扫描仪(Magnetom Trio Tim,Siemens Healthcare,德国)室温下进行测试.序列参数如下:切片厚度(slice thickness, SL)为2.5 mm,重复时间(repetition time, TR)为1 500 ms,回波时间(echo tiem,TE)为17~170 ms.弛豫率是通过拟合信号强度对不同铁浓度(mmol)下的TE值来计算得出.样品NIRF成像能力通过IVIS来鉴定,测试参数为激发波长选择680 nm,接受波长为780 nm.
1.2 双模态造影剂的体外成像效果为考察新合成造影剂在标记RBMSC过程中培养时间对成像效果的影响,设计4个时间点,分别为24 h、48 h、96和120 h.步骤为:将5×105个RBMSC与含铁质量浓度为1 μg/ml的stPEI-SPIO/IR-780纳米颗粒的培养基共孵育4 h,然后用磷酸盐缓冲溶液(phosphate buffer solution,PBS)洗两次,更换为含10%胎牛血清(fetal bovine serum,FBS)的DMEM (Dulbecco′s modification of Eagle′s medium) F12培养基,以后隔24 h换1次培养基并消化离心所到时间点的RBMSC,计数,重悬于300 μL PBS中,混匀后再与300 μL 1.5%琼脂糖凝胶均匀混合,冰中迅速冷却凝固.最后,样品的T2加权像同样借助临床3T MR扫描仪(SL为2.5 mm,TR为3 000 ms,TE为21~159 ms)测试. IVIS测量NIRF成像效果.
1.3 双模态造影剂的体内成像效果参照体外实验指导进行小鼠体内实验,以同样铁浓度的stPEI-SPIO/IR-780与RBMSC共孵育4 h.用PBS洗后,离心计数1×106个,然后分散到50 μl PBS中,以同样密度和体积的未标记RBMSC为空白对照.实验组注射于小鼠右后腿肌肉,空白注射于小鼠左后腿肌肉.24h后进行MRI (TR为2, 500 ms; TE为49 ms,SL为1.0 mm)和IVIS扫描.
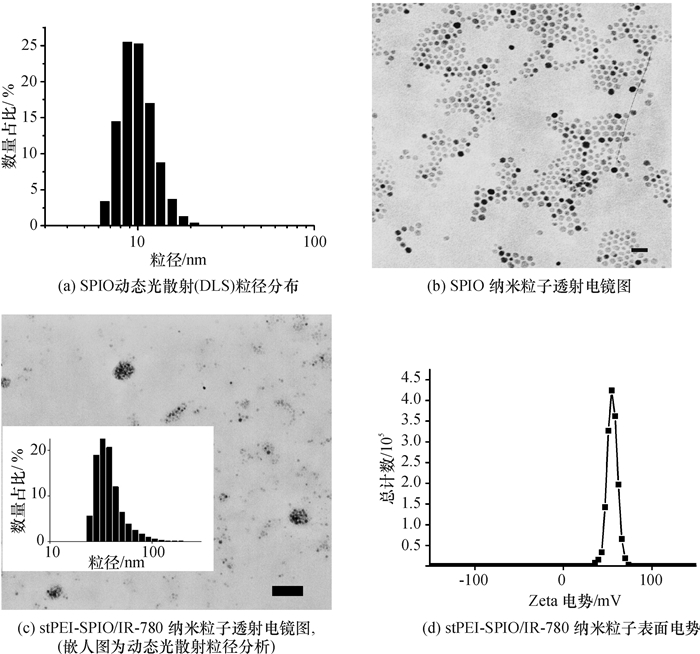
2 实验结果及讨论 2.1 SPIO和stPEI-SPIO/IR-780的合成表征SPIO纳米颗粒合成过程需要解决的关键问题是如何获得分散性好、磁学效果佳以及合适粒径的纳米颗粒.目前SPIO纳米粒子的合成主要采用热分解法[18]、共沉淀法、高温分解法、水热法或溶胶凝胶法.本文采用了热分解法,图 1(a)为不同粒径SPIO的数量百分数变化,表明此SPIO粒度较均匀,10 nm左右的SPIO占比例较多, 其数量最大峰粒径10.2±2.462 nm的多分散指数PDI (polydispersity index)为0.265.图 1(b)为SPIO纳米粒子TEM图,表明新制备的SPIO粒径均一,晶型和分散性较好.index)为0.265.图 1(b)为SPIO纳米粒子TEM图,表明新制备的SPIO粒径均一,晶型和分散性较好.
|
图 1 SPIO和stPEI-SPIO/IR-780纳米颗粒的表征 Figure 1 Characterization of SPIO and stPEI-SPIO/IR-780 nanocrystles |
SPIO纳米粒子用于细胞标记需要考虑3个方面:(1) 保证细胞对其内吞能力;(2) 在细胞中存留时间较长,便于追踪细胞动态; (3) 生物安全性,由于其终目的是作为生物体造影剂,故其应具有很好的生物相容性和无其他负面影响.
由于以油酸、油胺和9-十八烯胺为表面活性剂,以乙酰丙酮铁(Ⅲ)为铁供体制备的SPIO疏水纳米颗粒,生物毒性较大,因此,需要对SPIO表面进行化学修饰使其表现为亲水性.本文采用stPEI为表面活性剂,其疏水端与SPIO表面的疏水端结合,将带有大量正电荷亲水基团留在外面,因而制备了水溶性stPEI-SPIO/IR-780纳米粒子, 在水中有很好的分散力.如图 1(c)所示,DLS数量随粒径变化的柱状图显示数量最大峰粒径为39.54±16 nm (PDI=0.373),粒径维持在纳米级,比较适用于生物标记.不同表面电势对应的总计数如图 1(d)所示,总计数最多的stPEI-SPIO/IR-780纳米粒子表面电位为+55mV,这与PEI带有大量的正电荷相符合.
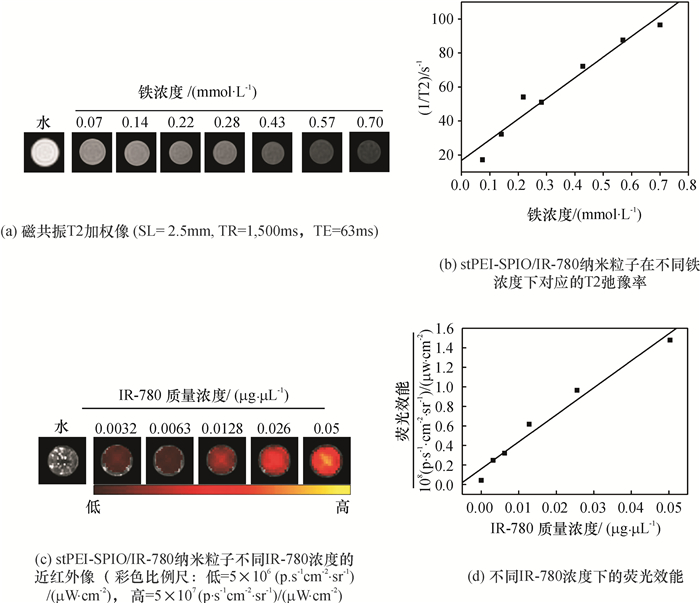
同热分解法合成的SPIO纳米探针一样,疏水性的荧光染料IR-780,大剂量注射对生物的毒性较大.因而,单纯IR-780也不能直接用于生物学实验中,而经stPEI修饰的SPIO和IR-780拥有良好的生物相容性,并且能够很好地和细胞膜通过正负电荷吸引而结合,从而,使得造影剂易于进入RBMSC[19].另外,stPEI-SPIO/IR-780纳米粒子也显示了出色的MRI和NIRF成像效果.在不同铁浓度下MRI的T2加权像如图 2(a)所示,随着stPEI-SPIO/IR-780溶液的含铁量增加,MRI图像越暗,其T2效果非常明显,1/T2与铁浓度拟合的直线如图 2(b)所示,stPEI-SPIO/IR-780纳米粒子的弛豫率达到121.583 mmol-1·s-1,此值比临床上的基于葡聚糖包裹的SPIO的T2造影剂Feridex高很多[20].同样,如图 2(c)和(d)所示,不同IR-780浓度下近红外像表明:NIRF成像强度随着IR-780浓度的升高而增强,IR-780浓度越高,图像越亮(注:荧光效能单位为(p·s-1·cm-2·sr-1)/(μW·cm-2),其中,“p”为photon,光子;“sr”为steradian,球面度).总体来看stPEI-SPIO/IR-780纳米粒子的MRI和NIRF成像效果有明显的浓度依赖性,但经stPEI修饰过的SPIO和IR-780很好地结合了MRI和NIRF成像的优点,且解决了生物相容性两方面的问题[21].
|
图 2 stPEI-SPIO/IR-780纳米颗粒成像能力表征 Figure 2 The imaging capacity of stPEI-SPIO/IR-780 nanocrystles |
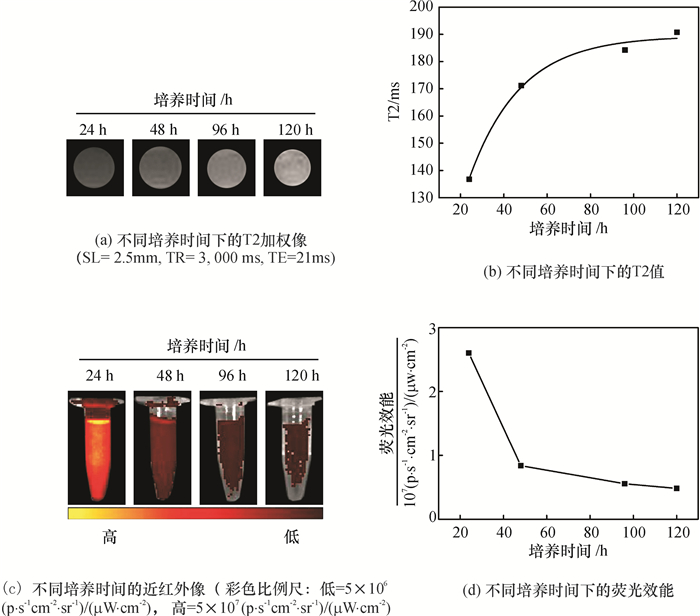
stPEI-SPIO/IR-780纳米粒子在体外RBMSC中的成像效果会随着培养时间的增加而减弱.不同培养时间下MRI成像效果如图 3(a)所示,随着培养时间从24 h到48 h,被标记细胞的MRI图像暗信号越来越弱,且不同培养时间下T2值从24 h的136.8 ms升高至48 h的171.2 ms如图 3(b)所示,整体呈上升趋势. NIRF成像也随培养时间增加而成像效果减弱,不同培养时间下的成像效果和荧光效能值,在24 h时信号值达2.603×107(p·s-1·cm-2·sr-1)/ (μW·cm-2),48 h后其强度迅速下降到8.376×106(p·s-1·cm-2·sr-1)/ (μW·cm-2),120 h后其强度变化接近平稳如图 3(c)和(d)所示.相对于MRI,NIRF的成像表现得更为灵敏.实验中,MR成像和NIRF成像都显示出成像效果对造影剂浓度的依赖性.对于MRI,纳米颗粒中包裹的SPIO越多,其T2成像效果越明显.同样,IR-780的含量越多,其光学信号值也越强.细胞标记实验中显示了与stPEI-SPIO/IR-780孵育后再培养24 h时的细胞成像效果最明显.24 h到48 h MRI和NIRF成像效果明显下降.尽管如此,48 h时的MRI和NIRF信号还能达到很好的辨认度.但96 h后,MRI的T2信号和NIRF信号已变得很弱,尤其是MRI图像的暗信号已非常弱.造成这一现象的主要原因是由于随培养时间的增加,细胞的不断分裂和细胞胞吐作用使得stPEI-SPIO/IR-780在细胞内的含量变小.实验结果也显示了其胞吐作用在24~48 h最为迅速.
|
图 3 stPEI-SPIO/IR-780纳米颗粒虽不同培养时间体外成像能力 Figure 3 The imaging capacity of stPEI-SPIO/IR-780 nanocrystles versus different culture time |
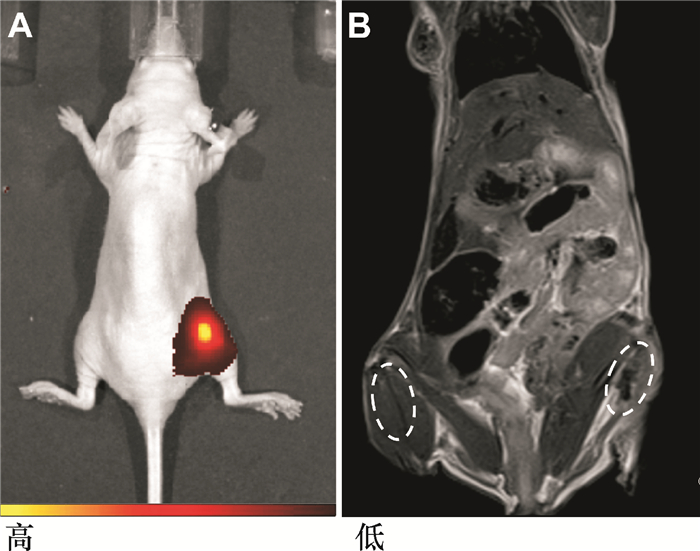
体外成像实验显示stPEI-SPIO/IR-780纳米颗粒有很好的成像效果,且MRI和NIRF成像相互弥补了各自的缺点,并呈现了各自的优点.通过体外实验证明高质量的影像效果是在最初的24 h内.体内实验选择了注射stPEI-SPIO/IR-780标记的RBMSC后24 h进行监测.如图 4(a)小鼠IVIS图像所示,NIRF成像显示了小鼠右腿上细胞注射的位置,图 4(b)所示的MRI图像也显示出明显的暗信号,此结果与NIRF显示相吻合.作为对照的左腿则NIRF没有任何信号,只有MRI图像上显示了白色的增强信号.体内实验注射到小鼠腿部肌肉的RBMSC也采用了与体外实验相同铁浓度的stPEI-SPIO/IR-780纳米颗粒共孵育. MRI图像和NIRF图像均很好地显示了注射位点于小鼠的右腿股部信号很强.与传统的单模态影像相比,这种双模态造影剂显著增加了检测的可信度.因为MRI虽然具有空间分辨率高,组织穿透力强等优点,但是获取图像时间较长,极易受到生物体的运动而导致出现伪影,从而不能准确地确诊.而NIRF成像的时间分辨率较高,成像速度较快,但其空间分辨率较低,而不能直观地观察出被检测组织的结构.本研究得到的stPEI-SPIO/IR-780具备了MRI和NIRF成像的优点,实现了双模态成像的效果,这不仅对被检测生物体的伤害大大降低,并且提高了诊断的准确度.
|
图 4 stPEI-SPIO/IR-780标记干细胞体内实验 Figure 4 In vivo of stPEI-SPIO/IR-780 labeled RBMSC A: IVIS图像(彩色比例尺:低=1.34×107(p·s-1·cm-2·sr-1)/(μW·cm-2),高=7.03×107 (p·s-1·cm-2·sr-1)/(μW·cm-2);B:磁共振图像(SL=1.0 mm, TR=2 500 ms, TE=49 ms) |
综上所述,用stPEI包裹修饰疏水的SPIO纳米粒子和IR-780荧光染料制备成的MRI/NIRF双模态造影剂stPEI-SPIO/IR-780具有合理的粒径、表面电位与在水中良好的分散性,且此双模态造影剂表现出很好的对比效果,无论在体外还是在体内实验都显示出很好的磁共振成像和近红外成像能力.体外对大鼠的骨干细胞的标记显示了很好的生物相容性和影像学效果.体内实验应用MRI和NIRF成像能够精确地定位被stPEI-SPIO/IR-780造影剂标记的干细胞.相比于传统的造影剂,该双模态造影剂具有更高的灵敏度和更长的成像窗口[22-23].所以,利用双模态造影剂并结合特定的互补成像手段在细胞标记和示踪上有非常大的应用前景.
| [1] | WANG N, ZHAO J Y, GUAN X, et al.Biological characteristics of adipose tissue-derived stem cells labeled with amine-surface-modified superparamagnetic iron oxide nanoparticles[J]. Cell Biology International, 2015, 39(8): 899-909. DOI: 10.1002/cbin.v39.8. |
| [2] | FOX I J, DALEY G Q, GOLDMAN S A, et al.Use of differentiated pluripotent stem cells in replacement therapy for treating disease[J]. Science, 2014, 345(6199): 889-1000. |
| [3] | ABE K, YAMASHITA T, TAKIZAWA S, et al.Stem cell therapy for cerebral ischemia: from basic science to clinical applications[J]. Journal of Cerebral Blood Flow & Metabolism, 2012, 32(7): 1317-1331. |
| [4] | GARBERN J C, LEE R T. Cardiac stem cell therapy and the promise of heart regeneration[J]. Cell Stem Cell, 2013, 12(6): 689-698. DOI: 10.1016/j.stem.2013.05.008. |
| [5] | BARTUNEK J, BEHFAR A, DOLATABADI D, et al.Cardiopoietic stem cell therapy in heart failure: the C-CURE (cardiopoietic stem cell therapy in heart failURE) multicenter randomized trial with lineage-specified biologics[J]. Journal of the American College of Cardiology, 2013, 61(23): 2329-2338. DOI: 10.1016/j.jacc.2013.02.071. |
| [6] | WANG H W, QIU X Y, NI P, et al.Immunological characteristics of human umbilical cord mesenchymal stem cells and the therapeutic effects of their transplantion on hyperglycemia in diabetic rats[J]. International Journal of Molecular Medicine, 2014, 33(2): 263-270. |
| [7] | MA N, CHENG H, LU M, et al.Magnetic resonance imaging with superparamagnetic iron oxide fails to track the long-term fate of mesenchymal stem cells transplanted into heart[J]. Scientific Reports, 2015, 5, Article number: 9058. |
| [8] | KOH Y G, CHOI Y J. Infrapatellar fat pad-derived mesenchymal stem cell therapy for knee osteoarthritis[J]. The Knee, 2012, 19(6): 902-907. DOI: 10.1016/j.knee.2012.04.001. |
| [9] | WEISSLEDER R, MAHMOOD U. Molecular Imaging[J]. Radiology, 2001, 219(2): 316-333. DOI: 10.1148/radiology.219.2.r01ma19316. |
| [10] | BARROW M, TAYLOR A, NIEVES D J, et al.Tailoring the surface charge of dextran-based polymer coated SPIONs for modulated stem cell uptake and MRI contrast[J]. Biomater Sci, 2015, 3(4): 608-616. DOI: 10.1039/C5BM00011D. |
| [11] | YI X M, YAN F, WANG F L, et al.IR-780 dye for near-infrared fluorescence imaging in prostate cancer[J]. Medical Science Monitor, 2015, 21: 511-517. DOI: 10.12659/MSM.892437. |
| [12] | FAYOL D, LUCIANI N, LARTIGUE L, et al.Managing magnetic nanoparticle aggregation and cellular uptake: a precondition for efficient stem-cell differentiation and MRI tracking[J]. Advanced Healthcare Materials, 2013, 2(2): 313-325. DOI: 10.1002/adhm.v2.2. |
| [13] | FRANGIONI J V. In vivo near-infrared fluorescence imaging[J]. Current Opinion in Chemical Biology, 2003, 7(5): 626-634. DOI: 10.1016/j.cbpa.2003.08.007. |
| [14] | CIERI N, OLIVEIRA G, GRECO R, et al.Generation of human memory stem T cells upon haploidentical T-replete hematopoietic stem cell transplantation[J]. Blood, 2015, 125(18): 2865-2874. DOI: 10.1182/blood-2014-11-608539. |
| [15] | HANSCH A, FREY O, SAUNER D, et al.In vivo imaging of experimental arthritis with near-infrared fluorescence[J]. Arthritis and Rheumatism, 2004, 50(3): 961-967. DOI: 10.1002/art.20112. |
| [16] | SUN S H, ZENG H, ROBINSON D B, et al.Monodisperse MFe2O4 (M=Fe, Co, Mn) nanoparticles[J]. Journal of the American Chemical Society, 2004, 126(1): 273-279. DOI: 10.1021/ja0380852. |
| [17] | WAN Q, XIE L S, GAO L, et al.Self-assembled magnetic theranostic nanoparticles for highly sensitive MRI of minicircle DNA delivery[J]. Nanoscale, 2013, 5(2): 744-752. DOI: 10.1039/C2NR32438E. |
| [18] | LI L, JIANG W, LUO K, et al.Superparamagnetic iron oxide nanoparticles as MRI contrast agents for non-invasive stem cell labeling and tracking[J]. Theranostics, 2013, 3(8): 595-615. DOI: 10.7150/thno.5366. |
| [19] | ALBANESE A, TANG P S, CHAN W C. The effect of nanoparticle size, shape, and surface chemistry on biological systems[J]. Annual Review of Biomedical Engineering, 2012, 14: 1-16. DOI: 10.1146/annurev-bioeng-071811-150124. |
| [20] | LIU H L, HUA M Y, YANG H W, et al.Magnetic resonance monitoring of focused ultrasound/magnetic nanoparticle targeting delivery of therapeutic agents to the brain[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(34): 15205-15210. DOI: 10.1073/pnas.1003388107. |
| [21] | JIN Q F, WANG Z Y, YAN F, et al.A novel cationic microbubble coated with stearic acid-modified polyethylenimine to enhance DNA loading and gene delivery by ultrasound[J]. PloS One, 2013, 8(9): e76544. DOI: 10.1371/journal.pone.0076544. |
| [22] | JIANG C X, CHENG H, YUAN A, et al.Hydrophobic IR780 encapsulated in biodegradable human serum albumin nanoparticles for photothermal and photodynamic therapy[J]. Acta Biomaterialia, 2015, 14: 61-69. DOI: 10.1016/j.actbio.2014.11.041. |
| [23] | FOY S P, MANTHE R L, FOY S T, et al.Optical imaging and magnetic field targeting of magnetic nanoparticles in tumors[J]. ACS Nano, 2010, 4(9): 5217-5124. DOI: 10.1021/nn101427t. |
 2016, Vol. 33
2016, Vol. 33

