细菌在自然环境以及机体内以生物被膜的形态存在,相比于浮游状态更容易显示出强大的生命活力.而生物被膜的形成是一个复杂的动态过程,细菌群体感应(quorum sensing, QS)系统在其中所起到的作用越来越重要.QS是细菌根据群体中细胞密度变化来调控自身基因表达的一种群体行为[1].微生物通过合成和分泌自诱导分子监控周围环境中自身或其他细菌的数量变化,当细菌的数量积聚增加到一定程度,这些自诱导分子能够进出细胞体内与受体结合,激活靶基因与基因编码酶的表达,发出生物信号,从而调控受体间的行为[2].QS最早是在海洋费氏弧菌发光现象的调控通路中被发现的[3].随后研究发现它是通过释放一类高丝氨酸内脂类分子(AHLs)来调控生物发光这一生理现象的,同时这些自诱导物还可以对自身产生特定行为,如生物被膜的形成、毒性因子的分泌[4].近来发现还有另一种信号分子可以使费氏弧菌发光,分析发现这些信号分子的本质结构是呋喃硼酸二酯,统称为AI-2.基因组分析发现55种以上的细菌均含有AI-2合成酶luxS的同源保守序列.但是,如金黄色葡萄球菌的阳性菌以寡肽为信号分子,铜绿假单胞菌的阴性菌主要以AI-1类为信号分子,这些细菌是否亦能够分泌出AI-2,或者其产生的AI-2分子的浓度是否能够增强群落生物被膜的形成,还需进一步研究.
本实验通过提取细菌的过夜培养上清,以哈氏弧菌BB170作为AI-2指示菌,检测细菌培养上清AI-2及其发光强度,并初步认识AI-2在生物被膜形成中的作用.
1 材料与方法 1.1 实验菌株保藏于实验室的实验菌株包括大肠杆菌(Escherichia coli)ATCC 25922、金黄色葡萄球菌(Staphylococcus aureus)ATCC 29213、沙门氏菌(Salmonella)ATCC 14028、铜绿假单胞菌(Pseudomonas aeruginosa)ATCC 27853、阪崎肠杆菌(EnterobacterSakazakii)ATCC 51329、志贺氏菌(Shigella)ATCC 25931、李斯特氏菌(Listeria monocytogenes)ATCC 19111.以上菌株活化均在超净上进行.哈氏弧菌BB170,购买于美国菌种保藏中心,实验室超低温冰箱保存.96孔聚乙烯平底细胞培养板,订购于鼎国公司;呋喃酮,购于阿拉丁;酶标仪(Model 680):日本Bio-Rad公司.
1.2 培养上清的制备实验用菌株应先营养肉汤活化,再接入新鲜胰蛋白胨大豆肉汤(TSB, Luqiao Technology Co.Ltd., China)摇动培养至其对数中期左右(37±1 ℃).将过夜培养的菌液12 000 r/min高速离心10 min(4 ℃)后,通过已高压灭菌干燥的0.22 μm一次性滤器,滤液即为实验所需的培养上清,-20℃保存可延长使用.
1.3 生物发光检测培养上清活性检测步骤可参照文献[5-6]并适当修改.步骤如下:哈氏弧菌BB170接种于AB培养基(1.75%(质量浓度,下同)氯化钠, 1.23%硫酸镁, 0.2%酸水解酪蛋白, 1 mmol/L磷酸钾, 1 mmol/L L-精氨酸, 1%甘油),30 ℃过夜培养.检测前,用新鲜AB培养基以1: 5 000稀释过夜的哈氏弧菌BB170培养液,摇匀.设V.harveyi BB170和AB培养基的过滤上清分别作为阳性和阴性对照,按体积比1: 9与1: 5 000稀释后的哈氏弧菌BB170混合,继续30 ℃摇动培养,5 h内每1 h取200 μL/孔至96孔酶标板,使用多功能酶标仪检测其生物发光强度.当阴性对照的发光强度达到最小,设此时的阳性对照的发光值为100%,比较金黄色葡萄球菌、沙门氏菌、铜绿假单胞菌、阪崎杆菌、志贺氏菌、李斯特菌的过滤培养上清的AI-2活性,以相对活性表示.同时,另一组加入5%(体积分数) 1 mL呋喃酮溶液,检测此时培养上清中AI-2的活性.
1.4 检测培养上清对大肠杆菌生物被膜形成能力具体步骤[7-8]如下:制备1.2×108/mL大肠杆菌菌悬液,取适量菌悬液加入到新鲜TSB,制成菌浓度为10%的菌悬液,同时,设置两组培养上清加入量,分别为50 μL和100 μL,再加入10%菌悬液,使得96孔细胞培养板每孔总体积为200 μL.37℃过夜培养.培养结束吸掉培养基,水洗去除浮游菌,室温自然风干后,加入200 μL/孔1%(质量浓度)结晶紫,静置20 min.自来水漂洗多次去除染液,室温风干.再加入95%乙醇200 μL,酶标仪测定波长630 nm处的光密度值OD630(optical density, OD),平行实验3组.对照组用新鲜培养基代替培养上清.
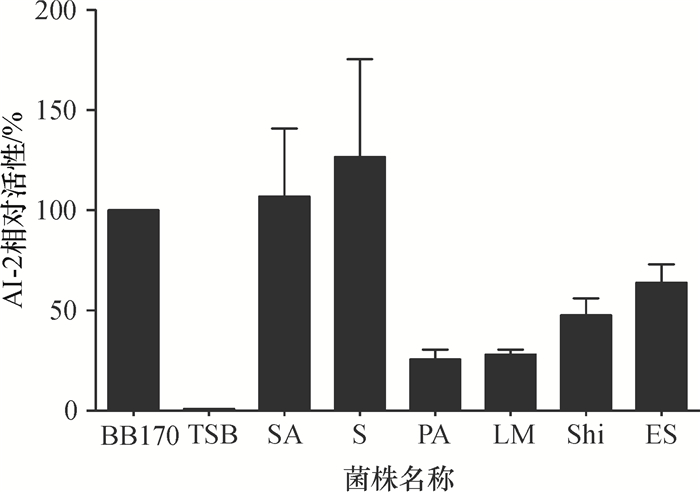
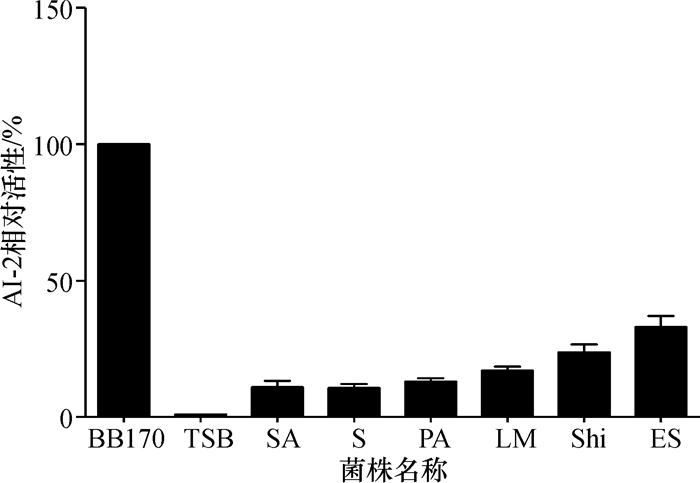
2 结果 2.1 培养上清生物发光检测利用AI-2报告菌株哈氏弧菌BB170,以TSB培养基、报告菌株的上清或稀释报告菌株菌悬液为背景对照,对细菌培养上清诱导生物发光的能力进行测定.图 1结果显示,所检测的细菌培养上清中存在某种成分可诱导BB170生物荧光,尤其是沙门氏菌和金黄色葡萄球菌上清的作用明显.另一方面,当加入呋喃酮后,发现呋喃酮能够抑制细菌培养上清AI-2活性,致使BB170发光强度有所降低,如图 2所示,可能是由于呋喃酮化学结构与AI-2的化学结构相类似,能够与QS系统的应答调控子结合而导致QS失活[9].结果表明金黄色葡萄球菌、铜绿假单胞菌、沙门氏菌、李斯特菌、志贺氏菌和阪崎杆菌均能分泌有活性的AI-2分子,菌株中存在AI-2介导的群体感应通路.
|
图 1 金黄色葡萄球菌(SA)、铜绿假单胞菌(PA)、沙门氏菌(S)、李斯特菌(LM)、志贺氏菌(Shi)、阪崎杆菌(ES)的过滤培养上清中AI-2活性检测 Figure 1 BB170 bioluminescense assay of S. aureus, P. aeruginosa, Salmonella, L. monocytogenes, Shigella, E. Sakazakii culture supernatant |
|
图 2 加入呋喃酮溶液后金黄色葡萄球菌(SA)、铜绿假单胞菌(PA)、沙门氏菌(S)、李斯特菌(LM)、志贺氏菌(Shi)、阪崎杆菌(ES)的培养上清AI-2活性检测 Figure 2 BB170 bioluminescense assay of S. aureus, P. aeruginosa, Salmonella, L. monocytogenes, Shigella, E. Sakazakii culture supernatant under the presence of furanone |
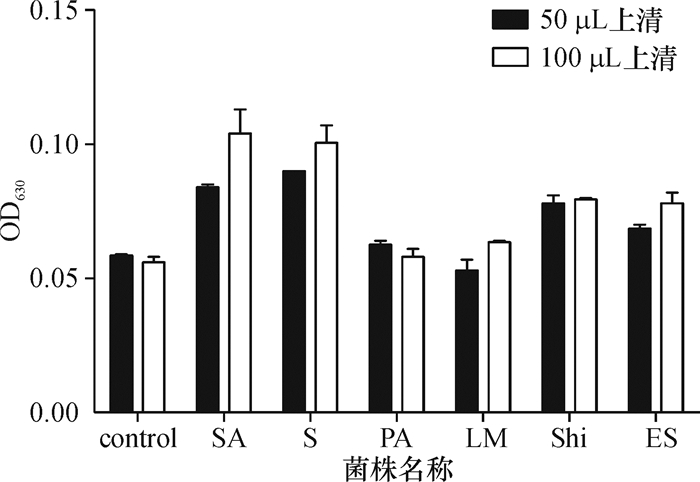
经典结晶紫染色法检测生物被膜形成能力,能够反映出细菌形成的生物被膜对孔壁的黏附能力.如图 3所示,大肠杆菌生物被膜的OD630(对照组)大约为0.06,而加入细菌培养上清后大肠杆菌生物被膜的OD630均有所增加.金黄色葡萄球菌和沙门氏菌的培养上清显著增强大肠杆菌生物被膜的形成能力,加入上清越多,OD630越高,成膜能力越强.加入铜绿假单胞菌和李斯特菌,OD630增幅不明显,与对照组OD630同一水平;而加入志贺氏菌和阪崎杆菌培养上清,两者的OD630大约为0.07左右,不同的上清加入量,OD630没有显示出差异.
|
图 3 不同加入量(50 μL和100 μL)培养上清对大肠杆菌生物被膜吸光度检测结果 Figure 3 Biofilm formation results of different dosage (50 μL and 100 μL) supernatant on E.coli biofilm |
一般来说,一种细菌只产生并仅感应自身分泌的一类特定种类的信号分子.如革兰氏阴性菌铜绿假单胞菌产生基于AI-1类的信号分子,即las系统和rhl系统[10].如革兰氏阳性菌金黄色葡萄球菌的Agr系统[11],是由寡肽介导的典型阳性菌QS系统.这些特定的信号分子只能被同种细菌所感应,并以此来识别自己和他菌的存在,调节自己的行为.
本实验所使用的AI-2指示菌哈氏弧菌BB170,由于其缺失AI-1感受器,因此,该菌仅对AI-2类分子发生反应并诱导自身发光.所以,使用哈氏弧菌BB170检测AI-2活性具有可靠性和有效性.在检测培养上清AI-2活性中,大部分细菌培养上清均能诱导哈氏弧菌BB170发光,表明无论是革兰氏阴性菌,还是阳性菌均存在着AI-2/luxS的QS系统.
细菌在自然环境中总是处于动态而复杂的多细菌共存的微生态中,这种微生态一般以生物被膜的形式存在,将细菌细胞包裹在生物被膜里面.那么细菌间就必需要有一种共同的语言来相互交流沟通,协调细菌的行动,才能共同应对环境的压力.从本实验的生物被膜形成能力检测的结果看,加入外源培养上清后,大肠杆菌生物被膜的形成能力都有所增强,提高了生物被膜的黏附能力.Merritt等[12]研究luxS突变的链球菌形成的生物被膜变化,发现luxS突变链球菌细胞聚集弱,菌体分散,生物被膜黏附能力减弱.而McNab等人[13]报道指出AI-2是Porphyromonas gingivalis和Streptococcus gordonii的混合种生物被膜的必要条件.AI-2信号分子为种间细菌交流提供桥梁,促使菌体聚集,还可促进生物被膜的形成.罗哲[14]等研究AI-2/luxS缺陷的伤寒沙门菌的基因表达,发现细菌动力基因表达下调,氨基酸蛋白代谢功能受到影响,这些功能都与生物被膜初始黏附有重要的作用.近来发现一种天然产物呋喃酮[15]能够抑制或降低AI-2活性从而阻止生物被膜的形成,引起人们的关注,但就现阶段来讲,对细菌的AI-2类QS系统研究还处于起步阶段,仍需进一步深入了解信号分子在种间胞内转导的调制机制.
| [1] |
许玉彬, 张颖, 王淼, 等. 细菌群体感应研究进展[J].
河南农业科学, 2013(12): 16-19.
XU Y B, ZHANG Y, WANG M, et al. Research progress on bacteria quorum sensing[J]. Journal of Henan Agricultural Sciences, 2013(12): 16-19. DOI: 10.3969/j.issn.1004-3268.2013.12.004. |
| [2] |
郭嘉亮, 陈卫民. 细菌群体感应信号分子与抑制剂研究进展[J].
生命科学, 2007, 19(2): 224-232.
GUO J L, CHEN W M. Advances in studies of quorum-sensing autoinducer and its inhibitors[J]. Chinese Bulletin of Life Sciences, 2007, 19(2): 224-232. |
| [3] |
钱妩燕, 江涛. 病原菌群体感应系统的研究进展[J].
国际呼吸杂志, 2012, 32(6): 425-430.
QIAN W Y, JIANG T. Quorum sensing in human pathogens[J]. International Journal of Respiration, 2012, 32(6): 425-430. |
| [4] | READING N C, SPERANDIO V. Quorum sensing: the many languages of bacteria[J]. FEMS Microbiology Letters, 2006, 254(1): 1-11. DOI: 10.1111/fml.2006.254.issue-1. |
| [5] |
姜铮, 陈宣男, 王雪松, 等. 长双歧杆菌NCC2705群体感应系统信号分子AI-2的检测[J].
生物技术通讯, 2010, 21(4): 540-543.
JIANG Z, CHEN X N, WANG X S, et al. Detection of the quorum-sensing signal autoinducer-2 of Bifidobacterium Longum NCC2705[J]. Letters in Biotechnology, 2010, 21(4): 540-543. |
| [6] |
周文渊, 张宏梅, 姜燕, 等. 腐败牛奶中三种细菌生物被膜特性探究[J].
现代食品科技, 2014, 01(1): 87-90+95.
ZHOU W Y, ZHANG H M, JIANG Y, et al. Biofilm research of several foodborne bacterial in spoiling milk process[J]. Modern Food Science and Technology, 2014, 01(1): 87-90+95. |
| [7] |
黄妙琴, 郭峰, 柯才焕, 等. 近岸海洋细菌的群体感应与生物膜形成关系[J].
厦门大学学报(自然科学版), 2010, 49(6): 863-870.
HUANG M Q, GUO F, KE C H. Quorum sensing signal molecule and biofilm-forming capacity in coastal bacteria[J]. Journal of Xiamen University(Natural Science), 2010, 49(6): 863-870. |
| [8] | O′TOOLE G A, PRATT L A, WATNICK P I, et al. Genetic approaches to study of biofilms[J]. Methods in Enzymology, 1999, 310(1): 91-109. |
| [9] | HE Z Y, WANG Q, HU Y J, et al. Use of the quorum sensing inhibitor furanone C-30 to interfere with biofilm formation by Streptococcus mutans and its luxS mutant strain[J]. International Journal of Antimicrobial Agents, 2012, 40(1): 30-35. DOI: 10.1016/j.ijantimicag.2012.03.016. |
| [10] |
杨帆, 张乐, 盛哈蕾, 等. 铜绿假单胞菌中群体感应系统的研究进[J].
中国抗生素杂志, 2012, 37(1): 16-20.
YANG F, ZHANG L, SHENG H L, et al. Research progress of quorum sensing in Pseudomonas aeruginosa[J]. Chinese Journal of Antibiotics, 2012, 37(1): 16-20. |
| [11] | 赵丽萍. 金黄色葡萄球菌中AI-2群体感应系统的调控[D]. 合肥: 中国科学技术大学生命科学学院, 2010. |
| [12] | MERRITT J, QI F, GOODMAN S D, et al. Mutation of luxs affects biofilm formation in Streptococcus mutans[J]. Infection and Immunity, 2003, 71(4): 1972-1979. DOI: 10.1128/IAI.71.4.1972-1979.2003. |
| [13] | RODERICK M N. LuxS-based signaling in Streptococcus gordonii: autoinducer 2 controls carbohydrate metabolism and biofilm formation with Porphyromonas gingivalis[J]. Journal of Bacteriology, 2003, 185(1): 274-284. DOI: 10.1128/JB.185.1.274-284.2003. |
| [14] |
罗哲, 王敏, 杜鸿, 等. LuxS/AI-2对伤寒沙门菌基因表达的调节[J].
江苏大学学报(医学版), 2011, 21(1): 34-41.
LUO Z, WANG M, DU H, et al. Analysis of Genes expression regulation controlled by luxS/AI-2 in Salmonella enterica serovar Typhi[J]. Journal of Jiangsu University(Medicine Edition), 2011, 21(1): 34-41. |
| [15] |
李月恒, 蒋丹, 周智. 细菌天然密度感应系统抑制剂的研究进展[J].
国际口腔医学杂志, 2011, 38(2): 246-248.
LI Y H, JIANG D, ZHOU Z. Research progress on natural quorum sensing system inhibitors in bacterial[J]. International Journal of Stomatology, 2011, 38(2): 246-248. |
 2016, Vol. 33
2016, Vol. 33

