挥发性有机化合物(Volatile Organic Compounds,VOCs)是一类毒性较大、范围广、种类繁多的大气污染物,近年来给人类健康与环境带来严重的威胁[1].目前,催化燃烧技术是处理VOCs众多方法中最有前景的一种技术,它具有能耗低、起燃温度低、处理效率高和无二次污染等优点[2-3].目前,用于VOCs催化燃烧处理的催化剂有粉末催化剂(包括贵金属,过渡金属氧化物、复合金属氧化物和六铝酸盐等)和整体式催化剂(包括堇青石或者铁铬铝负载的催化剂等).在这些催化剂当中,贵金属的催化活性较好[4-5],但是由于其价格较金属氧化物催化剂昂贵,而且易发生中毒,因此不适用于工业化生产.与贵金属催化剂相比,过渡金属氧化物的价格相对低廉,同时也能表现出较好的催化性能.氧化锰是一种廉价的过渡金属氧化物,由于具有多种不同的晶体结构(α-MnO2、β-MnO2和γ-MnO2)和多变的价态(+2、+3和+4),广泛应用于催化领域[6-9].
溶胶凝胶法是一种常用的催化剂的制备方法.这种方法不仅在改善催化剂的孔性能、反应选择性和收率方面有较好的表现[10],而且能够制备出化学均匀性好、纯度高、颗粒较细的纳米微粒[11].有研究表明,溶胶凝胶法制备出来的催化剂有利于提高反应的选择性[12].孙明等[13]以阴阳复合表面活性剂调控的溶胶凝胶法合成了氧化锰八面体分子筛(OMS-2) 催化剂,发现其在二甲醚催化燃烧表现出优异的催化性能,二甲醚完全燃烧温度为170 ℃.有研究表明,焙烧温度对催化剂的性能有一定的影响,在催化剂的制备过程中,焙烧温度会影响催化剂的物相、结晶度、比表面积、比孔体积、平均孔径等[14-15],从而影响催化剂的催化活性.Rida等[16]采用溶胶凝胶法制备了LaCrO3催化剂,并考察了200~1 000 ℃的焙烧温度对其催化活性的影响,发现焙烧温度高于700 ℃生成钙钛矿型LaCrO3晶相时的催化活性最优.
目前,采用溶胶凝胶法制备MnO2,并考察不同焙烧温度制备的催化剂对VOCs催化燃烧性能的研究尚未多见.本文采用溶胶凝胶法合成氧化锰的样品,探究焙烧温度对催化剂催化燃烧甲苯性能的影响,通过X射线衍射(XRD)、扫描电镜(SEM)、N2吸附-脱附、H2程序升温还原(H2-TPR)等表征方法对其结构、形貌及物理化学性能进行了分析表征,并讨论了催化剂的催化活性与结构的关系.
1 实验 1.1 催化剂制备在室温下,称取3.16 g的高锰酸钾(广州化学试剂厂)溶于200 mL蒸馏水,待高锰酸钾完全溶解后称取0.78 g富马酸(天津市福晨化学试剂厂)加入上述溶液中,持续搅拌30 min,在室温下凝胶24 h,随后将所得产物洗涤,并置于110 ℃干燥箱中干燥12 h.将干燥后的产物研磨,并在马弗炉焙烧2 h,温度分别为450 ℃,550 ℃,650 ℃,750 ℃,所得最终产物分别标记为MnO2-450,MnO2-550,MnO2-650,MnO2-750.
1.2 催化剂的表征物相分析采用ULTIMA-Ⅲ型X射线衍射仪(Shimadzu),Cu Kα射线,扫描速率5 °/min,管电压40 kV,管电流20 mA,将衍射图谱与JCPDS标准卡片比照;样品形貌采用扫描电镜(S-3400N(Ⅱ),Hitachi)进行观测,加速电压为0.3~30 kV,工作电压为15 kV;比表面积采用比表面孔径分析仪(ASAP 2380,Micromeritics),样品预先在200 ℃、N2气氛下处理3 h以上,在-196 ℃下进行吸附;H2-TPR采用TP5000化学吸附仪(美国Micromeritics公司)测定,催化剂预先在He气氛中升温到300 ℃处理1 h,随后冷却至室温并切换为氩氢混合气(V(Ar): V(H2)= 95: 5),吹扫至基线稳定后,以10 ℃/min升温至700 ℃进行程序升温还原反应.
1.3 催化剂活性评价在固定床反应装置中进行甲苯催化燃烧性能的测试(反应管的内径为8 mm),催化剂用量0.2 g(40~60目),并与0.2 g(40~60目)石英砂混合均匀,用热电偶测量内部温度.反应前后甲苯浓度的变化由气相色谱仪(Agilent 6820) 在线分析,检测器为氢火焰离子检测器,每隔30 min进样分析.反应气为甲苯和空气的混合气,甲苯通过饱和液体发生器汇入干空气流进入气路,混合气中甲苯的体积分数为0.1%,甲苯的进样质量浓度为4 g/m3,空速为20 000 h-1.起燃温度和完全转化温度分别为甲苯转化率的10%和99%,标记为T10和T99.
2 结果与讨论 2.1 物相表征图 1为不同焙烧温度的条件下制备的二氧化锰样品的X射线衍射(XRD)谱图.结果表明,当焙烧温度为450 ℃时,衍射谱图上是α-MnO2晶相(PDF41-0141) 的衍射峰,特征峰高而尖锐,表明样品结晶度良好,并且没有其他杂相峰.当焙烧温度升至550 ℃时,样品除了具有α-MnO2的特征峰外,还在2θ = 32.8°的位置出现1个杂峰,经过检索发现,该杂相峰与Mn2O3(PDF41-1442) 的特征峰吻合.当焙烧温度继续升到650 ℃和750 ℃时,杂相峰的数目增多,峰的强度增加,检索后发现这些杂相峰与Mn2O3(PDF41-1442) 的特征峰对应.XRD的结果表明,随着焙烧温度的升高,样品在550 ℃焙烧的时候已经出现了Mn2O3的晶相,样品开始由晶相α-MnO2逐渐向晶相Mn2O3转变.

|
图 1 不同焙烧温度时制得二氧化锰的X射线衍射谱图 Figure 1 XRD patterns of MnO2 samples synthesized at various calcination temperature. (a) MnO2-450; (b) MnO2-550; (c) MnO2-650; (d) MnO2-750. |
图 2为不同焙烧温度时制得二氧化锰的扫描电镜(SEM)图像.由图 2(a)可见,样品形貌显示为大小均一的纳米颗粒形貌,直径在20 nm左右.随着焙烧温度的升高,样品形貌出现明显的变化.图 2(b)为550 ℃焙烧所得的样品,可以看出一些小颗粒开始发生团聚.焙烧温度进一步升高至650 ℃,样品的形貌有了新的变化,除了一些团聚的小颗粒,还有部分直径为20 nm,长度为100 nm的纳米短棒,如图 2(c)所示.继续升高焙烧温度至750 ℃,可以看出样品的形貌主要以纳米短棒为主,还存在着一些团聚严重纳米颗粒.这主要是由于高温焙烧,样品不仅局部颗粒已烧结,其晶体结构发生了变化,由α-MnO2转变成Mn2O3,这与相应焙烧温度所得样品的XRD结果是一致的.

|
图 2 不同焙烧温度制得二氧化锰的扫描电镜图形 Figure 2 SEM images of MnO2 prepared at different calcination temperature. (a) MnO2-450; (b) MnO2-550; (c) MnO2-650; (d) MnO2-750 |
图 3为不同焙烧温度时制得二氧化锰的氮气吸附-脱附等温曲线和孔径分布曲线(内图).由图 3(a)~(d)可见,不同焙烧温度下制备的样品均具有第Ⅱ类吸附-脱附等温线.由于P/P0的增大,样品开始发生毛细孔凝聚或者分子层的吸附,当吸附压力达到气体的饱和蒸汽压,液化现象开始发生,吸附量在压力不变的情况下发生垂直上升.吸附脱附曲线存在明显的H3类型滞后环,结果表明材料中具有斜孔,这是由于材料粒子的堆积所导致[17].

|
图 3 不同焙烧温度制得的二氧化锰的N2吸附脱附曲线 Figure 3 N2 adsorption-desorption isotherms of MnO2 prepared at different calcination temperature |
表 1为不同焙烧温度时制得MnO2的微观结构参数结果.可以看出,焙烧温度为450 ℃时制得MnO2的比表面积最大,为60.56 m2/g.随着焙烧温度的升高,样品的比表面积逐渐减小,这可能是因为随着焙烧温度的升高,样品烧结团聚所造成的.各样品的比孔体积变化不明显,表明焙烧温度在450~750 ℃范围内对催化剂的比孔体积影响很小.样品的平均孔径变化明显,随着焙烧温度的升高,平均孔径不断增大,而比孔体积变化很小,说明催化剂种的小孔数量较少,大孔数量增加.
| 表 1 不同焙烧温度时制得二氧化锰的比表面积 Table 1 Specific surface area of MnO2 prepared at different calcination temperature |
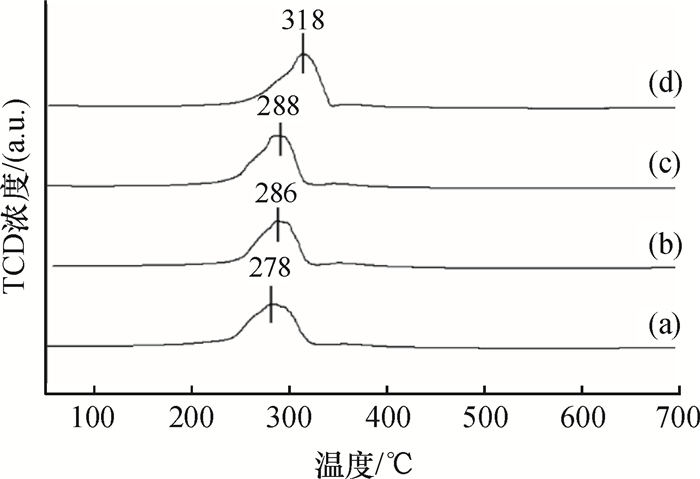
图 4所示是制备的锰氧化物的H2-TPR谱图.据文献[18],锰氧化物催化剂的还原过程一般为:MnO2→Mn2O3→Mn3O4→MnO.从图 4可以看出,催化剂在200~400 ℃有一个大包峰,与上述的还原过程一致.当H2-TPR的反应完成后,可以观察到样品的颜色变为浅绿色,表明H2-TPR实验的产物是MnO.不同焙烧温度的最低还原峰分别为278 ℃、286 ℃、288 ℃和318 ℃,286 ℃和288 ℃焙烧温度下制得的样品还原温度比较接近,可能是由于各催化剂的活性组分差异不大所造成的.由图 4可知,采用450 ℃焙烧的样品具有较低的低温还原峰,因此更加容易被还原.
|
图 4 不同焙烧温度时制得二氧化锰的H2-TPR谱图 Figure 4 H2-TPR patterns of MnO2 samples synthesized at various calcination temperature. (a) MnO2-450; (b) MnO2-550; (c) MnO2-650; (d) MnO2-750. |
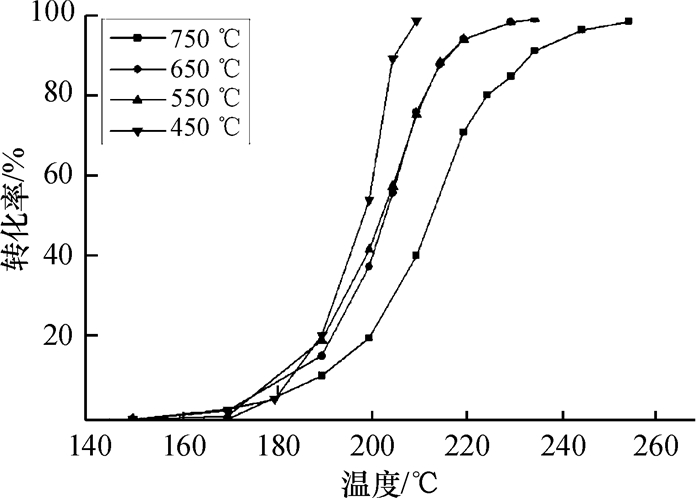
图 5所示为不同焙烧温度下制得二氧化锰催化剂对催化燃烧甲苯性能的影响.结果表明,各催化剂的甲苯催化燃烧活性有所不同,以450 ℃焙烧温度时制得的催化剂活性最高,完全燃烧温度T99约为210 ℃;焙烧温度为550 ℃和650 ℃时制备的催化剂活性次之,且两者的催化活性相近,完全燃烧温度T99约为235 ℃;750 ℃时制备的催化剂活性最差,完全燃烧温度T99约为255 ℃.二氧化锰的催化燃烧活性与其结构或者本身性质有关[7].从前述的表征结果看,样品MnO2-750已经形成晶型较完整的Mn2O3杂相,催化剂材料的比表面积较小,因此表面的活性位也较少.由H2-TPR的结果可知,样品MnO2-750的还原温度与其他样品相比是最高的,说明它的还原能力较差,所以MnO2-750具有较差的催化燃烧甲苯性能.相反,样品MnO2-450为纯相α-MnO2,具有较高的比表面积,因此表面的活性位相对较多,该样品的形貌也较为均一,有助于甲苯分子在催化剂的表面吸附与脱附.它的氢气还原起始温度较低,还原性能较好,因而具有较好的催化燃烧性能.MnO2-550和MnO2-650的催化性能相近,可能是由于它们的还原性能差异不大所造成的.
|
图 5 不同焙烧温度时制得二氧化锰催化剂对甲苯催化燃烧性能的影响 Figure 5 Effect of MnO2 obtained at various calcination temperatures on catalytic activity |
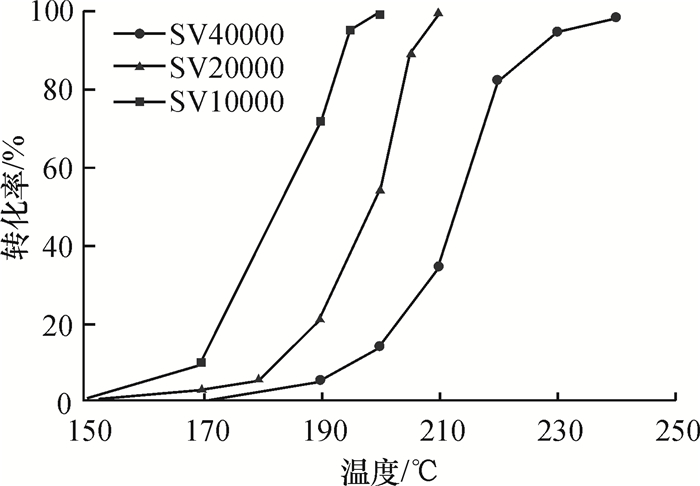
空速是影响催化燃烧性能的另一个重要因素.当甲苯进样浓度为4 g·m-3时,本文考察了不同的空速对二氧化锰催化活性的影响,如图 6所示.以450 ℃焙烧制备的二氧化锰催化剂为例,随着空速的提高,催化燃烧的曲线向高温范围偏移.由于空速的大小表示反应的气体分子在催化剂上停留时间的长短.当提高反应的空速,气体分子在催化剂表面的停留时间逐渐减少,少量甲苯分子没有被吸附在催化剂表面的活性位上会被立即带离催化剂的表面,因此,甲苯分子的催化燃烧不够充分,性能下降.
|
图 6 不同空速对二氧化锰催化剂催化活性的影响 Figure 6 Effect of different SV on catalytic activity of MnO2 |
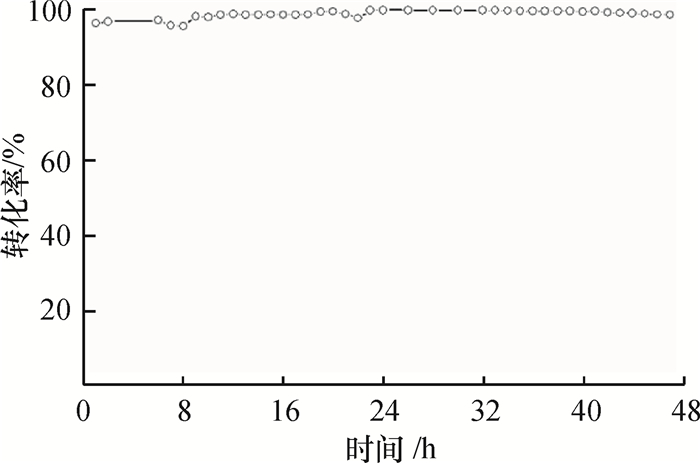
为了进一步考察催化剂的使用稳定性,将MnO2-450催化剂在甲苯进料浓度为4 g·m-3,空速为20 000 h-1,反应温度为210 ℃的条件下连续反应48 h,其结果如图 7所示.可以看出,在反应48 h的过程中,催化剂显示出优良的催化活性和较高的稳定性,甲苯转化率始终保持在95%以上.
|
图 7 MnO2-450催化剂催化甲苯燃烧性能 Figure 7 Toluene conversion as a function of reaction time over MnO2-450 |
本文以高锰酸钾和富马酸为原料合成了α-MnO2催化剂,考察了不同焙烧温度制备的α-MnO2对催化燃烧甲苯活性的影响.
(1) 焙烧温度对催化剂结构物相、形貌与比表面积有着明显的影响.焙烧温度为450 ℃时制备的材料为单相α-MnO2的纳米颗粒,随着焙烧温度的提高会有Mn2O3杂相形成,且比表面积减小.
(2) 焙烧温度对催化剂的催化燃烧的活性影响较大.随着焙烧温度的提高,催化剂的活性逐渐降低.焙烧温度为450 ℃时制备的催化剂催化性能最佳.
(3) 焙烧温度为450 ℃时制备的MnO2具有较大的比表面积(60.56 m2/g)和较低的氢气还原温度,形貌为单一均匀的粒子状,因此具有较好的催化燃烧甲苯性能,燃烧完全的温度为210 ℃.
| [1] |
王永强, 肖丽, 孙启猛, 等. Pd/La0.8Ce0.2MnO3/ZSM-5的制备及其甲苯催化燃烧活性[J].
燃料化学学报, 2014, 42(9): 1146-1152.
WANG Y Q, XIAO L, SUN Q M, et al. Preparation of the Pd/La0.8Ce0.2MnO3/ZSM-5 catalyst and its performance in catalytic combustion of toluene[J]. Journal of Fuel Chemistry and Technology, 2014, 42(9): 1146-1152. |
| [2] |
李永峰, 张碧欣, 文武, 等. 无过渡涂层铂基整体式催化剂的制备和应用[J].
现代化工, 2014(8): 110-113.
LI Y F, ZHANG B Y, WEN W, et al. Preparation and application of Pt-based monolithic catalysts without interlayer coating[J]. Modern Chemical Industry, 2014(8): 110-113. |
| [3] | LI W B, CHU W B, ZHUANG M, et al. Catalytic oxidation of toluene on Mn-containing mixed oxides prepared in reverse microemulsions[J]. Catalysis Tday, 2004, 93: 205-209. |
| [4] | LI Y F, LI Y, YU Q, et al. The catalytic oxidation of toluene over Pd-based FeCrAl wire mesh monolithic catalysts prepared by electroless plating method[J]. Catalysis Communications, 2012, 29: 127-131. DOI: 10.1016/j.catcom.2012.09.035. |
| [5] |
士丽敏, 储伟, 陈慕华, 等. 挥发性有机化合物催化燃烧用铂基催化剂的研究进展[J].
现代化工, 2006, 26(5): 24-28.
SHI L M, CHU W, CHEN M H, et al. Research progress in supported platinum catalysts for VOCs catalytic combustion[J]. Modern Chemical Industry, 2006, 26(5): 24-28. |
| [6] | KIM S C, SHIM W G. Catalytic combustion of VOCs over a series of manganese oxide catalysts[J]. Applied Catalysis B: Environmental, 2010, 98(3): 180-185. |
| [7] | WANG F, DAI H, DENG J, et al. Manganese oxides with rod-, wire-, tube-, and flower-like morphologies: highly effective catalysts for the removal of toluene[J]. Environmental Science & Technology, 2012, 46(7): 4034-4041. |
| [8] | SUN M, LAN B, YU L, et al. Manganese oxides with different crystalline structures: Facile hydrothermal synthesis and catalytic activities[J]. Materials Letters, 2012, 86: 18-20. DOI: 10.1016/j.matlet.2012.07.011. |
| [9] | SHI F, WANG F, DAI H, et al. Rod-, flower-, and dumbbell-like MnO2: Highly active catalysts for the combustion of toluene[J]. Applied Catalysis A: General, 2012, 433: 206-213. |
| [10] |
金云舟, 钱君律, 伍艳辉. 溶胶-凝胶法制备催化剂的研究进展[J].
工业催化, 2006, 14(11): 60-63.
JIN Y Z, QIAN J L, WU Y H. Advances in preparation of catalysts by sol-gel method[J]. Industrial Catalysts, 2006, 14(11): 60-63. DOI: 10.3969/j.issn.1008-1143.2006.11.015. |
| [11] | 王芳. 规整形貌MnOx的可控合成及其对甲苯氧化的催化性能研究[D]. 北京: 北京工业大学环境与能源工程学院, 2012. |
| [12] |
徐士伟, 储伟, 戴晓雁. 溶胶凝胶法制备甲醇裂解铜系催化剂[J].
化学研究与应用, 2005, 17(1): 110-110.
XU S W, CHU W, DAI X Y. Preparation of copper based catalysts by sol-gel technique for methanol decomposition to hydrogen[J]. Chemical Research and Application, 2005, 17(1): 110-110. |
| [13] |
孙明, 余林, 方奕文, 等. 氧化锰八面体分子筛:阴阳复合模板剂合成及二甲醚催化燃烧性能[J].
无机化学学报, 2008, 24(11): 1852-1858.
SUN M, YU L, FANG Y W, et al. Manganese oxide octahedral molecular sieves: preparation by mixed cationic/anionic surfanctans and application in catalytic combustion of dimethyl ether[J]. Chinese Journal of Inorganic Chemistry, 2008, 24(11): 1852-1858. DOI: 10.3321/j.issn:1001-4861.2008.11.022. |
| [14] |
高岩, 栾涛, 徐宏明, 等. 焙烧温度对选择性催化还原催化剂表征及活性的影响[J].
中国电机工程学报, 2012, 32(1): 143-150.
GAO Y, LUAN T, XU H M, et al. Sintering Temperature Effects on SCR Catalyst Characterization and Catalytic Efficency[J]. Proceedings of the CSEE, 2012, 32(1): 143-150. |
| [15] | VENKATASWAMY P, RAO K N, JAMPAIAH D, et al. Nanostructured manganese doped ceria solid solutions for CO oxidation at lower temperatures[J]. Applied Catalysis B: Environmental, 2015, 162: 122-132. DOI: 10.1016/j.apcatb.2014.06.038. |
| [16] | RIDA K, BENABBAS A, BOUREMMAD F, et al. Effect of calcination temperature on the structural characteristics and catalytic activity for propene combustion of sol-gel derived lanthanum chromite perovskite[J]. Applied Catalysis A: General, 2007, 327(2): 173-179. DOI: 10.1016/j.apcata.2007.05.015. |
| [17] |
孙明, 邢泽峰, 刘胜男, 等. 一步水热合成Ag-OMS-2纳米棒及其催化燃烧性能研究[J].
天然气化工: C1化学与化工, 2013, 38(2): 11-14.
SUN M, XING Z F, LIU S N, et al. One-step hydrothermal of Ag-OMS-2 nanorods and their catalytic combustion activities[J]. Natural Gas Chemical Industry, 2013, 38(2): 11-14. |
| [18] | TORRES J Q, GIRAUDON J M, LAMONIER J F. Formaldehyde total oxidation over mesoporous MnOx catalysts[J]. Catalysis Today, 2011, 176(1): 277-280. DOI: 10.1016/j.cattod.2010.11.089. |
 2016, Vol. 33
2016, Vol. 33