2. 广东工业大学 轻工化工学院,广东 广州 510006
2. School of Chemical Engineering and Light Industry, Guangdong University of Technology, Guangzhou 510006, China
二氢杨梅素(Dihydromyricetin,DMY)是天然多酚羟基双氢黄酮醇类化合物,为藤茶中的主要活性成分,在藤茶幼嫩的茎叶中含量很高,达38%以上[1].DMY在抗菌、抗氧化、降血糖、降血脂、增强免疫、保肝、抗癌等方面具有显著的生理活性,其生理毒性较小.其中,在抗氧化方面DMY可抑制自由基对人体各组织器官的损害,且随着DMY纯度(60%~ 90%)的增加,其抗氧化活性明显增强[2-5].
DMY分子结构具有完整的大π键共轭结构、较高的超离域度、强配位氧原子及合适的空间构型,是金属离子很好的螯合配体.铜离子在人体内具有电子载体和载氧色素的作用,且起着独特的催化作用,通常以蛋白质-铜复合物的形式存在,共同参与体内一些重要的酶及色素的合成.同时还可加速幼稚红细胞的成熟和释放[6-7].近年来有研究发现,许多生物活性成分的生理功效是通过其与金属离子相互作用产生的,且生物活性成分和金属离子的相互作用可以改变活性成分配体的生物效应,具有更强的生理功效[8-9],DMY与金属离子螯合配位后,其生理活性均有明显增强[10-11].DMY和铜离子具有很好的螯合性,而有关DMY-Cu(Ⅱ)配合物抗氧化活性的研究尚未见报道.本研究对DMY和DMY-Cu(Ⅱ)金属配合物清除羟基自由基(OH·)、超氧阴离子自由基(O2-·)和DPPH自由基(DPPH·)的能力进行比较,首次对比研究了DMY-Cu(Ⅱ)金属配合物和DMY配体在体外抗氧化活性,其结果为进一步寻找低毒、高效的天然黄酮改性产物作为抗氧化剂和药物提供一定的借鉴.
1 实验部分 1.1 仪器及试剂VERTEX 70型FTIR傅立叶红外光谱仪(德国Bruker公司);FluoroMax-4 VPF-100型荧光分光光度计(法国HORIBA Jobin Yvon公司);STA-409PC集合热分析仪(德国耐驰仪器制造有限公司)(升温速率为15 ℃/min,空气气氛,从室温升至800 ℃);Vario EL元素分析仪(德国Elementar公司);DF-101S型定时恒温磁力搅拌器(予华有限公司).
DMY(99%)自制;1, 1-二苯基苦基苯肼(DPPH) (美国Sigma公司);邻苯三酚、醋酸铜、双氧水等均为分析纯试剂.
1.2 实验方法 1.2.1 二氢杨梅素-铜配合物的制备称取0.920 g(4.0 mmol) DMY,置于160 mL无水乙醇中,加热、搅拌至完全溶解后,加入适量的无水醋酸钠调节pH值至7.0~8.0,继续搅拌1 h,而后加入0.798 g(4.0 mmol) (CH3COO)2Cu·2H2O,在70 ℃下搅拌回流8 h.然后待静置析出红褐色沉淀物后减压抽滤,将抽滤得到的沉淀物依次用无水乙醇和水反复洗涤.最后干燥,得到的红褐色粉状固体即为DMY-Cu(Ⅱ)金属配合物.
1.2.2 超氧阴离子自由基O2-·清除率的测定据文献[12-13]取5 mL 50 mmol/LTris-HCl缓冲液(pH为8.2),加入无水乙醇和去离子水各1 mL,混和均匀后在25℃的水浴中保温20 min.然后加入0.5 mL浓度为3 mmol/L的邻苯三酚(用10 mmol/LHCl配制),空白组为10 mmol/L的HCl溶液,迅速摇匀之后在波长320 nm下每隔30 s测定其吸光度,计算线性范围内1 min吸光值的增加值A1即邻苯三酚的自氧化速率.另外取5 mL 50 mmol/L的Tris-HCl缓冲液(pH为8.2),在加入邻苯三酚前先加入1 mL的DMY-Cu(Ⅱ)金属配合物溶液(无水乙醇溶解),同样方法操作,计算线性范围内每l min吸光度的增加值Ax即为加样品后邻苯三酚的自氧化速率.每个样品平行操作3次,求其平均值.清除率=[(A1-Ax)/A1]×100%.
1.2.3 羟自由基OH·清除率的测定根据Fenton方法[14],H2O2与亚铁离子可反应生成OH·,OH·存活时间较短但具有很高的活性.OH·用水杨酸显色能形成红色物质,该物质在波长510 nm处能被较强地吸收.由于其呈色与OH·量成正比,若在该体系中加入具有清除OH·功能的化合物,则会使有色物质的浓度大为降低.本实验采用Fenton方法研究DMY-Cu(Ⅱ)金属配合物清除OH·的能力.取3.00 mL 2 mmol/L FeSO4溶液,3.00 mL 6 mmol/L水杨酸-乙醇溶液,3 mL样品液(DMY-Cu(Ⅱ)金属配合物溶液)以及0.3 mL 0.3% H2O2溶液,混匀后在37℃的恒温水下反应40 min,在510 nm处测定其吸光度值Ax.另外以0.3 mL的蒸馏水代替0.3 mL 0.3% H2O2溶液,同样方法操作,在510 nm处测定其吸光度值A1.用3 mL的蒸馏水代替3 mL样品液,同样方法操作,测定吸光度值为A0.每个样品平行操作3次,求其平均值.清除率=[1-(Ax-A1) /A0]×100%.
1.2.4 DPPH·清除能力测定据文献[15-16]取2 mL DMY-Cu(Ⅱ)金属配合物(无水乙醇溶解),向其中加入2 mL 0.01 mmol/L DPPH无水乙醇溶液,在室温条件下避光反应30 min后,在波长517 nm处测量其吸光度Ax,用等体积的无水乙醇代替DPPH无水乙醇溶液作为空白组,在波长517 nm处测定其吸光度为A1,直接用DPPH无水乙醇溶液作为对照组,测定其吸光度为A0.每个样品平行操作3次,求其平均值.清除率=[1-( Ax-A1) /A0]×100%.
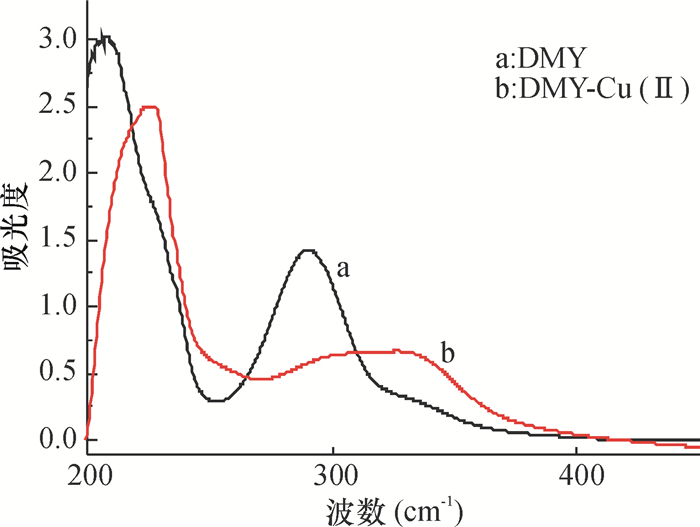
2 结果与讨论 2.1 DMY-Cu(Ⅱ)金属配合物的结构表征DMY及DMY-Cu(Ⅱ)金属配合物的紫外光谱如图 1所示,图 1中DMY分别在200~230 nm和280~310 nm处有吸收峰.当DMY与Cu2+螯合后DMY的吸收峰发生明显的红移,其红移现象可能是由于DMY与Cu2+形成配合物后,DMY配体上-OH的氢电离导致苯环与氧原子的共轭作用加强,使共轭体系电子的离域性增大,跃迁的能量降低,则吸收峰的位置自然向低波数方向移动.由图 1表明DMY与Cu2+发生了螯合作用.
|
图 1 DMY-Cu(Ⅱ)金属配合物及DMY的紫外光谱图 Figure 1 UV-Vis spectra of complex DMY-Cu(Ⅱ)and DMY |
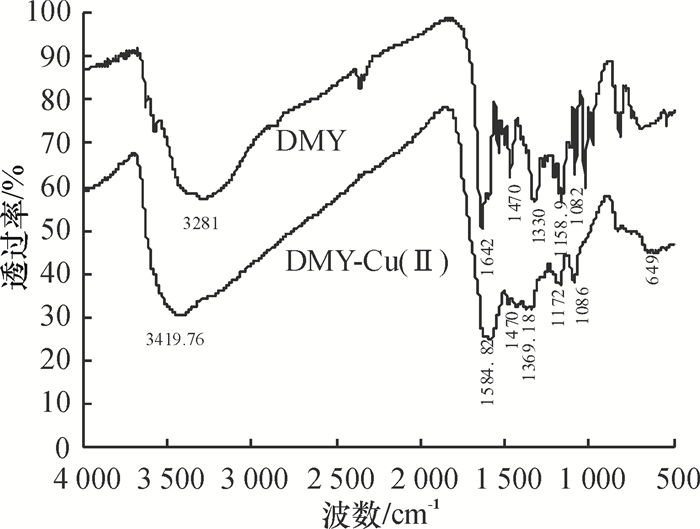
采用KBr压片法测定DMY-Cu(Ⅱ)金属配合物与DMY的红外吸收光谱(见图 2),用元素分析仪分析配合物中C、O、H和Cu元素的含量,其实验数据见表 1.
|
图 2 DMY及DMY-Cu(Ⅱ)金属配合物的红外光谱图 Figure 2 The IR spectra of complex DMY and DMY-Cu(Ⅱ) |
| 表 1 DMY-Cu(Ⅱ)配合物的元素分析数据 Table 1 The elemental analysis data of DMY-Cu(Ⅱ |
对比DMY与DMY-Cu(Ⅱ)金属配合物红外光谱可知,DMY-Cu(Ⅱ)金属配合物在1 450~1 600 cm-1处苯环骨架的吸收峰基本上无变化.同时C-O-C振动频率也基本上无变化,这说明DMY与Cu2+发生螯合后其苯环结构依然存在.在3 419.76 cm-1出现-OH特征吸收峰,则说明DMY与Cu2+发生螯合后其-OH还存在.与DMY的红外光谱相比,DMY的C=O吸收峰在1 642 cm-1,当与Cu2+作用时其吸收峰红移到1 584.82 cm-1,此外配合物在649 cm-1出现新的吸收峰,说明DMY与Cu2+发生了螯合作用并形成以Cu-O键结合的DMY-Cu(Ⅱ)金属配合物.元素分析测得配合物中C、H、O和Cu元素的含量与理论计算的结果也相当.
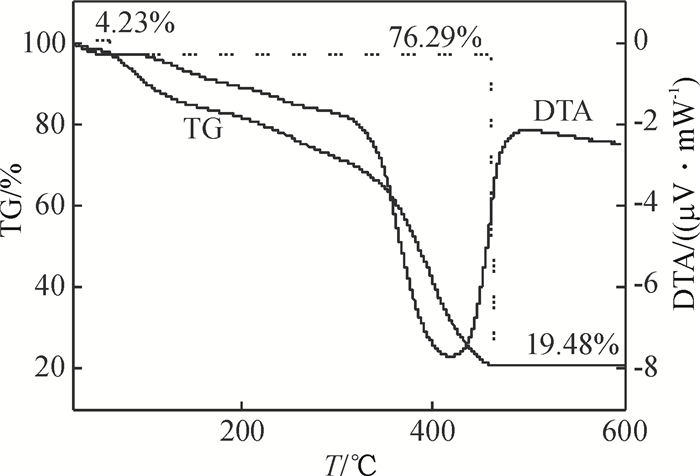
DMY-Cu(Ⅱ)金属配合物的热重分析结果如图 3所示.图 3中明显看出DMY-Cu(Ⅱ)金属配合物在100℃以下失重,其失重率约为4.23%,与失去1个水分子的量相当(理论计算失重率为4.50%),则说明此阶段失重的水为配合物分子外的结晶水.在120~420 ℃的失重为配体的燃烧分解,当温度升至460℃后配合物基本上没有失重,最后的残余物为氧化铜19.48%(理论计算值为20.00%).从整个热分解过程来看,DMY-Cu(Ⅱ)金属配合物热重的实验值与理论计算值基本相吻合.另据红外光谱的结果、元素分析及热重分析可以推断DMY易与Cu2+发生配合作用,其金属配合物的组成为[C15Hl0O8Cu]·H2O.
|
图 3 DMY-Cu(Ⅱ)配合物的TG-DTA分析 Figure 3 TG-DTA analysis of DMY-Cu (Ⅱ) complex |
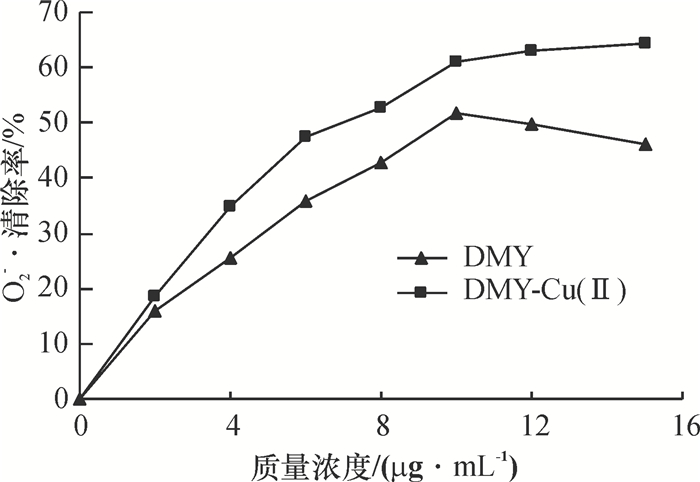
DMY和DMY-Cu(Ⅱ)配合物清除O2-·的测试结果如图 4所示.DMY对O2-·的清除率先随着样品浓度的增大而升高,当质量浓度大于10μg/mL时,随着DMY浓度增大对O2-·的清除率反而降低,其原因可能是在此条件下(pH 8.2) DMY部分结构发生开环和产生自氧化作用,导致其抗氧化活性降低.而DMY-Cu(Ⅱ)配合物对O2-·的清除效果随着浓度的增大逐渐增大,且清除效果明显优于配体DMY,说明在此条件下DMY-Cu(Ⅱ)配合物比配体DMY更稳定,不易发生自氧化作用;同时,也说明Cu2+与有机活性配体DMY协同作用可提高DMY抗O2-·活性的能力.
|
图 4 DMY及DMY-Cu(Ⅱ)配合物对O2-·自由基的清除作用 Figure 4 Scavenging effect of DMY and DMY-Cu(Ⅱ)complex on O2-· |
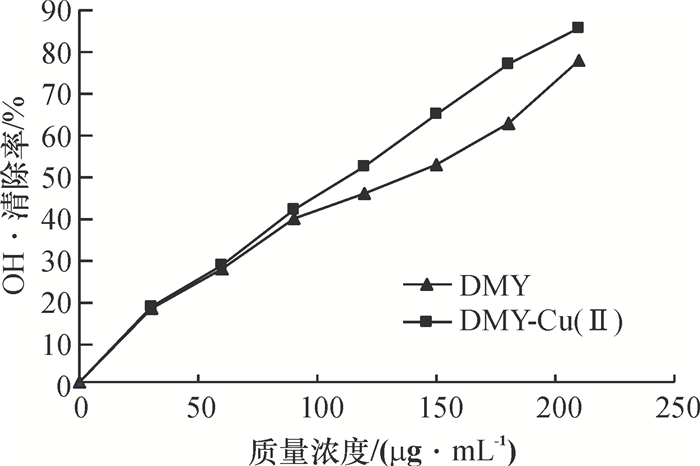
DMY和DMY-Cu(Ⅱ)金属配合物对OH·清除测试结果如图 5所示,其清除效果均随浓度的增大而增大.在低浓度的情况下二者对OH·清除作用基本相近,无大差异.然而在质量浓度大于60 μg/mL后DMY-Cu(Ⅱ)配合物对OH·清除效果明显优于DMY,说明Cu2+与有机活性配体DMY协同作用可提高DMY抗OH·活性的能力.
|
图 5 DMY及DMY-Cu(Ⅱ)配合物对OH·自由基的清除作用 Figure 5 Scavenging effect of DMY and DMY-Cu(Ⅱ)complex on OH· |
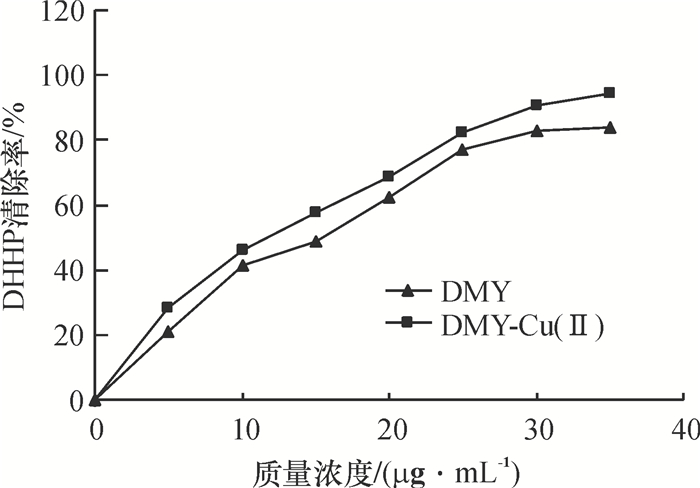
从图 6可知,DMY和DMY-Cu(Ⅱ)金属配合物对DPPH·均具有很好的清除作用,而且清除效果均随浓度的增大而增大.当DMY质量浓度大于30 μg/mL时,其清除率达到80%以上后,再随着DMY浓度的增加,其清除率变化很小.而DMY-Cu(Ⅱ)配合物对DPPH·的清除率随其浓度的增加呈线性增大,且相同浓度下DMY-Cu(Ⅱ)配合物对DPPH·的清除效果明显优于DMY,则说明Cu2+与有机活性配体DMY协同作用可提高DMY抗DPPH·活性的能力.
|
图 6 DMY及DMY-Cu(Ⅱ)配合物对DPPH·的清除作用 Figure 6 Scavenging effect of DMY and DMY-Cu(Ⅱ)complex on DPPH· |
在碱性条件下DMY易与Cu2+相互作用产生DMY-Cu(Ⅱ)金属配合物,通过紫外光谱、红外光谱、元素分析及热重-热差分析等对DMY-Cu(Ⅱ)金属配合物的结构进行表征,确定其组成为[C15Hl0O8Cu]·H2O.通过研究DMY-Cu(Ⅱ)配合物的抗氧化活性,结果表明DMY-Cu(Ⅱ)配合物比DMY具有更强的清除O2-·、OH·和DPPH·的能力,且DMY-Cu(Ⅱ)配合物抗氧化作用的稳定性更好.本研究的结果拓展了DMY的应用,为进一步寻找低毒、高效的天然黄酮改性化合物作为食品添加剂和药物提供一定的借鉴.
| [1] |
王丹, 郁建平, 刘灏. 藤茶二氢杨梅素抗氧化活性研究[J].
山地农业生物学报, 2013, 32(3): 243-246.
WANG D, YU J P, LIU H. The in Vitro and vivo antioxidant activity of Dihydromyricetin isolated from Ampelopsis grossedentata[J]. Journal of Mountain Agriculture and Biology, 2013, 32(3): 243-246. |
| [2] |
袁娟, 郭清泉, 曾金华, 等. 二氢杨梅素-锌配合物的合成及其与DNA相互作用研究[J].
分析测试学报, 2012, 31(8): 982-986.
YUAN J, GUO Q Q, ZENG J H, et al. Study on synthesis of Dihydromyricetin-Zinc complex and its interaction with DNA[J]. Journal of Instrumental Analysis, 2012, 31(8): 982-986. |
| [3] | XU Y, WANG F, WANG L, et al. Sensitive voltammetric sensor of dihydromyricetin based on Nafion/SWNT-modified glassy carbon electrode[J]. J Solid State Electrochem, 2012, 16: 1473-1480. DOI: 10.1007/s10008-011-1535-0. |
| [4] |
董倩倩, 陈立峰. 二氢杨梅素药理研究进展[J].
中南药学, 2005, 5(3): 295-298.
DONG Q Q, CHEN L F. Advances on pharmacological research of Dihydromyricetin[J]. Central South Pharmacy, 2005, 5(3): 295-298. |
| [5] | SHENY, LINDEMEYER A K, Gonzalez C, Shao, et al. Dihydromyricetin as a novel anti-alcohol intoxication medication[J]. J Neuro Sci, 2012, 32(1): 390-401. |
| [6] | PANDELOVA M, LOPEZ W L, Michalke B, et al. Ca, Cd, Cu, Fe, Hg, Mn, Ni, Pb, Se, and Zn contents in baby foods from the EU market: Comparison of assessed infant intakes with the present safety limits for minerals and trace elements[J]. J Food Comp Anal, 2012, 27(2): 120-127. DOI: 10.1016/j.jfca.2012.04.011. |
| [7] | HäNSCH R, MENDEL R R. Physiological functions of mineral micronutrients (Cu, Zn, Mn, Fe, Ni, Mo, B, Cl)[J]. Curr Opin Plant Biol, 2009, 12(3): 259-266. DOI: 10.1016/j.pbi.2009.05.006. |
| [8] |
李翠萍, 曹输稳, 余燕影. 二氢杨梅素研究进展[J].
化学试剂, 2010, 32(7): 608-612.
LI C P, CAO S E, YU Y Y. Advance in research on dihydromyricetin[J]. Chemical Reagents, 2010, 32(7): 608-612. |
| [9] | WU C, ZHENG X P, CHEN L L. Study on antioxidant activity of Dihydromyricetin-Zinc(Ⅱ) complex[J]. Adv Mater Res, 2011(183-185): 863-867. |
| [10] | SATHYADEVI P, KRISHNAMOORTHY P, BUTORAC R R, et al. Effect of substitution and planarity of the ligand on DNA/BSA interaction, free radical scavenging and cytotoxicity of diamagnetic Ni(Ⅱ) complexes: A systematic investigation[J]. Dalton Trans, 2011, 40: 9690-9696. DOI: 10.1039/c1dt10767d. |
| [11] |
李海霞. 二氢杨梅素-镍配合物的制备及其羟自由基的清除作用[J].
中国酿造, 2013, 32(5): 70-72.
LI H X. Synthesis and its OH·free radical scavenge capacity of dihydromyricetin-Ni complexes[J]. China Brewing, 2013, 32(5): 70-72. |
| [12] |
黄池宝, 罗宗铭, 宾丽英. 黄酮类化合物抗氧化性与其结构关系的研究[J].
广东工业大学学报, 2000, 17(2): 71-75.
HUAGN C B, LUO Z M, BIN L Y. Study on the relation between structure and antioxygenic activity of Flavonoid[J]. Journal of Guangdong University of Technology, 2000, 17(2): 71-75. |
| [13] | SHUKLA S, MEHTA A, MEHTA P, et al. Antioxidant ability and total phenolic content of aqueous leaf extract of Stevia rebaudiana[J]. Bert Exp Toxicol Pathol, 2012, 64(7-8): 807-811. DOI: 10.1016/j.etp.2011.02.002. |
| [14] |
颜军, 苟小军, 邹全付, 等. 分光光度法测定Fenton反应产生的羟基自由基[J].
成都大学学报(自然科学版), 2009, 28(2): 91-92.
YAN J, GOU X J, ZOU Q F, et al. Determination of hydroxyl radical generating from Fenton reaction by spectrophotometry[J]. Journal of Chengdu University (Natural Science Edition), 2009, 28(2): 91-92. |
| [15] |
翟广玉, 颜子童, 渠文涛, 等. 槲皮素锡的合成及其生物活性研究[J].
信阳师范学院学报(自然科学版), 2013, 26(1): 111-114.
ZHAI G Y, YAN Z T, QU W T, et al. Synthesis and biological activities of Quercetin-Sn[J]. Journal of Xinyang Normal University(Natural Science Edition), 2013, 26(1): 111-114. |
| [16] | Gülçina, Elmastaξ M, Aboul-Enein H Y. Antioxidant activity of clove oil—a powerful antioxidant source[J]. Arab J Chem, 2012, 5(4): 489-499. DOI: 10.1016/j.arabjc.2010.09.016. |
 2016, Vol. 33
2016, Vol. 33