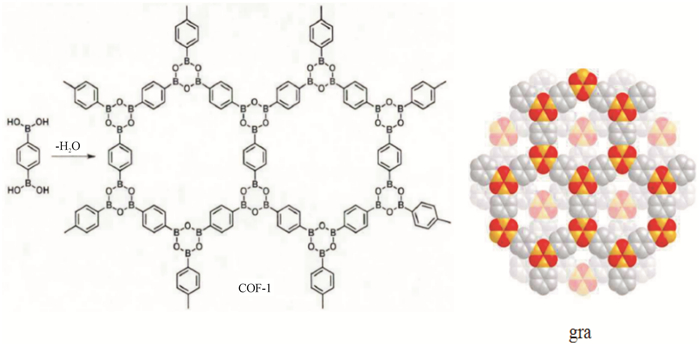
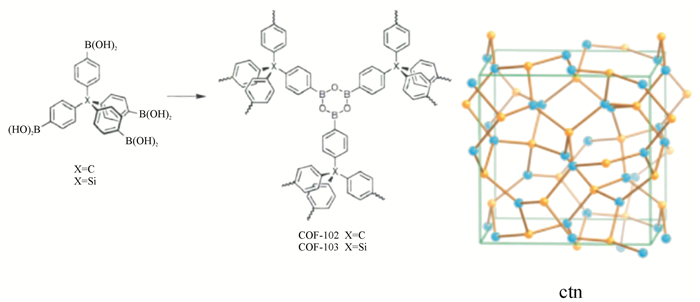
有机多孔材料是一种由相互贯通或者封闭的纳米孔洞构成网络结构的聚合物,因其具有大的比表面积和相对较低的密度,而被广泛用于气体存储及分离、非均相催化、光电等领域[1].按照有机多孔材料结构的规整性,可以将其分为无定形多孔材料和晶形多孔材料.无定形有机多孔材料主要包括固有微孔聚合物(PIMs)和共轭有机微孔聚合物(CMPs);晶形多孔材料主要有金属有机框架(MOFs)材料和共价有机框架(COFs)材料[2].晶形多孔材料较无定形多孔材料有如下优势:材料密度低、比表面积大、结构规整、孔道均一和结构相对稳定等特点.MOFs材料是金属与有机配体通过配位键结合而形成的晶形多孔材料,COFs材料是有机构筑基元通过共价键结合形成的晶形多孔材料[3],两者相比,COFs材料的热稳定性和化学稳定性更突出,应用前景更加广阔.Yaghi等[3]运用框架化学(Reticuler Chemistry)[4-5]设计思想,利用1, 4-对二苯硼酸通过自身脱水缩合形成B3O3,首次成功合成共价有机框架聚合物COF-1(见图 1),从而使COFs材料得到发展.Yaghi等[6]又采用具有正四面结构的四苯甲烷硼酸衍生物和六羟基三苯制备了一系列新型的具有3D构型的COFs材料,将二维结构成功拓展到三维,其中COF-103(见图 2)的比表面积为4 210 m2/g,是当时报道的比表面积最大的多孔有机晶体材料,而COF-108由于结晶属于较为空旷的bor型拓扑结构,其密度仅为0.179 g/cm3,是目前所发现的晶体材料中最轻的物质.
|
图 1 1,4-对二苯硼酸脱水自身缩合形成COF-l[3] Figure 1 Dehydration condensation of 1, 4-diphenyl boric acid to synthesize COF-l[3] |
|
图 2 四面体硼酸自身脱水缩合形成COF-102和COF-103[6] Figure 2 Self-condensation of tetrahedron boric acid to synthesize COF-102 and COF-103[6] |
COFs材料具有确定的构建方式,材料的结构可以根据单体的类型和构建方式来预测,控制孔径的大小可以通过改变构筑基元的大小或者调节其侧链长度.COFs材料的这种丰富的空间拓扑结构、可设计性、结构可调控性、高比表面积和低密度等特点,使其在气体储存、多相催化、光电器材等领域展现出潜在的应用前景.目前对COFs的研究重点集中在单体设计、合成方法和构建方式上,通过设计具有特殊性能的构筑基元从而合成不同结构和应用性能的COFs材料.
本文简要综述了COFs材料的构筑基元、构建方式和制备方法,以及COFs材料在气体储存分离、催化、光电等方面的应用,最后展望了COFs材料在这些领域的研究发展趋势.
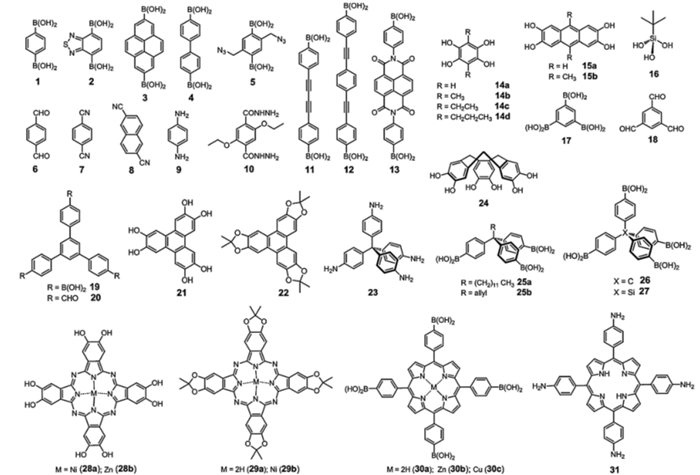
1 构筑基元和构建方式合成COFs材料的构筑基元必须满足两个基本条件:(1) 反应必须是可逆反应,构筑基元必须含有能引发可逆反应的反应基团;(2) 构筑基元在COFs材料中保持结构不变[7],构筑基元可以支撑整个骨架,限制聚合物链的自由旋转,避免骨架结构的变形或塌陷,提供较多自由空隙[8].人们可以根据用于合成COFs材料的构筑基元的特点及种类寻找新的构筑基元,通过对合成COFs材料构筑基元的筛选及修饰,不但实现了对COFs材料拓扑结构的可控性,而且还实现了对COFs材料孔径的可调性[5].如图 3所示,这些构筑基元已经成功应用于COFs材料的合成,它们的共同特点是:结构简单,容易合成;含有大的共轭体系,具有刚性结构.大体上可以将这些构筑基元分为以下几类:硼酸类、酚类、醛类和胺类.其中以硼酸类为构筑基元的COFs材料合成方法相对容易,操作简单.
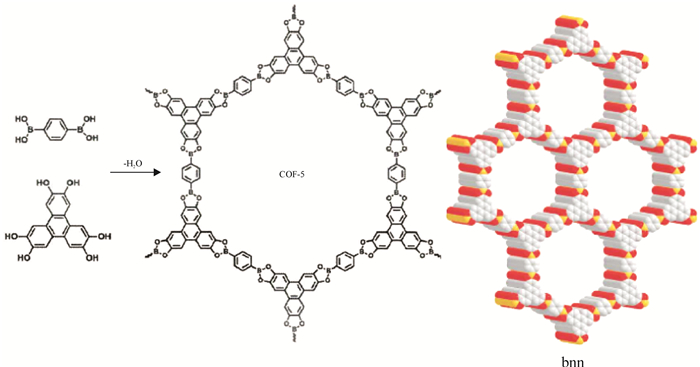
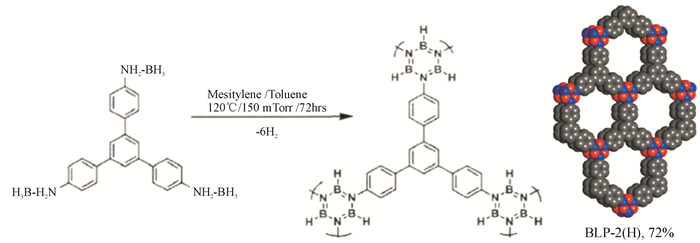
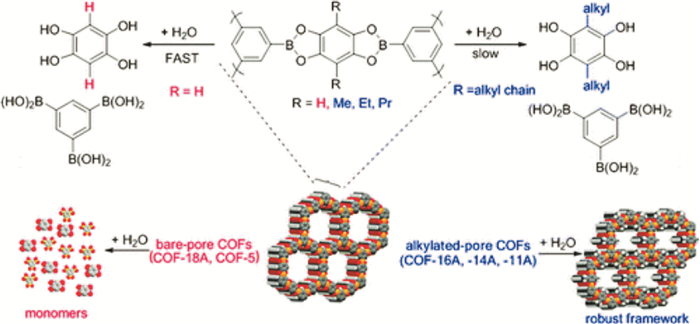
Yaghi等在报道COF-1的同时,利用1, 4-对二苯硼酸与2, 3, 6, 7, 10, 11-六羟基三苯脱水共缩合形成硼酸酯的方法合成了一种层与层平行排列的bnn结构的二维COFs材料(COF-5).COF-5的比表面积高达1 590 m2/g,孔径分布为2.7 nm(见图 4).对于COF-1和COF-5结构不同的现象,Yaghi等人认为不同反应温度下自缩合反应与共缩合反应是一对竞争反应的结论,同时暗示了COFs材料的形成是一个热力学控制的过程.Kaderi[10]小组成功报道了首例通过胺硼烷热解形成硼唑环,得到了一种层与层平行排列的bnn结构的二维晶形材料BLP-2(H)(见图 5),该材料比表面积为1 178 m2/g.然而硼酸类COFs材料中易水解的非C—C共价键,遇水不稳定,是该类材料的缺点,阻碍其应用.Lavigne等人[11]研究不同烷基修饰的COFs材料对水的稳定性.实验证明,通过烷基修饰的COFs材料遇水部分解离,但比表面积变化不大;而没有被烷基修饰的COFs材料遇水完全解离,结构几乎完全塌陷.这是因为在被烷基修饰的COFs材料中,烷基伸展在COFs材料的孔中有效地掩盖了硼的酸性位,阻碍了水的进攻,从而减慢了COFs材料的水解,提高了稳定性(见图 6).Hong Xu等人[12]通过亚胺连接得到六方二维分层架构的稳定的COFs材料.他们将电子供体集团合并到亚胺连接的苯环,极化亚胺键发生软化,这种电子效应降低了层间的排斥力并加强了层间的相互作用,增加了COFs材料的稳定性.
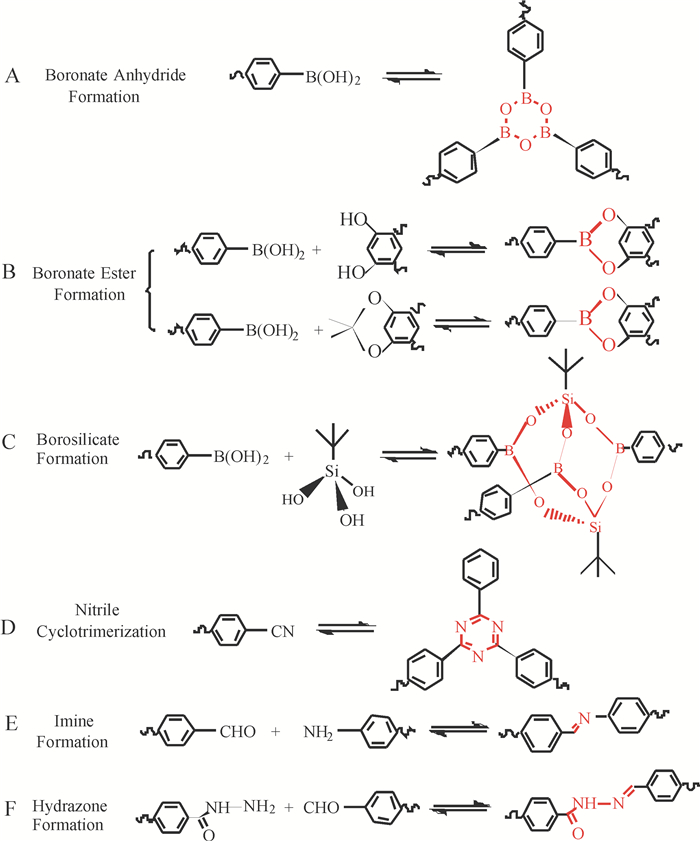
图 7列举了已报道的COFs材料的构建方式.从图中可以看出目前合成COFs材料的反应都是基于可逆反应.这些反应包括硼酸自缩合反应、硼酸与双羟基的共缩合反应、硼酸与硅醇形成硼酸硅脂反应、硼酸热解成硼唑环的反应、醛基与氨基缩合形成亚胺键和酰肼键反应、氨基三聚反应.适用氨基自聚的构建基元较少;B—O键对水和空气稳定性差,结构容易变形;亚胺键构建方式操作简单,反应高效,结构稳定,从而受到研究者的青睐.
|
图 7 COFs材料的连接方式[9] Figure 7 Schematic representation of the dynamic chemical reactions for the preparation of COFs. The covalent bonds formed through these synthetic routes are highlighted in red[9] |
Yaghi小组[13]首次将胺基和醛基缩合形成亚胺键的反应合成COFs材料.该小组利用线性的1, 4-对二苯甲醛与具有四面体结构的四氨基四苯甲烷反应得到一种五重互穿的金刚石拓扑结构的高度结晶COF-300(见图 8).Zhang等人[14]利用亚胺键合成三维COF-320,实验结果表明COF-320拥有稳定的多孔结构,其BET比表面积为2 400 m2/g,甲烷的贮存量为15.0%(质量分数).这表明通过亚胺键构建的COFs材料结构稳定,孔道结构不容易塌陷.Kandambeth等人[15]合成二维TpPa-1和TpPa-2,他们发现亚胺键本身的碱性,TpPa-1和TpPa-2对碱和热水有很高的稳定性.
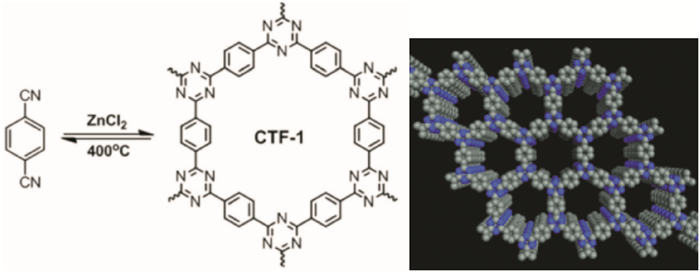
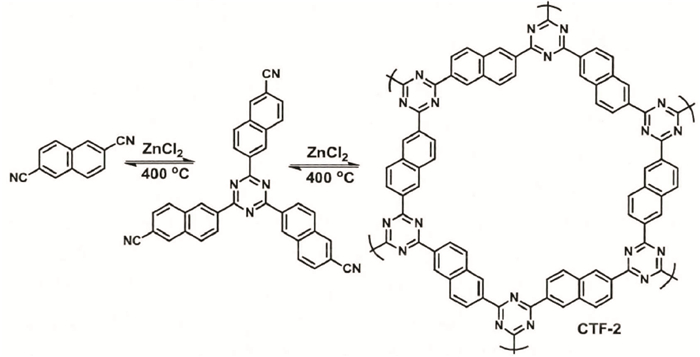
Thomas等人[16]首次报道了通过氰基自聚反应,利用离子热法形成三嗪环的方法合成一种层与层平行排列的二维COFs材料(CTF-1)(见图 9),比表面积为791 m2/g,孔径分布为1.2 nm.与此同时通过2, 6-naphthalenedicarbonitrile自聚形成CTF-2,进一步证实了通过氰基自聚的方法可以合成结构规整的COFs材料[17].
2 制备方法COFs材料构筑基元和构建方式的多样性使得COFs材料拥有多种结构、功能和应用,因此如何实现这些结构和功能也是研究者的研究重点.目前报道的COFs材料的制备方法主要有溶剂热法[3]、离子热法[12]和微波法[18].
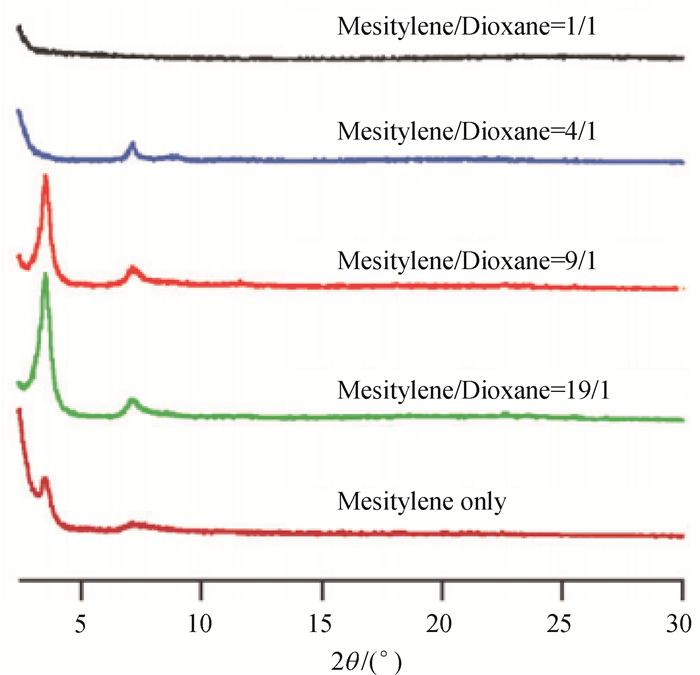
2.1 溶剂热法大多数COFs材料都是通过溶剂热法合成的:将反应体系密封在具有一定压力的反应管中,然后在80~120 ℃条件下加热反应2~9 d.COFs材料的生成受反应管中的压力、溶剂的种类和配比酸度、强度、反应温度和时间等条件的影响.Yaghi等人发现一般封管前的压力在0~19.95 Pa为适宜,而最佳反应温度在80~120 ℃[3].Jiang等人[19]揭示了溶剂的配比(1, 3, 5-三甲基苯与1, 4-二氧六环)对COFs材料晶形有序性产生的影响(见图 10).另外,单体的活性、溶解性、浓度、反应温度、反应时间和催化剂的选择都对最终产物产生影响.如果反应过快,晶体生长不完全;若反应速度过慢,则产率较低.热力学控制生成的材料可以进行自修复,所以适当的延长反应时间有利于结构更加规整,孔径分布越窄细.
|
图 10 合成COFs材料时使用不同的溶剂得到不同结晶度的材料的粉末衍射图[19] Figure 10 PXRD patterns for the COFs materials synthesized in mixed solvents of mesitylene and dioxane[19] |
离子热法是以离子液体或低共熔混合物为介质的一种合成方法.Thomas等人将1, 4-二氰基苯加入到熔融的氯化锌中得到一种晶型的多孔材料CTF-1[16].他们发现熔融的氯化锌在反应中起到重要的作用,既充当反应的溶剂还充当反应的催化剂.实验中还发现,材料的结构和性质与氯化锌的加入量有关,增加氯化锌的比例可以增大材料的比表面积但是降低了材料的有序性;只有氯化锌和反应单体比例合适才能得到晶形材料.相对于溶剂热法,离子热法反应条件苛刻,因为在高温熔盐中进行,反应难以控制,对构筑基元的热稳定性要求很高,目前通过离子热法只合成了两种晶形材料,即CTF-1和CTF-2[17](见图 11).
2.3 微波法微波法因其操作简便,热量集中效率高等特点可以加快反应速率[20-21],因此COFs材料也可以通过微波法制备[22-23].Cooper等人[18]利用微波加热法制备了2D的COF-5和3D的COF-102.该反应仅需20 min,反应速率是之前报道溶剂法的200倍.
COF-5的比表面积为2 019 m2/g,远高于之前通过溶剂热法得到的COF-5的比表面积(1 590 m2/g).但是微波法并不适用于所有的COFs材料的制备,在普遍适用上还需要长期的探索.
3 COFs材料的应用 3.1 气体存储及分离COFs材料因其有高比表面积而在气体或小分子存储上具有潜在应用价值[24],很多研究将COFs材料应用到氢气、甲烷、二氧化碳的储存中.构筑基元的结构和连接方式影响了COFs材料的孔径、孔体积和比表面积,从而决定了COFs材料对气体的储存能力.表 1总结了COFs材料在储氢、储二氧化碳及分离甲烷的应用.从表中得知,比表面积越大,气体储存能力越强;三维COFs材料因具有较高的比表面积和较低的密度以及疏松的堆积结构而具有更好的气体存储能力.三维COF-102[1]材料(BET比表面积为3 620 m2/g,孔径1.2 nm)呈现出7.24%(质量分数)的储氢能力(35 bar,77 K),而具有最大比表面积的二维PAF-1[25]材料(BET比表面积为5 600 m2/g)的储氢量为7.0%(质量分数).同样的,对于COFs材料用于甲烷气体的储存上[26],三维COFs材料储存甲烷气体的能力高于二维COFs材料.在298 K、35 bar条件下,COF-102甲烷储存量为187 mg/g, COF-103甲烷储存量为175 mg/g.三维COFs材料的储存二氧化碳能力较强,COF-102[6]和COF-103[6]的二氧化碳储存量在298 K、55 bar条件下分别为1 200 mg/g、1 190 mg/g[27].
3.2 催化应用功能化多孔材料在催化上的应用非常广泛,利用高表面积的COFs材料将催化活性位点引入,从而实现非均相催化.COFs材料在催化领域上有很大的优势,有序的孔道结构有利于物质的传输,不同的功能基团也可以实现不同种类的催化反应[27].值得注意的是,催化位点应易于引入,同时孔道的有效质量传导和材料结构的稳定性对催化效果有很大的影响.
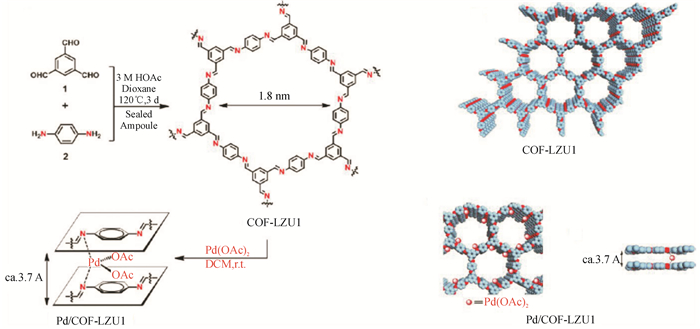
王为等人[28]通过制备出Pd/COF-LZU1材料来催化Suzuki-Miyaura反应(见图 12),实验表明Pd/COF-LZU1材料循环利用四次后催化效率基本没有变化,催化反应产率仍然能够达到96%,且结构基本保持.Jiang等人[29]报道了首例手性催化COFs材料.他们首先设计了含炔基的构筑基元,通过亚胺键连接方式构建出具有后修饰功能的COFs材料,利用Click反应,将手性的小分子催化剂载入到COFs材料的骨架中,进而实现了COFs材料在不对称催化上的应用.Hong Xu等人[13]通过手征性催化位置与COFs的孔壁合并起来,开发了一系列手性COFs材料,其中孔壁上的有机催化位置可被精确地调整来作为不对称迈克尔反应的异构催化剂.Hong Xu等人发现这些催化剂除了表现出高度加强的催化活性和高度对映选择性外,最重要的是它们可以在温水环境条件下催化反应,并可循环使用多次.
3.3 光电材料光电材料需要满足两个基本条件:第一,材料中的电子受光照容易激发;第二,电子在材料中容易传播.COFs材料拥有共轭体系,而且层与层平行堆积的二维COFs材料具有开放孔道,容易满足上面两个条件[11].
Jiang小组[30]首次报道了TP-COF材料应用在光电领域的例子(见图 13),该材料层层堆积结构和高度有序化的共轭大π体系有利于光子吸收和光电的传输,在可见光条件下能够导电,在340 nm或376 nm波长光的激发下能发射出很强的蓝色荧光,是一种性能优良的光致传输材料.另外酞菁类分子具有很强的吸光能力和大的平面结构从而在COFs发光材料中得到重视.Dichtel等人[31]报道了由酞菁骨架组成的COFs材料(见图 14),随后也有其他小组的相关报道[32-33].具有荧光特性的COFs材料都是基于芘发色团,而二维COFs材料中紧密堆积的结构会导致芘的荧光在一定程度上的减弱,因此,具有相对松散的堆积结构的三维COFs材料有望在光电领域中得到重视.
4 展望与总结COFs材料作为一种新型的共价有机晶形多孔材料,近年来得到社会的广泛关注.随着COFs材料的不断发展,其构筑基元种类繁多,构建方式灵活,给COFs材料的合成带来极大的方便.基于对COFs材料构筑基元的筛选和修饰,不仅能实现对COFs材料拓扑结构的可控性,还能对其材料孔径进行调控.但是COFs材料也存在不足之处,目前需要解决如下关键科学与技术问题:(1) 现有的三维COFs材料构筑基元结构单一(主要集中在四面体型),需设计合成新的刚性骨架,开辟新的构建方式,设计合成新型COFs材料,满足不同领域的应用需求;(2) 当前COFs材料主要采用溶剂热方法合成,其对操作方法及反应条件要求较高,限制了COFs材料的工业化应用;(3) 现阶段对COFs材料在催化应用方面的研究不够深入,可以考虑将催化剂引入到COFs材料中,制成具有合适形状、尺寸和机械强度的催化载体,以适应工业反应器的操作要求,同时提高催化效率;(4) 目前COFs材料的报道侧重于对其比表面积和孔分布的研究,缺少对作为工程材料用的COFs材料的结构设计和材料力学性能及其调控机制的研究;(5) 在COFs材料制备过程中,对于反应所涉及到的催化剂效应、溶剂化效应、产物分离与提纯技术以及聚合反应过程的热力学、动力学等基础问题缺少系统研究.
综上所述,COFs材料在合成及其应用方面的研究已经取得突破性的进展,与此同时,寻找新的构筑基元和构建方式,并对其反应本质进行系统研究,发展新的简便操作及合成方法,实现COFs材料在各个领域的广泛应用,仍是一个具有挑战性的课题.
| [1] | COTE A P, EL-KADERI H M, FURUKAWA H, et al. Reticular synthesis of microporous and mesoporous 2D covalent organic frameworks[J]. Journal of the American Chemical, 2007, 129(43): 12914-12915. DOI: 10.1021/ja0751781. |
| [2] | ROWAN S J, CANTRILL S J, COUSINS G R L, et al. Dynamic covalent chemistry[J]. Angew Chem Int Ed, 2002, 41: 898-952. DOI: 10.1002/1521-3773(20020315)41:6<>1.0.CO;2-R. |
| [3] | COTE A P, BENIN A I, OCKWIG N W, et al. Porous, crystalline, covalent organic frameworks[J]. Science, 2005, 310(5751): 1166-1170. DOI: 10.1126/science.1120411. |
| [4] | YAGHI O M, O'KEEFFE M, OCKWIG N W, et al. Reticular synthesis and the design of new materials[J]. Nature, 2003, 423: 705-714. DOI: 10.1038/nature01650. |
| [5] | OCKWIG N W, DELGADO-FRIEDRICHS O, O'KEEFFE M, et al. Reticular chemistry:occurrence and taxonomy of nets and grammar for the design of frameworks[J]. Accounts of Chemical Research, 2005, 38(3): 176-182. DOI: 10.1021/ar020022l. |
| [6] | EL-KADERI H M, HUNT J R, MENDOZA-CORTES J L, et al. Designed synthesis of 3D covalent organic frameworks[J]. Science, 2007, 316(5822): 268-272. DOI: 10.1126/science.1139915. |
| [7] | FENG X, DING X S, JIANG D L. Covalent organic frameworks[J]. Chemical Society Reviews, 2012, 41: 6010-6022. DOI: 10.1039/c2cs35157a. |
| [8] | THOMAS A. Functional materials:from hard to soft porous frameworks[J]. Angew Chem Int Ed, 2010, 49(45): 8328-8344. DOI: 10.1002/anie.201000167. |
| [9] | DING S Y, WANG W. Covalent organic frameworks (COFs):from design to applications[J]. Chemical Society Reviews, 2012, 42(2): 548-568. |
| [10] | JACKSON K T, REICH T E, EL-KADERI H M. Targeted synthesis of a porous borazine-linked covalent organic framework[J]. Chemical Communications, 2012, 48(70): 8823-8825. DOI: 10.1039/c2cc33583b. |
| [11] | 王蕾. 新结构共价有机框架材料的构建与性能研究[D]. 兰州: 兰州大学化学化工学院, 2014. |
| [12] | HONG X, JIA G, JIANG D L. Stable, crystalline, porous, covalent organic frameworks as a platform for chiral organocatalysts[J]. Nature Chemistry, 2015(7): 905-912. |
| [13] | URIBE-ROMO F J, HUNT J R, FURUKAWA H, et al. A crystalline imine-linked 3-D porous covalent organic framework[J]. J Am Chem Soc, 2009, 131(13): 4570-4571. DOI: 10.1021/ja8096256. |
| [14] | ZHANG Y B, SU J, FURUKAWA H, et al. Single-crystal structure of a covalent organic framework[J]. J Am Chem Soc, 2013, 135(44): 16336-16339. DOI: 10.1021/ja409033p. |
| [15] | KANDAMBETH S, MALLICK A, LUKOSE B, et al. Construction of crystalline 2D covalent organic frameworks with remarkable chemical (acid/base) stability via a combined reversible and irreversible route[J]. J Am Chem Soc, 2012, 134: 19524-19527. DOI: 10.1021/ja308278w. |
| [16] | KUHN P, ANTONIETTI M, THOMAS A. Porous, covalent triazine-based frameworks prepared by ionothermal synthesis[J]. Angewandte Chemie-International Edition, 2008, 47(18): 3450-3453. DOI: 10.1002/(ISSN)1521-3773. |
| [17] | BOJDYS M J, JEROMENOK J, THOMAS A, et al. Rational extension of the family of layered, covalent, triazine-based frameworks with regular porosity[J]. Advanced Materials, 2010, 22(19): 2202-2205. DOI: 10.1002/adma.v22:19. |
| [18] | CAMPBELL N L, CLOWES R, RITCHIE L K, et al. Rapid microwave synthesis and purification of porous covalent organic frameworks[J]. Chem Mater, 2009, 21: 204-206. DOI: 10.1021/cm802981m. |
| [19] | FENG X, CHEN L, DONG Y, et al. Porphyrin-based two-dimensional covalent organic frameworks: synchronized synthetic control of macroscopic structures and pore parameters[J]. Chem Comm, 2011, 47(7): 1979-1981. DOI: 10.1039/c0cc04386a. |
| [20] | KAPPE C O. Controlled microwave heating in modern organic synthesis[J]. Angew Chem Int Edit, 2004, 43(46): 6250-6284. DOI: 10.1002/(ISSN)1521-3773. |
| [21] | KAPPE C O, DALLINGER D. Controlled microwave heating in modern organic synthesis: highlights from the 2004-2008 literature[J]. Mol Divers, 2009, 13(2): 71-193. DOI: 10.1007/s11030-009-9138-8. |
| [22] | NI Z, MASEL R I. Rapid production of metal-organic frameworks via microwave-assisted solvothermal synthesis[J]. J Am Chem Soc, 2006, 128(38): 12394-12395. DOI: 10.1021/ja0635231. |
| [23] | JHUNG S H, LEE J H, YOON J W, et al. Microwave synthesis of chromium terephthalate MIL-101 and its benzene sorption ability[J]. Adv Mater, 2007, 19: 121-124. DOI: 10.1002/(ISSN)1521-4095. |
| [24] | SCHLAPBACH L, ZUTTEL A. Hydrogen-storage materials for mobile applications[J]. Nature, 2001, 414(3): 353-358. |
| [25] | BEN T, REN H, MA S Q, et al. Targeted synthesis of a porous aromatic framework with high stability and exceptionally high surface area[J]. Angew Chem Int Ed, 2009, 121(50): 9621-9624. DOI: 10.1002/ange.200904637. |
| [26] | FURUKAWA H, YAGHI O M. Storage of hydrogen, methane and carbon dioxide in highly porous covalent organic frameworks for clean energy applications[J]. Journal of the American Chemical Society, 2009, 131(25): 8875-8883. DOI: 10.1021/ja9015765. |
| [27] | 丁三元. 功能化共价有机框架材料: 设计合成、表征及应用[D]. 兰州: 兰州大学化学化工学院, 2014. |
| [28] | DING S Y, GAO J, WANG Q, et al. Construction of covalent organic framework for catalysis:Pd/COF-LZUl in Suzuki-Miyaura coupling reaction[J]. Journal of the American Chemical, 2011, 133(49): 19816-19822. DOI: 10.1021/ja206846p. |
| [29] | XU H, CHEN X, GAO J, et al. Catalytic covalent organic frameworks via pore surface engineering[J]. Chem Commwi, 2014, 50(11): 1292-1294. DOI: 10.1039/C3CC48813F. |
| [30] | WAN S, GUO J, KIM J, et al. A belt-shaped, blue luminescent, and semiconducting covalent organic framework[J]. Angewandte Chemie (International Edition), 2008, 47(46): 8826-8830. DOI: 10.1002/anie.v47:46. |
| [31] | SPITLER E L, DICHTEL W R. Lewis acid-catalysed formation of two-dimensional phthalocyanine covalent organic frameworks[J]. Nature Chemistry, 2010(2): 672-677. |
| [32] | DING X, GUO J, FENG X, et al. Synthesis of metallophthalocyanine covalent organic frameworks that exhibit high carrier mobility and photoconductivity[J]. Angew Chem Int Ed, 2011, 50(6): 1289-1293. DOI: 10.1002/anie.v50.6. |
| [33] | DING X, CHEN L, HONSHO Y, et al. An n-channel two-dimensional covalent organic framework[J]. J Am Chem Soc, 2011, 133(37): 14510-14513. DOI: 10.1021/ja2052396. |
 2016, Vol. 33
2016, Vol. 33