细胞色素P450(Cytochrome P450,CYP450)是生物体内一组结构和功能密切相关的超家族基因编码的同工酶,该酶系对内、外源化合物的转化、失活及活化起着至关重要的作用,包括参与类固醇激素、维生素、脂肪酸衍生物等内源性物质的合成和降解[1],外来化合物如药物、环境污染物、致癌物的代谢等[2].CYP2E1是CYP450酶系的重要成员之一,其编码的二甲基亚硝胺D-脱甲基酶是极其重要的Ⅰ相代谢酶,其主要参与亚硝胺及其前体物和低分子量卤代氰类化合物在体内的代谢,也参与苯、乙醇、四氯化碳和烟草中的3’羟基吡啶等多种低分子量化合物的代谢[3-4],特别是参与多种前致癌物和前毒物,如亚硝胺、苯胺等物质的转化为最终致癌活性物质,因此,在多种癌症易感性中起着重要作用.CYP2E1被认为是机体对环境、工业毒物或致癌物敏感程度的重要决定因素[5-6].
本文采用生物信息学方法, 对人CYP2E1基因序列特征、编码的蛋白结构、理化性质、空间结构、酶的活性中心和系统发育进行预测和分析,从分子水平揭示CYP2E1的作用机制,为其转化环境化合物及致癌机理提供理论依据,也为污染物的防治提供新的思路与途径.
1 材料与方法 1.1 序列来源人CYP2E1基因及蛋白的GenBank的登录号分别为NC000010.11和NM000773.3.
1.2 分析方法利用NCBI(http://www.ncbi.nlm.nih.gov/blast)找到CYP2E1的开放阅读框及编码蛋白.利用DNAStar软件的Editseq程序,对该开放阅读框编码氨基酸进行翻译,并分析其氨基酸序列;利用ProtParam (http://www.expasy.ch/tools/prot-param.html)在线工具预测人CYP2E1各理化性质;使用DNAStar软件的Megalingn程序对人、猴、犬、牛、猪、小鼠、大鼠的CYP2E1编码蛋白序列进行系统进化分析;利用Tampered(www.ch.embnet.org/software/tepred-form.html)在线工具分析人CYP2E1的跨膜结构; 采用SignalP(http://www.cbs.dtu.dk/services/SignalP)在线工具分析CYP2E1编码蛋白的信号肽.利用DNAStar软件中Protean程序和Chou-Fasman法(http://www.predictprotein.org/)预测人CYP2E1二级结构;利用WOLFPsort软件预测人CYP2E1的亚细胞定位;利用SWISS-MODEL(http://swissmodel.expasy.org/)软件预测CYP2E1三级结构和酶的活性中心;采用ExPASY的ProtScale (http://expasy.org/tools/protscale.html)软件分析人CYP2E1的亲(疏)水性.
2 结果与分析 2.1 人CYP2E1基因基本信息人CYP2E1基因定位于第10号染色体(10q24.3),其上游为2 788 bp, 下游为599 bp, 由8个内含子、9个外显子和典型的TATA盒组成,其大小为11 413 bp, cDNA长度为1 497 bp[7].该基因碱基组成:A=21.1%[397], G=18.6%[350], T=19.2%[361], C=41.1%[362], Ambigous=0.00%[0], (A+T)=40.3%[758], (C+G)=59.7%[712].显然,4种碱基比例不平衡.CG含量显著大于AT含量.CYP2E1基因中存在2个多态位点,分别位于其5’端和内含子6中[8].
2.2 人CYP2E1的主要理化性质和亲(疏)水性预测经DNAStar分析人CYP2E1编码的功能蛋白由493个氨基酸组成,相对分子质量约为172 386.6 Da.氨基酸组成:碱性氨基酸15个(K, R), 占3.1%;酸性氨基酸14个(D, E), 占2.9%;疏水性氨基酸41个(I, L, F, W, V), 占8.3%;极性氨基酸210个(N, C, Q, S, T, Y), 占42.5%.等电点理论值7.04,表明人CYP2E1蛋白的极性氨基酸与疏水性氨基酸占有较大比例.经ProtParam软件分析,推测人CYP2E1的分子式为C6778H10986N2074O2429S374;在波长280 nm时吸光度(A值)为1.6;其不稳定系数为44.09;其脂肪族氨基酸系数为43.79;其总平均亲水性是0.583.该蛋白氨基酸组成中Gys、Gly、Thr、Leu含量较高,依次为6.2%、5.8%、4.8%和11.8%,而Trp含量仅为1.0%;其亲(疏)水性如图 1所示,存在8个高疏水性区域,分别分布于8~23、64~81、168~185、209~214、286~300、308~317、381~396、437~459氨基酸位点处;主要的最小分值区域位于139、140、141、142、143、144、145和146这8个氨基酸位点,该区域为高亲水性区域.因此,推测该蛋白是高疏水性蛋白.
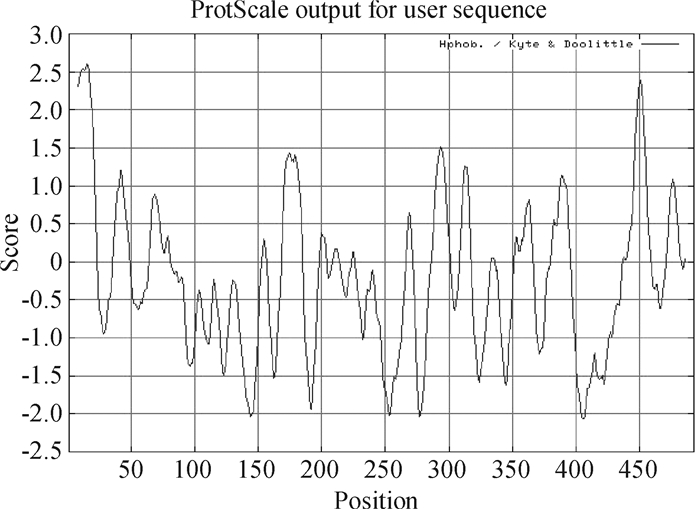
|
图 1 人CYP2E1疏水性分析 Figure 1 Hydrophobicity analysis of CYP2E1 |
预测与分析蛋白跨膜结构域对于准确了解蛋白质分子结构与功能以及在细胞中的定位具有重要意义[9].本文采用Tampered软件分析了CYP2E1跨膜结构,结果如图 2所示.根据预测模型,编码蛋白产生了6次高峰,分别在44~62、99~118、205~223、248~264、327~347以及480~499氨基酸位点处,推测该蛋白存在6个跨膜区域,即一条多肽链跨膜折叠,形成由6个α螺旋段反平行装配的球状膜蛋白.推测该蛋白是跨膜蛋白.
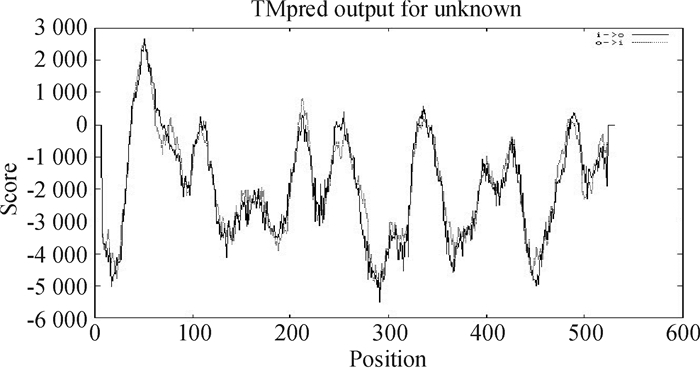
|
图 2 人CYP2E1的跨膜区域分析 Figure 2 Analysis of transmembrane domains of CYP2E1 |
采用SignalP3.0 Server软件对CYP2E1进行信号肽预测,结果如图 3所示,C列为剪切位点得分,S列为信号肽得分,Y列为综合剪切位点得分,典型信号肽的C值和Y值趋向于+1,S值在剪切位点之前高而在剪切位点之后变低,当C、Y、S值计算结论是YES时表明预测结果较好[10].分析结果表明,CYP2E1肽段分值曲线典型,C值为0.831,Y值为0.659,S值为0.653,C, Y, S均为最大值, 其切割点位于第28位和第29氨基酸之间,该蛋白的信号肽位于第1-28位氨基酸.
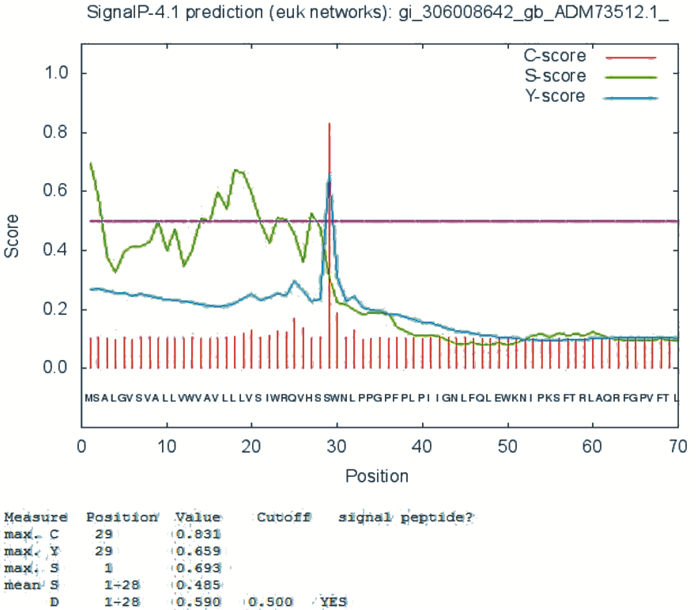
|
图 3 人CYP2E1信号肽预测 Figure 3 Prediction of signal peptide of CYP2E1 |
对于未知功能蛋白质的分子结构和结构域或功能单位进行确认,有助于了解该蛋白的生物学功能[11].本文采用Protean程序分析CYP2E1二级结构,结果如图 4所示.从图 4可以看出该蛋白中有6段α-螺旋,分布于9-26, 34-79, 92-96, 110-202, 251-279, 375-389等氨基酸残基位点处;有6处β-折叠,分布于210-213,233-237,295-326,349-379,386-401,402-405位点;还有32处β-转角,分布于30-33,63-159,193-221,230-261,276-303,318-367,382-396,408-411等位点.人CYP2E1有典型的细胞色素P450二级结构,在二级结构基础上进一步发生紧密的卷曲与折叠,形成三维空间结构,这样有利于被催化底物可以沿着β1折叠进入催化中心部位.采用WOLFPsort软件对预测该蛋白亚细胞定位,判断该蛋白质主要定位于膜结构上,最可能分布于内质网膜、过氧化物酶体、溶酶体与高尔基体等膜上.
|
图 4 人CYP2E1二级结构图 Figure 4 Secondary structure of CYP2E1 |
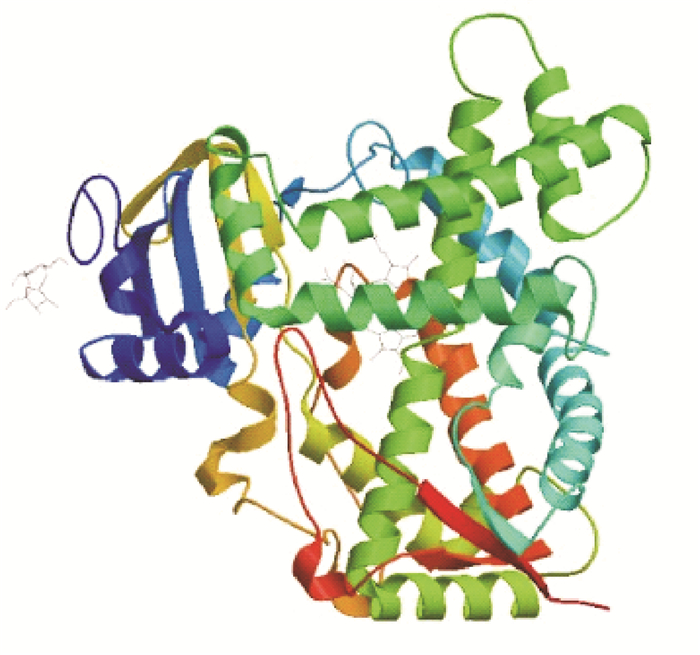
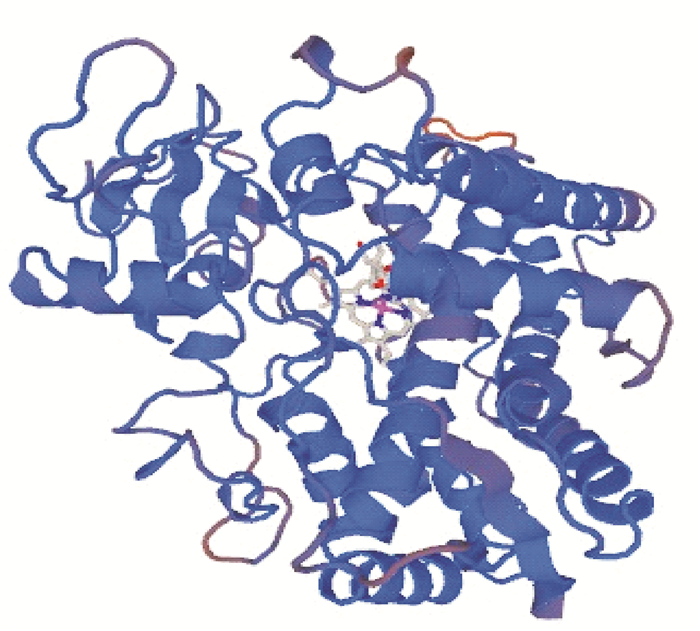
经SWISS-MODEL软件模拟人CYP2E1的高级结构和活性中心如图 5和图 6所示.预测出CYP2E1活性中心的体积约为0.19 nm3, 外表为小球状,整个分子有6个α-螺旋和1个β折叠,Asn202残基、Ser298残基以及Phe205残基有可能与铁卟啉环形成活性中心,CYP2E1蛋白血红素铁和底物催化位点之间的距离在0.3~0.6 nm之间,在空间上和底物结合为三明治式的结构, 参与催化反应.
|
图 5 人CYP2E1三级预测结构 Figure 5 Tertiary structure of CYP2E1 |
|
图 6 人CYP2E1的预测活性中心 Figure 6 Prediction of the active center of CYP2E1 |
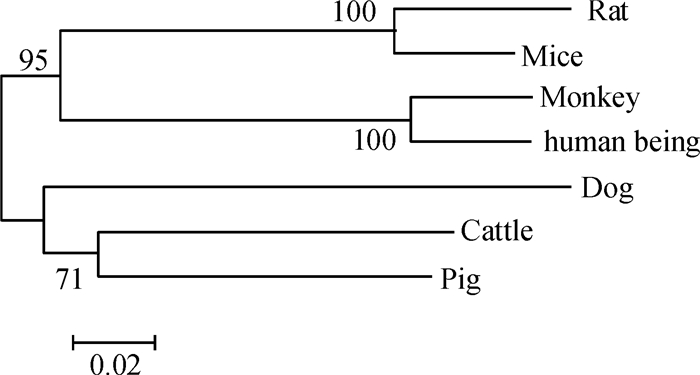
采用Megalingn程序,将人与6物种(猴、犬、牛、猪、小鼠和大鼠)的CYP2E1氨基酸序列进行同源性分析,并构建系统发育树,如图 7所示.人类与猴相似度为96%;与大鼠、小鼠相似度均为80%,与牛相似度为71.2%,与犬相似度为72%,与猪相似度为70%.说明CYP2E1蛋白在进化上具有高度保守性.
|
图 7 人与6物种的系统发育树 Figure 7 Phylogenetic trees of human being and other 6 species |
本文通过对CYP2E1的一般性质、亲疏水性、二级结构、三级结构、活性中心、跨膜结构、信号肽以及亚细胞定位等进行预测分析,依分析结果推测人CYP2E1处在细胞的膜结构上,可能是膜结合蛋白,而且是一种跨膜蛋白,即一部分亲水肽段在膜外,一部分疏水肽段埋在磷脂双分子中与膜共价结合,催化功能位点则处于亲水肽段部位[12].本文还预测了信号肽剪切位点,表明该基因表达具有信号肽,推测该蛋白在信号肽的引导下通过内质网膜进入腔内进行修饰成熟,然后整合在质膜上.对CYP2E1酶活性中心分析表明酶活性中心体积较小,仅为0.19 nm3, 这可能与代谢小分子化合物有关;CYP2E1与底物结合形成类似三明治式结构,如:其分子的Phe205和Phe293残基可与氯唑沙宗的苯并唑环形成π-π共轭,Asp202残基与氯唑沙宗羟基、Ser298残基与氯唑沙宗氯化基团均以氢键形式结合.活性中心的这种结构构象也揭示了CYP2E1可与多种底物(如丁二烯、苯胺、甲苯、二甲基亚硝胺、乙醇、月桂酸等)结合的机理.
通过对人CYP2E1氨基酸序列与其他6种哺乳动物该蛋白序列的比较和聚类研究,表明CYP2E1具有高度保守性,人与猴的相似度达95%,与啮齿动物小鼠和大鼠的相似度为80%,说明在生物进化过程中,该基因的保守序列变化很小,以至于其表达产物的生物活性类似,提示我们在开展CYP2E1的毒理学及药理学方面的研究时,可以考虑以其他实验动物(如小鼠、大鼠等)和其细胞系作为模型实验材料,深入探讨其作用特点与机理.
| [1] |
Shark A H, Crawford M A, Reifen R. Update on alpha-linelic acid[J].
Nutrition Reviews, 2008, 66(6): 326-332.
DOI: 10.1111/j.1753-4887.2008.00040.x. |
| [2] |
Brunner G. Mass transferfrom solid mater in gas extraction[J].
Ber Bunsenged Phys Chem, 1984: 887-891.
|
| [3] |
Dwivedi C, Natarajan K, Matthees D P. Chemmopreventive effects of dietary flaxseed oil on colon tumor development[J].
Nutrition Cancer, 2005, 51(1): 52-58.
DOI: 10.1207/s15327914nc5101_8. |
| [4] |
Yaniv Z, Schafferman D, Shamir I, et al. Cholesterol and triglyceride reduction in rats fed Matthiola incana seed oil rich in(n -3)fatty acids[J].
J Agric Food Chem, 1999, 47(2): 637-642.
DOI: 10.1021/jf980744k. |
| [5] |
Nguyen A D, Le Goffic F. Limits of wiped film short-path distiller[J].
Chemical Engineering Science, 1997, 52(16): 2661-2666.
DOI: 10.1016/S0009-2509(97)00089-4. |
| [6] |
Cvengros J, Pollak S, Micov M, et al. Film wiping in the molecular evapotator[J].
Chemical Engineering Journal, 2001, 81(1): 9-14.
|
| [7] |
David B G. A theoretical and experimental study of the centrifugal molecular still[J].
Aiche J, 1972, 18(2): 269-276.
DOI: 10.1002/(ISSN)1547-5905. |
| [8] |
Christon R, Haloue R, Durand G. Dietary polyunsaturated fatty acids and aging modylate lutathione-ralated antioxidants in rat liver[J].
J Nutr, 1995, 125: 3062.
|
| [9] |
Rui L M. Supercritical CO2 extraction of γ-linolenic acid(GLA) from the cyanobacterium Arthrospira(Spirulina)maxma experinents and modeling[J].
Chemical Engineering Joumal, 2005, 10(5): 147-152.
|
| [10] |
Guil Guerrero J L, Campra-Madrid P, Belarbi E H. γ-Linolenic acid purification from seed oil sources by argentated silica gel chromatography colum[J].
Process Biochemistry, 2000, 36(1): 341-354.
|
| [11] |
Baba N H, Antoniades K, Habbal Z. Effects of dietary canola, olive, and lino lenic acid enriched olive oils on plasma lipids, lipid peroxidation and lipoprotein lipase activity in rats[J].
Nutrition Research, 1999, 19(4): 601-612.
DOI: 10.1016/S0271-5317(99)00025-1. |
| [12] |
Xu W K, Mong L S, Li Z Y. Isolation and identification of a bitter constituent from Luo-han-guo[J].
Sunripe Fruits Guihaia, 1992(12): 136-138.
|
 2015, Vol. 32
2015, Vol. 32