苦瓜(Momordica charantia L)属葫芦科苦瓜属植物,为一年生攀缘草本, 其果实被称为凉瓜,具有良好的医疗保健作用,适宜于药食两用[1].研究证明苦瓜果肉富含蛋白质、脂肪、膳食纤维、碳水化合物、胡萝卜素、多种维生素及微量元素等营养成分,此外, 还富含生物碱、三萜类、黄酮类、皂苷类等多种生物活性成分[2-3].苦瓜味苦性寒,具有清热解暑,明目解毒等药用功效,临床上已证实其具有显著降血糖和提高免疫力等功效[4-6].
目前, 关于苦瓜的研究多集中于其多糖、皂甙等成分及其生物学活性,然而,对苦瓜的抗氧化活性以及抗衰老功效的研究尚未见详细报道.鉴于此,本文对苦瓜不同提取物的体外抗氧化活性进行研究,旨在为进一步拓展苦瓜的生物学功能并为开发苦瓜保健产品及药物提供理论和实验基础.
1 材料与方法 1.1 材料与试剂苦瓜购自广东省番禺南亭蔬菜市场; DPPH(1,1-二苯基-2-苦基肼)购自阿拉丁试剂公司;抗坏血酸(VC)、亚硝酸钠、硝酸铝、氢氧化钠、苯酚、浓硫酸、邻苯三酚、无水乙醇、H2O2、水杨酸、硫酸亚铁、Tris、浓盐酸均为国产分析纯.
1.2 仪器与设备UV-1800型紫外可见光分光光度计,恒温水浴锅,高速冷冻离心机,RE-5298A旋转蒸发仪,低温冰箱,SHZ-Ⅲ型循环真空泵,超声波清洗器KQ2200-DV,电热恒温鼓风干燥箱等.
1.3 苦瓜黄酮提取物与多糖提取物的制备苦瓜黄酮用80%乙醇提取,多糖则用蒸馏水进行提取.
新鲜苦瓜洗净切薄片,置50℃烘箱中烘干,粉碎备用.称取适量苦瓜粉末,加80%乙醇,超声波提取,滤液50℃下用旋转蒸发仪减压浓缩至无醇味,即为苦瓜黄酮提取物.取部分浓缩液用水分散,依次用石油醚、乙酸乙酯、正丁醇萃取,除去溶剂,分别得到石油醚、乙酸乙酯、正丁醇以及水层部分的黄酮提取物,4℃冰箱保存,待用.上述残渣挥去乙醇后,加蒸馏水回流提取2次,每次3h,水提液浓缩后加无水乙醇,使其终浓度达80%,4℃冰箱静置6h沉淀析出,离心即得苦瓜粗多糖.
1.4 多糖含量和总黄酮含量的测定采用苯酚-硫酸法测定苦瓜粗多糖中多糖的含量[7].总黄酮含量的测定采用亚硝酸钠-硝酸铝比色法[8].
1.5 抗氧化活性测定 1.5.1 对羟自由基清除能力的测定(水杨酸比色法) [9-10]测定原理:利用H2O2对Fe2+混合产生·OH,向该体系中加入水杨酸,以·OH氧化水杨酸所得产物的吸光值表示·OH含量,吸光值越大,·OH越多,该物质在波长510nm下有最大吸收.若加入有清除·OH功能的被测物,便会与水杨酸竞争·OH而使紫色产物生成量减少,固定时间在510nm处测量含被测物反应液的吸光度并与空白液比较便能测定被测物对·OH的清除作用.
测定方法:取苦瓜各部分提取物,分别配制成一定质量浓度的样品母液,再将该母液稀释成所需的不同浓度.各取上述浓度的样品溶液2 mL,依次加入2 mL 9 mmol/L的FeSO4、2 mL 9 mmol/L的水杨酸、2 mL 8.8 mmol /L的H2O2,混匀,置37℃水浴中加热30 min,在510 nm下测定样品吸光度(Ai).每个质量浓度设3个平行管,结果取平均值.考虑到样品本身的吸光值以2 mL 9mmol/L的FeSO4,2 mL水杨酸-乙醇及2 mL不同浓度的样品溶液为黄酮的本底吸收.以VC作阳性对照,根据下列公式计算清除率:清除率={[A0-(Ai-Aj)]/A0}×100%.
式中:A0为空白对照液的吸光度,Ai为加入样品溶液后的吸光度,Aj为不加H2O2的样品溶液本底的吸光度.
1.5.2 对超氧阴离子自由基的清除作用[10]测定原理:在碱性条件下,邻苯三酚自氧化生成O2-·和对325 nm波长紫外光有特征性吸收的中间产物,其氧化速度依赖于其自氧化产生的O2-·的浓度.若在反应体系中加入能清O2-·的物质,随着O2-·被清除,邻苯三酚自氧化过程会受抑制,因而溶液在325 nm处的吸收值将有所减弱,故通过测定溶液在325 nm处的吸光度可推断清除剂对O2-·的清除作用.
邻苯三酚自氧化速率测定:取4.5 mL 50 mmol/L的Tris-HCl缓冲液(pH8.2)与4.2 mL蒸馏水混匀,置25℃水浴保温20 min,加0.3 mL 3 mmol/L的邻苯三酚(已在25℃预热),迅速摇匀,用10 mmol/L盐酸溶液为参比,在325 nm下每隔30 s测定吸光度,连续记录4 min,将所得数据绘图,得一直线斜率即为邻苯三酚的自氧化速率V1.
加入样品溶液后邻苯三酚自氧化法速率测定:加邻苯三酚前先加一定体积黄酮溶液,对应相应量减少蒸馏水,按上述方法得到加入样品溶液后的邻苯三酚自氧化法速率V2.以VC为阳性对照.根据下列公式计算清除率:抑制率=[(v1-v2)/v1]×100%.式中:v1为邻苯三酚的自氧化速率,v2为加入样品溶液后邻苯三酚的自氧化速率,单位均为吸光度每分钟的增值.
1.5.3 对DPPH·自由基清除活性的测定测定原理:DPPH·在有机溶剂中呈紫色,在波长517 nm处有较大吸收值,加入抗氧化剂后,部分自由基被清除掉,使该波长下吸收强度减弱,因而可由此来评价某物质的抗氧化活性[11].
测定方法:用无水乙醇配制0.16 mmol/L DPPH溶液.分别于不同浓度的2 mL溶液样品中加入2 mL DPPH溶液,快速摇匀后室温下反应30 min,于517 nm波长下测吸光度,计算DPPH·的清除率.以VC为阳性对照,根据下列公式计算清除率:K={〔A0-(Ai-Aj)〕/A0}×100%.式中:A0为2 mL DPPH溶液+2 mL样品溶剂,Ai为2 mL DPPH溶液+2 mL样品液(或对照品溶液),Aj为2 mL无水乙醇+2 mL样品液(或对照品溶液).
2 结果与讨论 2.1 苦瓜提取物的定性分析黄酮类化合物基本碳架上有碱性氧原子,其多数为带有酚羟基的衍生物,它们可以与某些金属离子产生络合反应并与某些较强的还原剂发生颜色反应.因此,可根据黄酮类的这一特性,对其进行定性鉴定.将样液置试管中,依次加入表 1中试剂,摇匀后静置一段时间,观察其颜色变化反应,依据黄酮类化合特征显色反应可知,苦瓜提取物中含有黄酮类化合物.
| 表 1 苦瓜黄酮的显色反应 Table 1 Chromogenic reaction of flavonoids of balsam pears |
采用Molish反应.吸取1 mL样品液,加0.1 mL 5% α-萘酚乙醇,摇匀.沿试管壁加入1 mL浓硫酸,观察浓硫酸和糖交界面的颜色变化,以蒸馏水为阴性对照.结果浓硫酸和糖交界面出现紫色环,呈阳性,说明所提取的苦瓜多糖提取物中含有多糖.
2.2 苦瓜粗多糖的抗氧化性能如图 1所示,苦瓜粗多糖对·OH和DPPH·均有一定程度清除作用,且在一定程度范围内清除率与抗氧化剂浓度呈较好的线性关系.依趋势线性方程得出苦瓜粗多糖对·OH及DPPH·的半清除率浓度(IC50值)如表 2所示,可见其对DPPH·的清除效果优于·OH,但其抗氧化能力明显低于其黄酮提取物.

|
图 1 苦瓜粗多糖清除自由基的效果 Figure 1 The scavenging effect of balsam pear glycan on different free radicals |
| 表 2 苦瓜粗多糖清除不同自由基的拟合结果 Table 2 IC50 values of balsam pear glycan's scavenging free radicals |
如图 2所示, 苦瓜黄酮不同溶剂萃取物及VC对·OH均有不同程度的清除作用,且清除率随样品浓度增加而增大,在试验浓度范围内呈线性关系.其中苦瓜黄酮提取物及水层部分清除·OH能力显著高于乙酸乙酯萃取物、正丁醇萃取物和VC.对清除率-浓度作图,依趋势线方程求出苦瓜总醇提取物、乙酸乙酯萃取物、正丁醇萃取物和水层部分及对照VC的半清除率质量浓度(IC50值)如表 3所示,根据IC50值大小,水层部分清除·OH的能力最高,总醇提取物其次,两者对·OH的清除能力均强于VC,正丁醇萃取物和VC清除·OH的能力较接近,而乙酸乙酯萃取物对·OH的清除能力最弱.从清除能力大小可以看出醇提部分抗氧化活性物质主要分布于水相中.

|
图 2 对羟自由基的清除作用 Figure 2 The ·OH scavenging effects |
| 表 3 清除羟自由基的IC50比较 Table 3 The comparison of IC50 values between the different solvent extracts and contrast VC on scavenging ·OH |
如图 3所示,苦瓜黄酮不同溶剂萃取物和VC对邻苯三酚自氧化产生的超氧阴离子都表现出一定程度清除能力, 且样品浓度越大清除超氧阴离子能力越强,在一定浓度范围内呈现较好的线性关系.依趋势线方程求出苦瓜总醇提取物、乙酸乙酯萃取物、正丁醇萃取物和水层部分及对照VC的IC50值如表 4所示.IC50值越小,表明其清除能力越强,反之,则越弱.苦瓜黄酮不同溶剂萃取物及阳性对照VC对超氧阴离子清除率能力大小的顺序为:VC > 水层部分 > 总醇提取物 > 正丁醇萃取物 > 乙酸乙酯萃取物.水层部分对超氧阴离子的清除作用较好,但不如VC效果好,乙酸乙酯萃取物的效果最弱.

|
图 3 对超氧阴离子的清除作用 Figure 3 The O2-·scavenging effects of different solvent extracts and VC |
| 表 4 苦瓜黄酮不同溶剂萃取物与对照VC清除超氧阴离子的IC50比较 Table 4 The comparison of IC50 values between the different solvent extracts and contrast VC on scavenging O2-· |
由图 4可以看出,苦瓜黄酮不同溶剂萃取物及VC对DPPH·均有较强清除作用,且清除效果随样品浓度增加而增强,在试验浓度范围内呈一定剂量效应关系.依趋势线方程求出苦瓜总醇提取物、乙酸乙酯萃取物、正丁醇萃取物和水层部分及对照VC的IC50值如表 5所示,其清除率大小依次为总醇提取物 > 水层部分 > 乙酸乙酯萃取物 > 正丁醇萃取物 > VC,各萃取物均能以较低浓度清除DPPH·,且清除力均强于抗氧化剂VC,表明不同溶剂萃取的苦瓜黄酮类化合物均为较强的自由基清除剂.
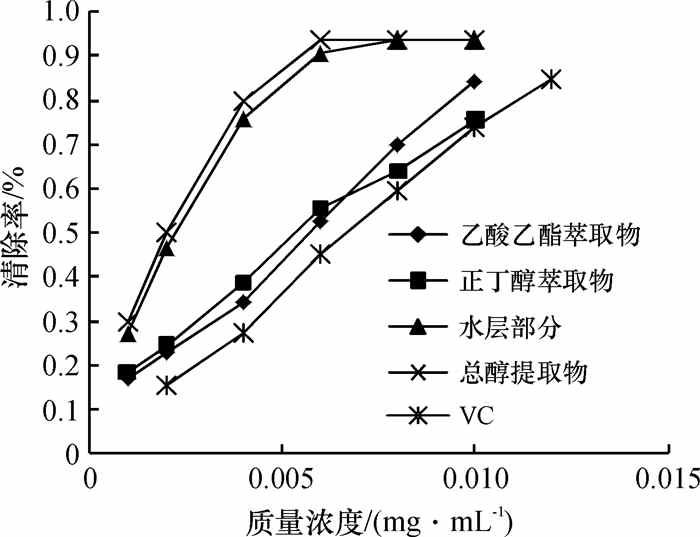
|
图 4 对DPPH·的清除作用 Figure 4 The DPPH scavenging effects of different solvent extracts and VC |
| 表 5 苦瓜黄酮不同溶剂萃取物与对照VC清除DPPH·的IC50比较 Table 5 The comparison of IC50 values between the different solvent extracts and contrast VC on scavenging DPPH |
苦瓜黄酮提取物和苦瓜粗多糖对3种自由基均有一定的清除能力,尤其是黄酮提取物的清除效果非常显著,与VC相当有的甚至优于VC,而多糖的清除效果则相对较差,表明苦瓜中抗氧化活性较强的成分是黄酮类物质.
自由基理论认为衰老是由氧自由基过度反应引起的,有机体的新陈代谢速率越高, 氧自由基的产生就越快,衰老过程就加快,清除自由基可起到延年益寿的作用[12].苦瓜黄酮具有很高的自由基清除活性,即苦瓜黄酮是一种很好的天然抗氧化剂.
| [1] |
邹宇晓, 廖森泰, 刘学铭, 等. 苦瓜的综合利用研究进展[J].
中国果菜, 2004(5).
Zou Y X, Liao S T, Liu X M, et al. The progress of the research on the comprehensive utilization of Bitter Gourd[J]. China Fruit and Vegetable, 2004(5). |
| [2] |
文良娟, 刘苇芬. 苦瓜黄酮的提取条件及其抗氧化活性研究[J].
食品科学, 2007, 09: 183-186.
Wen L J, Liu W F. Study on extracting and antioxidant activityo f flavonoids from momordica charantia L[J]. Food Science, 2007, 09: 183-186. |
| [3] |
陈敬鑫, 张子沛, 罗金凤, 等. 苦瓜保健功能的研究进展[J].
食品科学, 2012, 01: 271-275.
Chen J X, Zhang Z P, Luo J F, et al. Research advances in healthy functions of bitter gourd[J]. Food Science, 2012, 01: 271-275. |
| [4] |
张利芳. 苦瓜多糖的纯化及其免疫和抗氧化活性作用[D]. 武汉: 华中农业大学食品科学技术学院, 2010.
http://cdmd.cnki.com.cn/article/cdmd-10504-1010010146.htm
|
| [5] |
Nivitabishekam S N, Asad M, Prasad V S. Pharmacodynamic interaction of Momordica charantia with rosiglitazone in rats[J].
Chemico-Biological Interactions, 2009, 177(3).
|
| [6] |
Kumar G S, Shetty A K, Salimath P V. Modulatory effect of bitter gourd(Momordica charantia LINN.)on alterations in kidney heparan sulfate in streptozotocin-induced diabetic rats[J].
Journal of Ethnopharmacology, 2008, 115(2).
|
| [7] |
郑亚军. 椰花汁多糖醇沉工艺的研究[J].
食品科技, 2010, 01: 105-108.
Zheng Y J. Study on purification technology of polysaccharides from coconut inflorescence sap[J]. Food Science and Technology, 2010, 01: 105-108. DOI: 10.3969/j.issn.1672-979X.2010.02.009. |
| [8] |
丁利君, 周圳辉, 林燕如. 芒萁中黄酮物质的提取及其抗氧化研究[J].
食品科学, 2005, 08: 77-82.
Ding L J, Zhou Z H, Lin Y R. Study on extraction and anti-oxidation of the flavonoid from dicrano pteris pedata[J]. Food Science, 2005, 08: 77-82. |
| [9] |
Smirnoff N, Cumbes Q J. Hydroxyl radical scavenging activity of compatible solutes[J].
Phytochemistry, 1989, 28(4): 1057-1060.
DOI: 10.1016/0031-9422(89)80182-7. |
| [10] |
程超, 李伟, 汪兴平. 平菇水溶性多糖结构表征与体外抗氧化作用[J].
食品科学, 2005, 08: 55-57.
Cheng C, Li W, Wang X P. Study on the structure analysis and antioxidation effect in vitro of water soluble polysaccharide of pleurotusostreatus[J]. Food Science, 2005, 08: 55-57. |
| [11] |
Duan X J, Zhang W W, Li X M, et al. Evaluation of antioxidant property of extract and fractions obtained from a red alga, Polysiphonia urceolata[J].
Food Chemistry, 2006, 95(1): 37-43.
DOI: 10.1016/j.foodchem.2004.12.015. |
| [12] |
徐敏. 人体自由基与衰老的关系[J].
临床和实验医学杂志, 2006, 5(3): 289-290.
|
 2014, Vol. 31
2014, Vol. 31