薇甘菊(Mikania Micrantha)是菊科假泽兰属多年生藤本植物, 也称小花蔓泽兰或小花假泽兰.因其具有超强繁殖能力且适于攀缘缠绕于乔灌木, 往往重压于其冠层顶部阻碍该植物光合作用, 继而导致其死亡, 被认为是世界上最具危险性的有害植物之一, 因而被称为“植物杀手”[1].薇甘菊原产于中美洲, 现已广泛分布于我国海南及珠江三角洲地区, 它已被列入中国首批外来入侵物种[2].如何对其进行防除和有效的开发利用已成为治理的关键[3-4].目前对薇甘菊的开发利用研究主要集中于对其进行营养成分的提取和生理活性物质的发现[5-6]等方面.有关研究发现薇甘菊中含有多种化学成分[7], 包括单萜、倍半萜、醇和酮的衍生物、黄酮类化合物等, 其中多种物质具有潜在的保健与药用价值.
随着崇尚自然的消费理念逐步得到人们的认可, 天然防腐剂的研究与开发成为了防腐剂领域的研究热点[8].从天然产物中寻找植物源抗菌剂已成为植物学的研究方向之一.为此, 本文主要研究了薇甘菊叶总黄酮提取工艺, 并对其进行了黄酮提取液体外抑菌活性研究, 以期为薇甘菊的开发利用提供实验参考.
1 材料与仪器 1.1 材料与试剂薇甘菊叶采于2月份的广州市番禺区广东工业大学外环路, 日照充足, 洗净, 60 ℃烘干, 粉碎过40目筛, 备用.大肠杆菌(E.coli)、金黄色葡萄球菌(Staphylococcus aureus)、沙门氏菌(Salmonella)以及志贺菌(Shigella)均由广东工业大学微生物实验室提供.
胰蛋白胨大豆肉汤(TSB)(青岛高科园海博生物技术有限公司, 批号:20130725)、琼脂粉(青岛高科园海博生物技术有限公司, 批号:20130304).芦丁、亚硝酸钠、硝酸铝、氢氧化钠、无水乙醇、石油醚均为分析纯.
1.2 设备与仪器BS224S型电子分析天平(北京赛多利斯科学仪器有限公司);SHZ-D(Ⅲ)型循环水式多用真空泵(巩义市予华仪器有限责任公司);KQ2200- DV型超声波清洗器(昆山市超声仪器有限公司);UV-1800型紫外-可见分光光度计(上海精密科学仪器有限公司);LDZM-60KCS立式压力蒸汽灭菌器(上海申安医疗器械厂);DHP-9052型电热恒温培养箱(上海一恒科学仪器有限公司);HD-650-U标准型净化工作台(苏州安泰空气技术有限公司);ZHWY-103B型多振幅轨道摇床(上海智城分析仪器制造有限公司).
2 实验方法 2.1 超声辅助提取薇甘菊叶黄酮工艺研究 2.1.1 芦丁标准曲线的绘制参考文献[9-10]中的方法, 用体积分数70%的乙醇溶解10.2 mg芦丁标准品后定容到100 mL.分别取芦丁标准溶液0、1、2、3、4、5 mL到6支10 mL刻度试管中, 加0.3 mL质量浓度5%的亚硝酸钠水溶液, 摇匀, 放置6 min;加0.3 mL质量浓度10%的硝酸铝溶液, 摇匀, 放置6 min;加摩尔浓度为1 mol/L氢氧化钠溶液4.0 mL, 用体积分数70%的乙醇定容至10 mL, 摇匀, 以空白溶液为参照, 用紫外可见分光光度计测不同质量浓度芦丁溶液在510 nm下吸光度, 以芦丁质量浓度(mg/mL)为横坐标、吸光值A为纵坐标绘制标准曲线.
2.1.2 黄酮提取液的制备将薇甘菊叶的粉末与石油醚按1:10(g/mL)混合, 静置2 h, 抽滤, 滤渣晾干备用.称取处理过的粉末1 g置150 mL锥形瓶中, 加入适量乙醇, 进行超声辅助提取.将醇提液抽滤后定容至100 mL, 备用.
2.1.3 样品总黄酮的测定将薇甘菊叶黄酮待测液进行适量稀释, 取稀释液1 mL, 按2.1.1中方法加样, 在波长510 nm下测吸光度A, 按式(1)计算样品溶液中总黄酮质量浓度(mg/mL), 据式(2)可得总黄酮提取率.
| $ 总黄酮质量浓度 = \frac{{\left( {A - 0.0029} \right)}}{{11.497}}\left( {{\rm{mg/mL}}} \right), $ | (1) |
| $ \begin{array}{l} 总黄酮提取率 = \\ \frac{{总黄酮质量浓度 \times 10 \times 5 \times 100}}{{1000 \times 1.0005}} \times 100\% \end{array} $ | (2) |
采取确定3个因素、变换1个因素的方法分别对料液比、乙醇体积浓度、超声功率、超声时间这4个关键因素进行分析[11].料液比(g/mL)分析:确定提取时间为30 min, 乙醇体积分数为70%, 超声功率为60 W, 料液比分别为1:10、1:15、1:20、1:25、1:30、1:40;乙醇体积浓度(V/V)分析:确定提取时间为30 min, 物料比为1:30, 超声功率60 W, 将乙醇体积分数设定为30%、40%、50%、60%、70%和80%;超声功率(W)分析:确定提取时间为30 min, 物料比为1:30, 乙醇体积分数为50%, 超声功率为40、50、60、70、80、90 W;超声时间(min)分析:确定乙醇体积分数为50%, 料液比为1:30, 超声功率60 W, 超声时间分别为10、20、30、40、50、60 min.
2.1.5 正交试验设计在单因素试验基础上, 以乙醇体积浓度、超声功率、超声时间, 料液比为考察因素, 每个因素3水平进行L9(34)正交试验(表 1), 以总黄酮提取率为考察指标, 确定最佳提取工艺[12].
| 表 1 因素水平设计 Table 1 Factors and levels |
根据1.3中最佳提取工艺, 称取叶的粉末10 g, 提取溶剂为体积分数为50%的乙醇, 料液比1:30, 超声功率50 W, 提取时间50 min.然后抽滤除去废渣, 旋蒸浓缩至无醇味即得叶的黄酮提取液(经紫外分光光度测定总黄酮质量浓度为12.5 mg/mL).
2.2.2 供试菌种菌悬液制备准确移取80 μL活化好的菌液于装有4 mL无菌水的试管中, 充分摇匀, 校正浓度至0.5麦氏标准[13], 使含菌量达到108 cfu /mL, 备用.
2.2.3 样品抑菌效果测定采用打孔法[14-15].选用同样规格培养皿, 每皿加20 mL培养基, 凝固后, 将各菌种悬液100 μL分别加入各平板表面, 均匀涂开菌种, 待平板干燥后, 用直径为6 mm的玻璃管(0.1 MPa、121 ℃灭菌20 min)打孔.每皿均为4孔, 每菌做3次重复.以硫酸链霉素为阳性对照, 以无菌水为空白对照, 每孔加样60 μL.将细菌置37 ℃恒温培养箱培养24 h.取出后测量抑菌圈大小, 比较其抑菌效果.直径大于9 mm抑菌圈为有显著抑菌效果, 小于6 mm为无抑菌效果, 抑菌圈在6~9 mm之间为有一定抑菌作用.
2.2.4 最低抑菌浓度(MIC)测定采用试管法[16-17].取36支灭菌试管分为4组, 每组9支.每支试管加入1 mL TSB液体培养基, 另每组第1支试管加入1 mL薇甘菊叶黄酮醇提液(黄酮质量浓度为12.5 mg/mL), 混匀液体, 再从每组第1管吸取1 mL混匀液到每组第2管中, 如此类推一直到第8管, 再从第8管中吸取1 mL混匀液舍去, 第9管为细菌对照组, 不加药液.4组试管分别加入金黄色葡萄球菌、大肠杆菌、沙门氏菌和志贺菌液各50 μL.另取9支试管, 稀释步骤按上述进行, 此组不加入菌液, 为药液对照组.将试管置于37 ℃摇床中振荡培养24 h, 实验组与对照组对比观察结果.
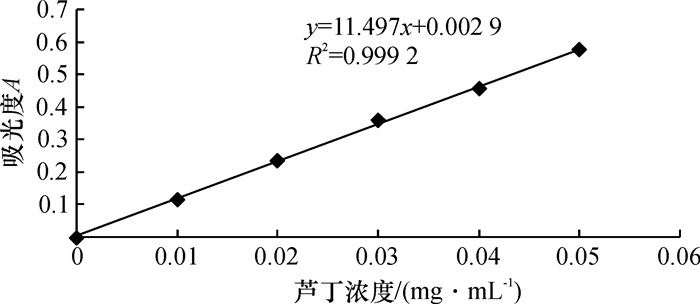
3 结果与讨论 3.1 芦丁标准曲线的绘制图 1为芦丁标准曲线, 表明在0~0.05 mg/mL质量浓度范围内的芦丁标准品在波长510 nm下吸光度有良好的相关性.线性方程为:y=11.497x+0.002 9;R2=0.999 2.
|
图 1 芦丁标准曲线 Figure 1 Standard Curve |
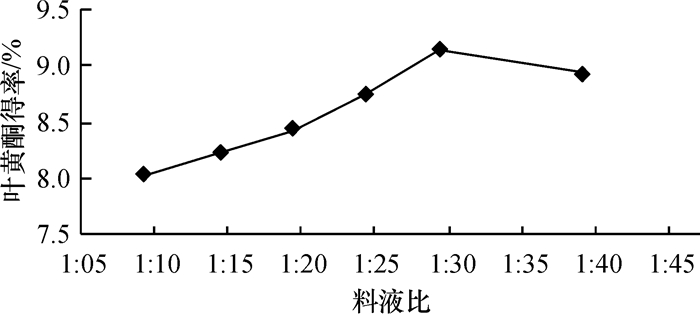
由图 2可知, 随料液比的增加, 总黄酮提取率呈先上升后下降趋势, 料液比为1:30时薇甘菊总黄酮提取率达到最大.其原因可能是在短时间内超声波促使组织细胞膜急剧破裂, 随之萃取的黄酮类物质迅速进入溶剂, 直至达到饱和.但当料液比增加至1:30后, 增加溶剂不但不会增加其提取率, 反而会更有利于杂质溶出, 因而提取率有所下降.
|
图 2 料液比对薇甘菊总黄酮提取率的影响 Figure 2 The influence of liquid-material ration on falconoids extraction |
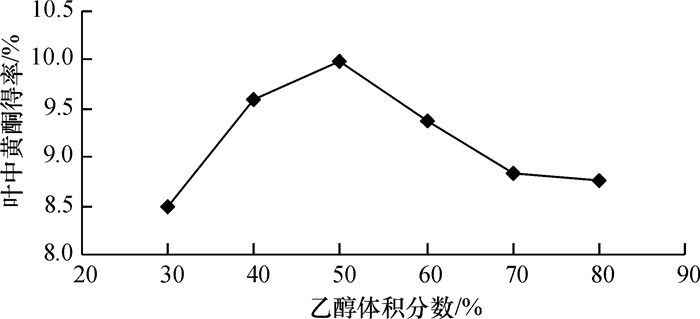
由图 3看出, 随乙醇体积浓度提高总黄酮提取率呈先上升后下降趋势, 乙醇体积分数达50%时黄酮提取率最高.可能是溶剂浓度太低, 不利于其渗透进入植物细胞内, 随着乙醇体积分数的提高, 黄酮类化合物溶出量增加.当乙醇体积浓度到一定水平时, 部分水溶性黄酮类化合物溶出量降低, 相反一些脂溶性成分溶出, 造成黄酮得率相对降低.
|
图 3 乙醇体积浓度(体积分数)对薇甘菊总黄酮提取率的影响 Figure 3 The influence of ethanol concentration on falconoids extraction |
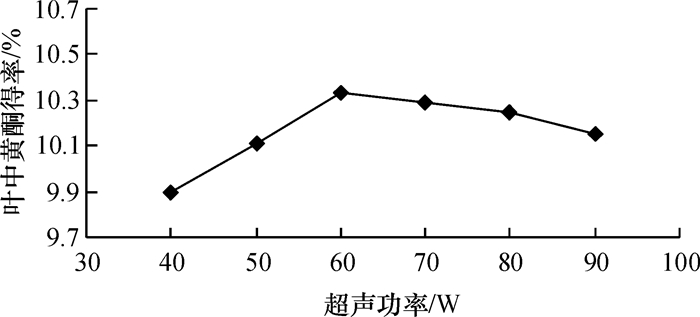
由图 4可知, 随超声功率增大, 总黄酮提取率呈先上升后下降趋势, 当超声功率为60 W时总黄酮提取率最高.这可能是不同物质对超声功率有不同的适应范围, 超过此范围超声可能会导致目标产物降解, 因而提取率显著下降.
|
图 4 超声功率对薇甘菊总黄酮提取率的影响 Figure 4 The influence of ultrasonic power on falconoids extraction |
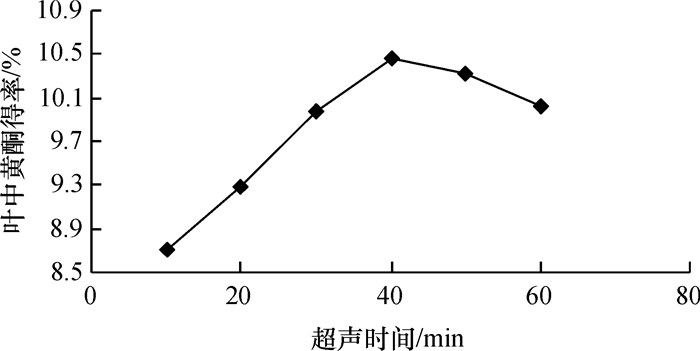
由图 5可知, 随时间延长总黄酮提取率呈先上升后下降趋势, 时间为40 min时总黄酮量最大.可能是达一定时间后大部分黄酮类物质已经溶出, 继续延长提取时间反而导致黄酮水解, 导致提取率降低.
|
图 5 超声时间对薇甘菊总黄酮提取率的影响 Figure 5 The influence of ultrasonic time on falconoids extraction |
由表 2可知, 各因素对薇甘菊叶黄酮提取影响的大小顺序为B>A>D>C, 即乙醇体积浓度>料液比>超声功率>超声时间.最佳提取条件组合为B2A2D1C3, 即:乙醇体积分数50%、料液比1:30、超声功率50 W, 超声时间50 min, 在此条件下薇甘菊叶黄酮提取率为10.616%.分别取3份同一批次的薇甘菊叶的粉末, 在最优组合条件下进行提取, 重复3次, 总黄酮提取得率分别为10.62%、10.80%、10.54%, RSD值为0.012 %, 证明该方法稳定可靠.
| 表 2 正交试验结果 Table 2 Results of orthogonal experiments |
由表 3可知, 薇甘菊叶的黄酮提取液对金黄色葡萄球菌、大肠杆菌、沙门氏菌、志贺菌的抑菌圈平均直径分别为15.0、11.0、7.5、8.0 mm;阳性对照硫酸链霉素组测得的直径分别为17.3、20.8、13.2、18.5 mm;阴性对照无菌蒸馏水组均无抑菌圈出现.由此可知, 薇甘菊叶的黄酮提取液对金黄色葡萄球菌和大肠杆菌有明显抑菌效果, 对沙门氏菌和志贺菌有一定的抑菌效果, 其中对金黄色葡萄球菌的抑制作用最强.
| 表 3 总黄酮提取液的抑菌效果(24 h) Table 3 Antibacterial activity of total falconoids extract (24 h) |
由表 4可知, 薇甘菊叶黄酮提取液在一定浓度下对4种菌均有一定抑制作用, 而且随着黄酮质量浓度的增加, 抑菌作用增强呈正相关, 具有广谱的抑菌性.其中, 对金黄色葡萄球菌和大肠杆菌的抑制作用最强, 其MIC均为1.562 5 mg/mL, 对沙门氏菌和志贺菌的抑制作用稍弱, 其MIC均为3.125 0 mg/mL(以黄酮质量浓度计).
| 表 4 总黄酮提取液的MIC1) Table 4 The MIC of total falconoids extract |
在单因素实验的基础上, 通过四因素三水平的正交试验, 得到了超声辅助提取薇甘菊叶中总黄酮的最优工艺.其中各因素对薇甘菊叶黄酮提取影响的大小顺序为B>A>D>C, 即乙醇体积分数>料液比>超声功率>超声时间.叶中总黄酮最佳提取工艺条件组合为B2A2D1C3 , 即:乙醇体积分数50%、料液比1:30、超声功率50 W、超声时间50 min, 在此条件下, 叶中总黄酮含量可达10.62%.
抑菌试验结果表明, 薇甘菊叶的黄酮提取液对常见的致病菌具有较好的抗菌活性, 而且随着提取液中黄酮质量浓度的增加而增强.薇甘菊叶的黄酮提取液对不同的菌种抑制效果不同, 其中对金黄色葡萄球菌的抑制作用最强, 对大肠杆菌的抑制作用稍微次之, 而对沙门氏菌和志贺菌的作用较弱, 这可能与提取液所含的黄酮种类、含量以及提取液中的其他活性成分有关, 原因还需要进一步深入研究.
薇甘菊叶的黄酮提取液良好的抑菌活性预示着其在天然防腐剂开发利用方面的广阔前景.由于薇甘菊生长能力强, 来源丰富, 对有效成分开发, 从而实现更好利用将具有重大意义.
| [1] |
孔国辉, 吴七根, 胡启明. 外来杂草薇甘菊(Mikania Micrantha H. B. K.)在我国出现[J].
热带亚热带植物学报, 2000, 8(1): 27-28.
|
| [2] |
李鸣光, 张炜银, 廖文波, 等. 薇甘菊研究历史与现状[J].
生态科学, 2000, 19(3): 41-45.
Li M G, Zhang W Y, Liao W B, et al. The history and status of the study on Mikania Micrantha[J]. Ecologic Science, 2000, 19(3): 41-45. |
| [3] |
Pimentel D, Zuniga R, Morrison D. Update on the environmental and economic costs associated with alien-invasive species in the United States[J].
Ecological Economics, 2005, 52: 273-288.
DOI: 10.1016/j.ecolecon.2004.10.002. |
| [4] |
Burnett K, Kaiser B, Roumasset J. Economic lessons from control efforts for all invasive species: Miconia calvescens in Hawaii[J].
Journal of Forest Economics, 2007, 13: 151-167.
DOI: 10.1016/j.jfe.2007.02.007. |
| [5] |
程丽坤, 刘小侠, 张青文, 等. 紫茎泽兰乙醇提取物对棉铃虫生长发育和繁殖力的影响[J].
昆虫学报, 2007, 50(3): 304-308.
Cheng L K, Liu X X, Zhang Q W, et al. Effect of ethanol extract of Eupatorium Adenophorum spreng on growth, development and reproduction of the cotton bollworm, Helicoverpa Armigera(Hubner)[J]. Acta Entomologica Sinica, March, 2007, 50(3): 304-308. |
| [6] |
吕朝军, 钟宝珠, 孙晓东, 等. 薇甘菊粗提物在椰心叶甲上的防控潜力[J].
昆虫学报, 2010, 53(3): 349-353.
Lü C J, Zhong B Z, Sun X D, et al. Control potential of extracts of Mikania Micrantha on brontispa longissima (Coleoptera: Chrysomelidae)[J]. Acta Entomologica Sinica, 2010, 53(3): 349-353. |
| [7] |
Wei X Y, Huang H J. Phenolic constituents from Mikania Micrantha[J].
Biochemical Systematics and Ecology, 2004, 32(11): 1091-1096.
DOI: 10.1016/j.bse.2004.04.013. |
| [8] |
赵志敏, 南艳平, 唐青涛, 等. 无患子总皂苷的体外抑菌及抗氧化活性研究[J].
时珍国医国药, 2013, 24(4): 799-801.
Zhao Z M, Nan Y P, Tang Q T, et al. In vitro antibacterial and antioxidant activities of soapnut saponin from Sapindus Mukorossi Gaertn[J]. Li Shi-zhen Medicine and Medica Research, 2013, 24(4): 799-801. |
| [9] |
朱慧, 马瑞君, 吴双桃, 等. 薇甘菊总黄酮的提取及清除羟自由基活性的测定[J].
食品科学, 2010, 31(6): 70-73.
Zhu H, Ma R J, Wu S T, et al. Ultrasonic-assisted extraction and radical scavenging activity of total flavanoids from different parts of Mikania Micrantha[J]. Food Science, 2010, 31(6): 70-73. |
| [10] |
赵爽, 严铭铭, 赵大庆, 等. 小飞蓬总黄酮提取工艺优选及体外抗氧化活性研究[J].
中成药, 2011, 33(2): 348-350.
|
| [11] |
张卫丽, 韩雅莉. 响应面法优化马尾松松针中总黄酮提取工艺[J].
广东工业大学学报, 2013, 30(1): 116-119.
Zhang W L, Han Y L. The extraction process of Pinus Massoniana optimized by response surface[J]. Journal of Guangdong University of Technology, 2013, 30(1): 116-119. |
| [12] |
张然, 王晶, 朱春花, 等. 超声波提取苏芡黄酮类化合物工艺[J].
食品科学, 2010, 31(22): 247-250.
Zhang R, Wang J, Zhu C H, et al. Ultrasonic extraction of flavonoids from Euryale Ferox planted in suzhou[J]. Food Science, 2010, 31(22): 247-250. |
| [13] |
李仪奎.
中药药理实验方法学[M]. 2版. 上海: 上海科学技术出版社, 2006.
|
| [14] |
高雪娟, 陈健, 孙红男, 等. 竹笋壳提取物抑菌活性研究[J].
食品工业科技, 2011, 10(32): 76-78.
Gao X J, Chen J, Sun H N, et al. Study on the antimicrobial activity of Bamboo Shoot shell extracts[J]. Science and Technology of Food Industry, 2011, 10(32): 76-78. |
| [15] |
董周永, 郭松年, 赵国建, 等. 石榴果皮提取物抑菌活性研究[J].
西北植物学报, 2008, 28(3): 0582-0587.
Dong Z Y, Guo S N, Zhao G J, et al. Antimicrobial activity of Pomegranate Peel extract[J]. Acta Bot Boreal Ccident Sin, 2008, 28(3): 0582-0587. |
| [16] |
钟希文, 梅全喜, 高玉桥, 等. 蛇鳞草提取液体外抑菌作用研究[J].
时珍国医国药, 2010, 21(9): 2238-2239.
|
| [17] |
廖建良, 揭育霞. 三叉苦叶提取物的抑菌活性研究[J].
广东农业科学, 2012(19): 90-92.
Liao J L, Jie Y X. Study on antimicrobial activities of the extract from Evodia Lepta leaves[J]. Guangdong Agricultural Sciences, 2012(19): 90-92. DOI: 10.3969/j.issn.1004-874X.2012.19.030. |
 2014, Vol. 31
2014, Vol. 31

