Effect of OsAOS2 gene on rice resistances to Magnaporthe oryzae and Xanthomonas oryzae pv. oryzae
-
摘要:
目的 研究OsAOS2在水稻抵抗稻瘟病菌和白叶枯病菌中的作用, 为水稻抗病育种工作提供依据。 方法 采用同源重组方法和CRISPR/Cas9系统分别构建OsAOS2的过表达载体和敲除载体, 遗传转化获得转基因水稻, 筛选得到过表达株系(OsAOS2-OE)和纯合敲除株系(OsAOS2-KO)。将野生型水稻日本晴(NPB)植株分别接种稻瘟病菌和白叶枯病菌后, 通过qRT-PCR检测OsAOS2表达量的变化情况; 将OsAOS2转基因水稻和NPB分别接种稻瘟病菌和白叶枯病菌后, 观察植株表型的变化; 在稻瘟病菌侵染下, 对OsAOS2转基因水稻和NPB进行抗病相关基因的qRT-PCR分析; 在几丁质和flg22诱导下, 检测水稻活性氧(ROS)积累情况; 同时, 分析接种稻瘟病菌24 h后OsAOS2-KO和NPB的转录组数据。 结果 qRT-PCR分析表明, NPB接种稻瘟病菌48 h和白叶枯病菌8 d时, OsAOS2表达量显著上调。对OsAOS2转基因水稻和NPB喷雾接种稻瘟病菌7 d后, NPB病斑面积显著大于OsAOS2-OE且小于OsAOS2-KO; 剪叶法接种白叶枯病菌14 d后, NPB病斑面积显著小于OsAOS2-KO。对OsAOS2转基因水稻接种稻瘟病菌后, 抗病相关基因OsPBZ1、OsPR1a、OsPAL1、OsLOX5在OsAOS2-OE中的表达量显著上调。在几丁质和flg22诱导下, OsAOS2-KO中ROS的积累量显著低于NPB, 但是起峰时间比NPB有所提前。转录组数据分析表明, 上调基因和下调基因分别有1 605个和1 151个。上调差异基因主要富集在金属离子结合和核糖体通路, 下调差异基因主要富集在翻译通路和细胞外区域。韦恩图显示: 52个基因在NPB中受稻瘟病菌诱导, 但在OsAOS2-KO中受到抑制; 11个基因在NPB中受抑制, 但在OsAOS2-KO中受诱导。对这63个表达模式相反的差异基因进行GO和KEGG分析发现, 参与应激反应和植物激素信号转导通路的基因数最多。 结论 稻瘟病菌和白叶枯病菌可以诱导OsAOS2的表达, OsAOS2通过病原菌分子模式触发的免疫(PTI)途径和茉莉酸(JA)、水杨酸(SA)介导的抗病反应正调控水稻对稻瘟病菌的抗性, 同时, OsAOS2在水稻抵御白叶枯病菌中也起重要作用。 Abstract:Objective The effect of OsAOS2 gene on rice resistances to Magnaporthe oryzae and Xanthomonas oryzae pv. oryzae (Xoo) was investigated to provide basis for disease resistance in rice breeding. Method OsAOS2 overexpression line (OsAOS2-OE) and homozygous knockout line (OsAOS2-KO) were obtained by genetic transformation with overexpression vector and knockout vector constructed by homologous recombination and CRISPR/Cas9 system, respectively. After infection with M.oryzae and Xoo, the expression profiles of OsAOS2 in wild type Nipponbare (NPB) were detected by qRT-PCR, and changes in the phenotypes of OsAOS2 transgenic rice and NPB were observed. qRT-PCR analysis of defense-related genes were performed in OsAOS2 transgenic rice and NPB under the infection of M.oryzae. The accumulation of reactive oxygen species (ROS) in OsAOS2 transgenic rice was detected under the induction of chitin and flg22. Meanwhile, the transcriptome of OsAOS2-KO and NPB at 24 h after infection with M.oryzae was analyzed. Result qRT-PCR analysis showed that the expression of OsAOS2 was significantly up-regulated at 48 h and 8 d after infection with M.oryzae and Xoo, respectively. After infected with M.oryzae by spray for 7 d, the lesion area of NPB was significantly larger than that of OsAOS2-OE but smaller than that of OsAOS2-KO; nevertheless, after inoculated with Xoo by leaf-clipping for 14 d, the lesion area of NPB was significantly less than that of OsAOS2-KO. The expression patterns of defense related-genes (OsPBZ1, OsPR1a, OsPAL1, and OsLOX5) were significantly upregulated in OsAOS2-OE transgenic rice after infection with M.oryzae. The ROS accumulation in OsAOS2-KO was significantly lower than that in the wild type under induction with chitin and flg22, but the peak time of ROS in OsAOS2-KO was slightly ahead of NPB. The transcriptome of OsAOS2-KO showed 1 605 upregulated differentially expressed genes (DEGs) and 1 151 downregulated DEGs compared with NPB. The upregulated DEGs were mainly enriched in the metal ion binding and ribosomal pathways, while the downregulated DEGs were mainly enriched in the translational pathway and extracellular regions. Venn plot showed that 52 genes were induced by M.oryzae in NPB but inhibited in OsAOS2-KO, while another 11 genes were inhibited in NPB but induced in OsAOS2-KO. GO and KEGG analysis on the 63 DEGs with opposite expression patterns showed that the majority of them were involved in stress response and plant hormone signaling pathway. Conclusion The infection of M.oryzae and Xoo can induce the expression of OsAOS2, which regulates rice resistance through pathogen-associated molecular pattern-triggered immune (PTI) pathway and JA- and SA-mediated defense responses; meanwhile, OsAOS2 also plays an important role in defense responses to bacterial blight. -
Keywords:
- OsAOS2 /
- jasmonic acid /
- disease resistance /
- rice blast /
- bacterial blight /
- transcriptome analysis
-
开放科学(资源服务)标识码(OSID):

水稻是世界上重要的农作物,是半数以上人口的主食来源[1]。然而,它易受到多种病原菌的侵害。稻瘟病菌(Magnaporthe oryzae)和白叶枯病菌(Xanthomonas oryzae pv. oryzae, Xoo)是威胁水稻产量和品质的重要病原菌。研究水稻与病原菌的互作机制,对培育抗病水稻品种具有重要意义[2]。
植物激素在水稻与病原菌的互作中起着重要调控作用。其中,茉莉酸(jasmonic acid, JA)作为信号分子,可以触发植物免疫,有效介导一系列抗病基因的表达和防御物质的合成,赋予植物广谱抗性,敲除JA合成途径上的基因可以使植物对各种病原菌的抗性降低,过表达JA合成途径上的基因则会提高植物对病原菌的抗性[3-5]。丙二烯氧合酶(allene oxide synthase, AOS)是参与JA生物合成途径的酶,它能够促使13-HPOT分解,形成不稳定环氧化物,随后通过多个步骤将其转变为JA[6]。水杨酸(salicylic acid, SA)和JA是植物生长发育过程中的重要防御激素。编码AOS的基因OsAOS2在水稻叶片中的表达受稻瘟病菌的显著诱导,OsAOS2过表达可上调PR1a、PR3和PR5以及SA合成通路上的基因OsPAL1、JA合成通路上的基因OsLOX5等抗病相关基因的表达,从而提高水稻对稻瘟病菌的抗性[7]。苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL)可以通过脱氨作用生成SA生物合成的前体物质反式肉桂酸t-CA,并调控植物的抗病过程[8-9]。脂氧合酶(lipoxygenase, LOX)是JA合成的关键酶,在植物中大量存在,且在植物抵御机械损伤和病虫侵染等逆境胁迫中起重要作用[10]。这些研究结果表明JA合成途径中的OsAOS2基因在水稻抗稻瘟病菌中起着非常重要的作用,但是其作用机制尚有待进一步研究。本研究通过构建OsAOS2过表达和敲除的转基因水稻株系,对其抗稻瘟病菌和白叶枯病菌的性能进行分析,并对基因敲除株系受稻瘟病菌侵染的转录组数据进行分析,为水稻抗病育种工作提供依据。
1. 材料与方法
1.1 材料
试验所用水稻品种为福建农林大学功能基因组研究中心保存的野生型粳稻品种日本晴(Nipponbare, NPB)及本研究以NPB为背景构建的OsAOS2(LOC_Os03g12500)转基因材料。试验所用菌株为本实验室保存的稻瘟病菌菌株Guy11、白叶枯病菌菌株PXO99A、大肠杆菌(Escherichia coli)DH5α及购自天根生化科技有限公司的根瘤农杆菌(Agrobacterium)EHA105;CRISPR/Cas9载体和中间载体pYL-U3/U6a-gRNA由华南农业大学馈赠,过表达载体为本实验室保存的pCXUN-HA;本研究所用的引物见表 1。
表 1 本研究所用引物Table 1 Primers used in this study引物名称Primer name 引物序列Primer sequence 用途Purpose OsAOS2-F ATGGAGCTAGGCGTGCCACT 目的基因克隆 OsAOS2-R TTAAGCAGTACGATTGACGGCG Target gene cloning OsAOS2-U3-F GGCACGTCCCGCCTGGCCCATTCA CRISPR/Cas9第1靶点验证 OsAOS2-U3-R AAACTGAATGGGCCAGGCGGGACG CRISPR/Cas9 1st target validation OsAOS2-U6a-F GCCGTGGAGAAGATGGAGCTGACC CRISPR/Cas9第2靶点验证 OsAOS2-U6a-R AAACGGTCAGCTCCATCTTCTCCA CRISPR/Cas9 2nd target validation UbiP-seq TTTTAGCCCTGCCTTCATACGC 过表达载体测序 NosR-seq AGACCGGCAACAGGATTCAATC Sequencing of overexpression vector U-F CTCCGTTTTACCTGTGGAATCG 敲除靶点第1轮扩增 gRNA-R CGGAGGAAAATTCCATCCAC Knockout target round 1 amplification Uctcg-B1′ TTCAGAGGTCTCTCTCGCACTGGAATCGGCAGCAAAGG CRISPR/Cas9第1靶点扩增 gRctga-B2 AGCGTGGGTCTCGTCAGGGTCCATCCACTCCAAGCTC CRISPR/Cas9 1st target amplification Uctga-B2′ TTCAGAGGTCTCTCTGACACTGGAATCGGCAGCAAAGG CRISPR/Cas9第2靶点扩增 gRcggt-BL AGCGTGGGTCTCGACCGGGTCCATCCACTCCAAGCTC CRISPR/Cas9 2nd target amplification OsPAL1-QF AGGAGCTCGGCTGCGTATT OsPAL1定量PCR OsPAL1-QR ATGCCGAGGAACACCTTGTT qRT-PCR of OsPAL1 OsLOX5-QF CTGATGAGGAGTTTGCACGA OsLOX5定量PCR OsLOX5-QR TCGTCCTTCAGGAGCAGAAT qRT-PCR of OsLOX5 OsPR1a-QF CGTCTTCATCACCTGCAACTACTC OsPR1a定量PCR OsPR1a-QR CATGCATAAACACGTAGCATAGCA qRT-PCR of OsPR1a OsPBZ1-QF CCCTGCCGAATACGCCTAA OsPBZ1定量PCR OsPBZ1-QR CTCAAACGCCACGAGAATTTG qRT-PCR of OsPBZ1 1.2 方法
从水稻数据库(https://ricedata.cn/gene/)和NCBI网站(https://www.ncbi.nlm.nih.gov)检索OsAOS2的基因信息,下载得到氨基酸序列。
1.2.1 CRISPR/Cas9敲除载体构建及转基因植株验证
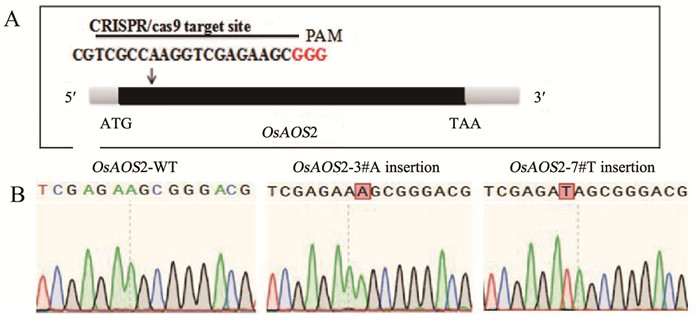
参照文献[11]构建OsAOS2的敲除载体:从OsAOS2的编码序列(coding sequence, CDS)中选择两个靶点,通过网站(http://skl.scau.edu.cn/targetdesign/)设计靶点接头引物,用于扩增目的片段,并将其与酶切载体相连,以构建敲除载体。将经过验证的载体质粒送武汉伯远生物科技有限公司进行遗传转化,获得转基因水稻。以阳性转基因水稻株系DNA为模板,在靶点位置前后100~150 bp处设计并合成引物,再进行条带扩增、凝胶电泳检测,然后送生工生物工程(上海)股份有限公司测序。通过DSDecodeM网站(http://skl.scau.edu.cn/dsdecode/)对测序结果进行分析,筛选不同编辑类型的纯合突变株进行繁殖,并验证表型。
1.2.2 过表达载体的构建及转基因植株验证
以NPB的cDNA作为模板扩增OsAOS2(1 437 bp),并将其与经过限制性内切酶XcmⅠ酶切处理的pCXUN-HA载体连接,构建过表达载体。然后,将这个载体转化至大肠杆菌中,菌液经PCR扩增检测,再用引物(UbiP、NosR)进行测序确认,将测序结果比对正确的菌液扩大培养,提取质粒后,送武汉伯远生物科技有限公司遗传转化,获得T0代过表达转基因水稻苗,检测各株系中OsAOS2的表达量,选择上调倍数高且对结实率影响不大的株系进行后续试验。
1.2.3 水稻喷雾接种稻瘟病菌
将保有稻瘟病菌菌株Guy11的滤纸片贴到完全培养基(complete medium, CM)上28 ℃活化培养3~4 d。将CM上的菌丝切成小块,菌丝面朝下移入米糠培养基中,经过3 d的培养,用载玻片刮掉菌丝,并在黑光灯下产孢。然后,用含有0.02%(质量分数)吐温的无菌水悬浮孢子,并通过尼康光学显微镜(ECLIPSE E100)调节孢子液的浓度,使其达到1×105个·mL-1。最后,用小喷壶对生长至三叶一心期的水稻均匀喷菌,移至暗箱中培养24 h后,转至接种室,保持温度28 ℃和80%的湿度,以便水稻更好地发病。以喷施质量分数为0.02%的吐温水为对照,分别取接种0、12、24、48、72 h的NPB叶片,通过qRT-PCR分析OsAOS2表达量的变化情况;7 d后调查转基因水稻和NPB植株的发病情况[4]。
1.2.4 水稻创伤接种稻瘟病菌
用鼠耳打孔器对6周龄水稻叶片进行轻微造伤,吸取7 μL孢子悬浮液(制备方法参照1.2.3)滴至创伤处。将接种区域用透明胶带紧密封闭,在28 ℃下培养7 d,通过惠普激光打印机(LaserJet Pro MFP M226dw Numero de Producto)扫描获取病斑图像,利用ImageJ软件统计病斑面积[4]。同时,从叶片病斑处剪下大约3 cm×1 cm小块,精提DNA,通过qRT-PCR对水稻叶片的真菌生物量进行定量分析。
1.2.5 水稻接种白叶枯病菌
将-80 ℃冷冻保存的白叶枯病菌在营养琼脂(nutrient agar, NA)平板上划线,28 ℃活化培养3 d,挑取细菌菌落转接至新的NAA培养基上培养3 d,重复1次,配制无菌MgCl2溶液(10 mmol·L-1)洗脱白叶枯病菌菌株PXO99A,菌液终浓度调至D600 nm值为0.6[4]。
采用剪叶法对水稻接种PXO99A。待水稻植株长至5周龄,用剪刀蘸取洗脱好的白叶枯病菌孢子悬浮液,蘸取菌液时需停留3~5 s,确保蘸取足量的菌液,然后将距离叶尖2 cm左右的部分剪去,为了确保每片叶都受到PXO99A的侵染,每剪2片叶需重复蘸取菌液。以喷施10 mmol·L-1的MgCl2为对照,分别取接种0、1、2、4、8 d的NPB叶片,通过qRT-PCR分析OsAOS2表达量的变化情况;14 d后调查转基因水稻和NPB叶片的发病情况[4]。
1.2.6 水稻抗病相关基因表达量分析
对转基因水稻和NPB植株喷雾接种稻瘟病菌孢子悬浮液(制备方法参照1.2.3),于不同时间点剪取水稻叶片,提取RNA,并反转录成cDNA,以Actin为内参,通过qRT-PCR分析抗病相关基因的表达情况。
1.2.7 水稻叶片中活性氧(reactive oxygen species, ROS)的测定
将6周龄水稻叶片打成若干小圆片,将小圆片置于灭菌双蒸水中避光浸泡。将ROS混合反应液(10 μL 20 mmol·L-1 L-012、1 μL 10 mg·mL-1 HPR、9 989 μL ddH2O)100 μL分别添加到96孔板中,将过夜浸泡的圆片挑入孔中,再浸泡30 min后,迅速加入激发子(几丁质或者flg22),并立即将其放入酶标仪(赛默飞世尔科技5250030)中进行激发光检测,持续时间为50 min,且每个样品不少于9次重复。
1.2.8 转录组测序及差异表达基因的鉴定与功能分析
将生长至三叶一心期的NPB和OsAOS2敲除株系接种稻瘟病菌菌株Guy11[4]。对接菌0 h和24 h的叶片进行RNA-seq转录组测序,3个生物学重复。使用宝日医生物技术(北京)有限公司提供的转录组文库,在Illumina NovaSeq 6000平台上进行测序。
通过百迈客云平台(https://www.biocloud.net)进行差异表达基因的鉴定和分析。利用HISAT2软件将RNA-seq测序得到的clean reads数据比对到水稻参考基因组Oryza_sativa.IRGSP_1.0.55上[12],使用DESeq2软件进行差异表达分析[13],筛选得到显著差异表达基因。对差异表达基因进行GO功能、KEGG富集分析,利用R包ClusterProfile作图[14]。通过VENNY 2.1在线软件(https://bioinfogp.cnb.csic.es/tools/venny/)绘制韦恩图。
2. 结果与分析
2.1 OsAOS2对稻瘟病菌和白叶枯病菌侵染的响应
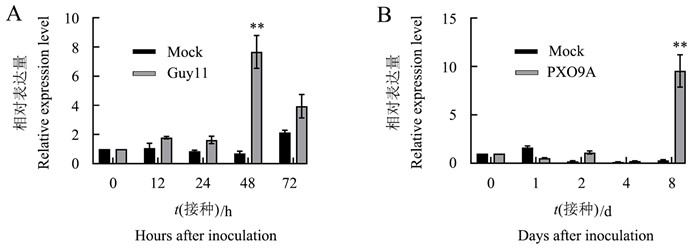
NPB植株接种稻瘟病菌12 h,OsAOS2基因轻微上调;48 h达到最大值,是相同时间点对照OsAOS2表达量的10.8倍;72 h表达量有所降低,但仍高于0 h和相同时间点对照的表达量(图 1A)。
NPB植株接种白叶枯病菌4 d内,OsAOS2的表达量未发生显著改变;但是在接种8 d时,它的表达量出现显著上调,是接种0 d时表达量的10.0倍(图 1B)。
以上结果说明OsAOS2的表达受到稻瘟病菌和白叶枯病菌的诱导,OsAOS2可能在水稻防御病害中发挥一定作用。
2.2 OsAOS2敲除植株的验证
在筛选OsAOS2敲除突变体中,经U3、U6a靶点测序分析验证分别得到6个纯合突变体。其中,3#和7#的突变类型分别插入碱基A和T,使编码的蛋白提前终止(图 2)。因此,后续以敲除突变体OsAOS2-KO-3#和OsAOS2-KO-7#株系进行表型分析。
2.3 OsAOS2过表达植株的验证
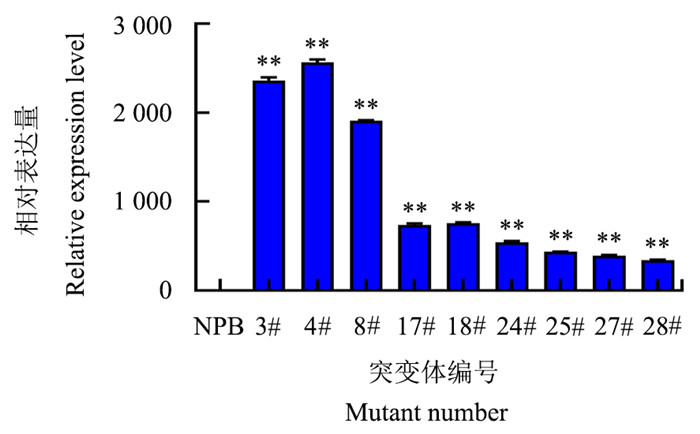
对OsAOS2过表达植株与NPB进行qRT-PCR验证,得到表达量上调300~2 500倍的9个株系,其中, OsAOS2-OE-3#和OsAOS2-OE-4#株系的表达量最高(图 3)。因此,后续选用OsAOS2-OE-3#和OsAOS2-OE-4#株系进行表型分析。
2.4 OsAOS2转基因水稻对稻瘟病菌和白叶枯病菌的抗性
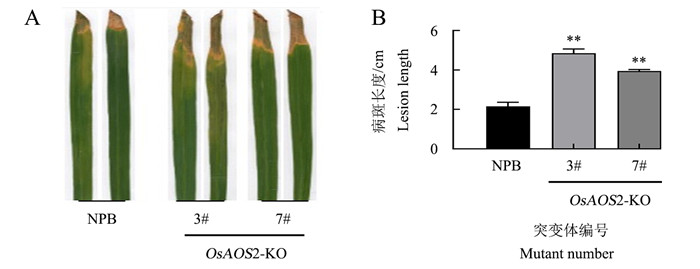
喷雾接种稻瘟病菌Guy11 7 d后,NPB叶片上仅出现少数2级病斑;OsAOS2-KO叶片上病斑数量显著增多,大部分为3级病斑,并伴有一定程度的4级病斑;而OsAOS2-OE叶片上仅出现1级病斑(图 4A)。经打孔造伤接种Guy11 7 d后,OsAOS2-KO-3# 和OsAOS2-KO-7#的病害程度显著高于NPB(图 4B),其病斑面积分别是NPB的1.7倍和1.8倍(图 4C),且病叶中的真菌数量明显多于NPB(图 4D)。这表明OsAOS2正调控水稻对稻瘟病菌的抗性。
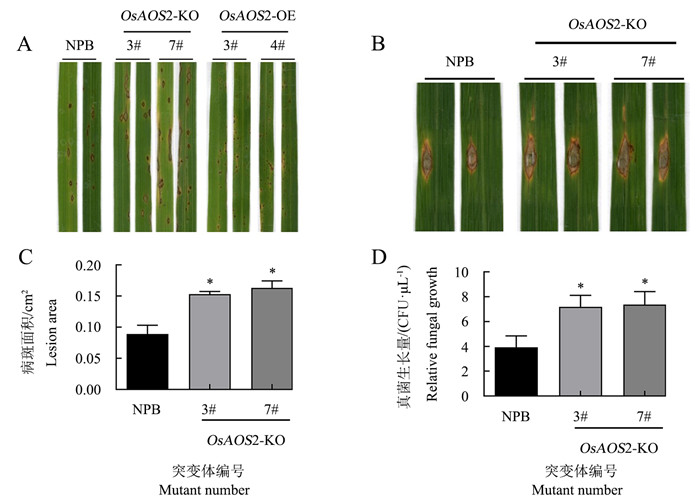 A.喷雾接种3周龄植株叶片的病害症状;B.创伤接种6周龄植株叶片的病害症状;C-D.创伤接种植株叶片的病斑面积和真菌生长量。*代表与NPB相比在0.05水平上差异显著(t-检验)。A.Disease symptoms of 3-week-old plants inoculated by spray; B.Disease symptoms of 6-week-old plants inoculated by trauma; C-D.Lesion area and fungal growth in leaves of plants inoculated by trauma. *represents significant difference at 0.05 level compared to NPB (t-test).图 4 OsAOS2转基因水稻植株接种稻瘟病菌7 d的表型Fig. 4 Phenotype of OsAOS2 transgenic rice at 7 d after infection with M.oryzae
A.喷雾接种3周龄植株叶片的病害症状;B.创伤接种6周龄植株叶片的病害症状;C-D.创伤接种植株叶片的病斑面积和真菌生长量。*代表与NPB相比在0.05水平上差异显著(t-检验)。A.Disease symptoms of 3-week-old plants inoculated by spray; B.Disease symptoms of 6-week-old plants inoculated by trauma; C-D.Lesion area and fungal growth in leaves of plants inoculated by trauma. *represents significant difference at 0.05 level compared to NPB (t-test).图 4 OsAOS2转基因水稻植株接种稻瘟病菌7 d的表型Fig. 4 Phenotype of OsAOS2 transgenic rice at 7 d after infection with M.oryzae经过剪叶法接种白叶枯病菌PXO99A 14 d后,NPB和OsAOS2-KO叶片上均出现黄化病症,且OsAOS2-KO的病害特征更加突出(图 5A);经过测量,OsAOS2-KO-3#和OsAOS2-KO-7#叶片上的病斑长度分别是NPB的2.5倍和2.0倍(图 5B)。这表明与NPB相比,OsAOS2敲除水稻植株对白叶枯病菌的抵抗力较弱。
2.5 OsAOS2敲除和过表达水稻中抗病相关基因的表达量
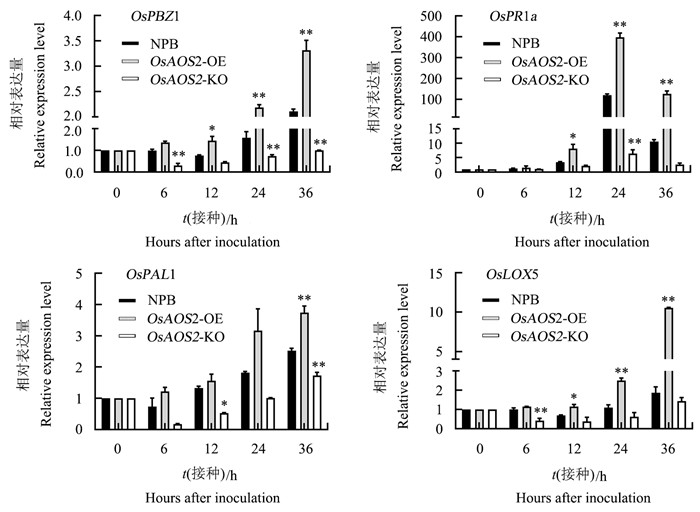
对NPB和OsAOS2转基因水稻接种Guy11后,检测到4个抗病相关基因的表达量出现了明显变化,分别为OsPBZ1、OsPR1a、OsPAL1以及OsLOX5(图 6)。随着时间的延长,这些基因的表达量在OsAOS2-OE中显著增加,而在OsAOS2-KO中保持较低水平。接种24 h后OsAOS2-OE中OsPBZ1、OsPR1a和OsLOX5基因的表达量分别为NPB的1.4、3.3、2.3倍;接种36 h后OsAOS2-OE中OsPAL1的表达量为NPB的1.5倍。SA通路标志基因OsPAL1和JA通路标志基因OsLOX5在OsAOS2-OE中的表达水平均随着时间延长显著提高,同时,OsAOS2-OE具有更强的抗病能力(图 5A),由此推测OsAOS2基因可能通过参与JA和SA的信号途径来调节转基因水稻的免疫功能。
2.6 OsAOS2敲除水稻中ROS的积累量
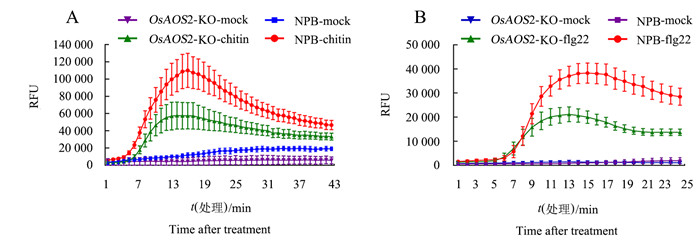
图 7显示,在几丁质和flg22的诱导下,无论是NPB还是OsAOS2-KO,都会出现ROS的爆发,但OsAOS2-KO中每分钟检测到的ROS爆发量均比NPB低,因此,NPB的ROS检测峰在OsAOS2-KO之上。在几丁质和flg22诱导下,NPB中ROS积累量达到顶峰的时间(16 min和15 min)均晚于OsAOS2-KO(14 min和13 min),OsAOS2-KO中ROS积累的峰值分别为NPB的44.5%和55.3%。这表明OsAOS2可以正调控由几丁质和flg22诱导的病原菌分子模式触发的免疫(pattern-triggered immunity, PTI)反应。
2.7 差异表达基因的筛选与功能分析
与未接菌(N0 h和A0 h)的植株相比,接种Guy11 24 h的NPB(N24 h)和OsAOS2-KO(A24 h)分别有9 346个和6 024个差异表达基因,其中,上调的差异表达基因分别有4 165个和2 679个,下调的差异表达基因分别有5 181个和3 345个(图 8A-B)。进一步分析N24 h和A24 h的数据,结果表明,2 756个基因显著表达,上调基因和下调基因分别有1 151个和1 605个(图 8C)。GO富集分析结果显示,上调差异基因主要富集在金属离子结合和核糖体通路,下调差异基因主要富集在翻译通路和细胞外区域(图 8D-E)。韦恩图显示:52个基因在NPB中受稻瘟病菌诱导,但在突变体植株中受到抑制;11个基因在NPB中受抑制,但在突变体植株中受诱导(图 9A)。在N24 h和A0 h样品中大部分基因上调,N0 h和A24 h样品中大部分基因下调,且N0 h和A0 h样品中部分基因表达水平可下调或上调到100倍(图 9B)。对这63个表达模式相反的差异基因进行GO和KEGG分析,结果表明,处于应激反应(Os03g0762300、Os03g0181100、Os03g0320600、Os07g0661400、Os07g0438700、Os03g0794500)和植物激素信号转导通路的基因(Os08g0201700、Os03g0402800、Os10g0468500、Os06g0696400、Os03g0181100、Os03g0790500)最多(图 9C-D)。
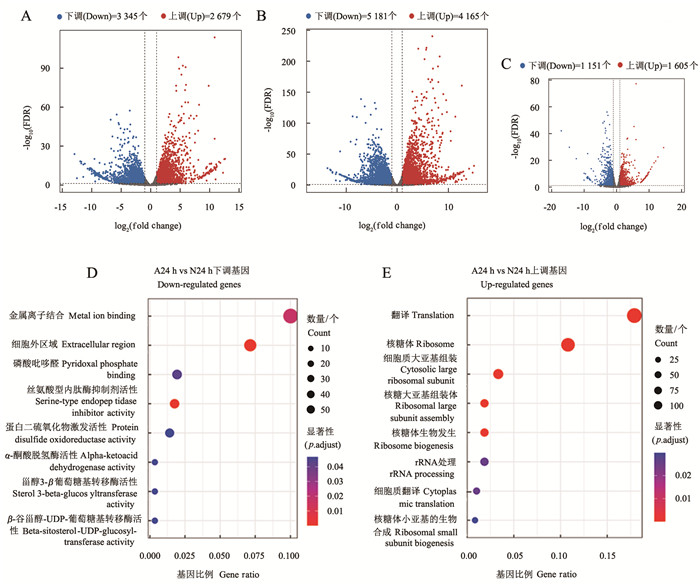 A.接种24 h(A24 h)与0 h(A0 h)相比OsAOS2-KO中差异表达基因的火山图;B.接种24 h(N24 h)与0 h(N0 h)相比NPB中差异表达基因的火山图;C.A24 h与N24 h相比差异表达基因的火山图;D.下调表达基因的GO富集气泡图;E.上调表达基因的GO富集气泡图。A.Volcano plot of differentially expressed genes in OsAOS2-KO after inoculation for 24 h (A24 h) compared to 0 h (A0 h); B.Volcano plot of differentially expressed genes in NPB after inoculation for 24 h (N24 h) compared to 0 h (N0 h); C.Volcano plot of differentially expressed genes in A24 h compared to N24 h; D-E.GO enrichment dotplots of down-and up-regulated genes.图 8 接种稻瘟病菌后OsAOS2-KO和NPB中的差异表达基因Fig. 8 Differentially expressed genes in OsAOS2-KO and NPB after inoculation with M.oryzae
A.接种24 h(A24 h)与0 h(A0 h)相比OsAOS2-KO中差异表达基因的火山图;B.接种24 h(N24 h)与0 h(N0 h)相比NPB中差异表达基因的火山图;C.A24 h与N24 h相比差异表达基因的火山图;D.下调表达基因的GO富集气泡图;E.上调表达基因的GO富集气泡图。A.Volcano plot of differentially expressed genes in OsAOS2-KO after inoculation for 24 h (A24 h) compared to 0 h (A0 h); B.Volcano plot of differentially expressed genes in NPB after inoculation for 24 h (N24 h) compared to 0 h (N0 h); C.Volcano plot of differentially expressed genes in A24 h compared to N24 h; D-E.GO enrichment dotplots of down-and up-regulated genes.图 8 接种稻瘟病菌后OsAOS2-KO和NPB中的差异表达基因Fig. 8 Differentially expressed genes in OsAOS2-KO and NPB after inoculation with M.oryzae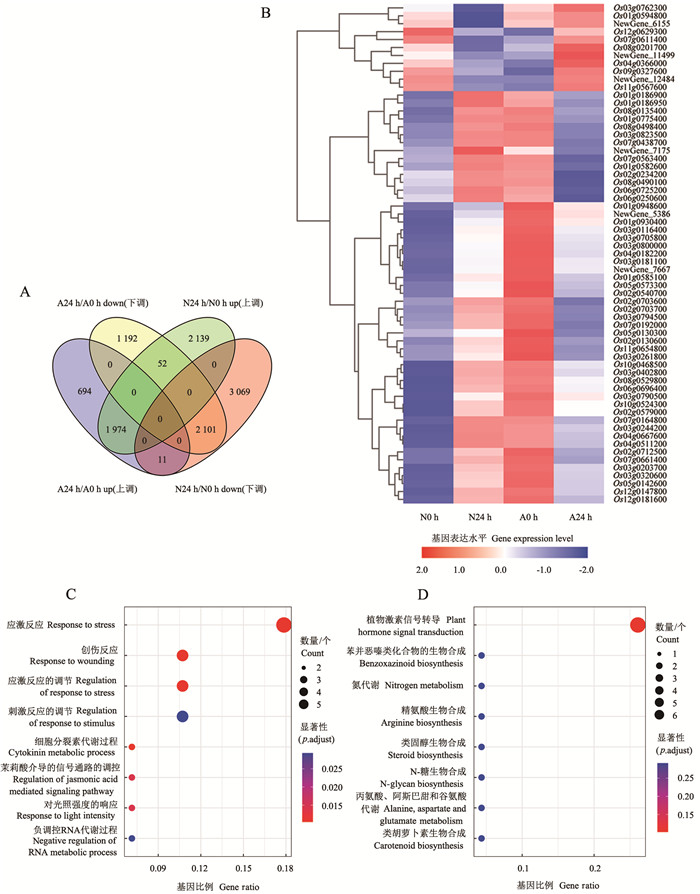 A.4类差异的韦恩图[OsAOS2-KO接菌后上调(A24 h/A0 h up)和下调(A24 h/A0 h down)的基因数(个),NPB接菌后上调(N24 h/N0 h up) 和下调(N24 h/N0 h down)的基因数(个)];B.63个表达模式相反的差异基因的聚类图;C.63个表达模式相反的差异基因的GO富集图;D.63个表达模式相反的差异基因的KEGG富集图。A.Venn plot of 4 categories of differences [count of up-regulated genes (A24 h/A0 h up) and down-regulated genes (A24 h/A0 h down) in OsAOS2-KO, count of up-regulated genes (N24 h/N0 h up) and down-regulated genes (N24 h/N0 h down) in NPB]; B.Clustering of 63 differential genes with opposite expression patterns; C.GO enrichment map of 63 differential genes with opposing expression patterns; D.KEGG enrichment map of 63 differential genes with opposite expression patterns.图 9 OsAOS2-KO和NPB中表达模式相反的差异基因及其功能分析Fig. 9 Genes with opposite expression pattern in OsAOS2-KO and NPB and their function analysis
A.4类差异的韦恩图[OsAOS2-KO接菌后上调(A24 h/A0 h up)和下调(A24 h/A0 h down)的基因数(个),NPB接菌后上调(N24 h/N0 h up) 和下调(N24 h/N0 h down)的基因数(个)];B.63个表达模式相反的差异基因的聚类图;C.63个表达模式相反的差异基因的GO富集图;D.63个表达模式相反的差异基因的KEGG富集图。A.Venn plot of 4 categories of differences [count of up-regulated genes (A24 h/A0 h up) and down-regulated genes (A24 h/A0 h down) in OsAOS2-KO, count of up-regulated genes (N24 h/N0 h up) and down-regulated genes (N24 h/N0 h down) in NPB]; B.Clustering of 63 differential genes with opposite expression patterns; C.GO enrichment map of 63 differential genes with opposing expression patterns; D.KEGG enrichment map of 63 differential genes with opposite expression patterns.图 9 OsAOS2-KO和NPB中表达模式相反的差异基因及其功能分析Fig. 9 Genes with opposite expression pattern in OsAOS2-KO and NPB and their function analysis3. 讨论
JA信号途径在植物应对生物和非生物胁迫中起着非常重要的作用,AOS是JA合成途径中的一种关键酶。苹果MdAOS受JA、脱落酸(abscisic acid, ABA)、乙烯等多种物质的诱导,并受机械伤害诱导表达[15];水曲柳FmAOS受寒冷、NaCl、干旱等逆境胁迫的影响,且FmAOS的表达受ABA、赤霉素(GA3)等信号途径调控[16];陈丽兰等[17]对甘蔗进行了转录组测序,筛选到对盐害、植物激素、干旱、病虫害等胁迫应答的ScAOS,其表达量在NaCl、聚乙二醇(PEG)、茉莉酸甲酯(MeJA)、病原菌和黏虫取食等胁迫条件下均显著增加,预示ScAOS在植物中有明显的抗病虫功能。
张同芳[6]研究表明,在机械损伤、二化螟侵蚀及外源JA的刺激下,OsAOS1和OsAOS2能够在JA合成途径中起到促进早期合成和保护后期合成的作用。解军辉等[18]发现:稻瘟病菌会影响OsAOS1的表达,OsAOS1敲除植株中的抗病相关基因,如OsPR1a、OsPR1b、OsPR10及OsPAL1,表达量较野生型显著降低;同时,OsAOS1突变不仅会减少ROS的积累,还会降低两个基础免疫标记基因OsKS4和OsPAL的表达水平。这一研究结果表明OsAOS1在水稻抗病方面起正调控作用。OsAOS2受稻瘟病菌诱导,过表达OsAOS2可以增强水稻对稻瘟病菌的抗性,但OsAOS2基因RNAi株系与野生型水稻抗病性并未发现差异[7]。为进一步解析OsAOS2基因在水稻与稻瘟病菌互作中的作用,本研究构建了OsAOS2的过表达和敲除转基因水稻,筛选得到纯合突变植株。采取喷雾法和创伤法接种稻瘟病菌后发现:相比于野生型,过表达株系表现出明显的抗性,与先前报道[7]一致;而基因敲除植株更感病且病斑面积和真菌相对生物量均更高,与文献[7]的结果不一致。这种情况可能与文献[7]是RNAi株系有关,尽管OsAOS2基因表达量受到抑制,但是仍有少量转录的mRNA翻译成蛋白质,生成微量的JA,通过级联反应放大来发挥其功能;而本研究基于CRISP/Cas9技术的基因敲除相对来说更彻底。利用qRT-PCR分析了转基因水稻和野生型水稻接种稻瘟病菌后一些抗病相关基因的表达水平,发现过表达株系中抗病相关基因的表达水平明显高于野生型,而敲除株系则相反。这说明OsAOS2对水稻抵抗稻瘟病菌有重要作用,其可能与SA和JA信号转导途径相互关联。
JA信号途径在水稻抵抗白叶枯病菌的侵染中发挥重要作用,可以增强水稻对白叶枯病菌的抗性。Uji et al[19]和Yamada et al[20]通过qRT-PCR分析发现,JA信号转导基因OsMYC2和OsJAZ8都能够促进水稻对白叶枯病菌的抗性。本研究结果表明,白叶枯病菌侵染可诱导野生型水稻中OsAOS2的表达,OsAOS2敲除植株接种白叶枯病菌后的感染程度明显高于野生型,这表明OsAOS2在水稻与白叶枯病菌互作中是有一定作用的。
PTI反应是植物体维持正常生长发育的重要机制,它能够识别受体和微生物表面结构,产生抵抗病原菌的化合物、SA、ROS以及胼胝质,进而抑制病原菌的生长,这种免疫反应被称为基础抗性[21-25]。通过对转基因水稻和野生型水稻进行几丁质和flg22处理,发现OsAOS2的敲除可以有效抑制ROS的积累,这表明OsAOS2参与水稻的PTI反应。
此外,对接种稻瘟病菌24 h后突变体株系和野生型的转录组数据进行分析,结果表明:52个基因在野生型中受稻瘟病菌诱导,但在突变体株系中受到抑制;11个基因在野生型中受抑制,但在突变体株系中受诱导。对这63个表达模式相反的差异基因进行GO和KEGG分析发现,处于应激反应和植物激素信号转导通路的基因最多。
综上,OsAOS2参与PTI反应,正调控水稻对稻瘟病菌的抗性,这是JA和SA信号途径协同作用的结果;同时,OsAOS2在水稻抗白叶枯病菌中也起重要作用。
-
图 4 OsAOS2转基因水稻植株接种稻瘟病菌7 d的表型
A.喷雾接种3周龄植株叶片的病害症状;B.创伤接种6周龄植株叶片的病害症状;C-D.创伤接种植株叶片的病斑面积和真菌生长量。*代表与NPB相比在0.05水平上差异显著(t-检验)。
Fig. 4 Phenotype of OsAOS2 transgenic rice at 7 d after infection with M.oryzae
A.Disease symptoms of 3-week-old plants inoculated by spray; B.Disease symptoms of 6-week-old plants inoculated by trauma; C-D.Lesion area and fungal growth in leaves of plants inoculated by trauma. *represents significant difference at 0.05 level compared to NPB (t-test).
图 8 接种稻瘟病菌后OsAOS2-KO和NPB中的差异表达基因
A.接种24 h(A24 h)与0 h(A0 h)相比OsAOS2-KO中差异表达基因的火山图;B.接种24 h(N24 h)与0 h(N0 h)相比NPB中差异表达基因的火山图;C.A24 h与N24 h相比差异表达基因的火山图;D.下调表达基因的GO富集气泡图;E.上调表达基因的GO富集气泡图。
Fig. 8 Differentially expressed genes in OsAOS2-KO and NPB after inoculation with M.oryzae
A.Volcano plot of differentially expressed genes in OsAOS2-KO after inoculation for 24 h (A24 h) compared to 0 h (A0 h); B.Volcano plot of differentially expressed genes in NPB after inoculation for 24 h (N24 h) compared to 0 h (N0 h); C.Volcano plot of differentially expressed genes in A24 h compared to N24 h; D-E.GO enrichment dotplots of down-and up-regulated genes.
图 9 OsAOS2-KO和NPB中表达模式相反的差异基因及其功能分析
A.4类差异的韦恩图[OsAOS2-KO接菌后上调(A24 h/A0 h up)和下调(A24 h/A0 h down)的基因数(个),NPB接菌后上调(N24 h/N0 h up) 和下调(N24 h/N0 h down)的基因数(个)];B.63个表达模式相反的差异基因的聚类图;C.63个表达模式相反的差异基因的GO富集图;D.63个表达模式相反的差异基因的KEGG富集图。
Fig. 9 Genes with opposite expression pattern in OsAOS2-KO and NPB and their function analysis
A.Venn plot of 4 categories of differences [count of up-regulated genes (A24 h/A0 h up) and down-regulated genes (A24 h/A0 h down) in OsAOS2-KO, count of up-regulated genes (N24 h/N0 h up) and down-regulated genes (N24 h/N0 h down) in NPB]; B.Clustering of 63 differential genes with opposite expression patterns; C.GO enrichment map of 63 differential genes with opposing expression patterns; D.KEGG enrichment map of 63 differential genes with opposite expression patterns.
表 1 本研究所用引物
Table 1 Primers used in this study
引物名称Primer name 引物序列Primer sequence 用途Purpose OsAOS2-F ATGGAGCTAGGCGTGCCACT 目的基因克隆 OsAOS2-R TTAAGCAGTACGATTGACGGCG Target gene cloning OsAOS2-U3-F GGCACGTCCCGCCTGGCCCATTCA CRISPR/Cas9第1靶点验证 OsAOS2-U3-R AAACTGAATGGGCCAGGCGGGACG CRISPR/Cas9 1st target validation OsAOS2-U6a-F GCCGTGGAGAAGATGGAGCTGACC CRISPR/Cas9第2靶点验证 OsAOS2-U6a-R AAACGGTCAGCTCCATCTTCTCCA CRISPR/Cas9 2nd target validation UbiP-seq TTTTAGCCCTGCCTTCATACGC 过表达载体测序 NosR-seq AGACCGGCAACAGGATTCAATC Sequencing of overexpression vector U-F CTCCGTTTTACCTGTGGAATCG 敲除靶点第1轮扩增 gRNA-R CGGAGGAAAATTCCATCCAC Knockout target round 1 amplification Uctcg-B1′ TTCAGAGGTCTCTCTCGCACTGGAATCGGCAGCAAAGG CRISPR/Cas9第1靶点扩增 gRctga-B2 AGCGTGGGTCTCGTCAGGGTCCATCCACTCCAAGCTC CRISPR/Cas9 1st target amplification Uctga-B2′ TTCAGAGGTCTCTCTGACACTGGAATCGGCAGCAAAGG CRISPR/Cas9第2靶点扩增 gRcggt-BL AGCGTGGGTCTCGACCGGGTCCATCCACTCCAAGCTC CRISPR/Cas9 2nd target amplification OsPAL1-QF AGGAGCTCGGCTGCGTATT OsPAL1定量PCR OsPAL1-QR ATGCCGAGGAACACCTTGTT qRT-PCR of OsPAL1 OsLOX5-QF CTGATGAGGAGTTTGCACGA OsLOX5定量PCR OsLOX5-QR TCGTCCTTCAGGAGCAGAAT qRT-PCR of OsLOX5 OsPR1a-QF CGTCTTCATCACCTGCAACTACTC OsPR1a定量PCR OsPR1a-QR CATGCATAAACACGTAGCATAGCA qRT-PCR of OsPR1a OsPBZ1-QF CCCTGCCGAATACGCCTAA OsPBZ1定量PCR OsPBZ1-QR CTCAAACGCCACGAGAATTTG qRT-PCR of OsPBZ1 -
[1] DEAN R, VAN KAN J A L, PRETORIUS Z A, et al. The top 10 fungal pathogens in molecular plant pathology[J]. Molecular Plant Pathology, 2012, 13(4): 414-430. DOI: 10.1111/j.1364-3703.2011.00783.x. [2] 程新杰, 岳洪亮, 张梦龙, 等. 水稻抗稻瘟病分子机制研究进展[J]. 大麦与谷类科学, 2021, 38(6): 12-16. DOI: 10.14069/j.cnki.32-1769/s.2021.06.003. CHENG X J, YUE H L, ZHANG M L, et al. Research progress in molecular mechanisms of rice blast resistance[J]. Barley and Cereal Sciences, 2021, 38(6): 12-16. DOI: 10.14069/j.cnki.32-1769/s.2021.06.003. [3] RUAN J J, ZHOU Y X, ZHOU M L, et al. Jasmonic acid signaling pathway in plants[J]. International Journal of Molecular Sciences, 2019, 20(10): 2479. DOI: 10.3390/ijms20102479. [4] 周永林, 申小磊, 周立帅, 等. OsLOX10正调控水稻对稻瘟病和白叶枯病的抗性[J]. 中国水稻科学, 2022, 36(4): 348-356. DOI: 10.16819/j.1001-7216.2022.210604. ZHOU Y L, SHEN X L, ZHOU L S, et al. OsLOX10 positively regulates defense responses of rice to rice blast and bacterial blight[J]. Chinese Journal of Rice Science, 2022, 36(4): 348-356. DOI: 10.16819/j.1001-7216.2022.210604. [5] 刘庆霞, 李梦莎, 国静. 茉莉酸生物合成的调控及其信号通路[J]. 植物生理学报, 2012, 48(9): 837-844. DOI: 10.13592/j.cnki.ppj.2012.09.013. LIU Q X, LI M S, GUO J. Regulation of jasmonic acid biosynthesis and jasmonic acid signaling pathway[J]. Plant Physiology Journal, 2012, 48(9): 837-844. DOI: 10.13592/j.cnki.ppj.2012.09.013. [6] 张同芳. 水稻丙二烯氧化合酶基因OsAOS1和OsAOS2在调控虫害诱导茉莉酸合成及抗虫性中的作用[D]. 杭州: 浙江大学, 2013. ZHANG T F. Role of allene oxide synthases, OsAOS1 and OsAOS2, in reguating the production of herbivore-induced jasmonic acid and herbivore resistance in rice[D]. Hangzhou: Zhejiang University. [7] MEI C S, QI M, SHENG G Y, et al. Inducible overexpression of a rice allene oxide synthase gene increases the endogenous jasmonic acid level, PR gene expression, and host resistance to fungal infection[J]. Molecular Plant-Microbe Interactions, 2006, 19(10): 1127-1137. DOI: 10.1094/MPMI-19-1127. [8] 王玉扬. 水稻苯丙氨酸解氨酶的表达特征和生物学功能研究[D]. 金华: 浙江师范大学, 2022. DOI: 10.27464/d.cnki.gzsfu.2022.000601. WANG Y Y. Expression characterisitic and biological functions of phenylalanine ammonialyase family in rice[D]. Jinhua: Zhejiang Normal University, 2022. DOI: 10.27464/d.cnki.gzsfu.2022.000601. [9] DING P T, DING Y L. Stories of salicylic acid: a plant defense hormone[J]. Trends in Plant Science, 2020, 25(6): 549-565. DOI: 10.1016/j.tplants.2020.01.004. [10] HEITZ T, BERGEY D R, RYAN C A. A gene encoding a chloroplast-targeted lipoxygenase in tomato leaves is transiently induced by wounding, systemin, and methyl jasmonate[J]. Plant Physiology, 1997, 114(3): 1085-1093. DOI: 10.1104/pp.114.3.1085. [11] MA X L, ZHANG Q Y, ZHU Q L, et al. A robust CRISPR/Cas9 system for convenient, high-efficiency multiplex genome editing in monocot and dicot plants[J]. Molecular Plant, 2015, 8(8): 1274-1284. DOI: 10.1016/j.molp.2015.04.007. [12] KIM D, LANGMEAD B, SALZBERG S L. HISAT: a fast spliced aligner with low memory requirements[J]. Nature Methods, 2015, 12(4): 357-360. DOI: 10.1038/nmeth.3317. [13] LOVE M I, HUBER W, ANDERS S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2[J]. Genome Biology, 2014, 15(12): 550. DOI: 10.1186/s13059-014-0550-8. [14] YU G C, WANG L G, HAN Y Y, et al. clusterProfiler: an R package for comparing biological themes among gene clusters[J]. Omics, 2012, 16(5): 284-287. DOI: 10.1089/omi.2011.0118. [15] 曹晏彬, 柏素花, 戴洪义. 苹果丙二烯氧化物合酶MdAOS的克隆和表达分析[J]. 基因组学与应用生物学, 2014, 33(2): 273-281. DOI: 10.13417/j.gab.033.000273. CAO Y B, BAI S H, DAI H Y. Cloning and expression analysis of an allene oxide synthase gene MdAOS from Malus domestica[J]. Genomics and Applied Biology, 2014, 33(2): 273-281. DOI: 10.13417/j.gab.033.000273. [16] 刘春浩, 梁楠松, 于磊, 等. 水曲柳丙二烯氧化物合成酶基因FmAOS序列与表达模式分析[J]. 植物生理学报, 2018, 54(5): 855-862. DOI: 10.13592/j.cnki.ppj.2017.0390. LIU C H, LIANG N S, YU L, et al. Sequence and expression analyses of allene oxide synthase gene FmAOS in Fraxinus mandschurica[J]. Plant Physiology Journal, 2018, 54(5): 855-862. DOI: 10.13592/j.cnki.ppj.2017.0390. [17] 陈丽兰, 王亚如, 郭燕芳, 等. 甘蔗丙二烯氧化物合成酶ScAOS的克隆与表达分析[J]. 分子植物育种, 2021, 19(11): 3549-3558. DOI: 10.13271/j.mpb.019.003549. CHEN L L, WANG Y R, GUO Y F, et al. Cloning and expression analysis of an allene oxide synthase gene ScAOS from sugarcane (Saccharum spp. hybrids)[J]. Molecular Plant Breeding, 2021, 19(11): 3549-3558. DOI: 10.13271/j.mpb.019.003549. [18] 解军辉, 寇艳君, 沈祥陵, 等. 水稻茉莉酸合成基因OsAOS1在稻瘟病抗性中的功能分析[J]. 分子植物育种, 2022, 20(20): 6631-6637. DOI: 10.13271/j.mpb.020.006631. XIE J H, KOU Y J, SHEN X L, et al. Functional analysis of rice jasmonic acid synthesis gene OsAOS1 in rice blast resistance[J]. Molecular Plant Breeding, 2022, 20(20): 6631-6637. DOI: 10.13271/j.mpb.020.006631. [19] UJI Y, TANIGUCHI S, TAMAOKI D, et al. Overexpression of OsMYC2 results in the up-regulation of early JA-responsive genes and bacterial blight resistance in rice[J]. Plant & Cell Physiology, 2016, 57(9): 1814-1827. DOI: 10.1093/pcp/pcw101. [20] YAMADA S, KANO A, TAMAOKI D, et al. Involvement of OsJAZ8 in jasmonate-induced resistance to bacterial blight in rice[J]. Plant & Cell Physiology, 2012, 53(12): 2060-2072. DOI: 10.1093/pcp/pcs145. [21] YUAN M H, JIANG Z Y, BI G Z, et al. Pattern-recognition receptors are required for NLR-mediated plant immunity[J]. Nature, 2021, 592(7852): 105-109. DOI: 10.1038/s41586-021-03316-6. [22] WANG Y, PRUITT R N, NVRNBERGER T, et al. Evasion of plant immunity by microbial pathogens[J]. Nature Reviews (Microbiology), 2022, 20(8): 449-464. DOI: 10.1038/s41579-022-00710-3. [23] AZIZI P, RAFⅡ M Y, ABDULLAH S N A, et al. Toward understanding of rice innate immunity against Magnaporthe oryzae[J]. Critical Reviews in Biotechnology, 2016, 36(1): 165-174. DOI: 10.3109/07388551.2014.946883. [24] ZIPFEL C. Plant pattern-recognition receptors[J]. Trends in Immunology, 2014, 35(7): 345-351. DOI: 10.1016/j.it.2014.05.004. [25] YU X, FENG B M, HE P, et al. From chaos to harmony: responses and signaling upon microbial pattern recognition[J]. Annual Review of Phytopathology, 2017, 55: 109-137. DOI: 10.1146/annurev-phyto-080516-035649.

 下载:
下载: