2 中国地质大学(武汉)生物地质与环境地质国家重点实验室, 湖北 武汉 430078;
3 上饶师范学院生命科学学院, 江西 上饶 334001;
4 南开大学生命科学学院, 天津 300071)
深地生物圈是指陆地以及海底表面以下、不以光合作用为能量来源的黑暗生物圈,主要由微生物构成[1],据最新估计全球深地微生物数量大约为7×1029~11×1029个细胞[2]。地下深部无光照、寡营养、高温高压等特殊的环境特点,塑造了不同于地表环境的深地微生物群落,近年来通过测序和纯培养的方法发现了许多新的深地微生物类群,这些微生物有其独特的生存方式和代谢机制[3~5]。深地微生物研究对于阐释地下元素循环规律,探索微生物的物质能量获取方式以及安全开发地下空间都具有重要的理论和现实意义[3~4]。
目前研究者已经在深地微生物的生物量、群落组成与地质条件之间的相关性及代谢方式方面取得了一系列进展[1]。近些年的研究表明陆地深地微生物多样性较低,其类群主要由变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)主导[6~8],在一些研究中变形菌门的微生物占据了微生物群落的绝大部分,特别是变形菌门的α-变形菌纲(Alphaproteobacteria)、β-变形菌纲(Betaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)比较常见,厚壁菌门中硫酸盐还原菌和产芽孢的一些属比较常见[6, 9~10]。由于地质条件的差异,不同深地环境中细菌群落组成差异较大,因此开展不同深地环境细菌群落组成特征的研究仍是全面了解深地生物圈的重要途径。此外,由于深地寡营养且无光照等环境特点,深地微生物圈的物质与能量来源也是人们重点关注的科学问题[1, 4]。总体而言,随深度的增加,深地微生物代谢方式由化能异养向化能自养转变[1, 4]。近来的研究结果表明自养产甲烷菌、产乙酸菌和硫酸盐还原菌等广泛参与H2氧化及CO2固定过程,甲烷厌氧氧化古菌和硫酸盐还原菌则可以利用CH4作为能量来源[4, 11]。Momper等[5]利用宏基因组技术发现美国Sanford地下实验室流体样本中细菌能够利用H2作为能量来源耦合CO2固定。深地寡营养条件下微生物参与的化能自养代谢方式被广泛报道,也有研究发现了深地的化能异养微生物类群[12~13]。例如Purkamo等[12]发现芬兰Outokumpu深地基岩中化能异养细菌是主导类群,这些细菌主要利用地层中埋藏的有机质为碳源。以上研究表明,不同研究位点由于可以利用碳源的变化,会导致细菌群落结构和生态功能产生极大的差异。因此在不同采样点或不同的采样深度开展细菌群落组成以及其代谢功能研究,将有助于人们更深入地认识深地微生物独特的群落组成和生态功能。
越来越多的研究表明通过共发生网络分析可以反映微生物之间的互作方式,进而揭示复杂微生物群落的组成与功能特征[14~15];微生物关键类群的改变会影响整个群落的结构和生态功能,因而可以通过关键类群来解析微生物群落的组成及其生态功能的变化[16~17]。此外,探究微生物群落组装过程能有效解释微生物群落组成机制,微生物的群落构建过程主要包括确定性过程(异质性选择和同质性选择)与随机过程(扩散限制和同质性扩散过程)[18~19]。基于生态位理论的假设认为确定性因子包括种间关系(竞争、互惠和寄生等)以及环境条件(pH、温度和盐度等)影响微生物群落组成,而基于中性理论的假设认为微生物群落由出生,死亡和定殖等随机过程控制[18~20]。确定性组装过程是常见的细菌群落组装方式,例如固氮和甲烷氧化细菌群落组装过程主要受确定性过程(异质性选择)控制,pH和总有机碳(TOC)是重要的环境调控因子[21~22]。然而,目前深地微生物研究主要聚焦于群落组成及功能,而对于微生物群落组装机制的研究还十分有限。
与海洋深地生物圈相比,陆地深地生物圈研究相对薄弱,这样的现状主要受制于陆地深地钻探的昂贵成本[1]。然而,深地实验室的建设为深地生物圈的研究提供了便利条件,因此本文以世界上埋深最大(2525m)的四川锦屏暗物质实验室所在的地下隧道为研究区,对黑暗无光、低辐射、高湿度、相对低温且寡营养的深地极端环境细菌群落进行探究。采集锦屏隧道内松散的表层岩壁和沉积物样品后对细菌16S rRNA扩增子进行测序,结合后续的生物信息学分析,旨在阐明锦屏深地生物圈细菌群落的组成、潜在功能、相互作用和组装机制。本文研究结果与不同深地环境下的细菌群落对比分析有助于厘清深地环境独特的细菌类群,研究结果将极大地提升人们对深地细菌群落组成、生态功能及其组装机理的了解,同时也为保障地下实验室工作人员的安全与健康,更好地设计建设地下实验室提供重要的参考。
1 材料与方法 1.1 样品的采集锦屏水电站隧道位于四川省凉山彝族自治州木里、盐源、冕宁三县交界处(28°20′50″N,101°56′0″E;图 1a),为了利用锦屏大河湾的天然落差发电,锦屏水电站截弯取直开挖了引水隧道(图 1b)。隧道全长17km,最大埋深可以达到2525m,上覆岩层主要是三叠纪的大理岩和灰岩[23]。样品采集于2017年6月底,采样时隧道内温度为10.7℃。分别采集隧道内两侧岩壁及隧道地面松散沉积物样品(图 1c),用已灭菌的采样铲刮取岩壁表层,在无菌的锡箔纸上混匀后分装至50ml离心管;为避免潜在的人为影响,采集沉积物样本时先去除表层2cm,再用采样铲取新鲜的松散沉积物样本混匀分装,每个采样点设3个生物学重复。3个岩壁样品分别记为YB2、YB3和YB4,3个沉积物样本分别标记为CJ3、CJ4和CJ5,并记录采样点照片和样品基本性状(图 1d~1i和表 1)。所有样品放置在装有干冰的保温箱内带回实验室,保存于-80℃冰箱用于后续处理与分析。将储存于冰箱中的岩壁与沉积物样品用冷冻干燥机(Alpha 1-4LD plus,Marin Christ,Germany)冷冻干燥,充分研磨后过200目筛,取5g过筛样品用于X射线衍射(XRD)分析(D8-Focus,Bruker AXS,Germany)。

|
图 1 四川锦屏隧道采样地点及样品点分布示意图 研究区域(a)及锦屏隧道地理位置(b);隧道内采样点分布图(c),岩壁采样点野外照片(d~f),沉积物采样点野外照片(g~i) YB: 岩壁,CJ: 沉积物;YB/CJ后面的数字表示采样点位置 Fig. 1 Schematic diagram of sampling sites in Jinping Tunnel, Sichuan Province. Study area (a) and geographical location of Jingping Tunnel (b), distribution of sampling sites in the tunnel (c), images of YB (wall of the tunnel)samples in the field (d~f), images of CJ (sediments in the tunnel) samples in the field (g~i). YB: rock wall; CJ: sediments. The numbers after YB and CJ indicate the sampling site |
| 表 1 四川锦屏水电站辅助隧道内不同位点样品性质 Table 1 Sample properties in service tunnels of Jinping Hydropower Station, Sichuan Province |
将已冷冻干燥的样品置于已灭菌研钵中与液氮混合研磨,研磨充分后过200目筛,取1g过筛样品用试剂盒(FastDNA® SPIN Kit for Soil MP Biomedicals,USA)提取样品总DNA,提取后的DNA利用微量核酸蛋白检测仪(ND2000,Thermo Scientific,USA)及琼脂糖凝胶电泳检测质量。采用引物520F(5′-AYTGGGYDTAAAGNG-3′)和802R(5′-TACNVGGGTATCTAATCC-3′)对细菌16S rRNA的V4区进行扩增,利用Illumina MiSeq PE300测序平台(上海派森诺生物有限公司)进行PCR产物测序,每个采样点有3个生物学测序重复,比如,岩壁样品YB2的3个测序重复分别记为YB2-1、YB2-2和YB2-3,其余样品标记方式以此类推。
1.3 数据分析方法测序得到原始序列用QIIME软件(Quantitative Insights Into Microbial Ecology,v1.8.0,http://qiime.org/)进行过滤,采用滑动窗口法去除低质量序列及引物,确保窗口中碱基平均质量≥ Q20,且截断后的序列长度≥ 150 bp。调用FLASH软件(v1.2.7)进行序列拼接[24],随后利用USEARCH软件(v5.2.236)去除嵌合体[25],剔除引物错配碱基数大于1及含连续相同碱基数大于8的序列。利用UCLUST的方法以97 % 为阈值将所得优质序列聚类成可操作分类单元(operational taxonomic unit,简称OTU)[26~27],基于Silva数据库(Release 115,http://www.arb-silva.de)对优质序列进行注释[28]。数据分析前先将所有样本的序列做抽平处理,然后利用mothur软件(v1.35.1)计算微生物多样性指数(Chao1指数和香农威纳指数)。利用FAPROTAX(v1.1,http://www.loucalab.com/archive/FAPROTAX/)对细菌群落的代谢功能做了预测分析。
箱线图、气泡图、散点图、堆叠柱状图、热图和Bray-curtis距离进行UPGMA聚类利用R软件(v3.6.1,https://www.r-project.org/)绘制,单因素方差分析利用SPSS(v26.0)软件完成。为了探究微生物群落组装方式,利用R软件中的picante包计算平均最近物种距离(mean nearest taxon distance,简称MNTD)、β-平均最近物种距离(β-mean nearest taxon distance,简称βMNTD)和β-最近物种指数(β-nearest taxon index,简称βNTI)等参数来评估样品间系统发育。βMNTD用以表征系统发育的变化,而βNTI是基于βMNTD观测值和由零模型获得的随机值计算得到的标准差[29]。βNTI值大于2或者小于-2,表示群落组装过程为确定性过程(分别表示异质性选择过程和同质性选择过程)[18]。相反,当|βNTI|值小于2,群落组装则以随机性过程为主[18]。为进一步确定随机性过程的分类,利用vegan包计算了基于群落的Bray-Curtis矩阵的Raup-Crick矩阵(Raup-Crick matrix,简称RCbray)。RCbray值大于0.95、| RCbray |值小于0.95和RCbray值小于-0.95分别代表扩散限制、不明确过程和同质性扩散[18, 29]。微生物OTU共发生网络分析,选取所有样本相对丰度加和大于0.05 % 的OTU,通过R包psych计算OTU间的Spearman相关性,只保留相关性系数r>0.75且显著性系数P < 0.01的数据来揭示锦屏隧道中微生物OTU间相互作用[30]。最后用Gephi软件(v0.9.2)实现共发生网络的可视化,并计算网络拓扑参数,将中介中心性(Betweeness centrality)得分最高的3个OTU确定为关键种[30~31]。
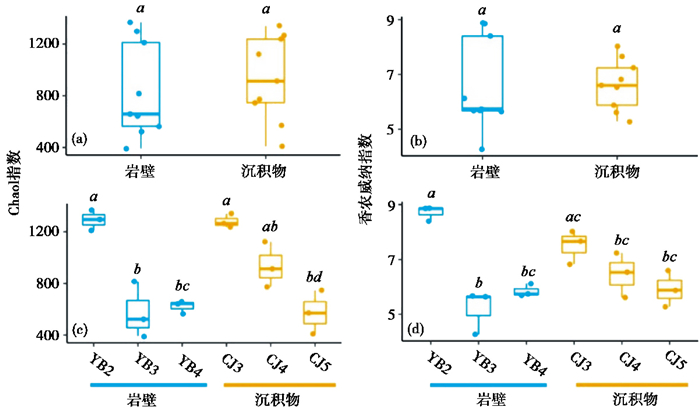
2 结果 2.1 隧道内细菌群落多样性不同样品通过16S rRNA扩增子测序获得的原始序列数为28472~35406(表 2),这些原始序列经过抽平处理后,再以97 % 为阈值在不同样本中划分为1193~2254个OTU(表 2)。α多样性结果显示岩壁和沉积物细菌群落的整体差异不显著(图 2a和2b),YB2样本细菌多样性最高,Chao 1指数及香农威纳指数分别为1292.54 ± 64.39和8.71 ± 0.22,且YB2样本的多样性指数与其他岩壁样本间存在显著性差异(图 2c和2d),而岩壁样本YB3和YB4多样性指数差异不大(Chao1指数: 575.85 ± 177.19 vs 621.87 ± 41.37,香农威纳指数: 5.19 ± 0.66 vs 5.85 ± 0.19)。沉积物样本间无显著性差异,多样性指数大小排序为CJ3>CJ4>CJ5(图 2c和2d)。
| 表 2 四川锦屏隧道不同样品细菌群落的序列数和OTU数 Table 2 Sequence number and OTU number of microbial communities in different samples at Jinping Tunnel, Sichuan Province |
|
图 2 四川锦屏隧道岩壁及沉积物细菌群落的α多样性 岩壁和沉积物整体Chao1指数(a)及香农威纳指数(b);岩壁和沉积物不同采样点的Chao1指数(c)及香农威纳指数(d);字母a~d用来标记不同样本间是否具有显著性差异(P < 0.05) Fig. 2 Alpha diversity of bacterial communities of rock wall and sediment samples of Jinping Tunnel, Sichuan Province. Boxplots of Chao 1 index (a) and Shannon-Wiener index (b) of whole rock wall and sediment samples. Chao 1 index (c) and Shannon Weiner index (d) of rock wall and sediment samples. Different letters(a~d)above the boxplot showed significantly difference(P < 0.05)among different sampling sites |
细菌群落组成分析结果表明,锦屏隧道细菌群落由变形菌门(Proteobacteria)主导,其它相对丰度较高的门类有放线菌门(Actinobacteria)和浮霉菌门(Planctomycetes)等(图 3a)。YB2样本与其它样本在细菌组成上具有较大差异,且在基于Bray-curtis距离的聚类分析中单独聚为一个分支(图 3a)。YB2样品中Proteobacteria是相对丰度最高的门类,平均相对丰度为34.8 %。其中Alphaproteobacteria纲的相对丰度最高(19.3 %),其次是Gammaproteobacteria纲,其相对丰度为9.7 % (图 3a)。Actinobacteria、Planctomycetes和Saccharibacteria的相对丰度分别为18.2 %、17.3 % 和10.4 % (图 3a)。其它岩壁样本(YB3、YB4)Proteobacteria的相对丰度远高于YB2,平均相对丰度为88.6 %,且由Gammaproteobacteria绝对主导,其平均相对丰度为74.5 % (图 3a)。沉积物样品聚类分析显示,不同采样点的沉积物细菌群落组成相似。其主导门类同样是Proteobacteria,在大部分样本中的相对丰度大于70 % (图 3a)。沉积物样本在纲水平上以Gammaproteobacteria为主导(平均相对丰度为61.4 %),其次为Alphaproteobacteria和Betaproteobacteria,平均相对丰度分别为9.4 % 和8.4 % (图 3a)。高丰度属的热图表明(图 3b),岩壁样本YB2和其他样本在属水平的组成上差异较大。YB2中Pir4_lineage、Planctomyces及慢生根瘤菌属(Bradyrhizobium)等属相对丰度较高,其相对丰度分别为4.2 %、3.4 % 和1.6 %。此外,嗜氢菌属(Hydrogenophaga)是深地环境常见属[32~33],在YB2中的相对丰度较高(0.80 %),而在其他样本中相对丰度小于0.17 %。其他样本中相对丰度较高的属有假单胞菌属(Pseudomonas)、嗜盐单胞菌属(Halomonas)及Ralstonia等,特别是Pseudomonas相对丰度达到了22.9 % ~44.4 % (图 3b)。

|
图 3 四川锦屏隧道岩壁和沉积物的细菌群落组成 相对丰度前十的细菌门类/纲及其基于Bray-curtis距离的UPGMA聚类分析(a);相对丰度前三十的细菌属(不包括未培养和未鉴定属)(b) CJ和YB后面第一个数字表示采样点位,第二个数字表示该点位样品生物学重复的序号 Fig. 3 Compositions of bacterial communities in the weathered rocks and sediments of Jinping Tunnel. Top 10phylum/class in relative abundance and their cluster analysis based on Bray-curtis distance and UPGMA method (a) and the top 30 bacterial genera(uncultured and unidentified genera are excluded) (b)in Jinping tunnel, Sichuan Province. The first numbers after YB and CJ indicate the sampling site and the second ones mean the biological duplicates of the sample at the same site |
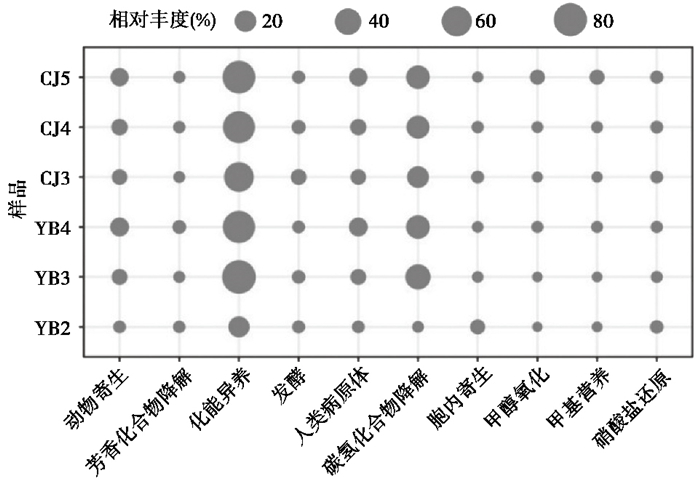
基于FAPROTAX的功能注释结果表明,锦屏隧道微生物群落代谢类型多样,但主要以有机化能异养的代谢方式获取能量,无机自养代谢的微生物相对丰度较低(图 4)。锦屏隧道微生物群落中利用有机质进行化能异养的序列占比63.3 % (1120个OTU,343818条序列),而这些化能异养微生物中绝大多数为好氧化能异养微生物(占总序列数的60.4 %),主要是Pseudomonas和Halomonas等属。可以进行各种烃类代谢的功能占比22.4 % (82个OTU,121811条序列),参与发酵的功能占比2.0 % (250个OTU,10967条序列)。此外,锦屏隧道内的微生物类群可以降解难利用的有机质,共占比2.8 % (132个OTU,15295条序列),主要与甲醇氧化、甲基营养和芳香化合物降解相关。深地生物圈寡营养环境代谢类型在锦屏隧道相对丰度较低,例如H2氧化是深地微生物常见的能量获取方式,但是锦屏隧道H2氧化微生物序列占比仅为0.2 %,主要是Hydrogenophaga和副球菌属(Paracoccus)两个属。甲烷氧化微生物类群序列占比更低(0.04 %),主要属于甲基孢囊菌科(Methylocystaceae)。厌氧寡营养条件下微生物能够利用低价态无机物作为电子供体,以高价态化合物作为电子受体进行呼吸作用。锦屏隧道氧化低价态硫化物或低价态锰的微生物序列占比为1.2 %,利用硝酸盐等含氮氧化物作为电子受体进行呼吸作用序列占比1.7 %,而以硫或高价态硫化物作为电子受体进行呼吸作用占比为0.4 %。此外,固氮也是深地寡营养环境常见的代谢方式[34],在锦屏中相关序列占比为0.6 %,大部分属于Bradyrhizobium。值得注意的是动物寄生相关序列占比达6.4 %,人类病原体相关序列占比达6.3 %,但大多是Ralstonia和嗜糖假单胞菌属(Pelomonas)等机会致病菌。
|
图 4 四川锦屏隧道岩壁与沉积物细菌群落FAPROTAX功能预测相对丰度排名前十的功能类群 Fig. 4 The top 10 functional groups based on FAPROTAX functional prediction in weathered rocks and sediments of Jinping Tunnel, Sichuan Province |
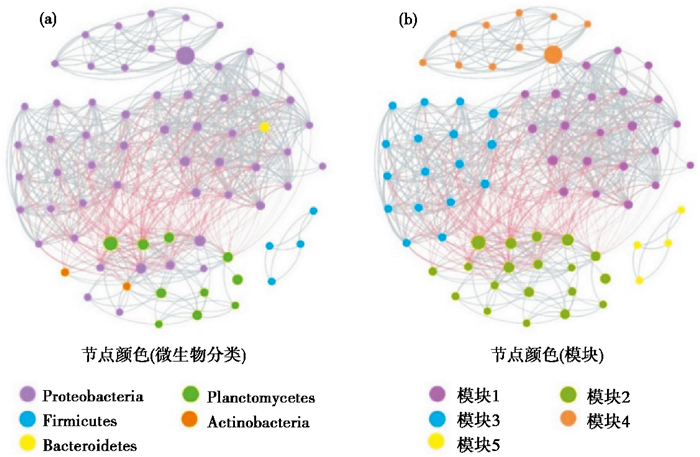
细菌群落的网络分析能够反映细菌之间的相互作用关系,锦屏隧道所有岩壁和沉积物样本的共发生网络分析表明,该网络由72个OTU节点和753条边构成(图 5),网络中边的正负分别反映边所连接的节点之间存在的共生或竞争关系。本文中的网络正相关的边占比72.6 %,负相关的边占比27.4 %。网络的拓扑特征参数可以进一步表征微生物OTU间复杂作用关系,其中网络模块化指数(MD)为0.88(该指数大于0.4,指示网络具有良好的模块性),平均聚类系数(avgCC)为0.82,这些参数高于随机网络说明该网络为非随机网络,而是由OTU节点紧密连接形成一种“小世界”网络结构[17, 30]。共发生网络中的节点隶属于5个细菌门类,变形菌门(Proteobacteria)和浮霉菌门(Planctomycetes)两个门的OTU占这些节点的90 % 以上(图 5a)。其中Proteobacteria的OTU占比最高(共有55个节点,占比76.4 %),其次是Planctomycetes(共有10个节点,占比13.9 %),剩余的依次是厚壁菌门(Firmicutes)(4个节点,占比5.6 %),放线菌门(Actinobacteria)(2个节点,占比2.8 %),拟杆菌门(Bacteroidetes)(1个节点,占1.4 %)。该网络总共划分为5个模块(图 5b),其中模块1、模块3及模块4中的节点主要属于Proteobacteria,模块2中的节点属于Proteobacteria、Planctomycetes及Actinobacteria,模块5则全部属于Firmicutes。根据中介中心性得分(Betweeness centrality)确定了3个潜在的关键类群(Keystone species): Ralstonia、Planctomyces和Woodsholea。
|
图 5 四川锦屏隧道岩壁与沉积物微生物OTU共发生网络 网络中的节点颜色分别表示门水平微生物分类(a)和不同模块(b),节点大小与中介中心性的大小成比例,边的粗细与节点间相关性大小成比例,其中灰色边代表正相关关系,红色边代表负相关 Fig. 5 Co-occurrence network based on OTUs in Jinping Tunnel, Sichuan Province. Nodes were colored based on the bacterial taxa at the phylum level (a) and modules (b), respectively. Node size is proportional to the betweeness centrality, and the thickness of edge is proportional to the correlation between nodes. Positive correlations were in gray, whereas negative ones were in red |
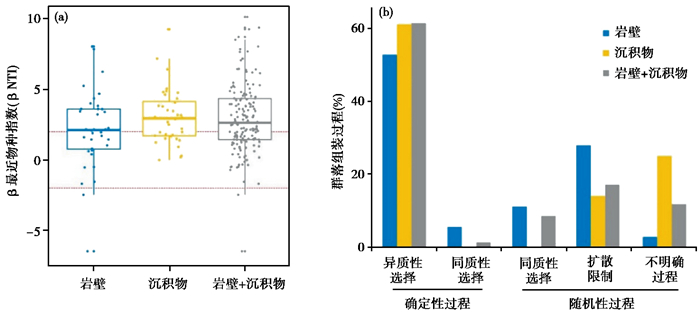
细菌群落组装分析表明,岩壁样本(YB2、YB3、YB4)、沉积物样本(CJ3、CJ4、CJ5)及岩壁与沉积物所有样本的群落构建过程均以确定性过程主导(βNTI值>2)(图 6a),其中异质性选择是主要的确定性过程(占比大于50 %),在岩壁、沉积物以及所有样本的微生物群落构建中所占比例分别为52.8 %、61.1 % 和61.4 %。随机性过程在微生物群落构建中的贡献较少,其中不明确过程在沉积物微生物群落构建中的贡献率为25.0 %,而对岩壁微生物群落构建贡献率仅有2.8 %,对所有样本中微生物群落构建的贡献为11.8 %。与沉积物和所有样本中的细菌群落构建相比,扩散限制及同质性扩散在岩壁细菌群落构建中的贡献较大,分别为17.0 % 和8.5 % (图 6b)。
|
图 6 四川锦屏隧道岩壁、沉积物和所有样品细菌群落构建的βNTI指数(a)和不同生态过程对细菌群落构建的贡献(b) Fig. 6 βNTI of bacterial communities in rock wall, sediments and total samples (a) and the contribution of different ecological processes to bacterial assembly (b) in Jinping Tunnel, Sichuan Province |
与其他陆地深地生物圈相比,锦屏隧道细菌群落α多样性指数(香农威纳指数5.19~8.71,见图 2b和2d)高于大部分深地生物圈。全球范围内大部分深地微生物群落多样性都极低,例如日本的Mizunami深地实验室、芬兰Outokumpu深钻以及Olkiluoto深地隧道(表 3)细菌群落香农威纳指数仅为1.62~3.75[8, 32, 35],只有个别研究位点的细菌群落的香农维纳指数与锦屏隧道细菌群落相近,如Lopez-Fernandez等[36]的研究表明位于瑞典的Äspö深地实验室钻孔涌出的地下水样本细菌群落香农威纳指数为6~8,深地生物圈普遍较低的细菌群落多样性可能是深地环境寡营养、厌氧或高温高压等极端环境的特点决定的。酸性矿坑低pH、热泉高温以及深地环境极度寡营养等极端环境下细菌的α多样性指数较低[35, 37~39],有机质或硫酸盐浓度等任何环境因子的波动都可能改变细菌群落多样性和结构[8]。锦屏隧道上方的裂隙水可以提供有机质,隧道的开挖也使得隧道内的温度和氧浓度等环境条件更加适宜细菌群落的定殖与增殖,因而使得锦屏隧道内细菌α多样性指数高于其他深地环境。
| 表 3 深地生物圈细菌群落相关研究基本信息 Table 3 Basic information of the studying sites for bacterial communities in deep biosphere |
Proteobacteria是深地生物圈是最常见的细菌门类[13, 33, 39],也是锦屏隧道中细菌群落的主导门类,深地生物圈不同研究位点的细菌群落在Proteobacteria的门水平和纲水平相对丰度都存在较大的差异。锦屏隧道中岩壁样本YB2中Proteobacteria相对丰度(34.8 %)较其他样本低,主要由Alphaproteobacteria组成(19.3 %)。而其它样本中Proteobacteria相对丰度(74.7 % ~91.0 %)远高于YB2,且主要由Gammaproteobacteria(49.7 % ~79.7 %)组成。瑞典Äspö 深地实验室地下水细菌群落多样性指数与锦屏隧道细菌群落接近,且同样由Proteobacteria主导,但是Proteobacteria相对丰度及纲水平组成上有较大差异,其Proteobacteria相对丰度平均为48.4 %,主要由δ-变形菌纲(Deltaproteobacteria)组成[36];而美国Sanford地下实验室等研究地点的细菌群落Proteobacteria相对丰度为15 % ~54 % (平均32 %)[40],与岩壁YB2十分接近。这些研究位点中Proteobacteria主导地位通常与其独特的环境条件有关,例如Sanford地下实验室含硫含氮化合物及有机质等丰富的代谢底物供养了能够自养或异养代谢的Proteobacteria类群,Betaproteobacteria的铁氧化细菌和Gammaproteobacteria甲烷氧化细菌都是Proteobacteria重要的组成部分,直接与空气接触的样本中则包含更多的好氧或兼性厌氧的异养代谢类群[40];而北美大陆伊利诺斯盆地钻井研究表明,Proteobacteria的相对丰度超过90 %,在该研究中Proteobacteria几乎全部由γ-变形菌纲的Halomonas sulfidaeris组成(占Proteobacteria相对丰度大于90 %),地层中含铁矿物及硝酸盐能够为这种细菌提供丰富的电子受体[9]。Proteobacteria倾向于出现在低温微氧环境中[9~10, 31~32],锦屏隧道中沉积物样品及部分岩壁样品(YB3和YB4)出现高丰度的Proteobacteria可能与上述原因有关,但是确切的证据需要结合理化因子做进一步的研究。厚壁菌门(Firmicutes)也是深地生物圈细菌群落重要组成部分,它在高温厌氧的环境中出现频率较高[9~10, 31~32],其平均相对丰度可以达到35 % [33],但是Firmicutes在锦屏隧道中相对丰度很低,其相对丰度小于2.7 %。锦屏隧道中相对丰度较高的还有Actinobacteria和Planctomycetes,特别是在岩壁YB2中这两个门类相对丰度分别为18.2 % 和17.3 %,在其它样本中平均相对丰度分别为2.9 % 和1.3 %。这两个门类在瑞典Äspö 深地实验室和美国Sanford地下实验室等深地环境鲜有报道,但是在喀斯特洞穴环境Actinobacteria是常见门类[34, 39]。Actinobacteria和Planctomycetes都可以降解来源于动植物残体的难降解大分子有机质,此外Planctomycetes部分类群的兼性营养方式及生长缓慢的特性都有助于其适应寡营养的环境[4, 34]。因此出现相对丰度较高的Actinobacteria和Planctomycetes,可能是锦屏隧道与喀斯特洞穴有相似的基岩特性、矿物组成以及寡营养环境所致[4, 34]。以上结果表明由于采样深度不同及岩石类型的差异等原因,深地生物圈不同研究位点的细菌群落存在很大差异。随着深度的增加,地层裂隙的减少导致地表输入到深地环境的有机质变少,硝酸盐及硫酸盐等浓度都会随地层深度变化发生很大改变,岩石类型的变化也会导致水岩相互作用的产物发生变化[1, 8]。因此,地层深度改变引起的代谢底物变化可能是不同研究位点细菌群落差异较大的主要原因。
虽然不同研究位点的群落结构差异较大,锦屏隧道中依然检测到了Hydrogenophaga和Pseudomonas等深地生物圈常见的微生物类群[8, 32~33],但是其他深地环境常见类群硫酸盐还原菌、甲烷氧化菌及产甲烷菌在锦屏隧道中相对丰度极低。H2氧化细菌Hydrogenophaga在岩壁YB2中的相对丰度较高(0.80 %),而在其它样本中相对丰度小于0.17 % (图 3b)。Pseudomonas是锦屏隧道中相对丰度最高的属,在岩壁YB2中占比较低,而在其他样本中则高达22.9 % ~44.4 % (图 3b)。Pseudomonas功能多样,可以通过芳香烃化合物或甲醇化能异养,也可以通过硫代硫酸盐或CO的氧化获取能量[41]。锦屏隧道中的大部分Pseudomonas未能鉴定到种,但锦屏隧道中多个不同的OTU表明其潜在代谢方式的多样性。梭菌纲(Clostridia)具有硫酸盐还原功能的微生物类群也是深地生物圈常见类群[12, 33],但是锦屏隧道中Clostridia硫酸盐还原功能的微生物类群相对丰度很低,只在个别样本中出现。此外,通过对相对丰度前50的OTU分析发现,占群落整体31.3 % 的序列只鉴定到Saccharibacteria和Parcubacteria门水平,还有18.5 % 的序列只鉴定到Planctomycetes、Actinobacteria和酸杆菌门(Acidobacteria)等门类的纲水平,这些微生物的功能是未知的,这表明锦屏深地生物圈微生物组成及其生物地球化学循环仍有待进一步研究。
3.1.2 化能异养类群占主导深地生物圈大多为寡营养环境,因此深地微生物的能量来源一直是深地研究的关键科学问题[1, 5]。H2被认为是深地微生物重要的能量来源,不同深地生物圈广泛报道了活跃代谢H2的深地微生物类群[42~44]。但是芬兰Outokumpu断裂破碎带的地下细菌群落由化能异养类群占主导,这些细菌可以利用地层中埋藏的有机质作为碳源并获取能量[12],与之类似,锦屏隧道中细菌群落也以化能异养代谢主导。深地环境的有机质可能来源于地层埋藏、地下水输入或微生物参与的甲烷、二氧化碳等同化作用[1, 13, 36]。有研究表明黑色片岩或蛇纹石化过程是常见的深地小分子有机质来源[45~46],而锦屏隧道地层主要为三叠纪大理岩,功能注释也发现甲烷氧化及碳固定微生物类群相对丰度极低。然而锦屏隧道岩溶裂隙发育,地下水丰富且易受降雨影响[23],因此锦屏隧道有机质可能主要由地下水将地表的有机质通过裂隙输入,这些微生物类群的有机质来源很大程度受水文条件的影响。同时锦屏隧道微生物可以利用甲醇、甲基化合物及芳香化合物作为碳源,表明这些微生物可能作为潜在的有机污染物降解者,被用来修复有机质污染环境。值得注意的是,锦屏隧道微生物功能注释发现了相对丰度较高的人类机会致病菌,其相对丰度高达6.3 %,而在一些具有代表性的深地基岩和地表土壤环境中其相对丰度均小于1 % [47~50],这些机会致病菌可能导致人体组织感染或呼吸系统疾病。这提醒人们在开发地下空间的同时,要充分考虑生物安全的因素,以减少人类暴露在机会致病菌下的风险[51],但是这些机会致病菌在多大程度或什么条件下会威胁到人类健康还需进一步研究。
3.2 锦屏隧道细菌的相互作用及群落构建机制共发生网络可以探究微生物间复杂的相互作用,锦屏隧道微生物网络拓扑结构表明节点间的连接是非随机的。网络拓扑参数表征微生物间相互作用方式,中介中心性(Betweeness centrality)用来表征某个OTU节点对整个网络连通性的影响,即中介中心性得分越高的OTU节点在维持网络结构稳定及功能上发挥重要作用,是网络中潜在的关键微生物类群[30~31]。因此,基于中介中心性得分确定微生物关键类群为Ralstonia、Planctomyces和Woodsholea,其中Ralstonia可以参与几丁质和芳香烃化合物的降解,也可参与硝酸盐还原、尿素分解等氮循环过程,功能注释发现个别种可以氧化H2获取能量。Planctomyces主要参与化能异养或硝酸盐还原过程,而Woodsholea功能未知。关键类群对整个细菌群落的结构和功能发挥着与其丰度不成比例的重要作用,关键类群作用大小主要取决于可参与其生态功能的微生物类群的多样性[17, 52]。锦屏隧道内细菌关键类群主要参与有机质分解和硝酸盐还原过程,而其他细菌类群也广泛参与该生态过程,因此可以削弱关键类群对细菌群落的整体影响,有利于整个群落结构和功能的稳定[17, 52]。
此外,该网络存在明显的模块化结构,不同的模块可能代表不同的功能单元,各个模块间也存在较强的生态联系。节点间的连接主要是正相关关系(72.6 %),但是模块1、3和模块2之间存在较多的负相关关系,表明模块1、3和模块2之间的微生物类群存在相互竞争关系[30]。FAPROTAX功能注释结果表明,大部分模块中的OTU节点参与几丁质、芳香烃、甲醇及木质素降解等化能异养过程,但是也有少部分OTU节点可参与H2氧化、硫氧化及氮固定等自养过程。模块1中的细菌类群可以降解几丁质、木质素及甲醇等进行化能异养,部分类群也可以氧化H2获取能量,如Pelomonas、Pseudomonas、Ralstonia的部分种。模块2中的细菌类群主要与硝酸盐还原或氨氧化等氮循环过程有关,主要细菌类群是假诺卡氏菌属(Pseudonocardia)和Planctomycetaceae的Pir4_lineage。模块3中的细菌类群主要与木质素和芳香烃降解等过程有关,主要类群是Halomonas和Pseudomonas。模块4中的细菌类群除几丁质降解等化能异养功能外,Ralstonia和伯克氏菌属(Burkholderia)部分种也可参与H2氧化,硫氧化及氮固定等自养过程。模块5中细菌类群与其他模块没有连接,表明该模块的细菌类群与其他模块在生态位上有一定差异。模块5中全部属于Firmicutes,主要类群Anaerovorax和Fusibacter都与发酵作用有关,这也和其他深地生物圈Firmicutes类群的功能一致[33]。微生物群落成员基于其营养偏好和功能划分生态位,以上结果也显示同一模块内的细菌类群具有相似的功能。模块1、3和模块2之间的负相关关系表明模块之间对资源的相互竞争,而模块1和模块3中细菌类群都与有机质降解相关,在功能上有一定的冗余,有助于群落功能的稳定[54]。此外,模块4和模块5与其他模块的功能差异保证了整个群落的功能多样性[16, 53~54]。
群落构建分析表明锦屏隧道细菌群落构建以确定性过程为主导,其中异质性选择贡献最大,在岩壁细菌群落构建中占52.8 %,对沉积物细菌群落构建以及对所有样本细菌群落构建的贡献分别为61.1 % 和61. 4 %,这表明锦屏隧道细菌群落结构由特定的环境选择压力决定。异质性选择由生物或非生物环境条件下的动态选择决定,会导致微生物群落结构发生较大的变化[48]。目前已报道的微生物群落确定性组装过程多来自小麦地、大豆田和水稻田的土壤,这些生境中的确定性组装过程以同质性选择为主,造成这种群落组装方式的原因可能是长期耕种及灌溉导致的农田环境均匀化[55~57]。然而,Stegen等[18]对位于华盛顿的钻井微生物样品研究发现,环境过滤作用决定了地下环境中细菌群落的组成,并且在时间和空间变化越大的环境中确定性环境过滤作用对细菌群落影响越大。此外,Starnawski等[58]对深海沉积环境的研究也表明细菌群落组装过程由极端寡营养环境选择决定。锦屏隧道细菌群落确定性组装过程(异质性选择)表明锦屏隧道细菌群落受到环境选择压力,可能与隧道内黑暗无光且寡营养的极端环境特点有关。
4 结论本文基于16S rRNA扩增子测序的方法解析了锦屏隧道深地生物圈细菌群落组成及潜在的生态功能特征,探讨了细菌类群间的相互作用及群落组装机制。锦屏隧道细菌群落α多样性(香农威纳指数5.19~8.71)高于其他深地环境,其潜在原因是锦屏隧道上方的裂隙水为隧道内细菌群落提供有机质,且隧道的开挖也使得隧道内的温度和氧浓度等环境条件更加适宜细菌群落的定殖与增殖。锦屏隧道细菌群落组成以变形菌门(Proteobacteria)占主导,特别是γ-变形菌纲(Gammaproteobacteria)在大部分样本中的相对丰度大于61.4 %,这与其他深地生物圈微生物群落类似。但锦屏隧道特有的大理岩与灰岩的岩石组成及寡营养特征决定了其细菌群落的独特性,即放线菌门(Actinobacteria)和浮霉菌门(Planctomycetes)较其他深地生物圈更为丰富。岩溶裂隙水带来的有机质是锦屏隧道寡营养深部生物圈的主要能量来源,从而导致锦屏隧道细菌群落由好氧化能异养类群主导,而H2和CH4氧化等代谢方式在锦屏隧道中仅限于少数细菌类群。值得注意的是,在锦屏隧道中发现了相对丰度较高的动物寄生和人类机会致病菌(相对丰度达6.3 %),而在一些具有代表性的深地基岩和地表土壤环境中其相对丰度小于1 %。这表明人类活动对地下生物圈的潜在影响,同时也提醒人们在开发地下空间的同时,应高度关注地下空间的生物安全,以避免机会致病菌带来的潜在威胁。细菌群落共发生网络显示不同模块之间以正相关关系为主,表明这些模块间以共生或者协作方式对抗极端环境。细菌群落关键类群为Ralstonia、Planctomyces和Woodsholea,它们主要参与有机质降解或硝酸盐还原,Ralstonia也可以参与H2氧化,这些关键类群对维持网络的稳定性具有重要意义。锦屏隧道细菌群落组装以确定性过程(异质性选择)为主,这表明隧道内的细菌群落受到环境选择压力,可能是由隧道内黑暗无光且寡营养的极端环境所决定。锦屏隧道地下实验室埋深远远大于世界其他深地实验室,本研究结果拓展了人们对深地环境细菌群落特征、相互作用及组装机制的认识,同时也为地下空间的开发提供生物安全方面的参考。
致谢: 感谢审稿专家和编辑部杨美芳老师提出了宝贵的修改意见!
| [1] |
董海良. 深地生物圈的最新研究进展以及发展趋势[J]. 科学通报, 2018, 63(36): 3885-3901. Dong Hailiang. Recent developments and future directions of deep biosphere research[J]. Chinese Science Bulletin, 2018, 63(36): 3885-3901. |
| [2] |
Magnabosco C, Lin L H, Dong H, et al. The biomass and biodiversity of the continental subsurface[J]. Nature Geoscience, 2018, 11(10): 707-717. DOI:10.1038/s41561-018-0221-6 |
| [3] |
Cheeptham N. Advances and challenges in studying cave microbial diversity[M]//Cheeptham N. Cave Microbiomes: A Novel Resource for Drug Discovery. New York: Springer, 2012: 1-34.
|
| [4] |
Kieft T L. Microbiology of the deep continental biosphere[M]//Hurst C J. Their World: A Diversity of Microbial Environments Advances in Environmental Microbiology. Cham: Springer, 2016: 225-249.
|
| [5] |
Momper L, Jungbluth S P, Lee M D, et al. Energy and carbon metabolisms in a deep terrestrial subsurface fluid microbial community[J]. International Society for Microbial Ecology Journal, 2017, 11(10): 2319-2333. |
| [6] |
Davidson M M, Silver B J, Onstott T C, et al. Capture of planktonic microbial diversity in fractures by long-term monitoring of flowing boreholes, Evander Basin, South Africa[J]. Geomicrobiology Journal, 2011, 28(4): 275-300. DOI:10.1080/01490451.2010.499928 |
| [7] |
Itavaara M, Nyyssonen M, Kapanen A, et al. Characterization of bacterial diversity to a depth of 1500m in the Outokumpu deep borehole, Fennoscandian Shield[J]. FEMS Microbiology Ecology, 2011, 77(2): 295-309. DOI:10.1111/j.1574-6941.2011.01111.x |
| [8] |
Pedersen K, Bengtsson A F, Edlund J S, et al. Sulphate-controlled diversity of subterranean microbial communities over depth in deep groundwater with opposing gradients of sulphate and methane[J]. Geomicrobiology Journal, 2014, 31(7): 617-631. DOI:10.1080/01490451.2013.879508 |
| [9] |
Dong Y, Kumar C G, Chia N, et al. Halomonas sulfidaeris-dominated microbial community inhabits a 1.8km-deep subsurface Cambrian sandstone reservoir[J]. Environmental Microbiology, 2014, 16: 1695-1708. DOI:10.1111/1462-2920.12325 |
| [10] |
Aullo T, Ranchou-Peyruse A, Ollivier B, et al. Desulfotomaculum spp. and related gram-positive sulfate-reducing bacteria in deep subsurface environments[J]. Frontiers in Microbiology, 2013, 4: 362-373. DOI:10.3389/fmicb.2013.00362 |
| [11] |
Karsten P. The deep biosphere[J]. GFF, 2010, 132(1): 93-94. DOI:10.1080/11035891003692942 |
| [12] |
Purkamo L, Bomberg M, Nyyssonen M, et al. Heterotrophic communities supplied by ancient organic carbon predominate in deep fennoscandian bedrock fluids[J]. Microbial Ecology, 2015, 69(2): 319-332. DOI:10.1007/s00248-014-0490-6 |
| [13] |
Wu X F, Holmfeldt K, Hubalek V, et al. Microbial metagenomes from three aquifers in the Fennoscandian shield terrestrial deep biosphere reveal metabolic partitioning among populations[J]. International Society for Microbial Ecology Journal, 2016, 10(5): 1192-1203. |
| [14] |
Mora-Montes H M, Bates S, Netea M G, et al. A multifunctional mannosyltransferase family in Candida albicans determines cell wall mannan structure and host-fungus interactions[J]. Journal of Biological Chemistry, 2010, 285(16): 12087-12095. DOI:10.1074/jbc.M109.081513 |
| [15] |
Zhou H, Gao Y, Jia X H, et al. Network analysis reveals the strengthening of microbial interaction in biological soil crust development in the Mu Us Sandy Land, Northwestern China[J]. Soil Biology and Biochemistry, 2020, 144: 107782. DOI:10.1016/j.soilbio.2020.107782 |
| [16] |
Feng K, Zhang Z, Cai W, et al. Biodiversity and species competition regulate the resilience of microbial biofilm community[J]. Molecular Ecology, 2017, 26(21): 6170-6182. DOI:10.1111/mec.14356 |
| [17] |
Herren C M, McMahon K D. Keystone taxa predict compositional change in microbial communities[J]. Environmental Microbiology, 2018, 20(6): 2207-2217. DOI:10.1111/1462-2920.14257 |
| [18] |
Stegen J C, Lin X, Konopka A E, et al. Stochastic and deterministic assembly processes in subsurface microbial communities[J]. International Society for Microbial Ecology Journal, 2012, 6(9): 1653-1664. |
| [19] |
Zhou J Z, Ning D L. Stochastic community assembly: Does it matter in microbial ecology?[J]. Microbiology and Molecular Biology Reviews, 2017, 81(4): e2-17. DOI:10.1128/MMBR.00002-17 |
| [20] |
Jia X, Dini-Andreote F, Salles J F. Community assembly processes of the microbial rare biosphere[J]. Trends in Microbiology, 2018, 26(9): 738-747. DOI:10.1016/j.tim.2018.02.011 |
| [21] |
Feng Y Z, Chen R R, Stegen J C, et al. Two key features influencing community assembly processes at regional scale: Initial state and degree of change in environmental conditions[J]. Molecular Ecology, 2018, 27(24): 5238-5251. DOI:10.1111/mec.14914 |
| [22] |
Kou Y P, Wei K, Li C N, et al. Deterministic processes dominate soil methanotrophic community assembly in grassland soils[J]. Geoderma, 2020, 359: 114004. DOI:10.1016/j.geoderma.2019.114004 |
| [23] |
张春生, 周垂一, 刘宁. 锦屏二级水电站深埋特大引水隧洞关键技术[J]. 隧道建设, 2017, 37(11): 1492-1499. Zhang Chunsheng, Zhou Chuiyi, Liu Ning. Key technology of deep buried extra large diversion tunnel of Jinping Ⅱ Hydropower Station[J]. Tuunel Construction, 2017, 37(11): 1492-1499. DOI:10.3973/j.issn.2096-4498.2017.11.021 |
| [24] |
Magoc T, Salzberg S L. FLASH: Fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507 |
| [25] |
Caporaso J G, Kuczynski J, Stombaugh J, et al. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [26] |
Blaxter M, Mann J, Chapman T, et al. Defining operational taxonomic units using DNA barcode data[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2005, 360(1462): 1935-1943. DOI:10.1098/rstb.2005.1725 |
| [27] |
Edgar R C. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 2010, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btq461 |
| [28] |
Quast C, Pruesse E, Yilmaz P, et al. The SILVA ribosomal RNA gene database project: Improved data processing and web-based tools[J]. Nucleic Acids Research, 2013, 41(D1): D590-D596. |
| [29] |
Stegen J C, Lin X, Fredrickson J K, et al. Quantifying community assembly processes and identifying features that impose them[J]. International Society for Microbial Ecology Journal, 2013, 7(11): 2069-2079. |
| [30] |
Jiao S, Liu Z S, Lin Y B, et al. Bacterial communities in oil contaminated soils: Biogeography and co-occurrence patterns[J]. Soil Biology and Biochemistry, 2016, 98: 64-73. DOI:10.1016/j.soilbio.2016.04.005 |
| [31] |
Gokul J K, Hodson A J, Saetnan E R, et al. Taxon interactions control the distributions of cryoconite bacteria colonizing a High Arctic ice cap[J]. Molecular Ecology, 2016, 25(15): 3752-3767. DOI:10.1111/mec.13715 |
| [32] |
Ino K, Konno U, Kouduka M, et al. Deep microbial life in high-quality granitic groundwater from geochemically and geographically distinct underground boreholes[J]. Environmental Microbiology Reports, 2016, 8(2): 285-294. DOI:10.1111/1758-2229.12379 |
| [33] |
Momper L, Kiel Reese B, Zinke L, et al. Major phylum-level differences between porefluid and host rock bacterial communities in the terrestrial deep subsurface[J]. Environmental Microbiology Reports, 2017, 9(5): 501-511. DOI:10.1111/1758-2229.12563 |
| [34] |
Engel A S. Microbial life of cave systems[M]//Engel A S. Life in Extreme Environments. Berlin: De Gruyte, 2015: 79-95.
|
| [35] |
Nyyssonen M, Hultman J, Ahonen L, et al. Taxonomically and functionally diverse microbial communities in deep crystalline rocks of the Fennoscandian shield[J]. International Society for Microbial Ecology Journal, 2014, 8(1): 126-138. |
| [36] |
Lopez-Fernandez M, Broman E, Turner S, et al. Investigation of viable taxa in the deep terrestrial biosphere suggests high rates of nutrient recycling[J]. FEMS Microbiology Ecology, 2018, 94(8): 121-129. |
| [37] |
Cole J K, Peacock J P, Dodsworth J A, et al. Sediment microbial communities in Great Boiling Spring are controlled by temperature and distinct from water communities[J]. International Society for Microbial Ecology Journal, 2013, 7(4): 718-729. |
| [38] |
Hao C B, Wei P F, Pei L X, et al. Significant seasonal variations of microbial community in an acid mine drainage lake in Anhui Province, China[J]. Environmental Pollution, 2017, 223: 507-516. DOI:10.1016/j.envpol.2017.01.052 |
| [39] |
Yun Y, Wang H M, Man B Y, et al. The relationship between pH and bacterial communities in a single karst ecosystem and its implication for soil acidification[J]. Frontiers in Microbiology, 2016, 7: 1955. DOI:10.3389/fmicb.2016.01955 |
| [40] |
Osburn M R, LaRowe D E, Momper L M, et al. Chemolithotrophy in the continental deep subsurface: Sanford Underground Research Facility(SURF), USA[J]. Frontiers in Microbiology, 2014, 5: 610. DOI:10.3389/fmicb.2014.00610 |
| [41] |
Kriiger B. Structural elements of bactopterin from Pseudomonas carboxydoflava carbon monoxide dehydrogenase[J]. Biochimica et Biophysica Acta, 1987, 912(3): 357-364. DOI:10.1016/0167-4838(87)90040-9 |
| [42] |
Wu X F, Pedersen K, Edlund J, et al. Potential for hydrogen-oxidizing chemolithoautotrophic and diazotrophic populations to initiate biofilm formation in oligotrophic, deep terrestrial subsurface waters[J]. Microbiome, 2017, 5(1): 37. DOI:10.1186/s40168-017-0253-y |
| [43] |
Hernsdorf A W, Amano Y, Miyakawa K, et al. Potential for microbial H2 and metal transformations associated with novel bacteria and archaea in deep terrestrial subsurface sediments[J]. International Society for Microbial Ecology Journal, 2017, 11(8): 1915-1929. |
| [44] |
Pedersen K. Metabolic activity of subterranean microbial communities in deep granitic groundwater supplemented with methane and H2[J]. International Society for Microbial Ecology Journal, 2013, 7(4): 839-849. |
| [45] |
Petsch S T, Eglinton T I, Edwards K J. 14C-Dead living biomass: Evidence for microbial assimilation of ancient organic carbon during shale weathering[J]. Science, 2001, 292(5519): 1127-1131. DOI:10.1126/science.1058332 |
| [46] |
Wang X B, Ouyang Z Y, Zhuo S G, et al. Serpentinization, abiogenic organic compounds, and deep life[J]. Science China: Earth Sciences, 2014, 57(5): 878-887. DOI:10.1007/s11430-014-4821-8 |
| [47] |
包明, 何红霞, 马小龙, 等. 化学氮肥与绿肥对麦田土壤细菌多样性和功能的影响[J]. 土壤学报, 2018, 55(3): 734-743. Bao Ming, He Hongxia, Ma Xiaolong, et al. Effects of chemical nitrogen fertilizer and green manure on bacterial diversity and function in wheat field soil[J]. Acta Pedologica Sinica, 2018, 55(3): 734-743. |
| [48] |
Zhang J, Chen M, Huang J F, et al. Diversity of the microbial community and cultivable protease-producing bacteria in the sediments of the Bohai Sea, Yellow Sea and South China Sea[J]. PLoS One, 2019, 14(4): e0215328. DOI:10.1371/journal.pone.0215328 |
| [49] |
Purkamo L, Kietavainen R, Nuppunen-Puputti M, et al. Ultradeep microbial communities at 4.4km within crystalline bedrock: Implications for habitability in a planetary context[J]. Life, 2020, 10(1): 2. DOI:10.3390/life10010002 |
| [50] |
Zhou Y P, Bastida F, Zhou B, et al. Soil fertility and crop production are fostered by micro-nano bubble irrigation with associated changes in soil bacterial community[J]. Soil Biology and Biochemistry, 2020, 141: 107663. DOI:10.1016/j.soilbio.2019.107663 |
| [51] |
Adetutu E M, Ball A S. Microbial diversity and activity in caves[J]. Microbiology Australia, 2014, 35(4): 192-194. DOI:10.1071/MA14062 |
| [52] |
Banerjee S, Schlaeppi K, van der Heijden M G A. Keystone taxa as drivers of microbiome structure and functioning[J]. Nature Reviews Microbiology, 2018, 16(9): 567-576. |
| [53] |
Banerjee S, Kirkby C A, Schmutter D, et al. Network analysis reveals functional redundancy and keystone taxa amongst bacterial and fungal communities during organic matter decomposition in an arable soil[J]. Soil Biology and Biochemistry, 2016, 97: 188-198. DOI:10.1016/j.soilbio.2016.03.017 |
| [54] |
Louca S, Polz M F, Mazel F, et al. Function and functional redundancy in microbial systems[J]. Nature Ecology & Evolution, 2018, 2(6): 936-943. |
| [55] |
Shi Y, Li Y T, Xiang X J, et al. Spatial scale affects the relative role of stochasticity versus determinism in soil bacterial communities in wheat fields across the North China Plain[J]. Microbiome, 2018, 6(1): 6-27. |
| [56] |
Zhang B G, Zhang J, Liu Y, et al. Biogeography and ecological processes affecting root-associated bacterial communities in soybean fields across China[J]. Science of the Total Environment, 2018, 627: 20-27. DOI:10.1016/j.scitotenv.2018.01.230 |
| [57] |
Jiao S, Lu Y H. Soil pH and temperature regulate assembly processes of abundant and rare bacterial communities in agricultural ecosystems[J]. Environmental Microbiology, 2020, 22(3): 1052-1065. DOI:10.1111/1462-2920.14815 |
| [58] |
Starnawski P, Bataillon T, Ettema T J G, et al. Microbial community assembly and evolution in subseafloor sediment[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(11): 2940-2945. DOI:10.1073/pnas.1614190114 |
2 State Key Laboratory of Biogeology and Environmental Geology, China University of Geosciences(Wuhan), Wuhan 430078, Hubei;
3 College of Life Science, Shangrao Normal University, Shangrao 334001, Jiangxi;
4 College of Life Science, Nankai University, Tianjin 300071)
Abstract
Understanding of the composition and potential function of microbial communities in deep biosphere is of great significance, which benefits for the understanding of life limit and offers valuable information on bio-safety in utilization of underground space. Jinping Tunnel(28°20'50″N, 101°56'0″E) is located in Liangshan Yi Autonomous Prefecture, Sichuan Province. The overlying rock is Triassic marble and limestone, and the maximum buried depth can reach 2525m. Bacterial community plays an important role in the ecological function of deep biosphere, the excavation of Jinping tunnel provides a valuable opportunity for the study of microbial community in the terrestrial deep biosphere. To explore the bacterial composition, potential functions and assembly mechanism in Jinping tunnel, loose surface rock wall and sediment samples were collected and subjected to 16S rRNA high-throughput sequencing. The Shannon Wiener index of bacterial communities in Jinping tunnel ranged from 5.19 to 8.71, which were higher than those previously reported from other deep biosphere study. Proteobacteria dominated bacterial communities in all samples, followed by Actinobacteria and Planctomycetes. At the class level, Gammaproteobacteria was the dominant group, with relative abundance over 61.4% in most samples. Alphaproteobacteria and Betaproteobacteria also showed high relative abundance. In terms of metabolic functions, heterotrophic bacterial groups were dominant, whereas bacterial groups using H2 and CH4 were in minor portions. The input of surface organic matter with water through karst fissures might provide substrate for these heterotrophs. Compared with microbial functions in deep bedrocks and surface soils, relatively high abundances of potential animal parasitism(6.4%) and human potential pathogens(6.3%) were surprisingly found in the functional annotations in Jinping tunnel, which may suggest the potential biosafety risks and human disturbance to the deep biosphere during the construction of the tunnels. The occurrence network analysis indicated a tightly connected modularity structure with more positive links among different modules and with Ralstonia、Planctomyces and Woodsholea as the keystone species. Community assembly analysis showed that the bacterial community assembly was dominated by deterministic processes, among which variable selection contributed the most, accounting for 52.8%, 61.1% and 61.4% in the tunnel wall, sediments and all samples, respectively, in Jinping tunnel. This may result from the extreme environmental conditions, which was characterized by darkness and oligotrophic conditions. Our results were the first report about the bacterial biota in Jinping tunnel, which provided the valuable information about bacterial community composition, potential functions and confirmed the role of environmental selection on bacterial community assembly. It not only enhanced our understanding about the terrestrial deep biosphere, but also provided important biosafety references for better development and utilization of Jinping underground space. 2020, Vol.41
2020, Vol.41

