2 黑龙江省第二水文地质工程地质勘察院, 黑龙江 哈尔滨 150030)
真菌作为陆地早期生物——隐花植物的地被植物(Cryptogamic Ground Covers,简称CGCs)的主要组成之一[1~2],由于其广泛的分布、极强的适应能力以及高的地质活性,被认为是自然界岩石风化过程中最重要的生物[3],因此,它们与岩石的相互作用对成壤早期矿物的风化具有重要意义。由于玄武岩在全球元素地球化学循环和气候变化方面的重要作用[4~6],玄武岩风化备受学界关注。前期大量的研究主要关注玄武岩在无机条件下的溶解[7~11],而对微生物参与下的玄武岩风化的研究相对薄弱。一些学者主要研究了细菌的代谢产物(有机酸和铁载体)对玄武岩风化的促进作用[12~14],而对于真菌尤其是不同种真菌如何影响大陆玄武岩早期风化过程中元素释放行为的研究较少。
已有研究表明,真菌主要通过生物物理作用和生物化学作用加快矿物和岩石的风化[15~16]。由于不同种真菌在生理结构和代谢功能上存在明显差异,故它们在促进矿物风化和元素释放方面可能存在显著不同。如在两周的真菌-蛭石反应实验中,真菌Pisolithus XC1和P.microcarpus可造成蛭石风化过程中K释放量达到2~3倍的差别[17]。在烟曲霉菌(Aspergillus fumigatus)和黄色蠕形霉菌(Talaromyces flavus)与蛇纹石的反应实验中,二者可造成蛇纹石中Mg释放量的显著不同[18]。而在黑曲霉菌(Aspergillus niger)和链格孢菌(Alternaria sp.)分别与碳酸盐矿物的反应实验中,这两种真菌由于代谢产物的差异造成了碳酸盐矿物溶解过程中元素Ca和Mg释放行为的显著不同[19]。但是不同属种的真菌对玄武岩中不同元素释放行为的影响差异还不得而知。为此,本研究选取中国最年轻的火山区域黑龙江省五大连池地区玄武岩风化土壤中的4种真菌,并与五大连池新鲜玄武岩进行溶解实验,观测在28 ℃、30天反应周期内二者相互作用过程中Mg、Al、Si、Ca、Ti、Mn、Fe、Ni、Sr这9种元素的释放速率,查明释放机理,探讨真菌属种差异对玄武岩风化的影响。
1 材料与方法 1.1 实验样品(1) 真菌
本研究风化实验所用的4种真菌(Aspergillus pesudofelis、Aspergillus viridinutans、Aspergillus undagawae和Aspergillus clavatus)分离自五大连池玄武岩地区的表层土,分离方法如下:将10 g土样加入100 ml无菌的去离子水中,在28 ℃的水浴锅中摇动2 h,静置30 min后取200 μL上清液滴于添加了抗生素(40 mg/L庆大霉素,Amersco,USA;30 mg/L链霉素,Sigma Aldrich,USA)的MEA固体培养基(20 g/L麦芽膏+18 g/L琼脂)表面,28 ℃培养14天。待真菌群落显著生长且形貌可辨时,对其进行分离,纯化,并鉴定属种,具体方法参照文献[18]。
(2) 岩石
实验所用的结晶玄武岩采自黑龙江省五大连池地区老黑山一处新鲜的玄武岩露头(48°43′27″N,126°08′13″E,),岩性为碱性玄武岩,喷出时代为1719~1721年[20]。挑选新鲜的具气孔构造的玄武岩样品进行粉碎。碎样前在实验室内分别用去离子水(Deionized Water,简称DIW)和无水乙醇进行清洗并40 ℃烘干,然后粉碎至75 μm,用样品筛收集45~63 μm的颗粒。将获得的玄武岩颗粒在DIW中超声清洗若干次,直至上清液清澈为止。清洗结束后将样品置于40 ℃烘箱中烘24 h,并用光学显微镜确认绝大多数颗粒粒径在45~63 μm之间。最后将烘干的粉末121 ℃灭菌20 min。通过以上步骤获得的样品作为风化实验的固体样。粉末样的BET(Brunauer,Emmett and Teller)-N2实验结果显示,样品的BET值为0.2437±0.0027 m2/g。
1.2 风化实验根据实验条件差异,本研究设置了两个系列实验:真菌-玄武岩风化实验和无菌玄武岩风化实验。其中,真菌-玄武岩风化实验标记为Exp-F1、Exp-F2、Exp-F3和Exp-F4(Exp-F)4组实验;无菌玄武岩风化实验包括NGM培养基溶解(Exp-NGM)和去离子水溶解(Exp-DIW)两组实验。实验关注不同条件下玄武岩的溶解动力学、9种元素的释放行为以及真菌生长过程中有机酸的代谢,实验主要步骤见图 1。
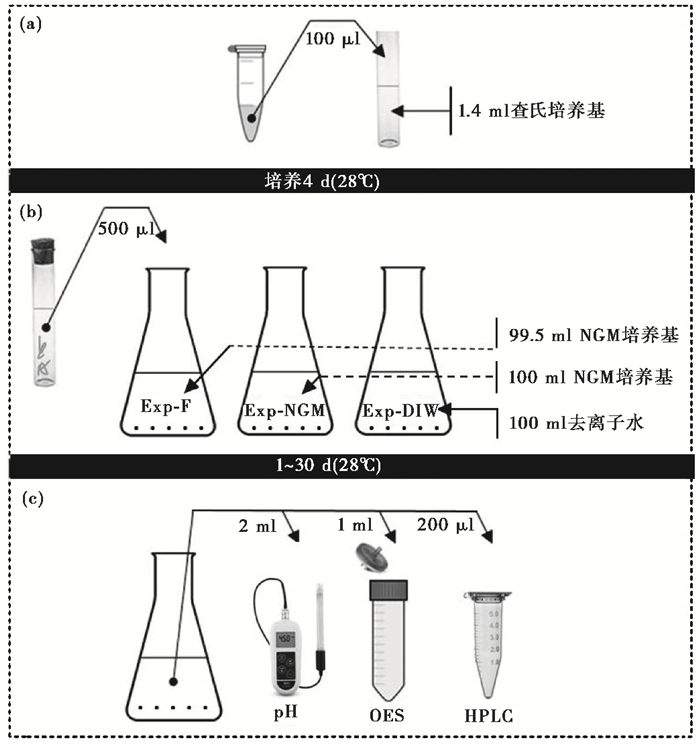
|
图 1 风化实验步骤(引自文献[11],略修改) (a)真菌孢子培养,(b)锥形瓶风化实验,(c)取样及分析步骤;其中锥形瓶风化实验所用的菌丝由已分离的孢子(悬浮液中孢子的初始浓度为3×106~5×106个/ml)在查氏培养基中培养4天(28 ℃)后获得 Fig. 1 The steps of weathering experiments(modified from reference[11]). (a)Fungal spores culture, (b)flask bioalteration experiments, and (c)sampling from the bulk solution and analyzing steps. The hyphae used in the flask bioalteration experiments were obtained after 4 days(28 ℃)incubation in the Czapek mineral medium containing spores that had been isolated(initial spore concentration in the suspension was 3×106~5×106/ml) |
本实验采用两种液体培养基。第一种为查氏培养基,真菌由孢子长成菌丝在其中完成。其成分如下(L- 1):2.97 g NaNO3,1.31 g K2HPO4,0.25 g MgSO4 7H2O,0.50 g KCl,0.01 g FeSO4 7H2O,20 g葡萄糖,4.34 g MES(2-[N-morphelino]ethane sulphonic acid,无水2-吗啉乙磺酸)。加入孢子前,用1N的盐酸将培养基pH值调至5.5,然后灭菌。其中,NaNO3、K2HPO4、MgSO4 7H2O和KCl溶液在高温灭菌锅内(121 ℃,20 min)灭菌,FeSO4 ·7H2O、葡萄糖和MES则经过抽滤后在紫外灯下灭菌。
第二种为锥形瓶中玄武岩风化实验所用的NGM培养基,成分如下(L- 1):2.97 g NaNO3,20 g葡萄糖,4.34 g MES。培养基配制完成后,用1N的盐酸将其pH调至5.5左右(实际调至5.29),并灭菌。其中,NaNO3作为氮源,葡萄糖作为碳源,MES作为溶液pH缓冲剂。由于玄武岩中无机磷的含量远高于细胞生长所需元素P的含量,因此,培养基中并未添加磷盐。
实验前将锥形瓶置于3v % HNO3 (0.05 mol/L)中浸泡24 h,接着用DIW反复冲洗,清洗完成后40 ℃烘干并灭菌。然后向瓶内依次加入已灭菌的玄武岩粉末5 g、NGM培养基/DIW以及0.5 ml菌丝(图 1a和1b),锥形瓶用0.22 μm的半透膜封口,以保证瓶内处于有氧环境。以上步骤完成后,将所有锥形瓶置于28 ℃、120 r/min的摇动培养箱内,反应开始。按照一定的取样时间,每次从锥形瓶中取2 ml溶液,立即测量其pH值,然后经0.22 μm醋纤滤头过滤,其中1 ml用来分析离子浓度,200 μL用来分析有机酸,剩余溶液作备份(图 1c)。根据细胞的生长曲线设定12次取样时间,依次为1天、2天、4天、6天、8天、10天、12天、15天、18天、22天、26天和30天。每组实验进行3个重复。
1.3 分析方法(1) 玄武岩物质组成
玄武岩样品的矿物组成测试采用Dmax Rapid Ⅱ型X射线衍射仪(XRD),扫描条件为Cu靶(38 kV and 20 mA),扫描速度0.3°/min,在南京大学内生金属矿床成矿机制研究国家重点实验室完成。全岩化学组成测试采用ARL-9800XP+型X射线荧光光谱仪(XRF),测试结果以氧化物的质量百分比表示,绝对误差 < 0.5 %,在南京大学现代分析中心完成。
(2) 溶液pH值与溶解有机酸分析
反应溶液pH值用VWR台式pH计(型号#8100)在室温下测量,精度为± 0.01。溶解有机酸用配有二极管阵列检测器的高效液相色谱(HPLC)(Agilent 1200,Agilent Technologies,Waldbronn,Germany)进行鉴定和定量分析。有机酸用安捷伦Aligent Zorbax SB-C8 (4.6×250 mm,5 μm)和XDB-C8(4. 6×75 mm,3. 5 μm)(按顺序安装)分离,流动相为50 mM的H3PO4(pH=2.5),流速为0.7 ml/min。实验所用的有机酸标样均购自Sigma-Aldrich官网。各有机酸的检测限如下(μmol/L):乙酸:0.083,柠檬酸:0.021,甲酸:0.013,富马酸:0.004,苹果酸:0.03,草酸:0.003,酒石酸:0.007。有机酸分析在南京大学医药生物技术国家重点实验室完成。
(3) 元素浓度
反应溶液的离子浓度通过电感耦合等离子体发射光谱法(ICP-OES)测得(i CAP 6300 spectrometer,Thermo Scientific,UK),在南京大学表生地球化学教育部重点实验室完成。溶液经0.22 μm醋纤滤头过滤后,按照时间序列,以不同的倍数用3v % HNO3稀释至3 ml,4 ℃保存以待测试。每次测试进行3次重复,取平均值作为测试结果,测试结果的标准偏差SD均小于5 %。为消除由于取样使得溶液体积减小而造成的实验误差,运用以下表达式对实验结果进行校正:
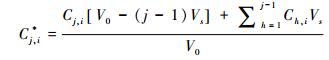
|
(1) |
公式(1)中,Cj,i*是元素i在第j次取样后的校正浓度(j=1,2,…,12),Cj,i是测量浓度,V0是反应体系溶液的初始体积(100 ml),Vs是每次的取样体积(2 ml),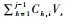
(4) 矿物表面分析
用带有能谱的扫描电镜(SEM型号:Carl Zeiss Supra 55;EDS(能谱仪:Energy Dispersive X-ray Spectrometer)型号:Oxford Aztec X-Max 150)对经过30天反应的玄武岩颗粒表面形态和成分进行分析,工作电压为5 kV,在南京大学内生金属矿床成矿机制研究国家重点实验室完成。
1.4 元素释放速率用线性溶解速率(Ril)表征元素的释放动力学,Ril的表达式如下:
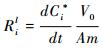
|
(2) |
公式(2)中,Ril是元素i的线性释放速率(mol/m2/s),dCi*/dt是元素i校正后的浓度对反应时间的微分,V0是反应体系溶液的初始体积(100 ml),A是BET-N2实验玄武岩粉末的比表面积(0.2437±0.0027 m2/g),m是溶液中玄武岩颗粒的初始质量(5 g)[21]。
2 结果 2.1 风化实验所用真菌的属种鉴定结果真菌属种鉴定结果如表 1所示,可知实验所用的4种真菌均为曲霉属真菌。该属广泛分布于土壤和地表水体中,也见于人和猫的体表[22],但这4种真菌的生理特性及代谢特征还不甚明确。
| 表 1 风化实验所用真菌的属种鉴定结果 Table 1 Species identification of the fungi used in weathering experiments |
表 2列出了五大连池玄武岩岩石样品的主要矿物和化学组成,从中可见,全岩主要由橄榄石、普通辉石和钠长石3种矿物组成,三者的体积分数之和达88.76 %。
| 表 2 玄武岩的主要矿物和化学组成 Table 2 Major mineralogical components and chemical compositions of the bulk basalt |
实验中的4种真菌均能在含有5 g玄武岩的NGM培养基中生长。同时,整个实验过程中,对照组Exp-NGM和Exp-DIW均保持无菌状态。这表明NGM培养基中的NaNO3(氮源)、葡萄糖(碳源)和玄武岩(生命必需元素)可满足这4种真菌的生长。根据实验结果,选取风化速率最快(Exp-F1,即含A. pseudofelis)和最慢(Exp-F2,即含A. viridinutans)的两组有菌体系,并结合无菌对照组Exp-NGM和Exp-DIW共同讨论同一群落中不同属种的真菌对玄武岩中各元素释放行为的影响(表 3和图 2)。
| 表 3 反应6天后有菌体系中检测到的6种主要有机酸浓度及检测限(μmol/L) Table 3 Six major organic acids were detected in the two Exp-F systems after six reaction days(μmol/L) |
|
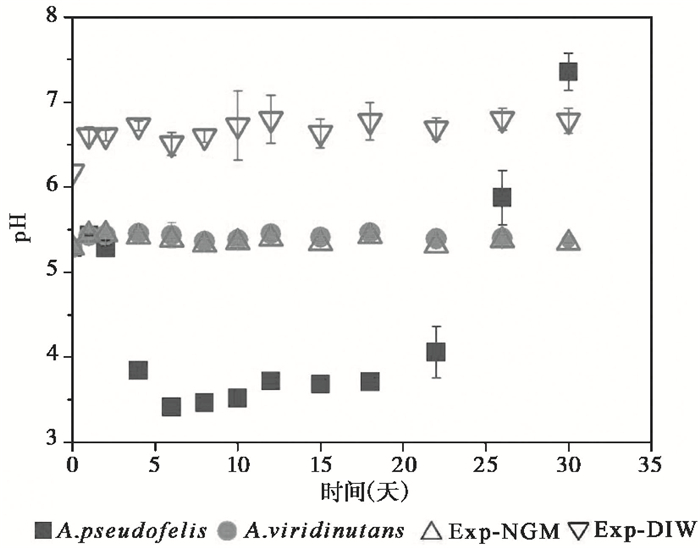
图 2 实验溶液pH值的变化 图中每个点的pH值均为3个重复实验的平均值,误差线为标准偏差 Fig. 2 Variations of pH in experimental solutions. The values at each point are the means of three replicates and the error bars are standard deviations |
图 2显示了4组体系中溶液pH值随反应时间的变化,从中可见,在30天的反应时间内,含A.viridinutans和Exp-NGM两组实验的溶液pH值几乎保持不变,Exp-DIW仅有微弱上升(+0.62),而含A. pseudofelis的体系溶液pH值在反应前6天由最初的5.29迅速降低至3.85,且在第6~22天内保持在3.41至4.06的低pH状态,22天后,pH迅速上升至30天的7.36。
我们分析了实验反应第6天含A. pseudofelis和含A. viridinutans两组体系中可溶有机酸的种类及含量(表 3),发现含A. pseudofelis体系中含有6种有机酸,而含A. viridinutans体系中只有3种,且前者中各有机酸的浓度远高于后者中对应有机酸的浓度。如草酸,前者为后者的666倍,甲酸为12倍,琥珀酸为2.8倍。此外,草酸的体积分数在含A. pseudofelis和含A. viridinutans两组体系中分别为84.9 %和11.5 %。
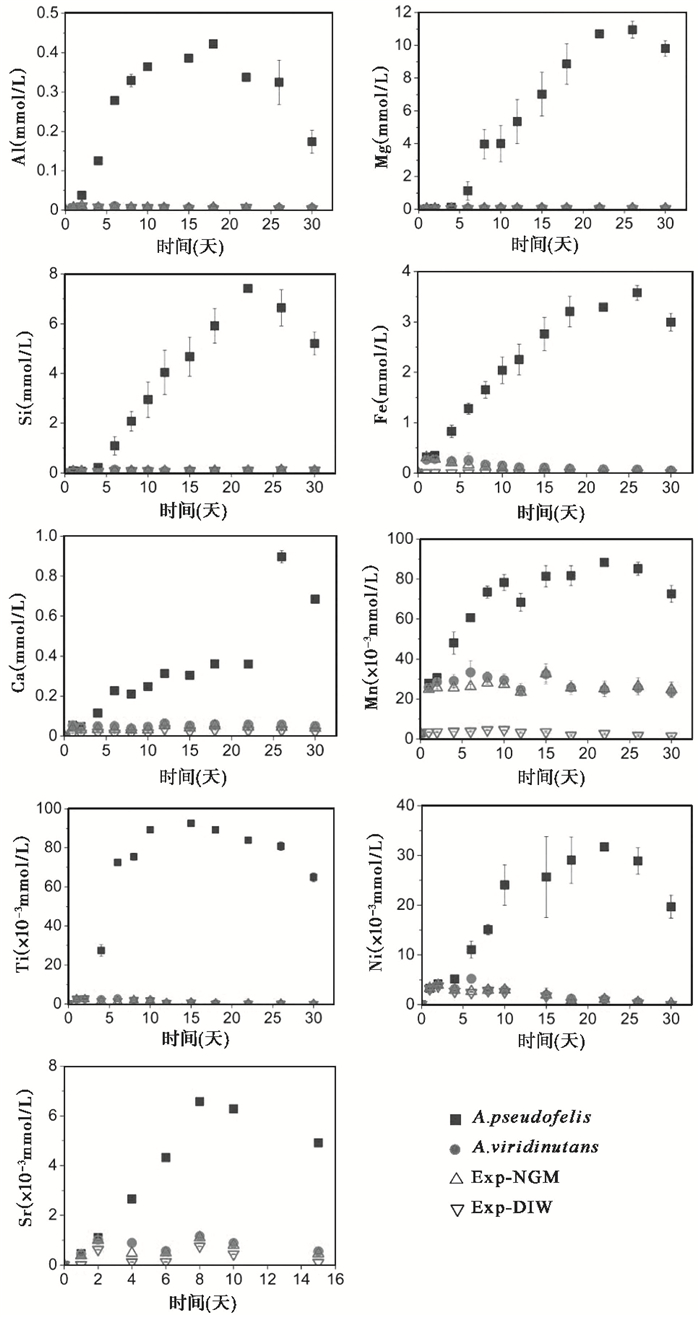
2.4 溶液中各元素的浓度为比较4组体系中9种元素的释放行为,应用公式(1)对溶液中各元素的浓度进行了换算并校正,结果如图 3所示。总体而言:1)含A. pseudofelis体系中各元素最高浓度显著高于无菌对照体系中相应元素的最高浓度,如Mg、Si、Ca、Fe和Ni这5种元素在含A. pseudofelis和Exp-NGM两组体系中的最高浓度比分别为219、93、18、11和8;而含A.viridinutans体系则与无菌对照体系中各元素的浓度值及变化趋势保持一致。2)对于含A.pseudofelis中的9种元素,其线性释放的时间区间差异较大,如Ca、Ti为6天,Sr为8天,Al、Mn为10天,Mg、Si、Fe、Ni为22天。在达到最高浓度后,除Ca、Mn、Ti这3种元素外,其余6种元素的浓度均呈线性下降。3)对于含A. viridinutans、Exp-NGM和Exp-DIW这3个体系,大多数元素(除Mn、Ni、Sr外)的浓度均在反应开始1天后达到最高值,随后保持稳定或缓慢下降。
|
图 3 玄武岩风化反应溶液中Al、Mg、Si、Fe、Ca、Mn、Ti、Ni和Sr的元素浓度随反应时间的变化 图中每个点的值均为3个重复实验的平均值,误差线为标准偏差 Fig. 3 The variation of concentrations of Al, Mg, Si, Fe, Ca, Mn, Ti, Ni and Sr with time in the reaction solution of basalt weathering. The values at each point are the means of three replicates and the error bars are standard deviations |
经过30天的反应,A.pseudofelis所在体系中玄武岩颗粒表面被球状和丝状的真菌细胞所覆盖。在这些细胞表面,可见形状不规则但表面光滑的碎片(图 4a)。EDS的分析结果(图 4b)显示:这些碎片的主要成分为SiO2,结合其形态,推断其为二氧化硅的无定形体。

|
图 4 扫描电镜下含A. pseudofelis所在体系反应30天后真菌团簇体表面的无定形硅(a)及EDS图像(b) Fig. 4 The amorphous silicon(a)and the EDS image(b)on the surface of the fungal clusters after 30 days reaction in Ext-A. pseudofelis system under scanning electron microscope |
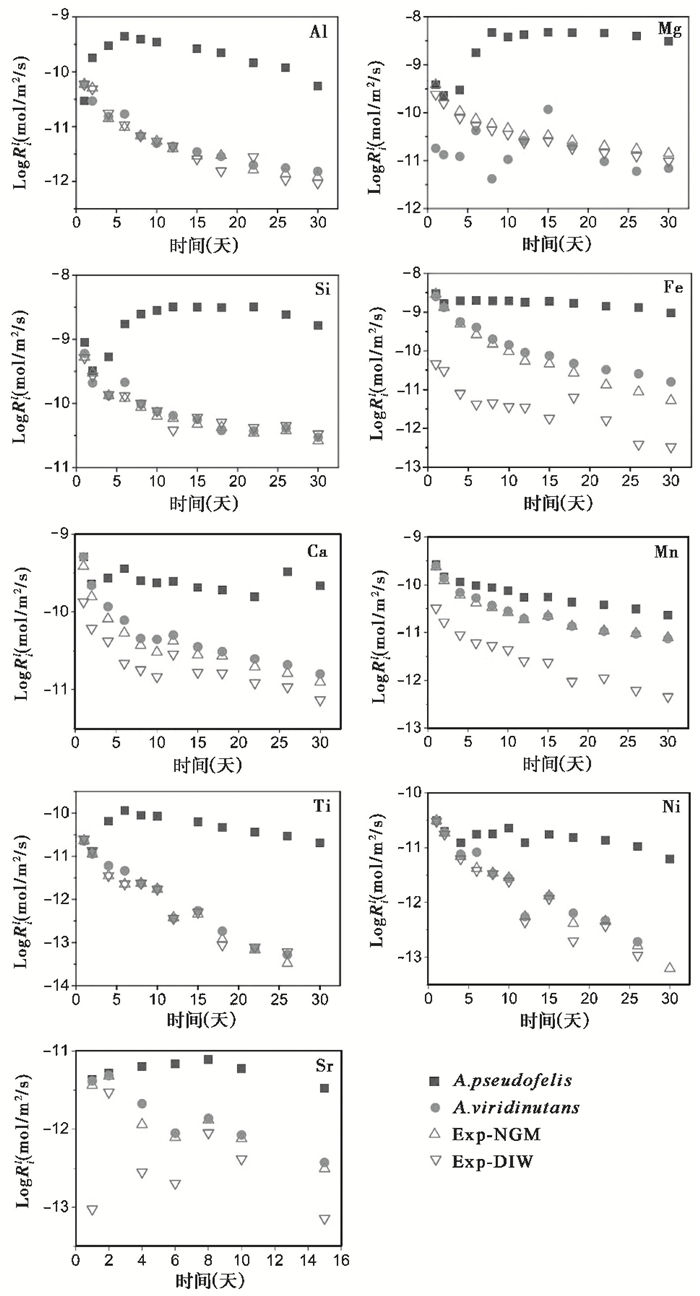
根据公式(2)计算4组体系中9种元素的线性释放速率,可发现含A. pseudofelis体系中9种元素的Ril值明显高于其余3组,如对于Mg、Si、Fe、Ca和Ni这5种元素,其在含A. pseudofelis体系中的最大线性释放速率为同一时间含A. viridinutans体系中的126、63、32、14和6倍,且各元素的Ril值随反应进程的变化差异明显,这表明控制9种元素释放行为的因素存在差异。因此,为理解各元素的Ril值的控制因素,我们绘制了LogRil-Time图,如图 5所示。从图 5中可以看出,Mg、Al、Ca、Ti、Sr这5种元素的Ril最大值均出现在最低溶液pH条件下(反应第6~8天)。
|
图 5 风化实验中Al、Mg、Si、Fe、Ca、Mn、Ti、Ni和Sr的元素线性溶解速率(LogRil)随反应时间的变化 Fig. 5 The variation of elemental linear dissolution rates(LogRil)of Al, Mg, Si, Fe, Ca, Mn, Ti, Ni and Sr with reaction time during basalt bioalteration experiments |
大量的野外和室内实验均表明微生物可栖居于火山岩表面[15~16, 23]。这些微生物种类多样,包括异养细菌、蓝藻细菌、藻类和真菌[24~25],其中,蓝藻细菌作为主要的光合微生物会首先栖居于新鲜岩石的表面[26~28]。但真菌由于具有极强的环境适应能力和高的地质活性,且常常与光合细菌共生形成地衣,广泛分布于大陆岩石圈表面(地衣分布面积可占地表总面积的6 % [29]),因此,它们在矿物和岩石早期风化过程中具有重要作用[14, 30]。但在实验室条件下,不同种的真菌对岩石风化过程中元素释放行为的影响有待于进一步研究。
3.1 元素释放机制真菌在与玄武岩相互作用过程中会代谢多种不同种类和浓度的有机小分子,包括有机酸和铁载体。这些有机物一方面可以提供质子,通过质子交换作用加快矿物溶解,同时也可以通过络合作用加快矿物表面元素的释放[31]。硅酸盐矿物的质子交换和络合催化作用对溶解贡献的速率经验公式可描述为[32]:
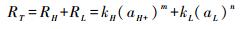
|
(3) |
公式(3)中,RT为总溶解反应速率,RH与RL分别为质子交换和络合催化反应速率,kH与kL分别为质子交换和络合催化反应的速率常数,aH+与aL分别为质子和络合物的活度,m与n为反应级数。
大量实验结果显示,H+与矿物表面金属阳离子的交换是造成矿物溶解的重要原因[33]。本研究中,根据元素的释放曲线(图 3)可以看出,含A. pseudofelis的反应体系中,9种元素的浓度均比另外3个体系高出一至两个数量级,且线性释放的时间区间更长。结合溶液pH变化曲线(图 2)和元素释放速率曲线(图 5),可以发现,Al、Mg、Si、Ca、Ti这5种元素的释放速率在反应第6天突然升高,且似乎表现出了最大值(Si除外),而反应第6天溶液所在体系为pH最小值,这表明以上5种元素的释放可能主要受控于质子交换作用,即溶液pH值。对于Fe、Ni这两种元素,其浓度曲线随时间变化具有较好的线性(图 3),线性释放区间长达18天(4~22天),且二者的线性溶解速率值在线性区间内基本保持恒定(图 5),这表明Fe、Ni两种元素在溶液中的释放机制并非由质子交换作用主导,络合作用可能具有重要作用。已有研究表明,微生物通过代谢铁载体可以显著提高矿物中Fe元素的释放速率[34~35],而铁载体-Fe的形成可以有效地保持Fe存在于溶液中[36]。这很好地解释了Fe元素的浓度曲线中,含A. pseudofelis体系中高的Fe浓度值和较长的线性区间。此外,虽然含A.viridinutans与Exp-NGM两体系的pH值变化一致,但可能由于铁载体的存在使得含A. viridinutans体系中Fe浓度高于Exp-NGM。
真菌生长除代谢铁载体外,还会代谢有机酸。对比含A. pseudofelis和含A. viridinutans两个体系,可以发现前者所在体系中草酸含量更高。通过含Ni(Ⅱ)与羧酸溶液的ATR-FTIR和XAFS分析发现,与真菌代谢的其他有机酸相比,草酸与Ni具有最强的络合能力[37];此外,草酸-Ni的稳定常数(107.64[37])较铁载体-Ni的稳定常数(105.37[38])高出两个数量级,这表明Ni更倾向于与草酸络合。因此,含A. pseudofelis体系中Ni的释放可能主要受控于高浓度的草酸。
对比前人细菌-玄武岩溶解实验[21, 39]的结果发现,Mg、Si、Fe这3种元素的线性释放区间小于10天,而本研究中这3种元素的线性区间可至18天。研究表明,随着玄武岩溶解过程的进行,矿物表面会形成富Si层,阻碍元素的继续释放[8]。随着矿物表面富Si层逐渐变厚,质子交换及络合催化作用对元素释放的作用越来越小。这时,元素的释放和矿物的进一步溶解则受控于富Si层的性质,而富Si层的性质则受pH、温度、物理作用等因素影响[40]。与细菌相比,真菌生长过程中某些特定结构(附着胞)的细胞壁会产生高达10~100 MPa的围压[41],而富Si层的弹性模量小于1 MPa[42],这意味着真菌生长过程中附着胞的围压可将富Si层撕裂,减缓了矿物表面的钝化。因此,真菌生长过程中的生物物理作用使得真菌在矿物(岩石)风化过程中具有了一定的优势。
3.2 矿物溶解顺序XRD结果显示,五大连池玄武岩样品主要由橄榄石、普通辉石、透辉石、钠长石和石英5种矿物组成(表 1)。其中,Mg、Fe主要赋存于橄榄石和普通辉石中,Ca主要赋存于普通辉石和透辉石中,Al主要赋存于普通辉石和钠长石中,Si主要赋存于钠长石和普通辉石中,其次在橄榄石、透辉石和石英中。因此,玄武岩的溶解可通过以上5种矿物的溶解近似描述。从溶液pH变化趋势(图 2)可以看出,在30天的反应周期内,4组体系均处于酸性至中性环境(pH=3.41~7.36)。在酸性条件下,石英几乎不发生溶解[43]。其余4种矿物的溶解总反应可描述为:
橄榄石:
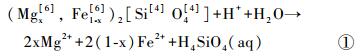
|
普通辉石:
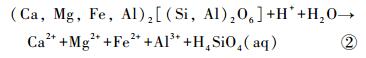
|
透辉石:
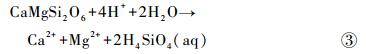
|
钠长石:
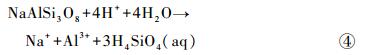
|
反应式①~④仅为矿物溶解反应的表观描述,并未表明反应机制和速率。根据①~④式可知,矿物在等化学计量数溶解过程中,各元素释放的摩尔比如下:橄榄石、普通辉石和透辉石的n(Mg)/n(Si)值分别为2、1和1/ 2;普通辉石和透辉石的n(Ca)/n(Si)值为1和1/ 2,n(Ca)/n(Mg)值为1和1;钠长石的n(Al)/n(Si)值为1/ 3。对于溶液中的Mg,其主要来源于玄武岩中含Mg矿物(橄榄石、普通辉石和透辉石)的溶解,而矿物的溶解不仅涉及化学键的断裂,同时也伴随着新化学键的生成。如反应式①中所示,橄榄石化学式中右上标的数字代表各原子的配位数,橄榄石溶解过程中,由于H3O+的存在,伴随着每6个Mg-O键中1个Mg-O键的断裂[44],6个Mg-OH2键生成,最终生成1个(Mg ·6H2O)2+。而每4个SiO-Mg键中的1个则生成SiO-H键,生成溶解态的H4SiO4。对于Ca和Al,质子交换作用使其以较快的速率(几分钟至几小时[45])从矿物中释放出来。
含A. pseudofelis体系中,n(Mg)/n(Si)值在30天的反应周期内可明显分为3阶段(图 6):阶段1为0~8天,此阶段n(Mg)/n(Si)值由0.5升高至2左右,表明在溶解的最初阶段(0~4天),透辉石首先发生溶解,随着真菌的生长,溶液pH值逐渐降低,橄榄石开始发生大量溶解;阶段2为8~22天,此阶段溶液中n(Mg)/n(Si)值保持在1.5左右,表明橄榄石和普通辉石等比例发生溶解;阶段3为22~30天,此阶段溶液中n(Mg)/n(Si)值从1.5逐渐上升至2附近,由于22天后随着溶液性质的变化,Si发生沉淀(图 4),溶液中Si的浓度降低,使得n(Mg)/n(Si)值升高。根据n(Ca)/n(Si)值的变化曲线,可以发现:在反应前4天,其变化轨迹与n(Mg)/n(Si)值一致,表明此阶段透辉石的溶解占主导;同样,n(Ca)/n(Mg)值的变化曲线似乎也说明了相同的现象。从n(Al)/n(Si)值变化曲线可见:在反应第2~6天,n(Al)/n(Si)值由约0.5降低至约0.25,这说明此阶段普通辉石优先于钠长石发生溶解,而反应8天后,n(Al)/n(Si)值不断降低,平均值为0.08。
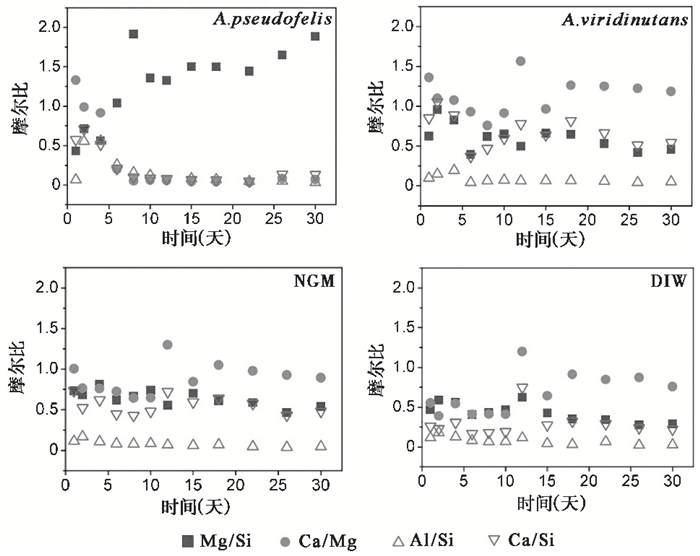
|
图 6 风化实验含A.pseudofelis、含A. viridinutans、Exp-NGM和Exp-DIW这4组体系溶液中n(Mg)/n(Si)、n(Ca)/n(Mg)、n(Al)/n(Si)和n(Ca)/n(Si)值随反应时间的变化 Fig. 6 The variation of n(Mg)/n(Si), n(Ca)/n(Mg), n(Al)/n(Si) and n(Ca)/n(Si)values over reaction time in the four reaction system solutions of containing A.pseudofelis, containing A.viridinutans, Exp-NGM和Exp-DIW during bioalteration experiments |
与含A.pseudofelis体系显著不同,在含A.viridinutans、Exp-NGM和Exp-DIW这3个体系中,n(Mg)/n(Si)值和n(Ca)/n(Si)值相对稳定,n(Mg)/n(Si)平均值依次为0.6、0.6和0.4,n(Ca)/n(Si)平均值依次为0.7、0.6和0.3;而n(Al)/n(Si)值变化趋势一致且数值接近,均为0.08。这表明在含A. viridinutans、Exp-NGM和Exp-DIW这3个弱酸性至中性的体系中,橄榄石和透辉石优先溶解,普通辉石次之,钠长石几乎未发生溶解,这与文献[27]的研究结果一致。
综上,对于研究的4个体系,含A. pseudofelis中反应早期以透辉石、橄榄石和钠长石溶解为主(0~6天),随后以橄榄石和普通辉石为主。而含A.viridinutans、Exp-NGM和Exp-DIW这3个体系中,始终以橄榄石和透辉石的溶解为主。以上分析假定了矿物溶解过程中元素的释放符合化学计量数,但研究表明矿物在溶解过程中元素存在非化学计量数的不一致性释放[46~47]。对于由质子交换控制的Mg、Al、Ca、Si这4种元素,根据其在溶液中的摩尔比对不同矿物的溶解情况进行分析得出的结论符合前人的研究结果[43],这表明本文的实验结果在一定程度上可信。
以上分析表明,与无机条件相比,真菌A.pseudofelis极大地加快了玄武岩的风化。同时,不同种的真菌对玄武岩风化速率的影响差异巨大,如A.pseudofelis与A. viridinutans为同一个微生物群落中的两种真菌,由于二者在代谢水平及产物上的差异,使得含A. pseudofelis体系中大多数元素的最大释放速率较含A. viridinutans体系高出1~2个数量级。但是,需要注意的是,本研究的实验结果是在适宜真菌生长的实验室条件下(如营养充足、温度适宜、缺少种间竞争)获得的,这比野外环境更有利于真菌的新陈代谢(至少要优于暴露在空气中的岩石表面,后者面临干燥、低温、营养匮乏等不良条件)。因此,本实验所给出的元素释放速率可能要高于自然界中的真实值。
4 结论和研究意义本研究利用真菌-玄武岩锥形瓶批式溶解实验,探究了实验室条件下同一群落中4种曲霉属真菌对新鲜玄武岩中Mg、Al、Si、Ca、Ti、Mn、Fe、Ni和Sr这9种元素释放行为的影响。实验结果显示:1)真菌A. pseudofelis的生长显著加快了以上9种元素的释放(如对于Mg、Si、Fe、Ca和Ni这5种元素,其在含A. pseudofelis体系中的最大线性释放速率为同一时间含A. viridinutans体系中的126、63、32、14和6倍),也提高了各元素的释放总量(如Mg、Si、Ca、Fe和Ni这5种元素在含A. pseudofelis和Exp-NGM两组体系中的最高浓度比分别为219、93、18、11和8);而真菌A. viridinutans并未明显加快玄武岩的风化(含A. viridinutans体系中各元素的浓度与无机对照组Exp-NGM始终接近),这表明不同种的真菌对玄武岩风化的影响差异巨大。2)真菌在生长过程中代谢的有机酸(主要是草酸)降低了溶液的pH值,显著提高了Al、Mg、Si、Ca、Ti这5种元素的释放速率。同时,真菌分泌的有机酸通过络合作用进一步加快了矿物中Fe和Ni的释放。3)真菌生长过程中菌丝尖端巨大的细胞围压可能对元素的释放也起到了重要作用,尤其在延长元素的线性释放区间方面尤为明显。
尽管实验室条件与野外条件存在差别,但我们的实验结果表明,在玄武岩地区,真菌的大量存在使得玄武岩的风化速率至少提高了一个数量级。这表明真菌的存在及演化对于地球早期地表岩石(至少是玄武岩)的风化产生了重要影响,通过加快岩石风化速率提高了生命必需元素Mg、Ca、Fe的释放,为早期植物的生长提供了营养。其次,Mg、Ca、Sr等碱土金属元素的释放有利于降低大气CO2含量,再者真菌还与光合微生物协同作用,使得大气O2含量升高,这为新元古代更高级的陆生真核生物的出现创造了条件[48]。
致谢: 感谢审稿人对本文提出宝贵的建设性修改意见。感谢黑龙江省第二水文地质工程地质勘察院的王鹤,以及黑龙江省五大连池风景区自然保护区管理委员会的王佳军和崔建宇等在样品采集过程中提供的帮助。
| [1] |
Elbert W, Weber B, Burrows S, et al. Contribution of cryptogamic covers to the global cycles of carbon and nitrogen[J]. Nature Geoscience, 2012, 5(7): 459-462. DOI:10.1038/ngeo1486 |
| [2] |
Mitchell R L, Cuadros J, Duckett J G, et al. Mineral weathering and soil development in the earliest land plant ecosystems[J]. Geology, 2016, 44(12): 1007-1010. DOI:10.1130/G38449.1 |
| [3] |
Gadd G M. Fungi, rocks, and minerals[J]. Elements, 2017, 13(3): 171-176. DOI:10.2113/gselements.13.3.171 |
| [4] |
Berner R A, Lasaga A C, Garrells R M. The carbonate-silicate geochemical cycle and its effect on atmospheric carbon dioxide over the past 100 million years[J]. American Journal of Science, 1983, 288(283): 641-683. |
| [5] |
Dessert C, Dupré B, François L M, et al. Erosion of Deccan Traps determined by river geochemistry:Impact on the global climate and the 87Sr/86Sr ratio of seawater[J]. Earth and Planetary Science Letters, 2001, 188(3-4): 459-474. DOI:10.1016/S0012-821X(01)00317-X |
| [6] |
Dessert C, Dupré B, Gaillardet J, et al. Basalt weathering laws and the impact of basalt weathering on the global carbon cycle[J]. Chemical Geology, 2008, 202(3): 257-273. |
| [7] |
Gislason S R, Hans P E. Meteoric water-basalt interactions. Ⅰ:A laboratory study[J]. Geochimica et Cosmochimica Acta, 1987, 51(10): 2827-2840. DOI:10.1016/0016-7037(87)90161-X |
| [8] |
Gislason S R, Eugster H P. Meteoric water-basalt interactions. Ⅱ. A field study in N. E. Iceland[J]. Geochimica et Cosmochimica Acta, 1987, 51(10): 2841-2855. DOI:10.1016/0016-7037(87)90162-1 |
| [9] |
Brady P V, Gíslason S R. Seafloor weathering controls on atmospheric CO2, and global climate[J]. Geochimica et Cosmochimica Acta, 1997, 61(5): 965-973. DOI:10.1016/S0016-7037(96)00385-7 |
| [10] |
Taylor A S, Lasaga A C. The role of basalt weathering in the Sr isotope budget of the oceans[J]. Chemical Geology, 1999, 161(1-3): 199-214. DOI:10.1016/S0009-2541(99)00087-X |
| [11] |
Oelkers E H, Gislason S R. The mechanism, rates and consequences of basaltic glass dissolution:Ⅰ. An experimental study of the dissolution rates of basaltic glass as a function of aqueous Al, Si and oxalic acid concentration at 25℃ and pH=3 and 11[J]. Geochimica et Cosmochimica Acta, 2001, 65(21): 3671-3681. DOI:10.1016/S0016-7037(01)00664-0 |
| [12] |
Drever J I, Stillings L L. The role of organic acids in mineral weathering[J]. Colloids & Surfaces A:Physicochemical & Engineering Aspects, 1997, 120(1-3): 167-181. |
| [13] |
Neaman A, Chorover J, Brantley S L. Implications of the evolution of organic acid moieties for basalt weathering over geological time[J]. American Journal of Science, 2013, 305(2): 147-185. |
| [14] |
Perez A, Rossano S, Trcera N, et al. Bioalteration of synthetic Fe (Ⅲ)-, Fe(Ⅱ)-bearing basaltic glasses and Fe-free glass in the presence of the heterotrophic bacteria strain Pseudomonas aeruginosa:Impact of siderophores[J]. Geochimica et Cosmochimica Acta, 2016, 188: 147-162. DOI:10.1016/j.gca.2016.05.028 |
| [15] |
Banfield J F, Barker W W, Welch S A, et al. Biological impact on mineral dissolution:Application of the lichen model to understanding mineral weathering in the rhizosphere[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(7): 3404-3411. DOI:10.1073/pnas.96.7.3404 |
| [16] |
Gadd G M. Geomicrobiology of the built environment[J]. Nature Microbiology, 2017, 2(4): 16275. DOI:10.1038/nmicrobiol.2016.275 |
| [17] |
Yuan L, Huang J, Li X, et al. Biological mobilization of potassium from clay minerals by ectomycorrhizal fungi and eucalypt seedling roots[J]. Plant and Soil, 2004, 262(1-2): 351-361. |
| [18] |
Li Z B, Xu J, Teng H H, et al. Bioleaching of lizardite by magnesium- and nickel-resistant fungal isolate from serpentinite soils-implication for carbon capture and storage[J]. Geomicrobiology Journal, 2015, 32(2): 181-192. DOI:10.1080/01490451.2013.835888 |
| [19] |
连宾, 侯卫国. 真菌在陆地生态系统碳循环中的作用[J]. 第四纪研究, 2011, 31(3): 491-497. Lian Bin, Hou Weiguo. The role of fungi in carbon cycling in forest ecosystem[J]. Quaternary Sciences, 2011, 31(3): 491-497. DOI:10.3969/j.issn.1001-7410.2011.03.12 |
| [20] |
Zou H, Reid M R, Liu Y, et al. Constraints on the origin of historic potassic basalts from Northeast China by U-Th disequilibrium data[J]. Chemical Geology, 2003, 200(1-2): 189-201. DOI:10.1016/S0009-2541(03)00188-8 |
| [21] |
Wu L, Jacobson A D, Chen H C, et al. Characterization of elemental release during microbe-basalt interactions at T=28℃[J]. Geochimica et Cosmochimica Acta, 2007, 71(9): 2224-2239. DOI:10.1016/j.gca.2007.02.017 |
| [22] |
Talbot J J, Houbraken J, Frisvad J C, et al. Discovery of Aspergillus frankstonensis sp. nov. during environmental sampling for animal and human fungal pathogens[J]. PLoS ONE, 2017, 12(8). |
| [23] |
Gudbrandsson S, Wolff-Boenisch D, Gislason S R, et al. An experimental study of crystalline basalt dissolution from 2≤ pH ≤ 11 and temperatures from 5 to 75℃[J]. Geochimica et Cosmochimica Acta, 2011, 75(19): 5496-5509. DOI:10.1016/j.gca.2011.06.035 |
| [24] |
Hausrath E M, Neaman A, Brantley S L. Elemental release rates from dissolving basalt and granite with and without organic ligands[J]. American Journal of Science, 2009, 309(8): 633-660. DOI:10.2475/08.2009.01 |
| [25] |
Gorbushina A A. Life on the rocks[J]. Environmental Microbiology, 2007, 9(7): 1613-1631. DOI:10.1111/j.1462-2920.2007.01301.x |
| [26] |
Büdel B. Ecology and diversity of rock-inhabiting cyanobacteria in tropical regions[J]. European Journal of Phycology, 1999, 34(4): 361-370. DOI:10.1080/09670269910001736422 |
| [27] |
Crispim C A, Gaylarde C C. Cyanobacteria and biodeterioration of cultural heritage:A review[J]. Microbial Ecology, 2005, 49(1): 1-9. |
| [28] |
Friedmann E I. Endolithic microbial life in hot and cold deserts[J]. Origins of Life, 1980, 10(3): 223-235. DOI:10.1007/BF00928400 |
| [29] |
Pennisi E. A lichen ménage à trois[J]. Science, 2016, 353(6297): 337. DOI:10.1126/science.353.6297.337 |
| [30] |
Warscheid T, Braams J. Biodeterioration of stone:A review[J]. International Biodeterioration & Biodegradation, 2000, 46(4): 343-368. |
| [31] |
Drever J I, Stillings L L. The role of organic acids in mineral weathering[J]. Colloids & Surfaces A:Physicochemical & Engineering Aspects, 1997, 120(1-3): 167-181. |
| [32] |
Furrer G, Stumm W. The coordination chemistry of weathering:Ⅰ. Dissolution kinetics of δ-Al2O3 and BeO[J]. Geochimica et Cosmochimica Acta, 1986, 50(9): 1847-1860. DOI:10.1016/0016-7037(86)90243-7 |
| [33] |
Blum A E, Stillings L L. Feldspar dissolution kinetics[C]//White A F, Brantley S L. Chemical Weathering Rates of Silicate Minerals. Reviews in Mineralogy, Chantilly, USA. 1995, 31: 291-352.
|
| [34] |
Liermann L J, Kalinowski B E, Brantley S L, et al. Role of bacterial siderophores in dissolution of hornblende[J]. Geochimica et Cosmochimica Acta, 2000, 64(4): 587-602. DOI:10.1016/S0016-7037(99)00288-4 |
| [35] |
Li Z B, Liu L W, Chen J, et al. Cellular dissolution at hypha- and spore-mineral interfaces revealing unrecognized mechanisms and scales of fungal weathering[J]. Geology, 2016, 44(4): 319-322. DOI:10.1130/G37561.1 |
| [36] |
Torres M A, West A J, Nealson K. Microbial acceleration of olivine dissolution via siderophore production[J]. Procedia Earth & Planetary Science, 2014, 10(10): 118-122. |
| [37] |
Strathmann T J, Myneni S C B. Speciation of aqueous Ni (Ⅱ)-carboxylate and Ni(Ⅱ)- fulvic acid solutions:Combined ATR-FTIR and XAFS analysis[J]. Geochimica et Cosmochimica Acta, 2004, 68(17): 3441-3458. DOI:10.1016/j.gca.2004.01.012 |
| [38] |
Hummel W, Mompean F J, IllemassèNe M, et al. Chemical thermodynamics of compounds and complexes of U, Np, Pu, Am, Tc, Se, Ni, and Zr, with selected organic ligands[J]. Organic Letters, 2005, 14(13): 3376-3379. |
| [39] |
Olsson-Francis K, Simpson A E, Wolff-Boenisch D, et al. The effect of rock composition on cyanobacterial weathering of crystalline basalt and rhyolite[J]. Geobiology, 2012, 10(5): 434-44. DOI:10.1111/gbi.2012.10.issue-5 |
| [40] |
Madejová J, Bujdák J, Janek M, et al. Comparative FT-IR study of structural modifications during acid treatment of dioctahedral smectites and hectorite[J]. Spectrochimica Acta Part A:Molecular & Biomolecular Spectroscopy, 1998, 54(10): 1397-1406. |
| [41] |
Goriely A, Tabor M. Estimates of biomechanical forces in Magnaporthe grisea[J]. Mycological Research, 2006, 110(7): 755. DOI:10.1016/j.mycres.2006.03.014 |
| [42] |
Quarch K, Kind M. Inorganic precipitated silica gel. Part 1:Gelation kinetics and gel properties[J]. Chemical Engineering & Technology, 2010, 33(6): 1034-1039. |
| [43] |
Brantley S L, Olsen A A. Reaction kinetics of primary rock-forming minerals under ambient conditions[M]//Heinrich H H, Turekian K. Treatise on Geochemistry(Second Edition). Boston: Elsevier, 2014: 70-71.
|
| [44] |
Frencis C A, Ribbe P H. The forsterite-tephroite series:Ⅰ. Crystal structure refinements[J]. American Mineralogist, 1980(11-12): 1263-1269. |
| [45] |
Lian B, Wang B, Pan M, et al. Microbial release of potassium from K-bearing minerals by thermophilic fungus Aspergillus fumigatus[J]. Geochimica et Cosmochimica Acta, 2008, 72(1): 87-98. DOI:10.1016/j.gca.2007.10.005 |
| [46] |
Kobayashi M, Sawada A, Tani Y, et al. Acid dissolution of olivines, feldspars and dunite[J]. Water Air & Soil Pollution, 2001, 130(1-4): 757-762. |
| [47] |
Pokrovsky O S, Schott J. Forsterite surface composition in aqueous solutions:A combined potentiometric, electrokinetic, and spectroscopic approach[J]. Geochimica et Cosmochimica Acta, 2000, 64(19): 3299-3312. DOI:10.1016/S0016-7037(00)00435-X |
| [48] |
Derry L A. Fungi, weathering, and the emergence of the animals[J]. Science, 2000, 311(5766): 1386-1387. |
2 The Second Hydrogeology and Engineering Geology Prospecting Institute of Heilongjiang Province, Harbin 150030, Heilongjiang)
Abstract
Fungi play an important role in minerals and rocks weathering and elements release. A variety of fungi are distributed and grown in the soil. However, different fungi species may have different function in the minerals and rocks weathering, as well as elements release process. In order to limit this difference, four fungi (Aspergillus pesudofelis, Aspergillus viridinutans, Aspergillus undagawae and Aspergillus clavatus)were isolated from the basaltic weathered soil, and batch dissolution experiments were designed. The weathering effects of four fungi on basalt under laboratory conditions (28℃, 30 d)were investigated. The dissolution rates and mechanisms of the analytical elements (including Mg, Al, Si, Ca, Ti, Mn, Fe, Ni, and Sr)revealed the differences in basalt weathering caused by the interactions with different species of fungi. The results showed that there were significant differences in the effects of different species on the weathering and elemental dissolution of basalt. Specifically, compared with the inorganic control groups, the growth of A.pseudofelis caused an obvious change in the solution pH, and increased the elemental linear release rate (Ril) significantly. The effects of different fungi species on solution pH and Ril varied greatly, and not all fungi could accelerated basal weathering. For example, after 30 days of reaction, the solution pH of the system with the fungus A.pseudofelis increased by 2.1, and the linear release rate of Mg was 22.5 times that of the inorganic control group. While the solution pH of the system with the fungus A.viridinutans was only increased by 0.1, and the linear release rate of Mg was approximately equal to that of the inorganic control group. The Ril for Mg, Al, Ca and Ti in the solution interacted with A.pseudofelis had the maximum values when the solution pH was the lowest, which indicated that the release behavior of these four elements were controlled by the proton exchange process, whereas the release of Ni and Fe was dominated by fungal metabolized oxalic acid. Our study showed that different fungi species had various capacity to metabolize organic acids and thus affected the release behavior of the elements in basalt. This suggests that those fungi with stronger capacity of metabolizing organic acids (such as oxalic acid)might play a significant role in enhancing the release rate of essential elements to life, such as Fe and Mg during the early stage of rock weathering. 2019, Vol.39
2019, Vol.39

