2 中国科学院南京地理 与湖泊研究所, 湖泊与环境国家重点实验室, 江苏 南京 210008;
3 南京师范大学地理科学学院, 江苏 南京 210023)
增温和持续加强的人类活动干扰是过去一个世纪全球变化的主要特征[1~2],即使是在偏远的高纬地区、高海拔地区,这些我们以往认为很少受到人类活动干扰的地区,其生态环境同样发生了较明显的变化。高山地区远离人类活动的直接干扰,对气候变化的响应非常敏感[3],增温引起的生态效应较其他地区可能更为显著[4~5]。尽管高山地区远离人类活动的直接影响,但由化石燃料燃烧和化肥施用等造成的区域或全球性大气污染[6],通过干湿沉降,也逐渐成为高海拔地区不断增强的环境压力[7~8]。高山湖泊生态系统如何响应与适应全球变化,是否会出现重大转变,已成为学术界关注的热点话题。
气候变化和大气污染沉降会影响高山湖泊理化特征,进而引起湖泊生物群落结构的改变[9~10]。然而,复杂的地质背景、地形地貌、垂直植被和土壤分布等湖泊流域特征,使得高山湖泊生态系统对外部驱动力的响应方式变得更为复杂[11]。最近的研究表明,气候变化和大气沉降对高山湖泊生态环境的影响可能受到了流域地表过程的调节影响[12~14]。气候变化会直接影响流域过程并间接地影响湖泊生态系统的结构与功能,如气温上升和大气氮沉降会直接促进流域植被发育与树线上升[15],同时促进地表微生物活动和元素地球化学循环速率[16],导致流域输入到湖泊中的溶解性有机质(DOM)和颗粒物质含量增加[14],进而影响水体碱度[15]。土壤和流域植被的发育还会增加入湖营养物质和溶解性有机碳(DOC)的含量,而DOC的输入会影响水体光透度、水体热量收支平衡、元素及营养循环[3, 14]。分布在不同海拔和垂直植被带的高山湖泊,在流域地貌形态、土壤发育状况以及植被类型与覆盖度上存在明显差异,在气候变暖和大气沉降输入的背景下,流域变化会对湖泊环境过程产生不同的影响[17]。然而,目前的沉积记录研究主要基于单个高山湖泊加以分析,缺少对特定研究区树线上下多个湖泊现代过程与古生态记录的对比分析。因此,需要我们对树线附近不同海拔的高山湖泊开展相关研究,甄别流域地表过程的异同、海拔梯度效应及其在湖泊生态环境变化模式中的调节作用。
我国西南地区分布着众多的小型淡水高山湖泊,这些湖泊大多属于冰川遗迹湖,海拔高度在3600~4500 m不等,多位于现代树线附近的冷杉林、杜鹃灌丛和高山草甸垂直植被带部位,在更高海拔的山体顶部,仍有一些现代冰川发育,规模通常较小,这些高山湖泊明显受冰川融水补给。这些湖泊普遍具有流域面积小、水体较深、冰封期长、营养水平低、食物网结构简单等特点[12, 18~21]。多样化的气候环境、流域特征和稳定的湖泊沉积记录,使本地区成为研究高山湖泊生物对全球变化不同响应模式和机理的理想地点。目前在该区只有少数的高山湖泊古湖沼研究工作[19~22],利用孢粉、硅藻、色素和枝角类等多古生态指标,揭示了气候变化与大气污染沉降对生态的影响[12, 19~22],并初步探讨了多因子相互作用对生态过程的影响机理。但已有的高山湖泊研究并未关注树线上下不同湖泊中更高营养级生物对过去近两百年来环境变化的响应模式,限制了研究区不同类型高山湖泊的生态变化对比以及区域规律性认识的获得。
枝角类(Cladocera)又简称溞类,水溞,属无脊椎动物,主要分布于淡水水体中,是湖泊食物链上的重要组成部分,是连接初级生产者和次级与高级消费者的关键环节[23~24]。并且由于其分类清晰、化石能较好地保存,可以根据沉积物中枝角类微化石的种类组成、形态和数量等信息推断沉积时的水体环境乃至影响水体的气候环境[23~24]。国外在高山地区的大量研究[25~26]显示,海拔梯度上水体温度、DOC和DOM含量差别显著且影响了枝角类群落结构特征和空间分布模式。位于树线以下(北方森林带)的湖泊中水体DOC和DOM含量明显高于树线以上(如苔原带)的湖泊,不仅为浮游动物提供了食物来源,还能有效地减少水体中的紫外辐射(UV)强度,而有利于枝角类等水生生物的生长[26]。在我国,虽然已有不少湖泊枝角类古生态的研究[27~28],但对高山湖泊枝角类生态与古生态的研究较为薄弱。基于以上分析,本研究选择滇西北高山树线以下的错恰湖和川西高原树线以上受冰融水补给的吉仁错两个湖泊作为研究对象,以沉积枝角类为主要代用指标,并结合硅藻、地球化学指标,重建近200年来湖泊生态变化过程,结合区域温度变化和氮沉降数据,分析气候变化以及大气沉降背景下,树线上下高山湖泊生物群落组成以及其对长期演化过程的响应,获得对树线上下湖泊生态变化模式的认识,为预测未来全球变化情景下高山湖泊生态系统的可能变化趋势提供重要依据。
1 研究区概况错恰湖(27°24′13″N,99°46′18″E)位于云南省迪庆藏族自治州香格里拉县,海拔高度3980 m;吉仁错(29°43′19″N,100°48′56″E)位于四川省甘孜藏族自治州雅江县,海拔高度4480 m(图 1)[22]。两个湖泊均属于冰川遗迹湖,湖泊最大水深均在27 m左右,营养水平均很低(表 1)。两个湖泊面积都很小,但吉仁错流域面积以及流域/湖泊面积比明显高于错恰湖。吉仁错位于川西高原树线以上,流域覆盖有稀疏的矮化高山杜鹃(Rhododendron lapponicum)灌丛,而错恰湖位于滇西北高山树线以下,完全被冷杉林和高山杜鹃林所包围。吉仁错水体清澈,透明度达到8.5 m,而错恰湖水色呈酱褐色,透明度明显较低(3.7 m);吉仁错水体呈弱碱性(pH 7.4),略低于错恰湖(pH 8.8)。吉仁错除受降水补给外,还接纳流域冰川和积雪融水补给,而错恰湖流域无冰川补给,主要受降水和积雪融水补给。两个湖泊流域没有直接的人类活动迹象。
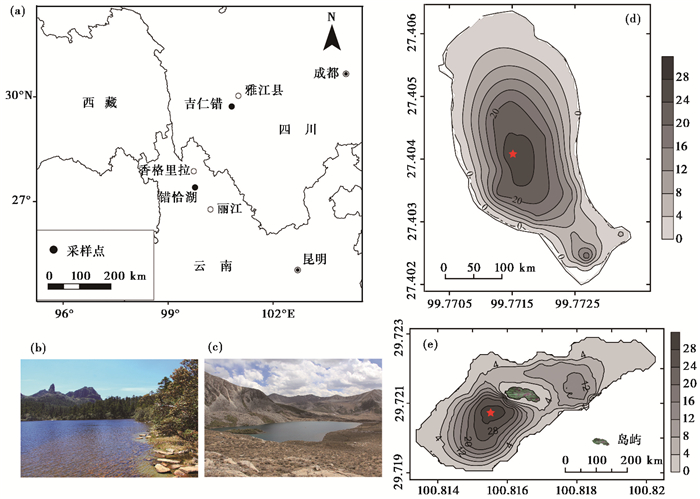
|
图 1 1湖泊地理位置(a),错恰湖(b)和吉仁错(c)流域概况,错恰湖(d)和吉仁错(e)等深图及采样点位置 Fig. 1 Location (a) of study sites, catchment and lake morphometry as well as location of sampling sediment core of Cuoqia Lake(b, d)and Jiren Lake(c, e) |
两个湖泊位于我国西南地区,受西南季风和南支西风的影响。冬半年(11~4月),气候偏冷干;夏半年(5~10月)季风降水充沛。据吉仁错附近气象站点(理塘,海拔3949 m;距吉仁错39 km)近55年来的温度和降水气象数据(数据来源于国家气候中心http://ncc.cma.gov.cn/cn/)显示,6~8月温度最高,12月至次年2月温度最低。理塘气象站点年均降雨量为730 mm,大多集中在5~9月,占全年总降雨量的89 %[22]。
2 采样与方法 2.1 样品采集2012年10月利用UWITEC重力采样器(直径60 mm)在错恰湖湖心处采集了一根长度为48 cm的沉积柱,现场按1 cm间隔进行分样,样品保存在自封袋中放于4 ℃的冰箱中冷藏以备分析;2014年5月在吉仁错湖心处利用Hon-Kajak大口径(直径90 mm)重力采样器采集了一根长度为38 cm的沉积柱,现场按0.5 cm间隔进行分样,同样在4 ℃的冰箱中冷藏以备分析。本文只分析错恰湖钻孔31 cm以上和吉仁错钻孔28.5 cm以上的样品。采样时均在现场利用YSI6600多参数水质仪对两个湖泊水深、溶解氧(DO)、pH值、电导率、浊度和叶绿素a指标进行了测量,利用塞氏(secchi)透明度盘测量水体透明度,并采集表层水样用于湖水总磷(TP)和总氮(TN)浓度分析。测试的水环境数据见表 1。
2.2 实验室分析实验室内,采用美国EG&G Ortec公司生产的高纯锗井型探测器(HPGe GwL - 120-15)进行210Pb和137Cs测定,用Constant Rate of Supply(CRS)模式结合1963年峰值时标的复合模式方法建立钻孔沉积年代序列[29~31]。总有机碳(TOC)浓度用重铬酸钾容量法(外加热法)测定;TN浓度用重铬酸钾硫酸消化凯氏法测定;沉积物氮同位素(δ15N)在Deltaplus质谱仪上进行测定;金属元素Ti含量采用全谱直读等离子体发射光谱仪(ICP- MS)测定。沉积物烧失量(LOI)是指在特定的高温条件下,样品损失的质量占总质量的百分比。其主要实验步骤为:称取约0.5 g干样于坩埚钳中,放入马弗炉内在550 ℃温度条件下连续灼烧4 h,待冷却到室温后,取出称量剩余样品重量并计算样品烧失量含量。
硅藻样品依据标准方法[32]进行处理。取约0.2 g沉积物,先用10 %盐酸去钙质胶结物,再用双氧水去有机质,离心清洗制片。硅藻种属鉴定参照Krammer和Lange-Bertalot的分类系统[33]。依据硅藻保存情况,每个样品的硅藻统计数控制在400粒以上,属种丰度用百分含量(%)、浓度(cell/g)和通量(单位为cell/(cm2·a))这3种方式表达。
枝角类样品处理方法根据Szeroczyńska和Sarmaja-Korjonen[34]的描述。称取3~5 g样品加入100 ml 10 %的KOH溶液浸泡并在60 ℃电热板上加热1 h,以去除有机质。样品清洗后,用38 μm的滤网进行过滤,然后将滤网上的残留物收集到离心管中并在4 ℃冰箱中冷藏12 h,吸取上清液后加入1滴甲醛固定,加入1~2滴番红试剂进行染色并定容到2 ml。提取定量的处理好的样品,在光学显微镜(放大200倍)下进行种类鉴定。每个样品中的统计数都达到200个以上,以减小数据统计的误差。统计时把所有化石残体(头壳、壳瓣、后腹部、尾爪、卵鞍)都进行统计,选择数量最丰富的片断进行计数来代表枝角类个体数。枝角类化石的分类鉴定主要参考Szeroczyńska和Sarmaja-Korjonen[34]、蒋燮治和堵南山[35]的图谱进行。统计出的枝角类用相对丰度(%)和沉积通量(单位为g/(cm2·a))两种方式表达。
以上所有指标均在中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室测试完成。
2.3 区域气象数据收集研究区最近50多年来的温度变化数据取自理塘县(海拔3949 m)和丽江市(海拔2394 m)气象监测站(来源于国家气候中心http://ncc.cma.gov.cn/cn/)。根据理塘县和丽江市分别自1952年和1960年以来的气象数据,利用ECOH-G千年长积分模型重建了过去1000年两地的年均温度变化[21],截取近200年来的温度数据作为本研究的历史气候数据。区域大气氮沉降数据取自已发表的喜马拉雅山冰芯记录提取的硝酸盐(NO3-)浓度变化序列[36]。
2.4 数据分析根据枝角类数据的降维对应分析结果判识,选择主成分分析(PCA)和冗余分析(RDA)来提取钻孔枝角类群落变化的动态信息。其中PCA分析(只有枝角类相对丰度数据)用于测试枝角类生态变化趋势;RDA分析(同时包括枝角类丰度数据和环境指标数据)用于测试环境因子与枝角类组合之间的关系,采用蒙特卡罗置换检验每个有效环境变量的显著性。RDA分析中,以枝角类数据作为响应变量,环境指标(TN、TOC、C/N、δ15N、TP和温度数据)和硅藻(优势属种相度丰度、硅藻浓度和通量)作为解释变量。在上述排序分析中选择至少在两个样品中出现、至少在一个样品中含量超过1 %的枝角类属种。所有排序分析均在CANOCO 4.5软件中运行[37]。
3 研究结果 3.1 钻孔年代错恰湖沉积钻孔中137Cs比活度峰值(367.9±18.7 Bq/kg)出现在7 cm深度(图 2a),对应于1963年的散落高峰期。137Cs是一种人工核素,由核试验产生,在北半球各地1963年的137Cs沉降量最大,可以用137Cs最大峰值做为时标来校验CRS模式年代结果[30]。本研究中由于采用CRS模式计算得到的1963年的深度与137Cs峰值不能对应,故对该钻孔采用混合模式,即用137Cs时标对CRS模式进行校正以建立深度-年代关系[31]。由于测定的210Pbex活度在25 cm以下较低,根据18~24 cm段的平均沉积速率来推算25 cm深度以下的沉积物年代。根据沉积物通量(DMAR)计算,沉积岩芯的平均沉积通量为0.012 g/(cm2·a),1899 A.D.之前(32~19 cm)沉积通量很低,约为0.010 g/(cm2·a),之后在1899~1953 A.D.之间(18~7 cm)出现波动上升,约为0.016 g/(cm2·a),从1953 A.D.(7~0 cm)开始出现明显下降,约为0.007 g/(cm2·a)。因此,推测错恰湖钻孔在31 cm处约1800 A.D.。
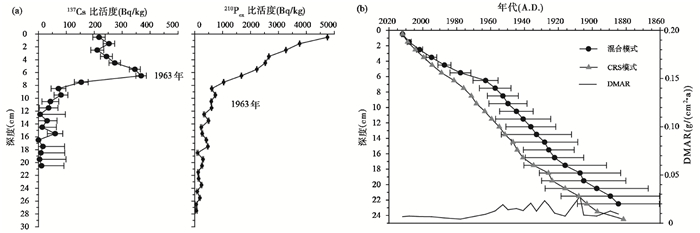
|
图 2 错恰湖钻孔137Cs和210Pbex比活度变化(a),年代-深度序列和沉积通量(b) Fig. 2 The variation of137Cs and210Pbex activities from the sediment core in Cuoqia Lake (a), as well as the age-depth model with sediment accumulation rates(DMAR) (b) |
吉仁错年代结果序列已发表[22],由于采用CRS模式计算得到的1963年的深度与137Cs峰值不能对应,同样采用混合模式对CRS模式进行校正以建立深度-年代关系。吉仁错沉积岩芯的平均沉积通量为0.031 g/(cm2·a),1900 A.D.之前(22.5~18.0 cm)沉积通量很低,约为0.010 g/(cm2·a),之后明显上升,约为0.035 g/(cm2·a)。因此,推测仁错钻孔在28.5 cm处为约1800 A.D.。
3.2 两个湖泊生物化石沉积记录错恰湖沉积钻孔中共鉴定出枝角类19个种,隶属于10属,优势种是浮游种长刺溞(Daphnia longispina)和沿岸种虱形大眼溞(Polyphemus pediculus),其中D. longispina相对丰度在54 % ~89 %之间,其他一些沿岸种如美丽尖额溞(Alona affinis)、点滴尖额溞(Alona guttata)、中型尖额溞(Alona intermedia)以及兼浮游种圆形盘肠溞(Chydorus sphaericus)较为常见,但相对丰度较低(平均小于10 %)。整个钻孔序列中,枝角类组合以D. longispina和P. pediculus相对丰度互有增减为主要特征,其他属种枝角类变化不明显(图 3a)。
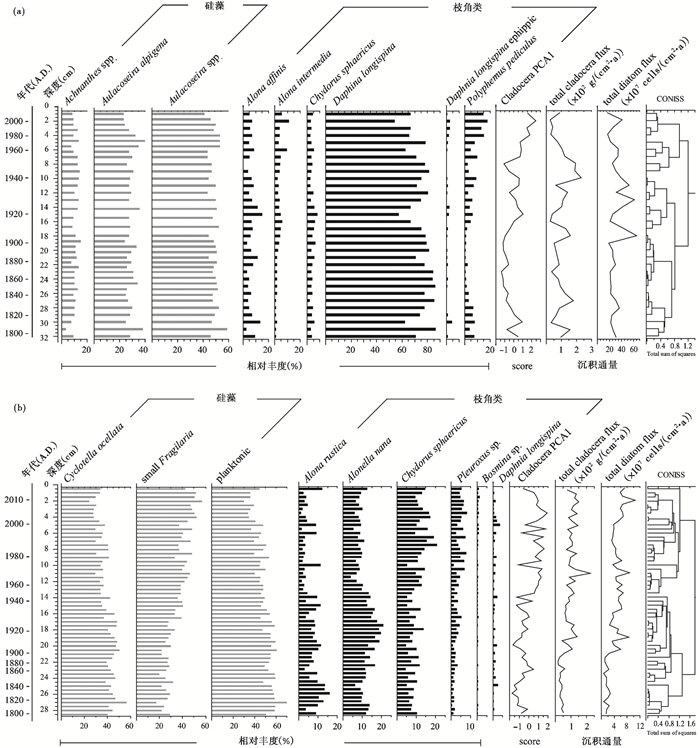
|
图 3 错恰湖(a)和吉仁错(b)钻孔中主要的硅藻(灰色)和枝角类(黑色)化石属种组合,以及枝角类组合的聚类分析结果 Fig. 3 The diagrams of community and sedimentary flux changes of cladoceran and diatom from Cuoqia Lake (a) and Jiren Lake (b), as well as the CONISS results according cladoceran composition |
吉仁错钻孔沉积物中共鉴定枝角类12个种[22],隶属于7属,优势种是沿岸种(总含量> 98 %),包括A. guttata、矩形尖额溞(Alona rectangula)、A. affinis、肋形尖额溞(Alona costata)、Alona rustica、方形尖额溞(Alona quadrangularis)、矮小税额溞(Alonella nana)、镰形顶冠溞(Acroperus harpae)、三角平直溞(Pleuroxus trigonellus)和C.sphaericus;浮游种仅有少量记录,包括D.longispina和象鼻溞(Bosmina sp.)。整个钻孔序列中,枝角类组合以P.trigonellus、C.sphaericus和A. costata相对丰度增加而A. rustica和A. nana相对丰度显著下降为主要特征(图 3b)。
错恰湖沉积钻孔中硅藻优势种为舟形藻属(Navicula)及曲壳藻属(Achnanthes),而后者又以高山直链藻(Aulacoseira alpigena)为主;总体上,硅藻属种组合变化不明显,浮游种与底栖种相对丰度持平,呈现略有消长的关系(图 3a)。吉仁错钻孔沉积硅藻优势种为浮游种眼斑小环藻(Cyclotella ocellata)和小型的脆杆藻属(Fragilaria)。1910 A.D.前C. ocellata含量高,此后呈逐渐下降趋势,而小型Fragilaria的含量则开始上升,1945 A.D.以来小型Fragilaria的增多和C. ocellata的降低趋势更为明显,总体上C. ocellata与小型Fragilaria类型的含量呈现互为消长的关系(图 3b)。
3.3 其他沉积指标与区域气候环境指标图 4列举了两个湖泊沉积钻孔主要地球化学指标以及重建的区域温度和指示大气氮沉降的硝酸盐指标的变化。
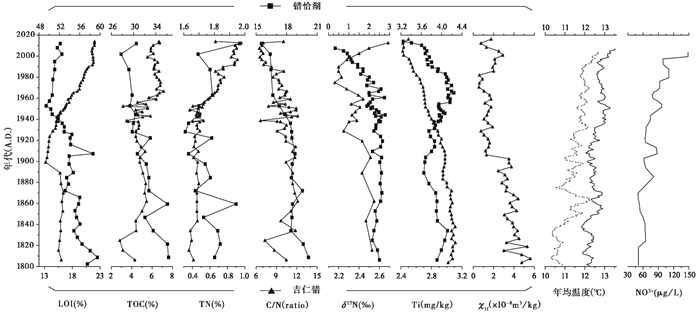
|
图 4 两个湖泊地球化学指标、喜马拉雅冰芯[36]中的NO3-含量以及重建的区域温度变化对比图 错恰湖各指标X坐标轴位于图表上方,吉仁错各指标X坐标轴位于图表下方;温度曲线中实线为重建的丽江年均温度,虚线为重建的理塘县温度序列 Fig. 4 Comparisons of geochemistry proxies(LOI, TOC, TN, C/N, δ15N, Ti and χlf) from Jiren Lake and Cuoqia Lake respectively, and NO3-concentration from Himalayan ice core[36], as well as reconstructed annual temperature from Lijiang City(solid line)and Litang County(dotted line). It should be noted that the X axis of each proxies from Cuoqia Lake are located above the plots, and for Jiren Lake are located below the plots |
错恰湖钻孔中LOI、TOC和TN含量在1950s之前整体上呈波动下降趋势,之后3个指标变化趋势出现差别,其中LOI含量在1950s后有缓慢上升,TOC则持续下降,而TN含量在1950s后出现波动上升并且上升幅度较为明显;C/N比值整体呈下降趋势;δ15N值在1940s之前较为平稳,之后出现明显波动下降;金属元素Ti含量在1910s之前略有下降,之后出现较明显上升并在1970s左右达到最大值,然后再次出现较明显下降。吉仁错沉积钻孔中LOI在1890s之前较为稳定,在1890s出现较明显下降后逐渐上升;TOC和TN含量在1840s之前呈上升趋势,在1840s至1930s处于较平稳期,之后出现快速上升;C/N比值在1860s之前呈上升趋势,之后整体出现波动下降;δ15N值在1990s之前呈波动下降,之后有明显上升;金属元素Ti含量整体呈下降趋势;而磁化率(χlf)在1980s之前呈波动下降,之后有所上升。
重建的温度结果显示,四川理塘县和云南丽江市两地近200年来的温度变化趋势较为一致,1800s~ 1850s年均温明显偏低,1850s之后温度开始明显上升,进入20世纪温度总体呈波动上升趋势。喜马拉雅冰芯中NO3-浓度自1880s以来呈上升趋势,1950s后进一步上升[36]。
3.4 枝角类和环境数据的RDA分析错恰湖RDA第一轴和第二轴共解释了42.4 %的枝角类变率,经过蒙特卡罗检验后进一步提取出硝酸盐含量和硅藻浓度两个显著因子(p < 0.05),它们分别独立解释了24.1 %和3.1 %的变率。从双轴图中可以看出(图 5),1800~1910 A.D.的样点排列在第一轴负方向,1910~1945 A.D.的样点处于第二轴的负方向与硅藻浓度变化的方向对应;1945 A.D.以来的样品主要分布在第一轴的正方向,与硝酸盐含量的增加相对应。
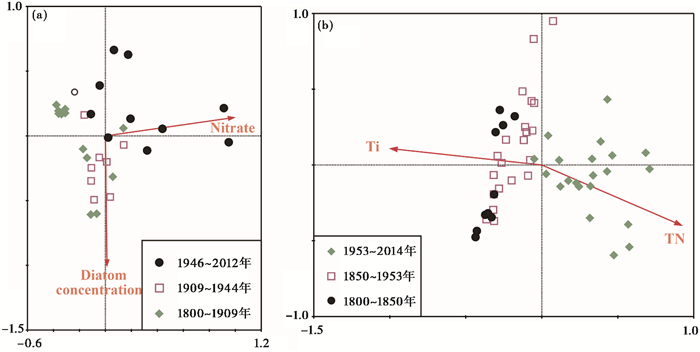
|
图 5 错恰湖(a)和吉仁错(b)枝角类群落变化冗余分析(RDA)双轴图 Fig. 5 The biplot of redundancy analysis of cladocera composition from two lakes |
吉仁错RDA第一轴和第二轴共解释了36.0 %的枝角类变率,经过蒙特卡罗检验后进一步提取出TN和Ti两个显著因子(p < 0.05),它们分别独立解释了15.5 %和17.6 %的变率。从双轴图中可以看出,1950 A.D.前的样点排列在第一轴负方向,与Ti含量的增加和TN变量增加的反方向相对应,1950~2014 A.D.的样品主要分布在第一轴的正方向,与TN的增加相对应。枝角类丰度的样点排列与组合带的划分吻合。
4 讨论 4.1 两个湖泊枝角类群落组合对比分析吉仁错中枝角类以沿岸种为优势种,浮游种含量很低,仅不到1 %。C.sphaericus、A.harpae、A.affinis、A.quadrangularis、A.guttata、A.rectangula等属种都是常见的耐冷种[38],常分布在高海拔和高纬地区湖泊中;而位于森林带中的错恰湖枝角类主要以大个体的浮游种D. longispina为绝对优势种,相对丰度平均超过70 %。已有研究显示,大个体浮游种枝角类D. longispina主要生活在敞水区,对温度变化敏感,受生长期时间长短和食物多少影响明显[39~40],在营养水平较高的湖泊中有大量分布[41]。然而本研究中两个湖泊营养水平均很低,TN和TP含量无明显差别,但海拔和水体透明度差别较明显。错恰湖海拔较低,年均温度相对于吉仁错约高3 ℃,另外吉仁错流域冰川覆盖,在生长期冰雪融水注入还会进一步降低水体温度。Slemmons等[42]通过对比研究认为阿拉斯加山地冰川融水补给的湖泊,平均水温甚至较无冰川融水补给的湖泊还要低2 ℃以上。由此,我们认为错恰湖较高的水体温度和相对较长的生长期是D. longispina的大量生长的主要原因之一。在贫营养的高山湖泊中,食物可获得量也是影响枝角类群落结构的主要因素[43]。有研究发现,在高山湖泊中有机碎屑是浮游动物的主要食物来源之一,其在枝角类食物构成中的比例甚至可以达到80 %左右[44]。错恰湖流域全为森林所覆盖,从流域输入的有机质含量明显高于吉仁错,因而能为浮游种枝角类提供相对较多的食物。此外,高海拔地区紫外辐射通常较强,不利于浮游动物的生长。有研究显示,DOC含量超过2 mg/L即能有效减少入湖紫外辐射[40, 45]。错恰湖从流域来的DOM和DOC含量高,DOC含量为3.74 mg/L,从而使水体颜色较深并能有效地降低水体紫外辐射,能为浮游种枝角类提供有利的生境条件,有利于浮游种枝角类D.longispina在敞水区的生长;而吉仁错透明度较高,水色较浅,DOC含量值仅为0.41 mg/L(见表 1),推测该湖水下紫外辐射强度较高,不利于敞水区浮游种枝角类的生长。
4.2 地化指标揭示的两个湖泊过去两百年来环境变化过程高山湖泊常年处于低温环境中,通常具有面积小、营养水平低的特点,其营养物质主要来源于流域,流域面积和植被类型往往成为决定湖泊营养水平的主要因素[5]。错恰湖LOI和TOC含量明显高于吉仁错(见图 4),分析主要是因为错恰湖被森林包围,植物残体会通过雨水冲刷而被带到湖泊中,而吉仁错尽管湖泊流域面积较大,但流域植被并不发育,因而湖泊有机质含量相对较低。两个湖泊C/N比值均呈下降趋势,指示湖泊内源初级生产力水平上升[46~47]。此外,错恰湖钻孔中TOC和LOI含量整体呈下降趋势,C/N比值大于10且呈持续下降趋势(见图 4),表明该湖有机碳以外源输入为主但内源生产力不断上升而外源输入不断减少。Ti通常被用来指示流域土壤侵蚀过程,Ti下降通常意味着流域植被发育,流域侵蚀能力下降[48]。错恰湖中Ti在1900s以前略有下降,可能指示小冰期(LIA)结束后流域植被的发育过程,而1900s之后Ti含量的上升推测可能与流域人类活动(如砍伐植被或季节性放牧)有关,1960s后Ti含量出现明显下降则可能反映了近几十年来气候明显变暖引起流域植被发育,流域侵蚀力进一步下降。由此推断:尽管近两百年来错恰湖初级生产力水平上升,但从流域输入的有机质含量下降非常明显,导致近两百年该湖泊有机质含量逐渐下降,这一过程可能与流域植被发育并逐步趋于稳定导致从流域输入的有机质含量不断下降有关。流域植被的发育不仅可能与增温有关,还可能与流域营养补充有关,错恰湖中δ15N在1940s以来出现较为明显的下降(见图 4),而δ15N比值下降通常被用来指示大气氮沉降过程[12, 48],由此推测1960s以来区域大气氮沉降尤其是活性氮的输入促进了流域植被的发育,进而降低了流域侵蚀过程,可能是影响Ti含量下降的因素之一。
4.3 两个湖泊近两百年来生物群落演化过程分析错恰湖沉积钻孔中枝角类组合一直以浮游种D.longispina和沿岸种P.pediculus、A.affinis、A.intermedia以及兼浮游种C.sphaericus种类组成为主。枝角类群落的变化主要是D.longispina和P.pediculus相对丰度的交替增减(见图 3a)。根据枝角类个体生态学的特点可知,这些属种能在高纬地区湖泊和温带高山湖泊中生活,在生长期较长、食物相对充足的湖泊中能大量生长[38, 41, 44, 49],说明过去200年来错恰湖水体温度相对较高,可获得的食物量也相对较为充足。P. pediculus为大个体的肉食性枝角类,会捕食其他枝角类[50],有研究显示D.longispina个体较大且主要生活在敞水区,因而容易被鱼类和其他捕食者所捕食[51],捕食压力增加还会引起Daphnia spp.产生休眠卵,进入滞育状态[23]。图 3a中,D.longispina的休眠卵在1820年代左右、1930年代左右和2000年以来分别出现3次较明显增多,对应P.pediculus相对丰度较高的3个时期。由此我们推测P.pediculus与D.longispina相对丰度的交替变化指示两者之间存在捕食与被捕食的关系。吉仁错沉积钻孔枝角类组合一直以沿岸种Alona、Acroperus和兼浮游的Chydorus种类组成为主,浮游种不发育(见图 3b)。整体变化主要为喜好偏酸性环境的A.guttata和A.rustica逐渐下降和喜好较暖水体的C.sphaericus及A.harpae的上升。反映区域气候变暖一方面促进了喜好较暖水体属种的生长,另一方面引起流域冰川加速融化,冰融水携带从流域来的碱性溶解物质引起了湖泊pH值的变化,进而影响了枝角类群落[22]。
错恰湖硅藻群落变化不明显,浮游种Achnanthes spp.相对丰度略有波动,在1970s以来出现较明显上升,至1980s后逐渐下降。在北美、欧洲的大量研究显示,气候变暖引起浮游种硅藻相对丰度出现明显上升[52~53]。而本研究中两个湖泊硅藻群落并未表现出类似的变化趋势,尤其是吉仁错浮游硅藻相对丰度反而出现较明显下降趋势,表现为喜碱性底栖小型硅藻Fragilaria相对丰度出现持续增加,分析主要是受到了水体pH上升的影响,气候变暖引起流域有机质和碱性物质输入增加,通过冰融水等径流进入湖泊,导致湖泊碱化进而明显地影响pH值[22]。同样,在北美3个高山湖泊的研究[15]发现,受水体碱度上升的影响近百年来湖泊中喜碱性硅藻Fragilaria相对丰度明显上升,与本文研究结果一致。
4.4 两个湖泊生物群落对近两百年来环境变化响应特征对比分析RDA分析结果显示(图 5),指示区域大气沉降水平的硝酸盐含量和硅藻浓度是影响错恰湖枝角类群落变化的主要环境因子。错恰湖中δ15N在1950s以来出现明显下降,而TN含量也出现较明显的上升趋势,湖泊营养水平出现上升,指示大气沉降也是高山湖泊营养水平上升的影响因素之一,可能会通过上行效应影响湖泊生物群落结构。错恰湖中环境指标TOC和TN含量在过去两百年呈下降趋势(见图 4),指示从流域输入的外源有机质含量逐渐下降,而优势种枝角类D. longispina的相对丰度并未出现相应的下降趋势(见图 3a),此外,虽然硅藻和枝角类沉积通量在1900s之前较低,但之后出现明显波动并于1970s以来明显下降,并未表现出与大气氮沉降有明显的相关性。D. longispina主要生活在敞水区[51],在贫营养的高山湖泊中,食物资源通常比较匮乏,据此推测,在贫营养的错恰湖内源生产力的上升(藻类的生长)也是维持该湖较高浮游枝角类的主要因素之一。吉仁错中硅藻和枝角类沉积通量在过去100年来均出现阶段性上升趋势(见图 3b),而RDA结果显示吉仁错枝角类群落变化与TN含量和反映流域侵蚀特征的Ti有较显著的相关性,指示湖泊初级生产力水平和流域物质的输入影响了枝角类群落变化[22]。推断过去100年来区域大气氮沉降以及外源营养物质的输入引起藻类生物量上升,进而通过上行效应促进了枝角类生物量的提高。
尽管已有不少重建的温度序列都显示区域近两百年来气候出现变暖[12, 54~55],尤其是1970年代以来,上升趋势更加明显,但数理统计结果显示温度变化并不是错恰湖枝角类群落变化的主要影响因子。在青藏高原地区的研究[56]发现,相较于植被茂密的地区,植被稀疏的地区温度表现出较大的变化幅度。茂密的植被和增加的降水会增加区域云量并降低太阳辐射量,进而对气候变暖起到缓冲作用。错恰湖流域稠密的云杉林和杜鹃林能够减缓气候变暖,降低了气候变暖对生物群落的影响。此外,Pepin和Lundquist[4]认为海拔梯度上,位于0 ℃等温线附近的区域升温最明显,该范围带的冰雪融水影响地表反照率进而导致进一步升温。理塘县1952年以来的监测数据显示该地年均气温为3.27 ℃,根据海拔梯度效应推算出吉仁错年均气温约为0.1~0.3 ℃;丽江市1960年以来的监测数据显示该地年均气温为13.76 ℃,推算可知错恰湖年均气温约为2.8~3.4 ℃。根据冰冻圈效应理论[4],过去两百年来吉仁错温度变化应更加明显,升温对生物群落的影响也相应更为重要,温度的变化可能通过间接的方式,比如冰雪融水输入[22],影响了枝角类和硅藻群落的变化。
两个湖泊硅藻群落变化有较明显差异,错恰湖变化不明显,而吉仁错中硅藻群落变化较明显,这种变化趋势与两个湖泊中枝角类群落变化特征相一致。反映过去两百年来气候变化和大气营养物质的输入对树线以上湖泊生物群落结构的影响要比树线以下湖泊显著。这一现象在区域其他湖泊中同样存在,如Wischnewski等[20, 57]在藏东南林芝地区的LC6湖和川西伍须海两个树线以下湖泊的调查显示,近两百年来这些湖泊中硅藻群落仅出现较微弱的变化,分析可能是因为流域植被发育以及云量的增多减缓了区域温度上升,另外也可能跟冰雪融水间接抵消了气候变暖的影响和湖泊形态特征(如夏季水体不分层)有关;Hu等[12]对青藏高原东南缘9个高山湖泊硅藻记录的对比研究显示,尽管硅藻群落变率并不显著,但湖泊容量、面积、海拔和DOC含量是这些湖泊硅藻群落变率出现截然相反变化的主要因素。另外,对比两个湖泊沉积钻孔中两种生物门类指标的变化过程发现,两个湖泊中的枝角类群落均有较明显变化,而硅藻群落方面,错恰湖变化并不明显,只有吉仁错中硅藻群落出现较明显变化。分析可能是因为浮游植物受气候变化和湖泊内部物理特征影响,而浮游动物群落不仅受区域气候环境变化和外源营养物质输入的影响,还受到湖泊内部种间捕食和竞争压力的影响。
5 结论两个贫营养湖泊中枝角类群落组成有明显差异,位于较高海拔的吉仁错以沿岸种枝角类为主,而位于树线以下的错恰湖则以浮游种D. longispina为绝对的单一优势种。分析主要是因为两个湖泊海拔梯度原因引起的温度差异和从流域输入的有机质含量差异引起的。对于错恰湖来说,一方面该湖较高的水体温度和相对较长的生长期有利于D. longispina的大量生长,另一方面错恰湖流域全为森林所覆盖,从流域输入的有机质含量明显高于吉仁错,不仅能为枝角类提供食物来源,还能降低湖泊水体透明度而有效地降低水体紫外辐射强度,从而有利于浮游枝角类的生长。而吉仁错海拔高、水温低、生长期短,且从流域输入的有机质含量少,这些因素可能是浮游种枝角类较少的主要原因。
过去两百年来,较高海拔的吉仁错中枝角类群落的变化特征为喜好偏酸性环境的属种A.guttata和A.rustica相对丰度逐渐下降并伴随着喜好较暖水体的C.sphaericus及A.harpae相对丰度的上升,硅藻群落的变化表现为喜碱性环境的底栖小型硅藻Fragilaria相对丰度持续增加而浮游硅藻相对丰度出现较明显下降,分析认为主要是由于大气沉降和气候变化引起的冰融水输入,增加了湖泊营养水平和改变了水体碱度而导致的。位于树线以下被森林包围的错恰湖硅藻群落较为稳定,没有发生明显的变化,枝角类组合出现浮游种D.longispina和食肉性沿岸种P.pediculus相对丰度交替增减的变化,分析主要是枝角类群落内两个属种间捕食与被捕食关系引起的。尽管数理统计结果显示气候变化并没有对两个湖泊枝角类群落有显著影响,但高海拔的吉仁错枝角类和硅藻群落变化相对更明显,分析可能与气候变化的间接影响有关。两个湖泊自身理化环境和流域特征差异可能影响了湖泊生态环境的演化过程和生物群落的响应模式。错恰湖流域覆盖有森林而对气候变化有缓冲作用,气候变化并没有引起生物群落结构发生明显变化,枝角类群落的变化主要受种间捕食作用影响,而吉仁错海拔较高、流域植被不发育,不仅受大气沉降影响,还因受冰雪融水作用的影响而对气候变化更为敏感,气候变暖不仅促进了喜暖水环境枝角类的增多,还通过冰融水输入而影响了水体pH值,进而引起了喜碱性枝角类和硅藻的增多。
致谢: 英国拉夫堡大学John Anderson教授和中国科学院南京地理与湖泊研究所赵成研究员协助野外采样;中国科学院南京地理与湖泊研究所夏威岚老师、朱育新老师、刘一兰老师分别提供了放射性测年结果、金属元素、氮同位素及总有机碳结果。两位评审专家和编缉部杨美芳老师对本文提出了许多宝贵的修改意见。在此一并感谢!
| [1] |
IPCC, Climate change 2013: The Physical Science Basis[M]. Cambridge, UK, and New York: Cambridge University Press, 2014: 1-9.
|
| [2] |
王绍武. 全球气候变暖与未来发展趋势[J]. 第四纪研究, 1991(3): 269-276. Wang Shaowu. Global climate warming and its trend in the future[J]. Quaternary Sciences, 1991(3): 269-276. |
| [3] |
Williamson C E, Saros J E, Schindler D E. Sentinels of change[J]. Science, 2009, 323(5916): 887-888. DOI:10.1126/science.1169443 |
| [4] |
Pepin N C, Lundquist J D. Temperature trends at high elevations:Patterns across the globe[J]. Geophysical Research Letters, 2008, 35(14): 330-337. |
| [5] |
Battarbee R W, Kernan M, Rose N. Threatened and stressed mountain lakes of Europe:Assessment and progress[J]. Aquatic Ecosystem Health & Management, 2009, 12(2): 118-128. |
| [6] |
Galloway J N, Cowling E B. Reactive nitrogen and the world:200 years of change[J]. Ambio, 2002, 31(2): 64-71. DOI:10.1579/0044-7447-31.2.64 |
| [7] |
Hu Z, Anderson N J, Yang X, et al. Catchment-mediated atmospheric nitrogen deposition drives ecological change in two alpine lakes in SE Tibet[J]. Global Change Biology, 2014, 20(5): 1614-1628. DOI:10.1111/gcb.2014.20.issue-5 |
| [8] |
Liu X, Zhang Y, Han W, et al. Enhanced nitrogen deposition over China[J]. Nature, 2013, 494(7438): 459-462. DOI:10.1038/nature11917 |
| [9] |
Catalan J, Pla-Rabés S, Wolfe A P, et al. Global change revealed by palaeolimnological records from remote lakes:A review[J]. Journal of Paleolimnology, 2013, 49(3): 513-535. DOI:10.1007/s10933-013-9681-2 |
| [10] |
Hood E W, Williams M W, Caine N. Landscape controls on organic and inorganic nitrogen leaching across an alpine/subalpine ecotone, Green Lakes Valley, Colorado front range[J]. Ecosystems, 2003, 6(1): 0031-0045. DOI:10.1007/s10021-002-0175-8 |
| [11] |
Myers N, Mittermeier R A, Mittermeier C G, et al. Biodiversity hotspots for conservation priorities[J]. Nature, 2000, 403(6772): 853-858. DOI:10.1038/35002501 |
| [12] |
Hu Z, Yang X, Anderson N J, et al. The landscape-atmosphere continuum determines ecological change in alpine lakes of SE Tibet[J]. Ecosystems, 2017. |
| [13] |
Saros J E, Rose K C, Clow D W, et al. Melting alpine glaciers enrich high-elevation lakes with reactive nitrogen[J]. Environmental Science & Technology, 2010, 44(13): 1480-1494. |
| [14] |
Fritz S C, Anderson N J. The relative influences of climate and catchment processes on Holocene lake development in glaciated regions[J]. Journal of Paleolimnology, 2013, 49(3): 349-362. DOI:10.1007/s10933-013-9684-z |
| [15] |
Karst-riddoch T L, Pisaric M F J, Smol J P. Diatom responses to 20th century climate-related environmental changes in high-elevation mountain lakes of the northern Canadian Cordillera[J]. Journal of Paleolimnology, 2005, 33(3): 265-282. DOI:10.1007/s10933-004-5334-9 |
| [16] |
Rogora M, Mosello R, Arisci S. The effect of climate warming on the hydrochemistry of alpine lakes[J]. Water, Air and Soil Pollution, 2003, 148(1-4): 347-361. |
| [17] |
Larsen I J, Almond P C, Eger A, et al. Rapid soil production and weathering in the Southern Alps, New Zealand[J]. Science, 2014, 343(6171): 637-640. DOI:10.1126/science.1244908 |
| [18] |
羊向东, 王苏民, 童国榜, 等. 云南鹤庆古湖晚更新世的孢粉记录及其古气候学意义[J]. 第四纪研究, 1998(4): 335-343. Yang Xiangdong, Wang Sumin, Tong Guobang, et al. The Late Pleistocene pollen record in the lake sediments from ancient Heqing Lake and its significance for palaeoclimate[J]. Quaternary Sciences, 1998(4): 335-343. |
| [19] |
韩艳, 肖霞云, 羊向东, 等. 全新世以来滇西北地区天才湖粒度特征及古降水[J]. 第四纪研究, 2011, 31(6): 999-1010. Han Yan, Xiao Xiayun, Yang Xiangdong, et al. The grain size characteristics of Tiancai Lake in northwestern of Yunnan Province and paleo-precipitation history during the Holocene[J]. Quaternary Sciences, 2011, 31(6): 999-1010. |
| [20] |
Wischnewski J, Mackay A W, Appleby P G, et al. Modest diatom responses to regional warming on the southeast Tibetan Plateau during the last two centuries[J]. Journal of Paleolimnology, 2011, 46(2): 215-227. DOI:10.1007/s10933-011-9533-x |
| [21] |
Kong L, Yang X, Kattel G, et al. The response of Cladocerans to recent environmental forcing in an alpine lake on the SE Tibetan Plateau[J]. Hydrobiologia, 2016, 784(1): 1-15. |
| [22] |
孔令阳, 羊向东, 王倩. 高山湖泊吉仁错枝角类古生态变化及其对气候环境的响应[J]. 湖泊科学, 2017, 29(3): 730-739. Kong Lingyang, Yang Xiangdong, Wang Qian. Paleoecological change and response to climatic environmental change of Cladoceran from an alpine lake-Jiren Co[J]. Journal of Lake Sciences, 2017, 29(3): 730-739. DOI:10.18307/2017.0323 |
| [23] |
Jeppesen E, Leavitt P, Meester L D, et al. Functional ecology and palaeolimnology-Using Cladoceran remains to reconstruct anthropogenic impact[J]. Trends in Ecology & Evolution, 2001, 16(4): 191-198. |
| [24] |
Eggermont H, Martens K. Preface:Cladocera crustaceans:Sentinels of environmental change[J]. Hydrobiologia, 2011, 676(1): 1-7. DOI:10.1007/s10750-011-0908-9 |
| [25] |
Chételat J, Amyot M. Elevated methylmercury in high arctic Daphnia and the role of productivity in controlling their distribution[J]. Global Change Biology, 2009, 15(3): 706-718. DOI:10.1111/gcb.2009.15.issue-3 |
| [26] |
Sweetman J N, Rühland K M, Smol J P. Environmental and spatial factors influencing the distribution of Cladocerans in lakes across the central Canadian Arctic treeline region[J]. Journal of Limnology, 2010, 69(1): 76-87. DOI:10.4081/jlimnol.2010.76 |
| [27] |
Liu G, Liu Z, Gu B, et al. How important are trophic state, macrophyte and fish population effects on Cladoceran community? A study in Lake Erhai[J]. Hydrobiologia, 2014, 736(1): 189-204. DOI:10.1007/s10750-014-1906-5 |
| [28] |
Liu Y, Chen G, Hu K, et al. Biological responses to recent eutrophication and hydrologic changes in Xingyun Lake, Southwest China[J]. Journal of Paleolimnology, 2017, 57(4): 343-360. DOI:10.1007/s10933-017-9952-4 |
| [29] |
万国江. 现代沉积的210Pb计年[J]. 第四纪研究, 1997(3): 230-239. Wan Guojiang. 210Pb dating for recent sedimentation[J]. Quaternary Sciences, 1997(3): 230-239. |
| [30] |
张信宝, 龙翼, 文安邦, 等. 中国湖泊沉积物137Cs和210Pb ex断代的一些问题[J]. 第四纪研究, 2012, 32(3): 430-440. Zhang Xinbao, Long Yi, Wen Anbang, et al. Discussion on applying 137Cs and 210Pb ex for lake sediment dating in China[J]. Quaternary Sciences, 2012, 32(3): 430-440. |
| [31] |
刘恩峰, 薛滨, 羊向东, 等. 基于210Pb与137Cs分布的近代沉积物定年方法——以巢湖, 太白湖为例[J]. 海洋地质与第四纪地质, 2009, 29(6): 89-94. Liu Enfeng, Xue Bin, Yang Xiangdong, et al. 137Cs and 210Pb chronology for modern lake sediment:A case study of Chaohu Lake and Taibai Lake[J]. Marine Geology & Quaternary Geology, 2009, 29(6): 89-94. |
| [32] |
Battarbee R W, Cameron N G, Golding P, et al. Evidence for Holocene climate variability from the sediments of a Scottish remote mountain lake[J]. Journal of Quaternary Science, 2001, 16(4): 339-346. DOI:10.1002/(ISSN)1099-1417 |
| [33] |
Krammer K, Lange-Bertalot H. Bacillariophyceae 1-4[M]//Ettl H, Gerloff J, Heynig H, et al. Süsswasserflora von Mitteleuropa, Band 1-4. Jena, Germany: Gustav Fischer Verlag, 1986-1991.
|
| [34] |
Szeroczyńska K, Sarmaja-Korjonen K. Atlas of subfossil Cladocera from central and northern Europe[M]. Świecie: Friends of the Lower Vistula Society, 2007: 2-82.
|
| [35] |
蒋燮治, 堵南山. 中国动物志, 节肢动物门, 甲壳纲, 淡水枝角类[M]. 北京: 科学出版社, 1979: 1-305. Chiang Siehchih, Du Nanshan. Fauna Sinica Crustacer Freshwater Cladocera[M]. Beijing: Science Press, 1979: 1-305. |
| [36] |
Thompson L G, Yao T, Mosley-Thompson E, et al. A high-resolution millennial record of the South Asian monsoon from Himalayan ice cores[J]. Science, 2000, 289(5486): 1916-1920. DOI:10.1126/science.289.5486.1916 |
| [37] |
ter Braak C J F, Šmilauer P. CANOCO Reference Manual and CanoDraw for Windows User's Guide:Software for Canonical Community Ordination (version 4.5)[J]. Ithaca, New York:Centre for Biometry Wageningen, 2002, 1-351. |
| [38] |
Harmsworth R V. The developmental history of Blelham Tarn (England) as shown by animal microfossils, with special reference to the Cladocera[J]. Ecological Monographs, 1968, 38(3): 223-241. DOI:10.2307/1942429 |
| [39] |
Nevalainen L, Luoto T P. Faunal (Chironomidae, Cladocera) responses to post-Little Ice Age climate warming in the high Austrian Alps[J]. Journal of Paleolimnology, 2012, 48(4): 711-724. DOI:10.1007/s10933-012-9640-3 |
| [40] |
Fischer J M, Olson M H, Williamson C E, et al. Implications of climate change for Daphnia in alpine lakes:Predictions from long-term dynamics, spatial distribution, and a short-term experiment[J]. Hydrobiologia, 2011, 676(1): 263-277. DOI:10.1007/s10750-011-0888-9 |
| [41] |
Rautio M, Mariash H, Forsstrøm L. Seasonal shifts between autochthonous and allochthonous carbon contributions to zooplankton diets in a subarctic lake[J]. Limnology and Oceanography, 2011, 56(4): 1513-1524. DOI:10.4319/lo.2011.56.4.1513 |
| [42] |
Slemmons K E H, Saros J E, Simon K. The influence of glacial meltwater on alpine aquatic ecosystems:A review[J]. Environmental Science:Processes & Impacts, 2013, 15(10): 1794-1806. |
| [43] |
Rautio M, Vincent W F. Benthic and pelagic food resources for zooplankton in shallow high-latitude lakes and ponds[J]. Freshwater Biology, 2006, 51(6): 1038-1052. DOI:10.1111/fwb.2006.51.issue-6 |
| [44] |
Strecker A L, Cobb T P, Vinebrooke R D. Effects of experimental greenhouse warming on phytoplankton and zooplankton communities in fishless alpine ponds[J]. Limnology and Oceanography, 2004, 49(4): 1182-1190. DOI:10.4319/lo.2004.49.4.1182 |
| [45] |
Leavitt P R, Vinebrooke R D, Donald D B, et al. Past ultraviolet radiation environments in lakes derived from fossil pigments[J]. Nature, 1997, 388(6641): 457-459. DOI:10.1038/41296 |
| [46] |
Castañeda I S. Schouten S. A review of molecular organic proxies for examining modern and ancient lacustrine environments[J]. Quaternary Science Reviews, 2011, 30(21-22): 2851-2891. DOI:10.1016/j.quascirev.2011.07.009 |
| [47] |
沈吉, 张恩楼, 夏威岚. 青海湖近千年来气候环境变化的湖泊沉积记录[J]. 第四纪研究, 2001, 21(6): 508-513. Shen Ji, Zhang Enlou, Xia Weilan. Records from lake sediments of the Qinghai Lake to mirror climatic and environmental changes of the past about 1000 years[J]. Quaternary Sciences, 2001, 21(6): 508-513. |
| [48] |
胡竹君. 青藏高原东南缘高山湖泊生态变化与驱动机制[D]. 北京: 中国科学院大学博士论文, 2013: 38-45. Hu Zhujun. Ecological Changes and Corresponding Mechanisms in Alpine Lakes of the Southeast Margin of Tibetan Plateau[D]. Beijing: The Doctoral Thesis of University of Chinese Academy of Science, 2013: 38-45. |
| [49] |
Lotter A F, Birks H J B, Hofmann W, et al. Modern diatom, cladocera, chironomid, and chrysophyte cyst assemblages as quantitative indicators for the reconstruction of past environmental conditions in the Alps. Ⅰ. Climate[J]. Journal of Paleolimnology, 1997, 18(4): 395-420. DOI:10.1023/A:1007982008956 |
| [50] |
Packard A T. Horizontal Distribution, Feeding Rates and Prey Selectivity of the Littoral Predator, Polyphemus pediculus[D]. New Hampshire: The Doctoral Thesis of New Hampshire University, 1992: 1-127.
|
| [51] |
Jeppesen E, Jensen J P, Amsinck S. Reconstructing the historical changes in Daphnia mean size and planktivorous fish abundance in lakes from the size of Daphnia ephippia in the sediment[J]. Journal of Paleolimnology, 2002, 27(1): 133-143. DOI:10.1023/A:1013561208488 |
| [52] |
Smol J P, Wolfe A P, Birks H J, et al. Climate-driven regime shifts in the biological communities of Arctic lakes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(12): 4397-4402. DOI:10.1073/pnas.0500245102 |
| [53] |
Rühland K M, Paterson A M, Smol J P. Lake diatom responses to warming:Reviewing the evidence[J]. Journal of Paleolimnology, 2015, 54(1): 1-35. DOI:10.1007/s10933-015-9837-3 |
| [54] |
杨保, 王鑫, 宋苗, 等. 过去2000年温度集成重建研究:进展与展望[J]. 第四纪研究, 2017, 37(5): 954-962. Yang Bao, Wang Xin, Song Miao, et al. Temperature reconstructions of last millennium and common era climate variations:Present status and future prospects[J]. Quaternary Sciences, 2017, 37(5): 954-962. |
| [55] |
郭超, 马玉贞, 刘杰瑞, 等. 过去2000年来西藏羊卓雍错沉积物粒度记录的气候变化[J]. 第四纪研究, 2016, 36(2): 405-419. Guo Chao, Ma Yuzhen, Liu Jierui, et al. Climatic change recorded by grain size in the past about 2000 years from Yamzhog Yumco Lake, Tibet[J]. Quaternary Sciences, 2016, 36(2): 405-419. |
| [56] |
You Q L, Kang S C, Pepin N, et al. Relationship between temperature trend magnitude, elevation and mean temperature in the Tibetan Plateau from homogenized surface stations and reanalysis data[J]. Global and Planetary Change, 2010, 71(1-2): 124-133. DOI:10.1016/j.gloplacha.2010.01.020 |
| [57] |
Wischnewski J, Kramer A, Kong Z, et al. Terrestrial and aquatic responses to climate change and human impact on the southeastern Tibetan Plateau during the past two centuries[J]. Global Change Biology, 2011, 17(11): 3376-3391. DOI:10.1111/j.1365-2486.2011.02474.x |
2 State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, Jiangsu;
3 School of Geography Science, Nanjing Normal University, Nanjing 210023, Jiangsu)
Abstract
Southwest China, which includes the eastern margin of Tibet, is a hotspot of global biodiversity research. Previous studies showed rapid ecological change in this region, due to global environmental forcing, most notably landcover change and Nr deposition. In this study, two alpine glacier lakes, one is Jiren Lake(29°43'19″N, 100°48'56″E), located above the modern treeline(altitude ca. 4480 m a.s.l.), from Yajiang County, Garze tibetan autonomous prefecture, in Western Sichuan Plateau, and the other Lake Cuoqia(27°24'13″N, 99°46'18″E), lies below the modern treeline(altitude ca. 3980 m a.s.l.), from Shangri-La City, Diqing Tibetan Autonomous prefecture, in northwest Yunnan Province, are selected. All lakes are deep(of maximum water depth about 27 m), small and oligotrophic. A 48 cm long sediment core was taken from the center of Cuoqia Lake using UWITEC sediment corer(diameter is 60 mm) in 2012, and divided by 1 cm in the field, and a 38 cm long sediment core was taken from the center of Jiren Lake using Hon-Kajak sediment corer(diameter is 90 mm) in 2014, and 0.5 cm divided in the field. Multi-proxies(i.e., cladoceran, diatom, geochemical) from two lakes sediment cores over the past 200 years, 0~28.5 cm of Jiren Lake and 0~31 cm depth of Cuoqia Lake, were analysed, to reconstruct the environment change history of two Lakes, and to understand how physicochemical characteristics and catchment characteristics of lakes above and below treeline affect the composition of aquatic organisms(i.e., cladocera and diatom) and their response to environmental change. Based on the 210Pb/137Cs dating, the chronology of two cores were established. The composition of cladocera are different in two oligotrophic lakes, littoral species(Alona spp., Pleuroxus spp. etc) and ubiquitous species Chydorus sphaericus are dominated in Jiren Lake, while the Cuoqia Lake was predominated by planktonic cladocera Daphnia longispina with rare littoral species. The diatom assemblages at Jiren Lake was predominated by small Fragilaria and Cyclotella. Aulacoseira spp. and benthic species were dominated at Cuoqia Lake. During the last 200 years, all cladocera and diatom composition showed obvious changes in Jiren Lake, while, there are subtle changes of diatom composition and only obsolete fluctuation between the dominate cladcera species D. longispina and predatory species Polyphemus pediculus at Cuoqia Lake. Our results indicates that, the composition of aquatic organisms(cladoceran and diatom) and their response to regional environmental change were mediated by lake altitude, lake physicochemical characteristics and catchment characteristics. Lower altitude and higher water temperature in Cuoqia Lake promote the growth of planktonic cladocera, besides, high DOM and DOC taken from the catchment not only provide more available food for cladocera, but also reduce the water transparent and UV radiation, and then benefit the survive of planktonic species in the open water zone. For the case of Jiren Lake, lower water temperature, shorter growth period and higher UV radiation intensity should restrained the growth of planktonic cladocera. Although there is no evidence of climate warming affect the composition changes of cladocera and diatom in two lakes, climate warming may contribute to the noticeable change of organisms in Jiren Lake indirectly. Higher altitude of Jiren Lake makes it more sensitive to climate change, and the degradation of increase temperature during the past 200 years should be higher than that in Cuoqia Lake, climate warming result in more glacial water inputs and reduced the pH of water body, ultimately changed the composition of cladocera and diatom. For the Cuoqia Lake, lower altitude and forest cover around the catchment buffer the increasing temperature, thus, no obvious change of aquatic organism in this lake. 2018, Vol.38
2018, Vol.38

