文章信息
- 曾凡达, 李纲
- ZENG Fan-da, LI Gang
- 花状CdO微球的制备及其对高氯酸铵热分解的催化性能
- Preparation of flower-like CdO microspheres and its catalytic performances towards thermal decomposition of ammonium perchlorate
- 材料工程, 2020, 48(6): 91-97
- Journal of Materials Engineering, 2020, 48(6): 91-97.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.000287
-
文章历史
- 收稿日期: 2019-03-27
- 修订日期: 2020-01-13
复合固体推进剂是固体发动机的动力来源,主要用于导弹的发射以及各类空间飞行器的运载。复合固体推进剂通常由粉末金属燃料、固体粉末氧化剂、高分子黏结剂以及其他附加成分混合组成。高氯酸铵(AP)是复合固体推进剂中常用的氧化剂,其在整个推进剂系统中的质量占比高达60%~90%[1]。显而易见,AP的热分解特性(如热分解温度、分解活化能、分解过程释放的热量等)将显著影响推进剂的整体燃烧性能。在AP的热分解过程中,热分解温度值的降低和热释放量的增加能大幅缩短燃料的点火延迟时间,从而使推进剂获得更高的燃烧速率和更好的燃烧综合性能[2-3]。因此,越来越多的科研工作者将寻找具有高活性的AP热分解用催化剂作为研究的重点。迄今为止,已有多种催化剂应用于AP热分解上的报道。如Chen等[4]采用水热合成法获得了三种不同直径的α-MnO2纳米线,并比较了三者对AP热分解的催化效果。研究结果发现,直径为11 nm的α-MnO2纳米线表现出最为优异的催化性能,它可使AP的热分解温度降低130 ℃。Wang等[1]采用水热-热分解法制备出了具有级次结构的多孔NiO,Co3O4及NiCo2O4,并对三者催化AP热分解的性能进行了测试。结果表明,三者均对AP的热分解过程具有促进作用,分别可使AP的高温热分解温度降低113.8,136.2 ℃和109.9 ℃。Hosseini等[5]报道了球形α-Fe2O3纳米颗粒可使AP的热分解温度降低61 ℃,分解热增加482 J/g。Li等[6]采用微乳液-均相沉淀法制得的CuO纳米线可使AP热分解温度降低114.4 ℃。催化剂对AP热分解过程的作用除受到诸如制备方法、形貌和微结构等因素的影响外,在更大程度上依赖于催化剂本身的化学组成。因此,合成具有不同化学组成和形貌的新材料并评价其催化AP热分解的效果,可为AP热分解用高效催化剂的筛选与开发提供基础数据参考,这对推动固体推进剂领域的快速发展具有积极的意义。
目前用于AP热分解的催化剂大多为具有3d电子构型的过渡金属元素组成的单一氧化物或复合金属氧化物,而具有4d电子结构的过渡金属构成的氧化物用于催化AP热分解方面的研究报道较少。本工作选择具有4d价电子构型的Cd为基础元素,尝试采用溶剂热合成-热分解两步法制备具有新型形貌的CdO材料,并探索其作为催化剂应用于AP热分解中的可能性。即以Cd(Ac)2为原料,以甲醇为溶剂,采用溶剂热法首先合成出Cd醇盐前驱体。随后将前驱体物质煅烧,从而获得最终目标产物CdO材料。借助X射线衍射(XRD)、扫描电子显微镜(SEM)、透射电子显微镜(TEM)和N2吸附-脱附等手段对样品的物相、形貌及孔结构进行表征。采用差示扫描量热(DSC)技术对CdO催化分解AP的性能进行评价。
1 实验材料与方法 1.1 花状CdO微球的制备采用溶剂热合成-热分解两步法制备CdO花状微球。第一步,制备镉醇盐前驱体。将3.0 g二水醋酸镉溶解于300 mL无水甲醇中,直至形成透明的溶液。将该溶液移入500 mL水热反应釜,置于200 ℃的鼓风干燥箱中恒温6 h。反应结束后,采用真空抽滤的方式收集釜底的沉淀,并用无水甲醇多次淋洗。随后将其置于60 ℃的干燥箱中烘干,即得到前驱体物质。第二步,热分解前驱体物质。将前驱体装于瓷舟并置于马弗炉中进行热处理,即得到最终目标产物CdO材料。热处理温度为450 ℃,所用时间为90 min,升降温速率为2 ℃/min。
1.2 结构表征在X’Pert PRO型衍射仪上对样品的晶相结构和纯度进行表征,Cu靶,Kα辐射,扫描步长0.02°;在Avatar 360型透射傅里叶变换红外光谱仪上测定前驱体的红外吸收谱图,KBr压片制样,测量范围4000~400 cm-1;在STA 449C型热分析仪上测定前驱体的热重曲线,空气氛围,升温速率10 ℃/min,温度范围30~800 ℃;用Quanta 250F型扫描电镜和JEM 2100型透射电镜观察样品的形貌;N2吸附-脱附曲线在Micromeritics ASAP2020型氮气吸附仪上测定,工作温度为-195.8 ℃;样品比表面积由BET法算得,孔径分布曲线则由脱附支数据用BJH法计算获得。
1.3 催化性能的评价称取商用AP与CdO材料(质量比为98:2),加入少许乙醇进行研磨混合。待乙醇挥发后,采用STA 449C型热分析仪对样品进行DSC测试。N2氛围,气体流速为20 mL/min,试样量3 mg左右,测试温度为30~600 ℃,铝质样品池,根据AP的热分解温度、分解热释放量以及反应活化能来评价催化剂的活性。
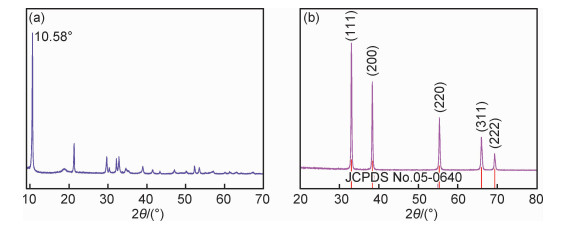
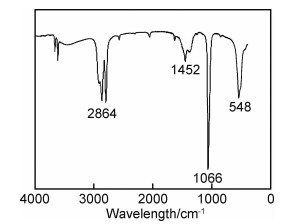
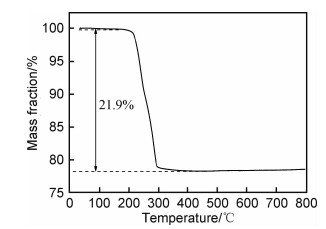
2 结果与分析 2.1 前驱体和产物的物相分析图 1为前驱体和产物的XRD谱图。前驱体的衍射峰(图 1(a))与标准数据库中已知的所有含镉物质均不能对应,表明在本工作的制备条件下可能合成出了新的物质。需要注意的是,在2θ=10.58°处出现了一个强烈的特征衍射峰。Wang等[7]在甲醇体系中采用溶剂热法合成NiO时,也在2θ≈10°处出现了类似衍射峰,认为该特征衍射峰是有机醇盐Ni(CH3O)2形成的标志。鉴于本工作采用的合成体系与文献[7]较为类似,仅将原料由Ni(Ac)2换成了Cd(Ac)2,因此推测新物质可能是有机镉醇盐。将该前驱体在450 ℃煅烧后,所获产物的XRD谱图示于图 1(b)。可知,样品所有的衍射峰与CdO标准数据(JCPDS No.05-0640)完全吻合,在2θ为33.0°,38.3°,55.3°,65.9°和69.3°处出现的衍射峰分别对应于CdO的(111),(200),(220),(311)和(222)晶面。在整个谱图中,除了CdO的衍射峰外,没有观察到其他杂质峰,证实所得产物的纯度较高。此外,观察到这些特征衍射峰的峰型尖锐,表明所获产物CdO材料结晶良好。为了确定前驱体的分子结构和化学组成,对其进行了红外光谱测试,如图 2所示。谱图上2864 cm-1处出现的吸收峰源于—CH3上C—H键的对称伸缩振动;1452 cm-1处出现的吸收峰归属于—CH3上C—H键的弯曲振动;1066 cm-1处出现的强吸收峰对应于C—O键的伸缩振动;而低波数548 cm-1下出现的吸收峰通常是由M—O(M=metal)键的伸缩振动引起的。红外光谱的结果表明,本方法获得的前驱体物质化学组成可能为(CH3O)2Cd。为了验证这一点,对其进行了热重分析,结果如图 3所示。TG曲线显示,前驱体物质的失重率为21.9%。这与(CH3O)2Cd在空气氛围中的理论分解率26.4%较为接近。综合XRD,FT-IR以及TG实验结果,可以确定前驱体物质为(CH3O)2Cd。
|
图 1 前驱体(a)和产物(b)的XRD谱图 Fig. 1 XRD patterns of the precursor(a) and product(b) |
|
图 2 前驱体的FT-IR谱图 Fig. 2 FT-IR spectrum of the precursor |
|
图 3 前驱体的热重曲线 Fig. 3 TG curve of the precursor |
图 4为前驱体和产物的SEM图。由图 4(a),(b)可知,前驱体整体上呈花状微球形貌,尺寸从几个微米到数十微米不等。从单个微球的放大图(图 4(b))可知,微球是由厚度约25~50 nm的纳米片围绕着中心组装而成,并且这些纳米片的表面非常光滑。此外,从图 4(a)中还能观察到花状微球周围散落有纳米片。这些纳米片可能是从花状微球上脱落的,也可能是尚未完成自组装的。图 4(c),(d)为产物的SEM照片。由图 4(c)可见,样品的整体形貌和几何尺寸在煅烧前后基本保持不变。唯一的区别在于,煅烧后样品的表面出现了大量孔洞,这应该是前驱体镉醇盐在热解过程中释放出H2O和CO2分子造成的(图 4(d))。

|
图 4 前驱体(a),(b)和产物(c),(d)的SEM图 Fig. 4 SEM images of the precursor(a), (b) and product(c), (d) |
采用TEM对产物的形貌作进一步观察,结果示于图 5中。图 5(a)为单个纳米片的TEM照片。可见,纳米片上有大量狭缝状孔洞,这些孔洞的孔径分布较宽,且以大孔为主。图 5(b)为图 5(a)中选框区域的放大图。不难看出,多孔纳米片实际上是由众多纳米晶聚集链接而成。少数纳米晶的个体仍清晰可辨,但多数纳米晶之间已经发生了聚并,生长为尺寸更大的颗粒。基于TEM图片结果,可以推断纳米片上的小孔源于前驱体物质在热解过程中CO2和H2O分子的逸出,而大孔则来源于相邻纳米晶之间的聚并长大。从单个纳米晶的高分辨HRTEM照片上可观察到非常清晰的晶格条纹(图 5(c)),表明晶粒的晶化程度较好。测得相邻条纹间的距离为0.27 nm,这与(111)CdO晶面的间距值完全吻合。

|
图 5 产物的TEM图 (a)单个纳米片;(b)图 5(a)的局部放大图;(c)单个纳米晶的HRTEM图 Fig. 5 TEM images of the product (a)individual nano-flake; (b)enlarged TEM image in fig. 5(a); (c)HRTEM image of individual nano-grain |
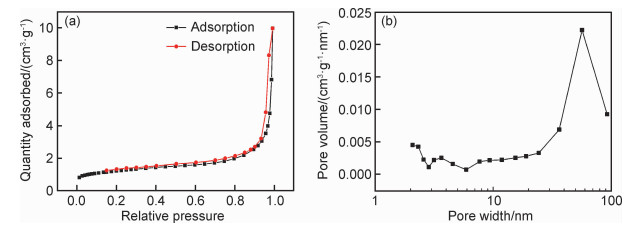
为了测定样品的比表面积和孔结构,对其进行了N2吸附-脱附曲线测试。吸附-脱附等温线及相应的孔径分布曲线如图 6所示。样品的等温线形状呈Ⅳ类(图 6(a)),在相对压力P/P0=0.9~1.0的范围内,出现了由毛细管的凝聚作用引起的H3型迟滞环,说明样品具有狭缝状孔道。滞后环出现在较高的相对压力位置,表明样品中有大孔(>50 nm)存在。此外,观察到滞后环的面积不大,说明样品的孔体积较小。孔径分布曲线表明(图 6(b)),孔径分布较宽,样品内兼有介孔和大孔,且以大孔为主。这与TEM直观观测到的孔结构信息完全一致。根据BET法计算得到样品的比表面积为4.35 m2/g,根据BJH算法确定出的样品孔体积为0.015 cm3/g。
|
图 6 产物的N2吸附-脱附等温线(a)及孔径分布曲线(b) Fig. 6 Nitrogen adsorption-desorption isotherm(a) and the corresponding pore size distribution curve(b) of the product |
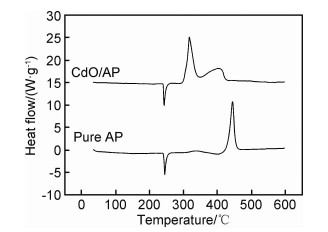
图 7为升温速率为20 ℃/min时纯AP及花状CdO/AP混合物的DSC曲线。可以看出,纯AP的DSC曲线上出现了1个吸热峰和2个放热峰。在245.0 ℃出现的吸热峰归因于AP的晶型转化,即AP由斜方晶系转变成立方晶系[8];在337.0 ℃处出现了微弱放热峰,其对应于AP的低温热分解过程(low-temperature thermal decomposition,LTD),在该阶段AP发生部分分解并生成中间产物[9];在444.4 ℃处出现的强烈放热峰对应于AP的高温热分解过程(high-temperature thermal decomposition,HTD),AP在该阶段完全分解为气体小分子[10]。花状CdO微球的引入对AP的晶型转变过程基本没有影响,但使其热分解行为有了较大的改变。具体而言,CdO的引入使得AP的低温分解和高温分解过程均有所提前,对应的峰值温度分别为317.4 ℃和402.8 ℃,比纯AP降低了19.6 ℃和41.6 ℃。此外,从DSC曲线上放热峰所包围的面积来看,纯AP分解时释放的热量集中在HTD阶段,这表明AP的热分解以高温热分解过程为主;而添加CdO后,AP在LTD阶段的放热量显著增加,表明在低温热分解阶段的分解量有了很大程度的增长,其分解不再集中在高温热分解阶段,即CdO的添加可催化AP的热分解。就AP热分解过程中释放的总放热量来看,CdO的添加使得AP的放热量从586.9 J/g增至1091.7 J/g,增幅达0.86倍。AP热解过程中峰值温度的提前和放热量的增加均证实花状CdO微球对AP的热分解有较好的促进作用。
|
图 7 纯AP及花状CdO/AP混合物的DSC曲线 Fig. 7 DSC curves of pure AP and flower-like CdO/AP mixture |
高温分解反应的活化能是评价催化剂性能的另一项重要指标,可采用Kissinger公式[11-12]进行计算。
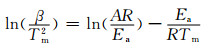
|
(1) |
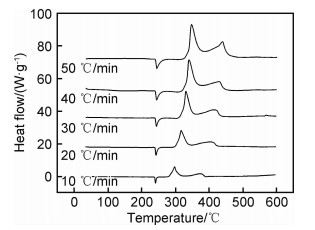
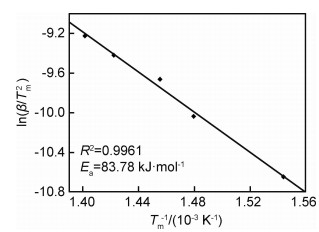
式中:β为升温速率;Tm为高温分解温度;R为理想气体常数;Ea为高温分解反应的活化能;A为指前因子。由式(1)可知,Ea是与升温速率β和高温分解温度Tm相关的函数。通过实验测得不同升温速率下AP的高温分解峰值温度,即可根据ln(β/Tm2)与1/Tm之间的线性关系求得分解反应的活化能值。图 8给出了CdO/AP混合物在不同升温速率下的DSC曲线。可知,随升温速率的增加,AP的高温分解峰值温度也随之升高。实验测定的ln(β/Tm2)-1000/Tm关系曲线如图 9所示。可知,ln(β/Tm2)与1000/Tm之间的线性关系较好,拟合直线的相关系数为0.9961。根据该拟合直线的斜率值,计算得出引入CdO后AP的高温分解反应活化能为83.78 kJ/mol,而在本课题组之前的研究中,测得的纯AP高温分解反应的活化能为280.5 kJ/mol[13]。可见,CdO的引入显著降低了AP高温热分解反应所需要克服的活化能。活化能的测定结果再一次证实,CdO花状微球对AP的高温热分解具有较好的催化效果。
|
图 8 不同升温速率下CdO/AP混合物的DSC曲线 Fig. 8 DSC curves of CdO/AP mixture with various heating rates |
|
图 9 ln(β/Tm2)与1000/Tm的关系曲线 Fig. 9 Relation curve of ln(β/Tm2) versus 1000/Tm |
如前文所述,AP的热分解可以分为低温热分解和高温热分解过程。通常认为[14-15],低温热分解过程包括NH4ClO4的部分解离、升华为NH3(g)和HClO4(g), HClO4(g)的分解和随后与NH3(g)的反应, 反应不完全的NH3(g)和HClO4(g)在残余AP表面的吸附等。高温热分解过程则对应于残余AP的解离与升华、低温热分解过程中吸附物的解吸以及NH3(g)与HClO4(g)的气相氧化还原反应等。上述过程可分别用化学反应方程式简要描述如下[11, 16]:
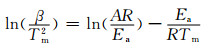
|
(2) |
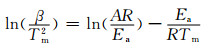
|
(3) |
DSC结果显示,花状CdO微球的加入对AP的低温热分解和高温热分解均有一定的促进作用。就低温分解过程来看,CdO与AP均匀混合后,其碱性氧化物的本性使得气相的HClO4更倾向于吸附在其表面,这势必会造成待分解AP晶体表面所吸附HClO4浓度的降低,从而使得NH4ClO4的解离反应更容易朝正反应方向进行,因而实现了AP低温热分解过程的加速。然而,因本工作所制得的花状CdO多孔微球的比表面积和孔容量均较低,表现出有限吸附HClO4的能力,故其对AP低温热分解过程的促进作用较为有限。此外,作为一种半导体材料,体相CdO的禁带宽度仅为2.6 eV[17],在合适能量源(如热能)的激发作用下,其表面易于生成电子(ecb-)-空穴(hvb+)对。研究表明[9, 11],在AP的高温热分解过程中,ecb-可和HClO4反应生成·O2-。而具有强氧化能力的hvb+和·O2-的存在,可为NH3被氧化为如H2O,NO2和N2O等小分子提供便利,因而CdO的加入也可以改善AP的高温热分解行为。实验结果显示,花状CdO微球的添加仅使AP的高温热分解温度降低了41.6 ℃,这可能与CdO表面的ecb--hvb+易于复合而使得ecb-和hvb+参与反应的机会减少相关。
3 结论(1) 采用两步法制备出花状多孔CdO微球。以Cd(Ac)2为原料,甲醇为溶剂,采用溶剂热法合成出由纳米片自组装形成的花状镉醇盐前驱体(CH3O)2Cd微球。将前驱体煅烧后,得到形貌保持良好的多孔CdO材料。
(2) CdO花状多孔微球对AP的热分解有一定的催化作用。在AP中引入2%的CdO,可使其高温分解峰值温度从444.4 ℃降低至402.8 ℃,分解热从586.9 J/g提高到1091.7 J/g,高温分解反应活化能从280.5 kJ/mol减少至83.78 kJ/mol。
(3) CdO花状多孔微球对AP低温热分解的促进,源于HClO4在其表面的吸附推动了AP解离反应的正向进行;其对AP高温热分解的促进,是热激发在其表面所生成的ecb--hvb+对参与反应的结果。
| [1] |
WANG J G, JIN L N, QIAN X Y, et al. Preparation and catalytic activity comparison of porous NiO, Co3O4 and NiCo2O4 superstructures on the thermal decomposition of ammonium perchlorate[J]. Journal of Nanoscience and Nanotechnology, 2016, 16: 8635-8639. DOI:10.1166/jnn.2016.11635 |
| [2] |
HOSSEINI S G, ABAZARI R, GAVI A. Pure CuCr2O4 nanoparticles:synthesis, characterization and their morphological and size effects on the catalytic thermal decomposition of ammonium perchlorate[J]. Solid State Sciences, 2014, 37: 72-79. DOI:10.1016/j.solidstatesciences.2014.08.014 |
| [3] |
YU C P, ZHANG W C, GAO Y, et al. Shape-controlled syntheses of Co3O4 nanowires arrays with excellent catalytic performances upon ammonium perchlorate decomposition[J]. Materials Research Bulletin, 2018, 97: 483-489. DOI:10.1016/j.materresbull.2017.09.049 |
| [4] |
CHEN L J, ZHU D Y. The particle dimension controlling synthesis of α-MnO2nanowires with enhanced catalytic activity on the thermal decomposition of ammonium perchlorate[J]. Solid State Sciences, 2014, 27: 69-72. DOI:10.1016/j.solidstatesciences.2013.11.001 |
| [5] |
HOSSEINI S G, AYOMAN E. Synthesis of α-Fe2O3 nanoparticles by dry high-energy ball-milling method and investigation of their catalytic activity[J]. Journal of Thermal Analysis and Calorimetry, 2017, 128: 915-924. DOI:10.1007/s10973-016-5969-6 |
| [6] |
LI C F, YIN Y D, HOU H G, et al. Preparation and characterization of Cu(OH)2 and CuO nanowires by the coupling route of microemulsion homogenous precipitation[J]. Solid State Communications, 2010, 150: 585-589. DOI:10.1016/j.ssc.2009.12.039 |
| [7] |
WANG J J, WEI C Z, PANG H, et al. Facile synthesis of mono-dispersive hierarchical nickel-based microspheres as potential catalysts[J]. Catalysis Communications, 2011, 12: 1031-1036. DOI:10.1016/j.catcom.2011.03.016 |
| [8] |
HAN A J, LIAO J J, YE M Q, et al. Preparation of nano-MnFe2O4 and its catalytic performance of thermal decomposition of ammonium perchlorate[J]. Chinese Journal of Chemical Engineering, 2011, 19(6): 1047-1051. DOI:10.1016/S1004-9541(11)60090-6 |
| [9] |
TAN L H, XU J H, ZHANG X J, et al. Synthesis of g-C3N4/CeO2 nanocomposites with improved catalytic activity on the thermal decomposition of ammonium perchlorate[J]. Applied Surface Science, 2015, 356: 447-453. DOI:10.1016/j.apsusc.2015.08.078 |
| [10] |
HOSSEINI S G, HOSSEINI T S J, BABAEI K, et al. The effect of average particle size of nano-Co3O4 on the catalytic thermal decomposition of ammonium perchlorate particles[J]. Journal of Thermal Analysis and Calorimetry, 2016, 124: 1243-1254. DOI:10.1007/s10973-016-5333-x |
| [11] |
LI Q, HE Y, PENG R F. Graphitic carbon nitride(g-C3N4) as a metal-free catalyst for thermal decomposition of ammonium perchlorate[J]. RSC Advances, 2015, 5: 24507-24512. DOI:10.1039/C5RA01157D |
| [12] |
LI H T, ZHAO K, TIAN S Q, et al. Origin of the efficient catalytic thermal decomposition of ammonium perchlorate over (2-1-10) facets of ZnO nanosheets: surface lattice oxygen[J]. RSC Advances, 2017, 7: 40262-40269. DOI:10.1039/C7RA07906K |
| [13] |
CHEN R, LI G, BAI W Y, et al. Synthesis of rod-like porous MgFe2O4 architectures as a catalyst for ammonium perchlorate thermal decomposition[J]. Nano, 2018, 13(6): 1850069. DOI:10.1142/S1793292018500698 |
| [14] |
谈玲华, 徐建华, 寇波, 等. g-C3N4/NiO复合材料的制备及其对AP热分解的影响[J]. 材料工程, 2016, 44(11): 96-100. TAN L H, XU J H, KOU B, et al. Preparation of g-C3N4/NiO composites and its effect on thermal decomposition of ammonium perchlorate[J]. Journal of Materials Engineering, 2016, 44(11): 96-100. DOI:10.11868/j.issn.1001-4381.2016.11.016 |
| [15] |
熊文慧, 张文超, 俞春培, 等. 多孔纳米CoFe2O4的制备及其对高氯酸铵的热分解催化性能[J]. 物理化学学报, 2016, 32(8): 2093-2100. XIONG W H, ZHANG W C, YU C P, et al. Preparation of nanoporous CoFe2O4 and its catalytic performance during the thermal decomposition of ammonium perchlorate[J]. Acta Physico-Chi-mica Sinica, 2016, 32(8): 2093-2100. |
| [16] |
TIAN S Q, LI N, ZENG D W, et al. Hierarchical ZnO hollow microspheres with exposed (001) facets as promising catalysts for the thermal decomposition of ammonium perchlorate[J]. Cryst Eng Comm, 2015, 17: 8689-8696. DOI:10.1039/C5CE01160D |
| [17] |
TURGUT G, AKSOY G, SKENDERO LU D, et al. The effect of Eu-loading on the some physical features of CdO[J]. Ceramics International, 2018, 44: 3921-3928. DOI:10.1016/j.ceramint.2017.11.183 |
 2020, Vol. 48
2020, Vol. 48


