文章信息
- 张传香, 陈亚玲, 巩云, 刘慧颖, 戴玉明, 丛园
- ZHANG Chuan-xiang, CHEN Ya-ling, GONG Yun, LIU Hui-ying, DAI Yu-ming, CONG Yuan
- 二硫化钼/石墨烯复合材料的一步水热合成及电催化性能
- One-step hydrothermal synthesis and electrocatalytic performance of MoS2/RGO composites
- 材料工程, 2020, 48(5): 56-61
- Journal of Materials Engineering, 2020, 48(5): 56-61.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2018.001129
-
文章历史
- 收稿日期: 2018-09-25
- 修订日期: 2019-11-21
2. 南京航空航天大学 材料科学与技术学院, 南京 210016
2. College of Material Science and Technology, Nanjing University of Aeronautics and Astronautics, Nanjing 210016, China
过渡金属硫族化合物作为新型的氧还原催化剂,一直受到广泛的关注和研究。1986年,过渡金属硫族化合物Mo4.2Ru1.8Se8具有和Pt相近的氧还原反应(oxygen reduction reaction,ORR)活性被报道[1]。随后对该类催化剂的研究则主要集中在采用钼、钴、铁[2-6]等元素对电催化剂进行修饰、掺杂方面。Mukerjee课题组[7]制备了过渡金属硫族化合物催化剂,该催化剂为二维层状结构,其氧还原过程为二电子转移。Wang等[8-9]的研究表明,MoS2催化剂的氧还原反应是按照高效的四电子途径进行,O2在氧还原过程中直接被还原为O2-,没有中间产物。同时还发现,MoS2催化剂的氧还原活性和转移电子数受催化剂颗粒尺寸影响很大,当催化剂颗粒尺寸为几纳米时,氧还原反应的转移电子数总是趋近于4,且不受电位影响。Eng课题组[10]对MoSe2,WS2和WSe2分别进行了化学剥离,以期得到高比表面积催化剂,但剥离后催化剂的氧还原性能提升并不明显,MoSe2的自身独特电子结构使其ORR活性略高于WS2和WSe2。
过渡金属硫族化合物MoS2为六方晶系结构,具备独特的物理、化学性质,被广泛用作储氢材料[11]、电极材料[12-14]、润滑剂[15-16]以及光电化学催化材料[17-18]等。MoS2类似于“三明治”的结构样式,即一个Mo原子层被两个S原子层夹在中间,该结构是常态下稳定存在的层状晶体,且层与层之间的结合力为较弱的范德华力。层状MoS2催化剂的制备方法包括液相剥离法、化学插层法及水热法等。液相剥离法和化学插层法可制备层间作用力较弱的少层或单层二维催化剂,制得的催化剂有效活性表面积较大。相比上述两种方法,水热法操作容易且安全性高,制得的催化剂粒子纯度高、分散性好、晶形优良,且可通过改变Mo源或S源,制得不同形貌的MoS2。
石墨烯具有独特的电子结构,其二维平面内的每个碳原子具有3个p轨道和1个s轨道,而石墨烯优异的导电性正是来源于p轨道上剩下的π电子。石墨烯的结构非常稳定,理论厚度为0.35 nm,是最薄、最坚硬的二维材料。由于石墨烯高导电(15000 m2·V-1·s-1)和比表面积大(2640 m2·g-1)的特点,使其成为电催化剂载体的优秀候选者[19-20]。
本工作从降低催化剂成本、提高催化剂的稳定性出发,利用一步水热法,原位合成过渡金属硫族化合物MoS2与石墨烯的复合材料MoS2/RGO,将其作为燃料电池阴极催化剂,系统研究了其结构特性和电催化性能,以取代价格昂贵且易CO中毒的Pt/C。
1 实验 1.1 MoS2的制备将0.4 mmol(NH4)5Mo7O4·4H2O和11.2 mmol NH2CSNH2共混后加入80 mL蒸馏水,然后在25 ℃水浴锅中搅拌1 h,并用1 mol/L的HCl调节溶液pH值至6.0。分散均匀后,将混合液转移至100 mL容量的高压反应釜中(内衬为聚四氟乙烯),水热温度为180 ℃,反应时间为24 h。反应结束后降至室温,先后用去离子水和乙醇洗涤数次,得到黑色沉淀物,将该沉淀物在60 ℃真空烘箱中放置24 h烘干。最后将干燥后的产物在N2管式炉中升温至800 ℃,保温2 h,冷却后研细备用。
1.2 GO的制备取一定量的GO分散于蒸馏水中,超声搅拌1 h,搅拌过程中加入质量分数为80%的水合肼1 mL。待分散均匀后,将分散液转移至高压反应釜中,反应釜内衬为聚四氟乙烯,水热反应温度为100 ℃,反应时长为24 h。自然冷却至室温后,收集产物,先后用去离子水和乙醇洗涤数次,最后在60 ℃真空烘箱中干燥,研磨备用。
1.3 MoS2/RGO的制备量取80 mL蒸馏水,并加入40 mg GO,超声搅拌24 h,使GO均匀分散于水中,而后加入0.5 mmol的(NH4)5Mo7O4·4H2O和14 mmol的NH2CSNH2继续搅拌1 h,待均匀分散后,用0.1 mol/L的NaOH溶液调节pH值为6。将混合溶液转移至聚四氟乙烯反应釜中,保持水热温度180 ℃、反应时长24 h。最后将产物在N2炉中800 ℃煅烧2 h,冷却备用。
1.4 电极的制备称取5 mg制得的样品,加入50 μL Nafion膜溶液、0.5 mL蒸馏水和0.5 mL乙醇,搅拌超声30 min使悬浮液均匀分散。然后再用微量进样器取悬浮液逐滴滴加到电极表面,室温干燥待测。
1.5 测试与表征采用D8 X射线衍射仪(XRD,Cu靶,Kα射线源,λ=0.1541 nm)、S-4800场发射扫描电子显微镜(SEM)及JEM-2100透射电子显微镜(TEM)分别表征样品的物相组成、形貌及结构;电化学性能测试则利用CHI760D电化学分析仪在温度为25 ℃、常压三电极体系下进行。工作电极是涂覆所制备催化剂的玻碳电极(ϕ=5 mm),对电极为Pt丝电极(ϕ=0.5 mm),参比电极为饱和甘汞电极(SCE),电解液为0.1 mol·L-1的KOH溶液。进行电化学测试之前都先向溶液中通氧气0.5 h,使氧气达到饱和。
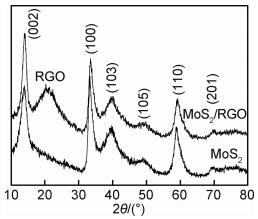
2 结果与分析 2.1 催化剂的组成与结构水热合成MoS2及MoS2/RGO复合材料的XRD谱图如图 1所示。可以看出,两样品的2θ衍射峰均位于14.0°,33.4°,39.7°,49.1°,58.9°以及69.9°,分别对应MoS2六方晶系(P63/mmc)的(002),(100),(103),(105),(110)以及(201)晶面(JCPDS 75-1539)。
|
图 1 MoS2与MoS2/RGO的XRD谱图 Fig. 1 XRD patterns of MoS2 and MoS2/RGO |
MoS2/RGO的衍射峰除了与MoS2具有相同的特征外,还在2θ=20.5°出现典型石墨烯的馒头峰,证明MoS2与RGO成功水热复合[21-22],(002)峰的减弱说明RGO的存在抑制了MoS2片层的再次堆叠。
图 2为MoS2及MoS2/RGO复合材料的SEM图。图 2(a)显示,MoS2呈球状形貌,其球体直径约为2 μm,且堆叠有序。从图 2(b)中看出,MoS2微球是花瓣状的片层堆叠形成的,其片层存在微微的卷曲,厚度约为5~20 nm。当MoS2与RGO复合后,样品呈片层堆叠状,见图 2(c),进一步放大可看到复合材料呈层状结构堆叠而形成的3D花瓣状形貌。具有一定间隔尺寸的花瓣状片层利于催化反应后电子的顺利转移,从而提高催化剂对氧的催化活性。

|
图 2 MoS2(a), (b)与MoS2/RGO(c), (d)的SEM图 Fig. 2 SEM images of MoS2(a), (b) and MoS2/RGO(c), (d) |
图 3为MoS2及MoS2/RGO的TEM图。从图 3(a)可以明显看到MoS2的球状结构有序地堆叠在一起。而经过一步水热法与RGO复合后,见图 3(c),样品分散性能有所提高,且MoS2片层呈微微卷曲状,并且均匀堆叠在石墨烯基底上,石墨烯薄层呈透明状。经过计算MoS2片层的堆叠层数约为8~13层,见图 3(b),其晶面间距d为0.62 nm,对应于MoS2的(002)晶面。而复合材料中MoS2的堆叠层数明显变少,见图 3(d),说明水热反应过程中,石墨烯作为载体的同时也起到了分散作用,增加了MoS2层间距而使MoS2形成少层结构,层间距的扩大可使样品在氧还原过程中加速电子的运动,从而加速氧化还原反应进程,提高样品的催化活性。

|
图 3 MoS2(a), (b)与MoS2/RGO(c), (d)的TEM图 Fig. 3 TEM images of MoS2(a), (b) and MoS2/RGO(c), (d) |
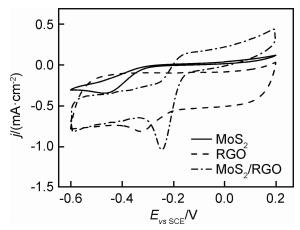
采用循环伏安法测试了扫描速率为20 mV·s-1时MoS2/RGO复合材料的氧还原活性,并分别与纯MoS2以及RGO进行对比,如图 4所示。MoS2催化氧还原峰出现在-0.46 V处,其对应的电流密度为-0.35 mA·cm-2;RGO的氧还原峰电位为-0.32 V,其对应的峰电流密度为-0.81 mA·cm-2。水热复合之后,MoS2/RGO复合材料的氧还原峰出现在-0.24 V处,分别比MoS2和RGO正移了0.22 V和0.06 V。其峰电流密度为-1.04 mA·cm-2,相比MoS2电流密度值提升了约2倍。可见,复合之后MoS2/RGO具有更优异的催化活性,证实MoS2在RGO中的良好分散性能,以及MoS2层间距的扩大使得催化剂对氧的还原活性有大幅度的提升。
|
图 4 MoS2,RGO和MoS2/RGO在O2饱和的0.1 mol·L-1KOH中的CV曲线 Fig. 4 CV curves of MoS2, RGO and MoS2/RGOin O2-saturated 0.1 mol·L-1 KOH |
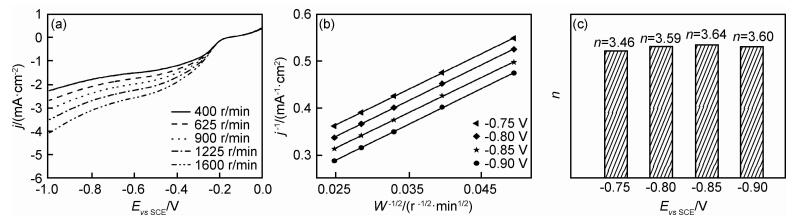
图 5为MoS2/RGO复合物在O2饱和的0.1 mol·L-1 KOH电解质溶液中不同旋转速率下的LSV曲线,不同电位下的K-L曲线以及催化氧分子还原过程中的转移电子数。可以看出,随圆盘电极转速由400 r/min增加到1600 r/min,MoS2/RGO催化剂的极限电流密度均匀增大。
|
图 5 MoS2/RGO在O2饱和的0.1 mol·L-1 KOH中不同旋转速率下的LSV曲线(a),不同电位下的K-L曲线(b)以及由K-L方程计算出的转移电子数(c) Fig. 5 LSV curves of MoS2/RGO in O2-saturated 0.1 mol·L-1 KOH under different rotating speeds(a), K-L curvesunder different potential(b), and the electron number(n) calculated according to K-L equation(c) |
为了计算MoS2/RGO复合材料在催化氧分子还原过程中的转移电子数n,根据催化剂在-0.75,-0.80,-0.85 V及-0.90 V不同电位下对应的极限电流密度值,利用Koutecky-Levich方程作K-L直线(均为拟合曲线)。根据曲线斜率,计算出催化剂在不同电位下催化氧分子还原过程中的转移电子数分别为3.46(-0.75 V),3.59(-0.8 V),3.64(-0.85 V)及3.60(-0.9 V),可知其平均转移电子数为3.58,趋近于高效的四电子转移过程。
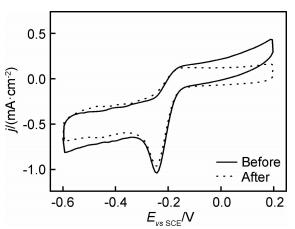
催化剂在测试过程中的稳定性也是判断其电催化性能的关键要素之一。为了探究水热复合对催化剂稳定性能的影响,对其进行了循环稳定性测试。图 6是MoS2/RGO复合材料在循环测试1000周次前后的CV图。可以看出,循环1000周次后MoS2/RGO催化剂的峰电位几乎没有变化,峰电流密度(-0.97 mA·cm-2)略有减小,为测试前的93.3%。而作为参照的Pt/C催化剂,在其循环测试1000周次后,电流密度保持率远低于MoS2/RGO催化剂[23]。
|
图 6 MoS2/RGO在O2饱和的0.1 mol·L-1 KOH中循环测试1000周次前后的CV图 Fig. 6 CV curves of MoS2/RGO in O2-saturated 0.1 mol·L-1KOH before and after 1000 cycles |
将MoS2/RGO与Pt/C的催化活性进行对比,并通过恒电位计时电流法测定MoS2/RGO催化剂催化氧还原过程中电流密度随时间变化的趋势。图 7为极化电位为-0.8 V时测定的MoS2/RGO复合物与Pt/C电流密度的变化曲线,插图为二者的LSV曲线。从LSV曲线的对比可见,MoS2/RGO的起始电压接近Pt/C商用催化剂,约为-0.2 V。把测试时稳定50 s后的电流密度值设为初始值(j0=2.44 mA·cm-2),经过20000 s测试后,其电流密度为2.19 mA·cm-2,电流密度保持率为89.7%。MoS2/RGO催化剂与商用催化剂Pt/C的j-t曲线对比发现,Pt/C在20000 s测试后电流密度保持率仅为81.2%, 可见复合材料MoS2/RGO催化剂的稳定性高于商用Pt/C催化剂。
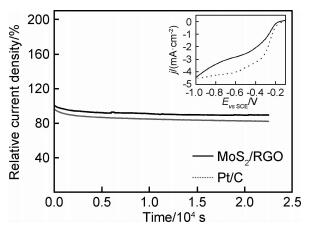
|
图 7 MoS2/RGO和Pt/C在O2饱和的0.1 mol·L-1 KOH中20000 s测试后的电流保持率(插图为MoS2/RGO和Pt/C的LSV曲线) Fig. 7 Relative current of MoS2/RGO and Pt/C in O2-saturated 0.1 mol·L-1 KOH after 20000 s(inset is LSV curvesof MoS2/RGO and Pt/C) |
(1) 水热法合成的MoS2呈片层状的花瓣形貌。与RGO复合后,MoS2花瓣状结构层数变少,层间距增加,且均匀附着在透明的RGO薄层上。
(2) 复合催化剂MoS2/RGO表现出良好的氧还原催化性能,其催化氧还原过程中平均转移电子数为3.58。
(3) 复合催化剂MoS2/RGO表现出近于Pt/C的催化活性,但高于Pt/C的催化稳定性,经20000 s测试后的电流密度保持率为89.7%,高于Pt/C的81.2%,有望成为替代商用催化剂Pt/C的非贵金属氧还原催化剂。
| [1] |
ALONSO-VANTE N, TRIBUTSCH H. Energy conversion catalysis using semiconducting transition metal cluster compounds[J]. Nature, 1986, 323(6087): 431-432. DOI:10.1038/323431a0 |
| [2] |
SUN T, WU Q, CHE R, et al. Alloyed Co-Mo nitride as high-performance electrocatalyst for oxygen reduction in acidic medium[J]. ACS Catalysis, 2015, 5(3): 1857-1862. DOI:10.1021/cs502029h |
| [3] |
史艳华, 赵杉林, 王玲, 等. 稀土Ce掺杂纳米晶Mn-Mo-Ce氧化物阳极及其选择电催化性能[J]. 材料工程, 2017, 45(9): 72-80. SHI Y H, ZHAO S L, WANG L, et al. Nanocrystalline Mn-Mo-Ce oxide anode doped rare earth Ce and its selective electro-catalytic performance[J]. Journal of Materials Engineering, 2017, 45(9): 72-80. |
| [4] |
ZIEGELBAUER J M, OLSON T S, PYLYPENKO S, et al. Direct spectroscopic observation of the structural origin of peroxide generation from Co-based pyrolyzed porphyrins for ORR applications[J]. Journal of Physical Chemistry C, 2008, 112(24): 8839-8849. DOI:10.1021/jp8001564 |
| [5] |
FERNANDEZ J L, RAGHUVEER V, MANTHIRAM A, et al. Pd-Ti and Pd-Co-Au electrocatalysts as a replacement for platinum for oxygen reduction in proton exchange membrane fuel cells[J]. Journal of the American Chemical Society, 2005, 127(38): 13100-13101. DOI:10.1021/ja0534710 |
| [6] |
GUO S J, LI D G, ZHU H Y, et al. Fe/Pt and Co/Pt nanowires as efficient catalysts for the oxygen reduction reaction[J]. Ange-wandte Chemie, 2013, 52(12): 3465-3468. DOI:10.1002/anie.201209871 |
| [7] |
RAMASWAMY N, ALLEN R J, MUKERJEE S. Electrochemical kinetics and X-ray absorption spectroscopic investigations of oxygen reduction on chalcogen-modified ruthenium catalysts in alkaline media[J]. Journal of Physical Chemistry C, 2011, 115(25): 12650-12664. DOI:10.1021/jp201841j |
| [8] |
WANG T Y, GAO D L, ZHUO J Q, et al. Size-dependent enhancement of electrocatalytic oxygen-reduction and hydrogen-evolution performance of MoS2 particles[J]. Chemistry-A Euro-pean Journal, 2013, 19(36): 11939-11948. DOI:10.1002/chem.201301406 |
| [9] |
WANG T Y, ZHUO J Q, CHEN Y, et al. Synergistic catalytic effect of MoS2 nanoparticles supported on gold nanoparticle films for a highly efficient oxygen reduction reaction[J]. Chemcat-chem, 2014, 6(7): 1877-1881. DOI:10.1002/cctc.201402038 |
| [10] |
ENG A Y S, AMBROSI A, SOFER Z, et al. Electrochemistry of transition metal dichalcogenides:strong dependence on the metal-to-chalcogen composition and exfoliation method[J]. ACS Nano, 2014, 8(12): 12185-12198. DOI:10.1021/nn503832j |
| [11] |
XIE J F, ZHANG J J, LI S, et al. Correction to controllable disorder engineering in oxygen-incorporated MoS2 ultrathin nanosheets for efficient hydrogen evolution[J]. Journal of the American Chemical Society, 2013, 135(47): 17881-17888. DOI:10.1021/ja408329q |
| [12] |
SHAO J, QU Q T, WAN Z M, et al. From dispersed micro-spheres to interconnected nanospheres:carbon-sandwiched monolayered MoS2 as high-performance anode of Li-ion batteries[J]. ACS Applied Materials & Interfaces, 2015, 7(41): 22927-22934. |
| [13] |
XIONG F Y, CAI Z Y, QU L B, et al. Three-dimensional crumpled reduced graphene oxide/MoS2 nanoflowers:a stable anode for lithium-ion batteries[J]. ACS Applied Materials & Interfaces, 2015, 7(23): 12625-12630. |
| [14] |
LI H L, YU K, FU H, et al. MoS2/graphene hybrid nanoflowers with enhanced electrochemical performances as anode for lithium-ion batteries[J]. Journal of Physical Chemistry C, 2015, 119(14): 7959-7968. DOI:10.1021/acs.jpcc.5b00890 |
| [15] |
王铁钢, 李柏松, 阎兵, 等. 爆炸喷涂WC-Co/MoS2-Ni多层复合自润滑涂层的摩擦学行为[J]. 材料工程, 2017, 45(3): 73-79. WANG T G, LI B S, YAN B, et al. Tribological behavior of multi-layered WC-Co/MoS2-Ni self-lubricating coating fabricated by detonation gun spraying[J]. Journal of Materials Engi-neering, 2017, 45(3): 73-79. |
| [16] |
LEVITA G, CAVALEIRO A, MOLINARI E, et al. Sliding properties of MoS2 layers:load and interlayer orientation effects[J]. Journal of Physical Chemistry C, 2014, 118(25): 13809-13816. DOI:10.1021/jp4098099 |
| [17] |
MA X Y, WANG Q, GU W X. Enhancement of photoelectric efficiency via optimization of absorption and excitation of surface plasmons in ZnO/CdS/MoS2/Ag multilayer films[J]. Journal of Nanoelectronics and Optoelectronics, 2015, 10(2): 191-194. DOI:10.1166/jno.2015.1726 |
| [18] |
ZHAO M, CHANG M J, WANG Q, et al. Unexpected optical limiting properties from MoS2nanosheets modified by a semiconductive polymer[J]. Chemical Communication, 2015, 51(61): 12262-12265. DOI:10.1039/C5CC01819F |
| [19] |
王莹, 李勇, 朱靖, 等. 氧化石墨烯表面稀土改性机理[J]. 材料工程, 2018, 46(5): 29-35. WANG Y, LI Y, ZHU J, et al. Surface modification mechanism of graphene oxide by adding rare earths[J]. Journal of Materials Engineering, 2018, 46(5): 29-35. |
| [20] |
曾斌, 陈小华, 汪次荣. 石墨烯负载硫化锌/硫化铜异质结的制备及光催化性能[J]. 材料工程, 2017, 45(12): 99-105. ZENG B, CHEN X H, WANG C R. Synthesis and photocatalytic properties of reduced graphene oxides loaded-nano ZnS/CuS heterostructures[J]. Journal of Materials Engineering, 2017, 45(12): 99-105. DOI:10.11868/j.issn.1001-4381.2015.001112 |
| [21] |
CHANG K, CHEN W X. Single-layer MoS2/graphene dispersed in amorphous carbon:towards high electrochemical perfor-mances in rechargeable lithium ion batteries[J]. Journal of Materials Chemistry, 2011, 21(43): 17175-17184. DOI:10.1039/c1jm12942b |
| [22] |
CHANG K, CHEN W X, MA L, et al. Graphene-like MoS2/amorphous carbon composites with high capacity and excellent stability as anode materials for lithium ion batteries[J]. Journal of Materials Chemistry, 2011, 21(17): 6251-6257. DOI:10.1039/c1jm10174a |
| [23] |
陈亚玲, 宋力, 郭虎, 等. 水热合成二硫化钨/石墨烯复合材料及其氧还原性能[J]. 无机化学学报, 2016, 32(4): 633-640. CHEN Y L, SONG L, GUO H, et al. Hydrothermal synthesis and ORR performance of tungsten disulfide/reduced graphene oxide composite[J]. Chinese Journal of Inorganic Chemistry, 2016, 32(4): 633-640. |
 2020, Vol. 48
2020, Vol. 48


