文章信息
- 李嘉俊, 刘磊, 卢玉晓, 孙之剑, 马蕾
- LI Jia-jun, LIU Lei, LU Yu-xiao, SUN Zhi-jian, MA Lei
- 纳米Li2MnSiO4正极材料的高压水热法制备及其电化学特性
- Preparation and electrochemical characteristics of nanoscale Li2MnSiO4 cathode material by high pressure hydrothermal method
- 材料工程, 2019, 47(9): 108-115
- Journal of Materials Engineering, 2019, 47(9): 108-115.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2018.000682
-
文章历史
- 收稿日期: 2018-06-06
- 修订日期: 2018-10-12
正极材料是制约大功率、长寿命锂离子电池发展的重要因素之一。近年来,聚阴离子型正极材料迅速发展,其中硅酸盐系化合物Li2MSiO4(M=Ni,Co,Mn,Fe)受到了人们广泛关注[1-6]。Li2MSiO4的结构中有两个锂,理论上可以实现两个锂的可逆脱嵌,理论容量高达333mAh·g-1。2005年,Nytén等[1]用固相法首次制备出了纯相的Li2FeSiO4正极材料。然而,由于Fe4+很不稳定,Fe3+/Fe4+的转变过程比较困难,导致其第二个锂离子难以脱嵌。相对来说硅酸盐系的Li2MnSiO4较易实现Mn3+/Mn4+转变[7-8],而且Li2MnSiO4脱嵌锂的电压平台较高[9-10],两次电压平台相差较小,更容易实现二次脱锂。因此Li2MnSiO4被认为是很有前景的锂离子电池正极材料的候选者[11-12]。
目前报道的Li2MnSiO4正极材料的合成方法多为高温固相法[13-18]和溶胶凝胶法[3, 19-24],而采用水热法[25-26]、微波法[27]等方法制备Li2MnSiO4的报道相对较少。Gummow等[13]、Liu等[16]、Gao等[17]采用高温固相法合成了Li2MnSiO4材料,其中Gao等[17]制备的Li2MnSiO4首次放电比容量可达152mAh·g-1,循环15次后仍有73.5%的容量保持率。Aravindan等[20]、Ghosh等[21]、Qu等[22]采用溶胶凝胶法合成了纳米级的Li2MnSiO4材料,其中Aravindan等[20]制备的Li2MnSiO4颗粒细小均一,粒径在25~30nm范围内,其电化学性能显示在0.05C下Li2MnSiO4可实现0.97个Li+的可逆脱嵌。高温固相法和溶胶凝胶法都需要在较高温度(600~900℃)下进行烧结,相对来说水热法合成Li2MnSiO4的温度较低且可控性较好。Hwang等[25]、Luo等[26]采用传统水热法分别在200℃和170℃条件下合成了Li2MnSiO4材料,其中Luo等[26]合成的Li2MnSiO4颗粒具有独特的花状形貌,平均粒径为20nm,在0.05C下首次放电比容量高达226mAh·g-1。然而,水热生长的动力学因素,包括压强、反应温度、前驱体浓度等对Li2MnSiO4的形貌结构、颗粒大小等方面的影响尚不够深入,仍需要进一步深入研究。
本工作以氯化锰(MnCl2·4H2O)、二氧化硅(SiO2)和氢氧化锂(LiOH·H2O)为前驱体,采用高压水热法制备Li2MnSiO4正极材料。通过X射线衍射图、扫描电镜和透射电镜研究了压强、反应温度和前驱体浓度对Li2MnSiO4结构、形貌和晶粒大小的影响,通过充放电分析、循环倍率特性分析和交流阻抗分析进一步研究了碳包覆前后Li2MnSiO4的电化学性能。
1 实验材料与方法 1.1 样品制备首先称取摩尔比为1:1:2的MnCl2·4H2O, SiO2和LiOH·H2O在600mL去离子水中混合,制备混合溶液,在磁力搅拌作用下充分混合至形成土黄色混合溶液,然后将混合溶液快速转移到高压反应釜中密封,并向高压反应釜中充入适量氩气使体系的工作压强达到22MPa,分别在150, 180, 210℃和240℃条件下反应6h。反应结束后,用去离子水和乙醇对产物进行多次洗涤,并在60℃条件下干燥48h,即得到黄色Li2MnSiO4样品。将干燥好的Li2MnSiO4样品与一定量的蔗糖在适量的分散剂辅助下均匀混合,研磨后干燥,随后将混合后的样品放入高温管式炉中,在氩气氛围下先于350℃煅烧2h,再升到600℃煅烧4h,即得到黑色Li2MnSiO4/C样品。
1.2 电池组装将制备的Li2MnSiO4活性物质、导电剂乙炔黑和黏结剂聚偏氟乙烯(PVDF)按质量比8:1:1均匀混合,加入适量N-甲基吡咯烷酮(NMP)作为分散剂制成浆料,以铝箔为集流电极,涂覆后在80℃下干燥12h得到电池正极片。以金属锂片作为负极,聚丙烯多孔膜(Celgard 2400)作为隔膜,1mol·L-1的LiPF6/碳酸乙烯酯(EC)+碳酸二乙酯(DEC)(体积比为1:1)作为电解液,在氩气手套箱内组装成扣状半电池。
1.3 材料表征与电化学测试用TD-3500X射线衍射仪对样品进行物相和结构分析,辐射源为CuKα,扫描范围为10°~80°。采用扫描电镜和透射电镜研究样品的形貌和微观结构。采用ParStat4000电化学工作站对样品进行交流阻抗测试。通过CT-3008-5V10mA-164电化学测试系统分析样品的电化学特性,电压范围为1.5~4.5V。
2 结果与分析 2.1 物相分析图 1为不同压强与反应温度下反应6h所得Li2MnSiO4样品的X射线衍射图,其中图 1(a)和图 1(b)分别为150℃和240℃条件下样品的X射线衍射图。由图 1(a)可知,没有充气加压的条件下,150℃的反应体系压强约1MPa,此时虽然也有Li2MnSiO4晶体形成,但样品含有较多Li2SiO3杂质。当充气加压使反应压强达到22MPa时,Li2SiO3杂质衍射峰强度明显降低。反应温度升高240℃时,自然反应压强约3MPa左右,此压强下样品的衍射峰强度仍然较弱,并含有Li2SiO3杂质。而压强为22MPa时,样品的衍射峰强度显著提高,同时Li2SiO3杂质峰消失,这表明高压条件有利于合成高纯度的Li2MnSiO4。进一步分析表明制备的Li2MnSiO4样品为正交晶系Pmn21空间群,这一结果与Ghosh等[21]、Hwang等[25]的报道一致。计算得出Li2MnSiO4样品的晶格参数为a=0.6254nm,b=0.5297nm,c=0.4904nm。

|
图 1 不同压强与反应温度下所得Li2MnSiO4样品的X射线衍射图 (a)150℃;(b)240℃ Fig. 1 X-ray diffraction patterns of Li2MnSiO4 samples with different pressures and reaction temperatures (a)150℃; (b)240℃ |
反应温度是影响Li2MnSiO4合成的重要条件之一。图 2(a)为22MPa的压强在4种反应温度下反应6h所得Li2MnSiO4样品的X射线衍射图。可知,随着反应温度的升高,样品的主衍射峰强度逐渐增强,半高宽逐渐变窄,表明晶粒在逐渐变大,结晶度在逐渐提高。同时,Li2SiO3杂质峰的强度也随反应温度的升高明显降低,表明样品中的杂质含量在逐渐减少。当反应温度为240℃时,Li2SiO3杂质峰消失,所得样品为高纯的Li2MnSiO4晶体。根据Scherrer公式:
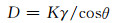
|
(1) |
|
图 2 不同反应温度所得Li2MnSiO4样品的X射线衍射图(a)和晶粒大小图(b) Fig. 2 X-ray diffraction patterns obtained at different reaction temperatures (a) and grain sizes(b) of Li2MnSiO4 samples |
式中:K为Scherrer常数;γ为X射线的波长;B为衍射峰半高宽;θ为衍射角;D为晶粒垂直于晶面方向的平均厚度。计算出不同反应温度下样品晶粒的大小如图 2(b)所示。可知,随温度升高,样品晶粒尺寸逐渐增大,240℃时晶粒平均尺寸为60.6nm。这是由于温度升高,促进了生长基元之间的相互碰撞,从而促进了晶粒的生长。因此,较高温度有利于获得晶粒尺寸较大的Li2MnSiO4材料。
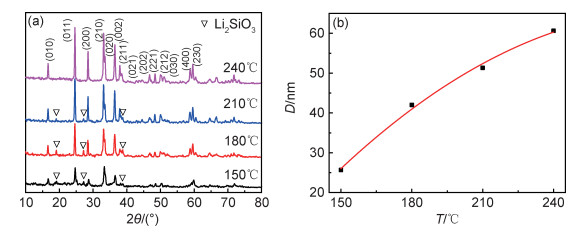
为了进一步研究前驱体浓度对合成Li2MnSiO4的影响,在240℃和22MPa下反应6h,考察4种前驱体浓度条件下制备的Li2MnSiO4,样品的X射线衍射图如图 3(a)所示。可知,随着前驱体浓度增加,样品的衍射峰强度略有减小。4种前驱体浓度下所得Li2MnSiO4的晶粒大小如图 3(b)所示。前驱体中反应物浓度由1mol·L-1增加到2.5mol·L-1,样品晶粒平均尺寸由60.6nm减小到43.4nm。这是由于浓度增加,导致溶液的过饱和度增大,较大的过饱和度有利于提高水热生长过程中的成核密度,进而减小了晶粒的平均尺寸。
|
图 3 不同前驱体浓度在240℃下所得Li2MnSiO4样品的X射线衍射图(a)和晶粒大小图(b) Fig. 3 X-ray diffraction patterns obtained at different precursor concentrations at 240℃ (a) and grain sizes (b) of Li2MnSiO4 samples |
图 4(a), (b),(c)分别为在22MPa压强下180, 210, 240℃下反应6h所制备的Li2MnSiO4样品的SEM图。可以看到当反应温度为180℃时,反应产物形貌为不规则颗粒,并且可以观察到明显的团聚现象,这一现象在反应产物颗粒尺寸较小时较为常见[28]。随着温度的升高,样品颗粒尺寸逐渐变大,团聚现象得到明显改善。当反应温度达到240℃时,样品颗粒最大且较为均匀,尺寸分布在100~300nm范围内。但是,在不同压强和不同前驱体浓度下得到的Li2MnSiO4样品颗粒的形貌均未发生明显的变化。图 4(d)为Li2MnSiO4样品的TEM图,插图为高分辨图像。由图像可知,Li2MnSiO4晶格排列整齐,结晶度良好。

|
图 4 不同反应温度下的Li2MnSiO4的SEM图 (a)180℃;(b)210℃;(c)240℃;(d)Li2MnSiO4样品的TEM图 Fig. 4 SEM images of Li2MnSiO4 sample at different reaction temperatures (a)180℃; (b)210℃; (c)240℃; (d)TEM image of Li2MnSiO4 sample |
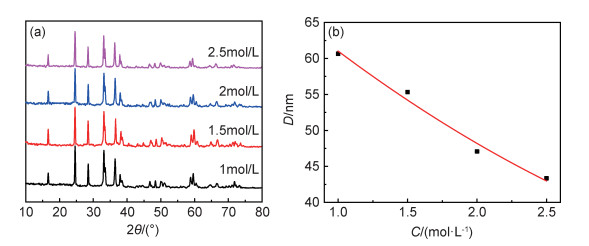
将2.5mol·L-1的前驱体浓度在22MPa,240℃下反应6h所制备的Li2MnSiO4封装成扣装半电池进行电化学性能测试。图 5(a)为Li2MnSiO4和Li2MnSiO4/C样品在0.1C下的首次充放电图。由图 5(a)可知,Li2MnSiO4首次充电比容量为195.2mAh·g-1,放电比容量为121.7mAh·g-1,较大的不可逆容量损失使得样品在首次充放电过程中的库仑效率只有62.3%。较低的库仑效率是由脱锂态Li2-xMnSiO4的结构不稳定造成的,脱锂后的Li2-xMnSiO4容易由晶态转化为非晶态[2]。Dominko[29]也指出Li2MnSiO4充放电时由于Jahn-Teller效应引起结构不稳定,导致材料快速粉化,从而对电化学性能产生不利影响。利用碳包覆改性后,Li2MnSiO4/C的首次充电比容量达到225.2mAh·g-1,放电比容量为178.6mAh·g-1,库仑效率提高到79.3%。50次循环后,Li2MnSiO4/C的充放电比容量都明显高于Li2MnSiO4的充放电比容量,如图 5(b)所示。这一放电比容量比Dong等[30]、Wang等[31]报道的用La3+(0.05C,257mAh·g-1),Ni2+(0.05C,274.5mAh·g-1)掺杂改性后的Li2MnSiO4/C材料要低,主要是由于La3+,Ni2+等金属阳离子掺杂后改善了活性材料载流子的扩散能力。
|
图 5 Li2MnSiO4和Li2MnSiO4/C样品首次充放电曲线(a)和第50次的充放电曲线(b) Fig. 5 First charge-discharge curves(a) and 50th charge-discharge curves(b) of Li2MnSiO4 and Li2MnSiO4/C samples |
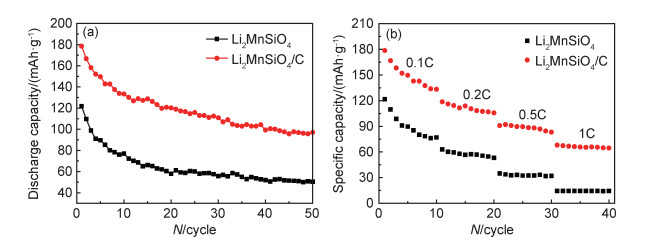
图 6(a)为Li2MnSiO4和Li2MnSiO4/C样品在0.1C下循环50次的循环特性图。在前10次循环过程中,两种样品的放电比容量都表现出较快的衰减趋势。在随后的循环中,两种样品放电比容量的衰减速度变缓且逐渐趋于稳定。循环50次后,Li2MnSiO4容量保持率为42.7%,而Li2MnSiO4/C的容量保持率为54.4%。循环性能的提升表明Li2MnSiO4/C表面的碳包覆层在一定程度上提高了脱锂时自身结构的稳定性。图 6(b)为两种样品的倍率特性图。随倍率增大,两种样品的放电比容量均显著降低,但Li2MnSiO4/C在不同倍率下仍比Li2MnSiO4具有更高的放电比容量。碳包覆后Li2MnSiO4/C的电化学性能的改善得益于Li2MnSiO4/C颗粒上的碳包覆层在充放电过程中为电子提供了快速传输通道,从而提高了材料表面的导电能力。
|
图 6 Li2MnSiO4和Li2MnSiO4/C样品的循环特性图和(a)和倍率特性图(b) Fig. 6 Cycle characteristics (a) and rate characteristics(b) of Li2MnSiO4 and Li2MnSiO4/C samples |
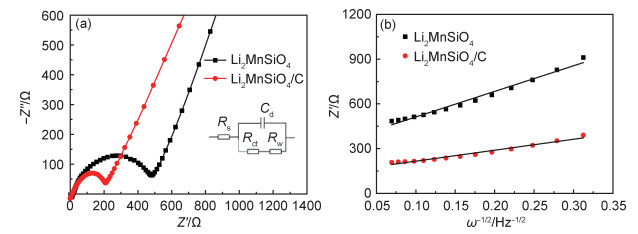
图 7(a)为Li2MnSiO4和Li2MnSiO4/C样品的EIS图。交流阻抗图是由一个半圆的高频部分和一条直线的低频部分组成,高频区半圆的左截距是样品电极和电极夹的系统电阻Rs,半圆的右截距是样品的电荷转移阻抗Rct,低频区域的直线表示由锂离子扩散过程引起的Warburg阻抗Rw。根据锂离子扩散系数DLi和Warburg系数σ的关系式:
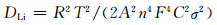
|
(2) |
|
图 7 Li2MnSiO4和Li2MnSiO4/C样品的交流阻抗图(a),Z′和ω-1/2在低频区的拟合图(b) Fig. 7 Alternating-current impedance plots(a) and fitting plots of Z′ and ω-1/2 in the low frequency region(b) of Li2MnSiO4 and Li2MnSiO4/C samples |
即可求出样品的DLi。式中,R为理想气体常数;T为室温;A为电极表面积,为2cm2;n为电荷转移数;F为法拉第常数;C为锂离子浓度。Warburg系数σ与Z′的值和低频区的频率ω存在如下关系:
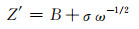
|
(3) |
式中,B为常量。以Z′为y轴,ω-1/2为x轴作图即得到一条直线如图 7(b)所示,直线的斜率即为σ的值。计算结果为Li2MnSiO4的Rct=484.1Ω,DLi=3.01×10-15cm2·s-1;Li2MnSiO4/C的Rct=207.6Ω,DLi=1.64×10-14cm2·s-1。这表明Li2MnSiO4/C颗粒表面的碳包覆层有效地减小了材料的电荷转移阻抗,提高了材料的锂离子扩散系数,因此更有利于锂离子的扩散,从而改善了材料的电化学性能。表 1总结了近年来不同方法制备的Li2MnSiO4样品的锂离子扩散系数。
| Sample | Preparation method | DLi/(cm2·s-1) | Reference |
| Li2MnSiO4/CLi2Mn0.9La0.1SiO4/CLi2Mn0.6La0.4SiO4/C | Polyol-assisted hydrothermal method | 1.78×10-152.84×10-143.05×10-15 | [30] |
| Li2MnSiO4Li2MnSiO4/C(LMS@Ni)/C | Solvothermal method | 5.11×10-181.61×10-172.96×10-17 | [31] |
| Li2MnSiO4Li2MnSiO4/C | Hydrothermal assisted method | 3.42×10-163.34×10-14 | [32] |
| Li2MnSiO4/C1%MoO2-Li2MnSiO4C | Sol-gel method | 4.94×10-162.40×10-15 | [33] |
| Li2MnSiO4Li2MnSiO4/C | High pressure hydrothermal method | 3.01×10-151.64×10-14 | In thispaper |
通过以上分析发现,目前Li2MnSiO4的电化学性能,尤其是循环特性有待进一步提高。虽然通过碳包覆的方法提高了Li2MnSiO4的充放电比容量,并有效提高了其锂离子的扩散系数,但是该方法没能明显改善其循环特性。另一种常用的改性方法为替位式掺杂改性,目前罗邵华等[34]、胡传跃等[35]、刘文刚等[36]已采用Mg2+,Ni2+,Ti2+等金属阳离子对Li2MnSiO4进行了掺杂,虽然对电化学性能有所改善,但仍未能有效解决Li2MnSiO4循环初期较大的不可逆容量损失的问题。因此,寻找合适的掺杂元素,在提高材料电导率的基础上,有效抑制锂离子脱嵌后的结构不稳定性,将是提高Li2MnSiO4循环特性的重要途径。
3 结论(1) 采用高压水热法以MnCl2·4H2O,SiO2和LiOH·H2O为前驱体在22MPa的压强下成功制备了Li2MnSiO4纳米材料。
(2) 高压和高温条件均有利于合成高纯度的Li2MnSiO4,前驱体浓度增大使得Li2MnSiO4的平均晶粒尺寸减小。
(3) 碳包覆后的Li2MnSiO4/C在0.1C下首次充电比容量为225.2mAh·g-1,放电比容量为178.6mAh·g-1,库仑效率为79.3%,循环50次后仍有54.4%的容量保持率。同时,碳包覆后的Li2MnSiO4/C的锂离子扩散系数为1.64×10-14cm2·s-1,相对于未包覆的Li2MnSiO4的锂离子扩散系数(3.01×10-15cm2·s-1)提高了一个数量级,表明碳包覆有效地减小了材料的电荷转移阻抗,提高了锂离子的扩散系数。
| [1] | NYTEN A, ABOUIMRANE A, ARMAND M, et al. Electro-chemical performance of Li2FeSiO4 as a new Li-battery cathode material[J]. Electrochem Commun, 2005, 7 (2): 156–160. DOI: 10.1016/j.elecom.2004.11.008 |
| [2] | KOKALJ A, DOMINKO R, MALI G, et al. Beyond one-ele-ctron reaction in Li cathode materials:designing Li2MnxFe1-xSiO4[J]. Chem Mat, 2007, 19 (15): 3633–3640. DOI: 10.1021/cm063011l |
| [3] | DENG C, ZHANG S, FU B L, et al. Characterization of Li2MnSiO4 and Li2eSiO4 cathode materials synthesized via a citric acid assisted sol-gel method[J]. Materials Chemistry and Physics, 2010, 120 (1): 14–17. |
| [4] | DOMINKO R, BELE M, GABERSCEK M, et al. Structure and electrochemical performance of Li2MnSiO4 and Li2FeSiO4 as pot-ential Li-battery cathode materials[J]. Electrochem Commun, 2006, 8 (2): 217–222. DOI: 10.1016/j.elecom.2005.11.010 |
| [5] | LIU L, WANG P F, LI J J, et al. Hydrothermal preparation and intrinsic transport properties of nanoscale Li2FeSiO4[J]. Solid State Ionics, 2018, 320 : 353–359. DOI: 10.1016/j.ssi.2018.03.025 |
| [6] |
胡国荣, 曹雁冰, 彭忠东, 等. 微波合成法制备锂离子电池正极材料Li2FeSiO4[J].
物理化学学报, 2009, 25 (5): 1004–1008.
HU G R, CAO Y B, PENG Z D, et al. Preparation of Li2FeSiO4 cathode material for lithium-ion batteries by microwave synthesis[J]. Acta Physico-Chimica Sinica, 2009, 25 (5): 1004–1008. DOI: 10.3866/PKU.WHXB20090418 |
| [7] | DOMINKO R, BELE M, KOKALJ A, et al. Li2MnSiO4 as a potential Li-battery cathode material[J]. J Power Sources, 2007, 174 (2): 457–461. DOI: 10.1016/j.jpowsour.2007.06.188 |
| [8] | DOMPABLO A D, ARMAND M, TARSCON J M, et al. On-demand design of polyoxianionic cathode materials based on elect-ronegativity correlations:an exploration of the Li2MSiO4 system (M=Fe, Mn, Co, Ni)[J]. Electrochem Commun, 2006, 8 (8): 1292–1298. DOI: 10.1016/j.elecom.2006.06.003 |
| [9] |
戴丽琴, 吴锋, 官亦标, 等. 石墨烯-Li2MnSiO4复合正极材料的合成与电化学性能研究[J].
化学学报, 2014, 72 (5): 583–589.
DAI L Q, WU F, GUAN Y B, et al. Synthesis and electroch-emical performance of graphene-Li2MnSiO4 composite[J]. Acta Chim Sin, 2014, 72 (5): 583–589. |
| [10] | AONO S, TSURUDO T, URITA K, et al. Direct synthesis of novel homogeneous nanocomposites of Li2MnSiO4 and carbon as a potential Li-ion battery cathode material[J]. Chem Commun, 2013, 49 (28): 2939–2941. DOI: 10.1039/c3cc40673c |
| [11] | BHASKAR A, DEEPA M, RAO T N, et al. In situ carbon coated Li2MnSiO4/C composites as cathodes for enhanced perfo-rmance Li-ion batteries[J]. J Electrochem Soc, 2012, 159 (12): A1954–A1960. DOI: 10.1149/2.042212jes |
| [12] |
高伟, 包丽颖, 苏岳锋, 等. Li2MnSiO4/CNTs复合正极材料的合成与电化学性能[J].
高等学校化学学报, 2013, 34 (7): 1709–1713.
GAO W, BAO L Y, SU Y F, et al. Preparation and electroch-emical performance of Li2MnSiO4/CNTs composite cathode material for lithium ion batteries[J]. Chem J Chin Univ-Chin, 2013, 34 (7): 1709–1713. |
| [13] | GUMMOW R J, SHARMA N, PETERSON V K, et al. Crystal chemistry of the Pmnb polymorph of Li2MnSiO4[J]. J Solid State Chem, 2012, 188 (22): 32–37. |
| [14] | KARTHIKEYAN K, ARAVINDAN V, LEE S B, et al. Elec-trochemical performance of carbon-coated lithium manganese silicate for asymmetric hybrid supercapacitors[J]. J Power Sources, 2010, 195 (11): 3761–3764. DOI: 10.1016/j.jpowsour.2009.11.138 |
| [15] | LIU J, XU H Y, JIANG X L, et al. Facile solid-state synthesis of Li2MnSiO4/C nanocomposite as a superior cathode with a long cycle life[J]. J Power Sources, 2013, 231 (6): 39–43. |
| [16] | LIU W G, XU Y H, YANG R. Synthesis, characterization and electrochemical performance of Li2MnSiO4/C cathode material by solid-state reaction[J]. J Alloy Compd, 2009, 480 (2): L1–L4. DOI: 10.1016/j.jallcom.2009.01.110 |
| [17] | GAO K, DAI C S, LV J, et al. Thermal dynamics and optim-ization on solid-state reaction for synthesis of Li2MnSiO4 mat-erials[J]. J Power Sources, 2012, 211 : 97–102. DOI: 10.1016/j.jpowsour.2012.03.048 |
| [18] | POLITAEV V V, PETRENKO A A, NALBANDYAN V B, et al. Crystal structure, phase relations and electrochemical prop-erties of monoclinic Li2MnSiO4[J]. J Solid State Chem, 2007, 180 (3): 1045–1050. DOI: 10.1016/j.jssc.2007.01.001 |
| [19] | ARAVINDAN V, RAVI S, KIM W S, et al. Size controlled synthesis of Li2MnSiO4 nanoparticles:effect of calcination temperature and carbon content for high performance lithium batteries[J]. J Colloid Interface Sci, 2011, 355 (2): 472–477. DOI: 10.1016/j.jcis.2010.12.038 |
| [20] | ARAVINDAN V, KARTHIKEYAN K, RAVI S, et al. Adipic acid assisted sol-gel synthesis of Li2MnSiO4 nanoparticles with improved lithium storage properties[J]. J Mater Chem, 2010, 20 (35): 7340–7343. DOI: 10.1039/c0jm01635g |
| [21] | GHOSH P, MAHANTY S, BASU R N. Improved electroch-emical performance of Li2MnSiO4/C composite synthesized by combustion technique[J]. J Electrochem Soc, 2009, 156 (8): A677–A681. DOI: 10.1149/1.3141517 |
| [22] | QU L, FANG S H, YANG L, et al. Synthesis and characteri-zation of high capacity Li2MnSiO4/C cathode material for lithium-ion battery[J]. J Power Sources, 2014, 252 : 169–175. DOI: 10.1016/j.jpowsour.2013.11.076 |
| [23] | LI Y X, GONG Z L, YANG Y. Synthesis and characterization of Li2MnSiO4/C nanocomposite cathode material for lithium ion batteries[J]. J Power Sources, 2007, 174 (2): 528–532. DOI: 10.1016/j.jpowsour.2007.06.126 |
| [24] | ZHANG Q Q, ZHUANG Q C, XU S D, et al. Synthesis and characterization of pristine Li2MnSiO4 and Li2MnSiO4/C cathode materials for lithium ion batteries[J]. Ionics, 2012, 18 (5): 487–494. DOI: 10.1007/s11581-011-0657-9 |
| [25] | HWANG J, PARK S, PARK C, et al. Hydrothermal synthesis of Li2MnSiO4:mechanism and influence of precursor concen-tration on electrochemical properties[J]. Metals and Materials International, 2013, 19 (4): 855–860. DOI: 10.1007/s12540-013-4029-z |
| [26] | LUO S H, WANG M, SUN W N. Fabricated and improved electrochemical properties of Li2MnSiO4 cathodes by hydrother-mal reaction for Li-ion batteries[J]. Ceramics International, 2012, 38 (5): 4325–4329. DOI: 10.1016/j.ceramint.2012.02.014 |
| [27] | MURALIGANTH T, STROUKOFF K R, MANTHIRAM A. Microwave-solvothermal synthesis of nanostructured Li2MSiO4/C (M=Mn and Fe) cathodes for lithium-ion batteries[J]. Chem Mat, 2010, 22 (20): 5754–5761. DOI: 10.1021/cm102058n |
| [28] |
庞维强, 樊学忠, 张教强. 纳米颗粒在制备过程中团聚现象的研究进展[J].
化学工业与工程技术, 2008, 29 (3): 19–23.
PANG W Q, FAN X Z, ZHANG J Q. Research progress on agglomeration of nanoparticle in its preparation[J]. Journal of Chemical Industry & Engineering, 2008, 29 (3): 19–23. DOI: 10.3969/j.issn.1006-7906.2008.03.006 |
| [29] | DOMINKO R. Li2MSiO4 (M=Fe and/or Mn) cathode materials[J]. J Power Sources, 2008, 184 (2): 462–468. DOI: 10.1016/j.jpowsour.2008.02.089 |
| [30] | DONG Y, ZHANG W L, WANG C M, et al. Synthesis of La-doped Li2MnSiO4 nano-particle with high-capacity via polyol-assisted hydrothermal method[J]. Electrochimica Acta, 2015, 166 : 40–46. DOI: 10.1016/j.electacta.2015.02.236 |
| [31] | WANG Y C, ZHAO S X, ZHAI P Y, et al. Solvothermal syn-thesis and electrochemical performance of Li2MnSiO4/C cathode materials for lithium ion batteries[J]. J Alloy Compd, 2014, 614 (10): 271–276. |
| [32] | LIU S K, XU J, LI D Z, et al. High capacity Li2MnSiO4/C nanocomposite prepared by sol-gel method for lithium-ion bat-teries[J]. J Power Sources, 2013, 232 (18): 258–263. |
| [33] | ZHU J T, TANG H Q, TANG Z Y, et al. Facile one step syn-thesis and enhanced electrochemical performance of molybdenum dioxide and carbon co-modified lithium manganese silicate cath-ode materials for lithium-ion batteries[J]. Electrochimica Acta, 2015, 166 : 183–189. DOI: 10.1016/j.electacta.2015.03.094 |
| [34] |
罗绍华, 李思, 王铭. Li2Mn1-xMgxSiO4正极材料合成与电化学性能[J].
稀有金属材料与工程, 2012, 41 (9): 118–122.
LUO S H, LI S, WANG M. Synthesis and electrochemical performance of Li2Mn1-xMgxSiO4 cathode materials for Li-ion battery[J]. Rare Metal Mat Eng, 2012, 41 (9): 118–122. |
| [35] |
胡传跃, 郭军, 文瑾. 锂离子电池Li2NixMn1-xSiO4(x=0.4~0.7)正极材料的电化学性能[J].
矿冶工程, 2013, 33 (2): 112–115.
HU C Y, GUO J, WEN J. Electrochemical performance of Li2NixMn1-xSiO4(x=0.4-0.7)cathode material for lithium ion batteries[J]. Min Metal Eng, 2013, 33 (2): 112–115. DOI: 10.3969/j.issn.0253-6099.2013.02.029 |
| [36] |
刘文刚, 许云华, 杨蓉, 等. Li2Mn0.1SiO4锂离子电池正极材料的合成及其性能[J].
热加工工艺, 2009, 38 (16): 25–28.
LIU W G, XU Y H, YANG R, et al. Preparation and perfor-mance of Li2Mn0.1SiO4 cathode material for lithium ion batteries[J]. Hot Working Technology, 2009, 38 (16): 25–28. DOI: 10.3969/j.issn.1001-3814.2009.16.008 |
 2019, Vol. 47
2019, Vol. 47


