文章信息
- 李久勇, 刘伟明, 张晓锋, 马一博, 陈牧, 邱然锋, 颜悦
- LI Jiu-yong, LIU Wei-ming, ZHANG Xiao-feng, MA Yi-bo, CHEN Mu, QIU Ran-feng, YAN Yue
- 高离子传导纳米多孔β-Li3PS4固态电解质的湿化学法制备
- Preparation of nanoporous β-Li3PS4 solid electrolyte with high ionic conductivity by wet chemical method
- 材料工程, 2019, 47(9): 101-107
- Journal of Materials Engineering, 2019, 47(9): 101-107.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2018.000134
-
文章历史
- 收稿日期: 2019-02-21
- 修订日期: 2019-05-13
2. 中国航发北京航空材料研究院, 北京 100095;
3. 北京市先进运载系统结构透明件工程技术研究中心, 北京 100095
2. AECC Beijing Institute of Aeronautical Materials, Beijing 100095, China;
3. Beijing Engineering Technology Research Center of Structural Transparent Parts for Advanced Carrier System, Beijing 100095, China
锂离子电池具有能量密度高,循环寿命长,无记忆效应等优势,在移动电子设备、信息通信、交通工具、新能源储能等领域得到了广泛应用[1-2]。由于传统锂离子电池所使用的有机液态电解液具有易泄漏和易燃易爆的风险,因此对于开发具有高安全性的无机固体电解质来替代液体电解液成为当前化学电源领域的研究热点[3]。
无机固态电解质主要包括氧化物和硫化物两大类,其中硫化物系因具有较高的离子电导率和良好的力学性能得到了广泛研究[4]。在硫系电解质中,Li2S-P2S5类物质因具有高离子电导率开发潜力而得到科研人员的广泛研究。例如,Li7P3S11在经过压片热处理后离子电导率高达1.7×10-2S·cm-1,这与目前使用的液体电解质相当[5]。此外,Kamaya等发现的晶体结构Li10GeP2S12[6],在27℃时的离子电导率约为1.2×10-2S·cm-1,但Ge的加入降低了电解质与金属锂负极的兼容性[7]。在Li2S-P2S5体系中,Li3PS4晶体是最稳定的结晶相[8],也是最具应用前景的电解质材料之一。在Li3PS4的3种晶相结构中,γ-Li3PS4为室温稳定相,离子电导率较低,为3.2×10-7 S·cm-1,当加热到195℃时,转变为具有快锂离子通道的亚稳相β-Li3PS4,离子电导率得到显著提高,达到10-4数量级,温度超过473℃后β相转变为高温相α-Li3PS4,降温过程中α相在270℃直接转变为γ相,没有β相产生[9]。这表明采用传统热处理方法无法获得室温稳定的β相。因此,如何将亚稳β相的稳定温度降低到室温,具有重要研究价值。
研究表明,引入无序固溶体[10]和结构纳米化[11-12]可获得室温稳定的亚稳相β-Li3PS4。Liu等通过液相合成制备了纳米多孔β-Li3PS4固态电解质,其室温离子电导率达1.6×10-4S·cm-1,比块体γ-Li3PS4提高了3个数量级[11]。本研究以四氢呋喃作为反应介质,采用湿化学法,制备出Li3PS4·3THF共沉淀前驱体,通过逐步升温加热的方式,有效去除了共沉淀产物中的四氢呋喃分子,制备出具有高离子电导率和低活化能的纳米多孔β-Li3PS4固态电解质,并分析测试了固态电解质的微观结构和电化学性能。
1 实验材料与方法 1.1 实验过程在手套箱(O2含量 < 1×10-7,H2O含量 < 1×10-7)内,将P2S5粉末(分析纯,含P量≥24.0%,国药化学试剂)和Li2S粉末(纯度99.9%, Alfa Aesar)按照摩尔比3:1在玛瑙研钵中直接混合并研磨均匀,之后转移至有一定体积四氢呋喃(Tetrahydrofuran, THF, 纯度99.5%, 分子筛额外干燥,含水量≤5×10-5,安耐吉化学)的锥形瓶中,使用磁力搅拌器以1000r/min转速搅拌20h,得到乳黄色溶胶产物。转移至离心管,以5000r/min转速离心处理5min之后倒出上层黄色清液,加入THF溶剂清洗并再次离心,重复操作3次,直至上层清液透明。使用真空泵室温初步抽除离心产物中的过量溶剂。将真空干燥后的样品研磨成粉末,然后逐步升温并抽真空,在80,90,100,120℃和140℃下依次保温10min,去除样品中以结合物形式存在的THF。将经上述过程干燥后所得样品在140℃下加热1h进行结晶,自然冷却后得到最终产物。整个制备过程均在惰性气体环境中进行。
1.2 表征测试所有样品在测试前均保存在手套箱内,并密封在自制的容器中以隔绝水氧。使用SU-8010型冷场发射扫描电子显微镜(SEM),D8 Advance型X射线衍射仪(XRD),JY HR-800型显微激光拉曼光谱仪(Raman),STA 499 F3型同步热分析仪(TGA-DSC)和TRISTAR Ⅱ 3020M型氮吸附BET比表面与孔分布测试仪对粉末样品进行表征分析。TGA-DSC测试氛围为干燥的氮气。
使用自制绝缘树脂模具和BJ-24型压片机对粉末样品进行冷压并辅助交流阻抗谱测试,样品质量约为0.1g,压强为499MPa,压制后的圆片样品尺寸为ϕ10mm×0.70mm。测试仪器为CHI650e型电化学工作站,频率范围为1Hz至1MHz,阻塞电极为不锈钢(SUS)柱。通过不同温度下测量的交流阻抗计算电解质活化能,测试温度范围为20~80℃,阻抗测试之前样品在每个温度下保温1h。采用CT2001A型LAND电池测试系统进行恒流充放电,测试固态电解质(SE)的对锂稳定性,测试结构为Li/SE/Li对称电池,其中锂片厚度约为0.1mm,电流密度为0.1mA·cm-2,每个充放电循环时间为2h。对SUS/SE/SUS和Li/SE/Li对称电池施加1V的恒定电压,通过测量电流来计算电子电导率并确定样品中锂离子迁移数。通过测试Li/SE/Au电池的循环伏安(CV)曲线来分析电解质样品的电化学窗口,扫描速率为5mV·s-1,测试电压范围为-0.5~5V,其中工作电极为镀金(厚约300nm)铝箔。
2 结果与分析 2.1 固态电解质的合成与表征为了研究升温过程中粉末样品的溶剂脱除和结晶情况,分别对80,100℃和140℃干燥后的样品进行热重和差热分析,结果如图 1所示。从80℃干燥样品的DSC曲线中观察到在139℃有一处吸热峰,未观察到明显放热峰,吸热峰对应TGA曲线中约17%(质量分数,下同)的失重,代表THF溶剂的失去。100℃干燥样品的DSC曲线中存在两个相对较弱的吸热峰并且在127℃观察到一处放热峰,TGA曲线表明,吸热峰对应温度范围内的失重约6.7%,说明100℃干燥后的样品中仍含有少量THF,结合XRD数据判断该放热峰对应于样品由无定形态变为β-Li3PS4的结晶峰。140℃干燥样品的DSC曲线仅在134℃有一处放热峰,TGA曲线中的对应位置没有明显质量变化,表明样品中的THF已被完全脱除。此放热峰对应β-Li3PS4的结晶峰。此外,3种样品的TGA曲线在150℃之后均显示出轻微的质量损失,且250℃之后失重更加明显,这与Li3PS4在高温下分解产生饱和蒸气压较低的硫单质有关[13]。
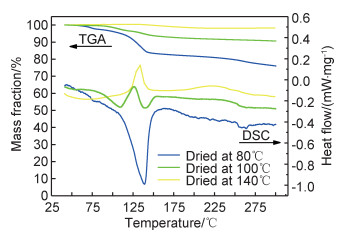
|
图 1 经过不同温度干燥后样品的TGA-DSC曲线 Fig. 1 TGA-DSC curves of samples after drying at different temperatures |
图 2为不同制备阶段粉末样品的XRD谱图。室温初步干燥后的产物在2θ=8.4°位置有一强峰,结合其他峰位及峰强可以判断为共结晶相Li3PS4·3THF[11]。经过80℃干燥之后,Li3PS4·3THF峰强明显减小,说明已去除部分THF溶剂。逐步升温干燥到140℃之后,Li3PS4·3THF的峰完全消失,并出现弱的Li3PS4结晶峰,说明此时THF溶剂已完全去除,且Li3PS4已开始结晶,这与TGA-DSC曲线结果一致(图 1)。在140℃下热处理1h后,所观察到的清晰衍射峰与β-Li3PS4的标准PDF卡片(JCPDS 076-0973)一致,表明形成了结晶性较好的β-Li3PS4晶体。
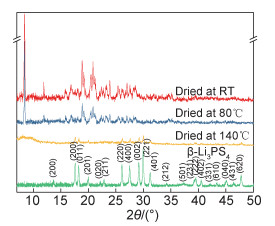
|
图 2 不同制备阶段粉末样品的XRD谱图 Fig. 2 XRD patterns of powder samples at different preparation stages |
图 3为不同制备阶段粉末样品的拉曼光谱。所有不同制备阶段的样品均在418cm-1位置有尖峰出现,对应的是PS43-的特征峰[14]。室温干燥和80℃干燥的样品在2850~3050cm-1出现THF中亚甲基的C—H伸缩振动峰[15],且80℃干燥样品该峰强度较弱,表明了THF溶剂的逐渐脱除。140℃干燥和结晶热处理的样品C—H伸缩振动峰消失,表明溶剂已完全去除,得到了纯β-Li3PS4固态电解质。这与XRD中的观察一致。
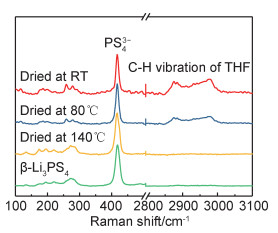
|
图 3 不同制备阶段粉末样品的拉曼光谱 Fig. 3 Raman spectra of powder samples at different preparation stages |
通过SEM观察了电解质粉末样品的表面形貌,结果如图 4所示。图 4(a)显示室温干燥后的粉末样品呈柱状或块状形态,晶粒尺寸小于10μm,表面较为光滑,图 5(a)中其氮气吸脱附等温线表明氮气吸附量较少。在经过逐步加热去除溶剂并热处理结晶之后,颗粒表面形貌发生变化,图 4(b)中的局部放大图像显示颗粒表面分布大量纳米孔洞。氮气吸脱附等温线表明在相对压力达到0.9以上时发生了明显的吸附,经过计算得到β-Li3PS4的BET表面积为28.3m2·g-1。图 5(b)显示了β-Li3PS4的孔径分布,平均孔径约为23nm。纳米结构的形成不仅可以降低相转变温度,使亚稳相β-Li3PS4在较宽的温度范围内稳定[11],同时产生大量晶格缺陷,引起颗粒表面的电荷不平衡并产生空位电荷[16],增加表面离子传导,提高离子电导率[17]。

|
图 4 电解质粉末样品的表面形貌 (a)室温干燥后样品;(b)β-Li3PS4颗粒及其表面的局部放大 Fig. 4 Surface morphologies of electrolyte powder samples (a)sample dried at RT; (b)β-Li3PS4 particles and local enlargement of the surface of particles |
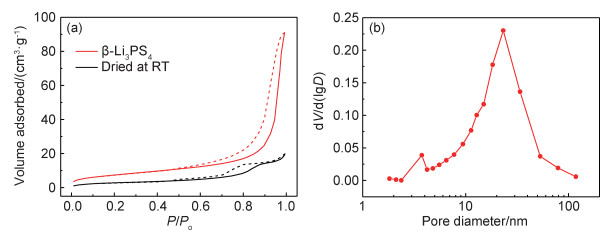
|
图 5 电解质粉末样品的氮气吸/脱附表征 (a)氮气吸/脱附等温线;(b)β-Li3PS4的孔径分布图 Fig. 5 N2 absorption/desorption characterization of electrolyte powder samples (a)N2 adsorption/desorption isotherms; (b)plot of the pore size distribution of β-Li3PS4 |
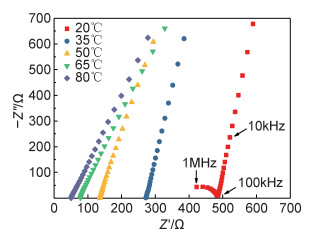
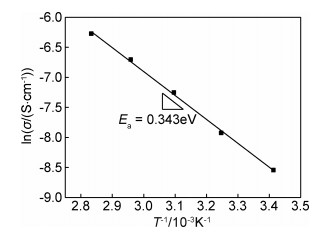
图 6与图 7分别展示了所制备的β-Li3PS4在不同温度下的Nyquist曲线及其离子电导率与温度的关系。由图 6可见,在20℃下测量的Nyquist曲线具有典型的离子导体的特征:代表界面转移电阻的高频区圆弧和表示离子扩散的低频区倾斜直线。离子扩散直线与横轴的交点为所测电解质阻抗。当温度升高至35℃时,曲线中的高频区圆弧消失,说明此时界面阻抗较小。同时,随着测试温度的升高,电解质总阻抗在逐渐减小。电导率计算公式为σ=L/(RS),其中:σ为样品电导率(S·cm-1);L为电解质压片厚度(cm);R为总阻抗(Ω);S为压片表面积(cm2)。最终计算得到20℃下β-Li3PS4固态电解质的离子电导率为1.84×10-4S·cm-1。其离子电导率与温度的关系遵循阿伦尼乌斯公式,根据图 7中直线的斜率可以计算其活化能为0.343eV。
|
图 6 β-Li3PS4在不同温度下的Nyquist图 Fig. 6 Nyquist plots of β-Li3PS4 at different temperatures |
|
图 7 β-Li3PS4离子电导率与温度的关系 Fig. 7 Relationship between ionic conductivity of β-Li3PS4 and temperature |
表 1总结了近年来通过湿化学法制备Li3PS4固态电解质的相关报道。由表 1可见,仅文献[20]与[23]所报道的室温离子电导率高于本研究中1.84×10-4S·cm-1的离子电导率,但文献[23]中电解质活化能高达0.425eV,电导率随温度变化较大,不利于低温环境下的使用。而文献[20]中采用了较为复杂的热压测试法,该方法可有效降低界面电阻,提高离子电导率。其冷压测试结果显示离子电导率降低至1.7×10-4S·cm-1。本实验中后续干燥和热处理工艺是制备高离子传导固态电解质的关键因素。通过由低温到高温的溶剂逐步脱除,得到具有高比表面积的纳米多孔结构β-Li3PS4,增加了锂离子表面传导,提高了离子电导率,并且由于纳米结构具备高的表面能,导致离子传导的能垒降低,减小了活化能[11, 17]。若直接高温加热可能导致未能及时脱除的溶剂与电解质发生副反应,同时导致结构坍塌,不能形成稳定的纳米结构。低温则难以除尽溶剂,会降低离子电导率。因此,采用逐步加热方式,在保证纳米结构的同时将溶剂去除干净。此外,能否制备出高离子电导率的固态电解质也与溶剂的选择有关。四氢呋喃作为一种中等极性的非质子溶剂,可与β-Li3PS4形成中等结合强度的共沉淀结合物,同时其沸点较低,为66℃,在保证与β-Li3PS4充分结合的同时也易于脱除。有研究表明,当使用碳酸二甲酯、甲基丙基酮等溶剂时,制备的电解质由于含有残留溶剂而导致离子电导率较低[19, 22]。
| Structure | Solvent | Ionic conductivity atRT/(S·cm-1) | Activation energy/eV | Subsequent processing | Reference |
| β-Li3PS4 | Tetrahydrofuran | 1.6×10-4 | 0.356 | Dried at 80℃, heat treated at 140℃ | [11] |
| Li3PS4 | N-methylformamide andn-hexane | 2.3×10-6 | 0.467 | Dried at 180℃ for 3h | [18] |
| β-Li3PS4 | Tetrahydrofuran | 7.44×10-6 | - | Heat treated at 160℃for 1h | [12] |
| Amorphous | Dimethyl carbonate | 6.4×10-6 | 0.623-0.757 | Dried at 190℃ | [19] |
| β-Li3PS4 | Ethyl acetate | 3.3×10-4 | 0.322 | Heating at 160℃ for pellet dried at 110℃ | [20] |
| 1.7×10-4 | - | Dried at 160℃ | |||
| β-Li3PS4 | Acetonitrile | 1.2×10-4 | 0.360 | Dried at 80℃, heat treated at 200℃ | [21] |
| Li3PS4 | Dimethyl carbonate | 6×10-6 | - | Dried at 160℃ for 2h | [22] |
| Methyl propy ketone | 3×10-7 | ||||
| Li3PS4 | Ethyl propionate | 2×10-4 | 0.425 | Dried at 170℃ for 2h | [23] |
| β-Li3PS4 | Diethylene glycol dimethyl ether | 2.76×10-5 | 0.417 | Dried at 140℃ for 12h | [24] |
| β-Li3PS4 | Tetrahydrofuran | 1.84×10-4 | 0.343 | Dried at 80, 90, 100, 120℃ and140℃, heat treated at 140℃ |
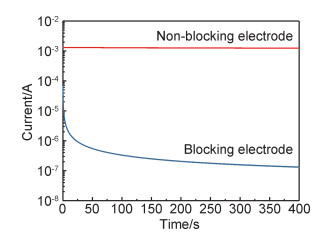
据研究报道,高电子电导率促进锂枝晶在固态电解质中的生长[25]。因此,除了提高离子电导率和减小活化能,降低固态电解质的电子电导率对于全固态锂电池至关重要。图 8展示了β-Li3PS4固态电解质在不同电极条件下,施加1V的恒定电压后其电流随时间的变化。当用锂片作为非阻塞电极(Li/β-Li3PS4/Li)时,观察到一恒定电流。计算得到该对称电池的电导率为1.56×10-4S·cm-1。这一数值与通过交流阻抗法测试得到电导率(1.84×10-4S·cm-1)相比略低,这与锂片和电解质压片之间形成的固态电解质界面膜增加界面阻抗相关[26]。当用不锈钢作为阻塞电极(SUS/β-Li3PS4/SUS)时,计算得到其电子电导率为1.3×10-8S·cm-1。这一极小的电子电导率表明所制备的β-Li3PS4固态电解质是优良的离子导体,其锂离子迁移数约为0.9999。
|
图 8 1V电压下β-Li3PS4固态电解质在不同电极条件下的电流-时间曲线 Fig. 8 Current-time curves of β-Li3PS4 solid electrolyte under different electrode conditions at 1V |
为了测试β-Li3PS4固态电解质的电化学稳定性,组装了Li/β-Li3PS4/Au电池进行CV测试,其中锂作为参比/对电极,金作为工作电极。如图 9(a)所示,在整个扫描电位-0.5V到5V的范围内,除了对应锂沉积(Li++e-→Li)的阴极电流和锂溶解(Li→Li++e-)的阳极电流外,没有观察到其他峰位,说明没有副反应发生,表明β-Li3PS4固态电解质与金属锂电极具有良好的稳定性且电化学窗口高达5V。同时,组装Li/β-Li3PS4/Li对称电池在恒电流密度下进行充放电循环,进一步测试β-Li3PS4与金属锂电极的循环稳定性。图 9(b)为在0.1mA·cm-2的电流密度下,Li/β-Li3PS4/Li对称电池室温下的电压变化曲线。在循环25次之后,电池极化较小,电压基本保持不变,表明β-Li3PS4固态电解质与金属锂兼容性良好。

|
图 9 β-Li3PS4的电化学稳定性以及金属锂电极的循环稳定性 (a)Li/β-Li3PS4/Au电池的CV曲线;(b)Li/β-Li3PS4/Li对称电池的恒电流密度循环 Fig. 9 Electrochemical stability of β-Li3PS4 and cycling stability with metallic lithium electrodes (a)CV curve of a Li/β-Li3PS4/Au cell; (b)constant current density cycle of a symmetrical Li/β-Li3PS4/Li cell |
(1) 通过湿化学法成功制备出室温稳定的纳米多孔β-Li3PS4固态电解质,其在20℃下的离子电导率高达1.84×10-4S·cm-1,活化能为0.343eV。
(2) 利用逐步升温加热的方式可有效脱除四氢呋喃溶剂,得到的电解质颗粒具有28.3m2·g-1的高BET表面积和约23nm的平均孔径,其纳米多孔结构增加了表面离子传导,有助于提高离子电导率和降低活化能。
(3) 所制备的β-Li3PS4固态电解质锂离子迁移数接近1,20℃下的电子电导率低至1.3×10-8S·cm-1,电化学窗口达到5V,具有优良的电化学稳定性,与金属锂电极可以良好兼容。
| [1] | TARASCON J M, ARMAND M. Issues and challenges facing rechargeable lithium batteries[J]. Nature, 2001, 414 (6861): 359–367. DOI: 10.1038/35104644 |
| [2] |
王一博, 赵九蓬. 3D打印柔性可穿戴锂离子电池[J].
材料工程, 2018, 46 (3): 13–21.
WANG Y B, ZHAO J P. 3D printing of flexible electrodes towards wearable lithium ion battery[J]. Journal of Materials Engine-ering, 2018, 46 (3): 13–21. |
| [3] |
黄峰, 周运鸿. 锂离子电池电解质现状与发展[J].
电池, 2001, 31 (6): 290–293.
HUANG F, ZHOU Y H. Review of electrolytes for lithium-ion batteries[J]. Battery, 2001, 31 (6): 290–293. DOI: 10.3969/j.issn.1001-1579.2001.06.012 |
| [4] | CHEN S J, XIE D J, LIU G Z, et al. Sulfide solid electrolytes for all-solid-state lithium batteries:structure, conductivity, stability and application[J]. Energy Storage Materials, 2018, 14 : 58–74. DOI: 10.1016/j.ensm.2018.02.020 |
| [5] | SEINO Y, OTA T, TAKADA K, et al. A sulphide lithium super ion conductor is superior to liquid ion conductors for use in rechargeable batteries[J]. Energy & Environmental Science, 2014, 7 (2): 627–631. |
| [6] | KAMAYA N, HOMMA K, YAMAKAWA Y, et al. A lithium superionic conductor[J]. Nature Materials, 2011, 10 (9): 682–686. DOI: 10.1038/nmat3066 |
| [7] | MO Y, ONG S P, CEDER G. First principles study of the Li10GeP2S12 lithium super ionic conductor material[J]. Chemistry of Materials, 2012, 24 (1): 15–17. DOI: 10.1021/cm203303y |
| [8] | MURAMATSU H, HAYASHI A, OHTOMO T, et al. Structural change of Li2S-P2S5 sulfide solid electrolytes in the atmosphere[J]. Solid State Ionics, 2011, 182 (1): 116–119. DOI: 10.1016/j.ssi.2010.10.013 |
| [9] | HOMMA K, YONEMURA M, KOBAYASHI T, et al. Crystal structure and phase transitions of the lithium ionic conductor Li3PS4[J]. Solid State Ionics, 2011, 182 (1): 53–58. DOI: 10.1016/j.ssi.2010.10.001 |
| [10] | DATHAR G K P, BALACHANDRAN J, KENT P R C, et al. Li-ion site disorder driven superionic conductivity in solid electr-olytes:a first-principles investigation of β-Li3PS4[J]. Journal of Materials Chemistry A, 2017, 5 (3): 1153–1159. DOI: 10.1039/C6TA07713G |
| [11] | LIU Z, FU W, PAYZANT E A, et al. Anomalous high ionic conductivity of nanoporous β-Li3PS4[J]. Journal of the American Chemical Society, 2013, 135 (3): 975–978. DOI: 10.1021/ja3110895 |
| [12] |
潘亦真, 李宇杰, 陈一民, 等. 纳米多孔β-Li3PS4固体电解质的溶剂脱除法制备及性能[J].
高等学校化学学报, 2016, 37 (7): 1232–1238.
PAN Y Z, LI Y J, CHEN Y M, et al. Performance of nanoporous β-Li3PS4 prepared by solvent removing method[J]. Chemical Journal of Chinese Universities, 2016, 37 (7): 1232–1238. |
| [13] | CHEN Y, CAI L, LIU Z, et al. Correlation of anisotropy and directional conduction in β-Li3PS4 fast Li+ conductor[J]. Applied Physics Letters, 2015, 107 (1): 013904. DOI: 10.1063/1.4926725 |
| [14] | TACHEZ M, MALUGANI J P, MERCIER R, et al. Ionic conductivity of and phase transition in lithium thiophosphate Li3PS4[J]. Solid State Ionics, 1984, 14 (3): 181–185. DOI: 10.1016/0167-2738(84)90097-3 |
| [15] | CADIOLI B, GALLINELLA E, COULOMBEAU C, et al. Geom-etric structure and vibrational spectrum of tetrahydrofuran[J]. The Journal of Physical Chemistry, 1993, 97 (30): 7844–7856. DOI: 10.1021/j100132a010 |
| [16] | MAIER J. Nano-ionics:trivial and non-trivial size effects on ion conduction in solids[J]. Zeitschrift für Physikalische Chemie, 2003, 217 (4): 415–436. |
| [17] | MAIER J. Ionic transport in nano-sized systems[J]. Solid State Ionics, 2004, 175 (1/4): 7–12. |
| [18] | TERAGAWA S, ASO K, TADANAGA K, et al. Liquid-phase synthesis of a Li3PS4 solid electrolyte using N-methylformamide for all-solid-state lithium batteries[J]. Journal of Materials Chemistry A, 2014, 2 (14): 5095–5099. DOI: 10.1039/c3ta15090a |
| [19] | PHUC N H H, MORIKAWA K, TOTANI M, et al. Chemical synthesis of Li3PS4 precursor suspension by liquid-phase shaking[J]. Solid State Ionics, 2016, 285 : 2–5. DOI: 10.1016/j.ssi.2015.11.019 |
| [20] | PHUC N H H, TOTANI M, MORIKAWA K, et al. Preparation of Li3PS4 solid electrolyte using ethyl acetate as synthetic medium[J]. Solid State Ionics, 2016, 288 : 240–243. DOI: 10.1016/j.ssi.2015.11.032 |
| [21] | WANG H, HOOD Z D, XIA Y, et al. Fabrication of ultrathin solid electrolyte membranes of β-Li3PS4 nanoflakes by evaporation-induced self-assembly for all-solid-state batteries[J]. Journal of Materials Chemistry A, 2016, 4 (21): 8091–8096. DOI: 10.1039/C6TA02294D |
| [22] | MATSUDA A, MUTO H, PHUC N H H. Preparation of Li3PS4 solid electrolyte by liquid-phase shaking using organic solvents with carbonyl group as complex forming medium[J]. Journal of the Japan Society of Powder and Powder Metallurgy, 2016, 63 (11): 976–980. DOI: 10.2497/jjspm.63.976 |
| [23] | PHUC N H H, MORIKAWA K, MITSUHIRO T, et al. Synthesis of plate-like Li3PS4 solid electrolyte via liquid-phase shaking for all-solid-state lithium batteries[J]. Ionics, 2017, 23 (8): 2061–2067. DOI: 10.1007/s11581-017-2035-8 |
| [24] | LIM H D, LIM H K, XING X, et al. Solid electrolyte layers by solution deposition[J]. Advanced Materials Interfaces, 2018, 5 (8): 1701328. DOI: 10.1002/admi.201701328 |
| [25] | HAN F, WESTOVER A S, YUE J, et al. High electronic conductivity as the origin of lithium dendrite formation within solid electrolytes[J]. Nature Energy, 2019, 4 (3): 1–10. |
| [26] | RANGASAMY E, SAHU G, KEUM J K, et al. A high cond-uctivity oxide-sulfide composite lithium superionic conductor[J]. Journal of Materials Chemistry A, 2014, 2 (12): 4111–4116. DOI: 10.1039/C3TA15223E |
 2019, Vol. 47
2019, Vol. 47


