文章信息
- 张国芳, 翟亭亭, 胡锋, 侯忠辉, 张羊换, 许剑轶
- ZHANG Guo-fang, ZHAI Ting-ting, HU Feng, HOU Zhong-hui, ZHANG Yang-huan, XU Jian-yi
- 纳米CuO催化剂晶粒尺寸对Mg2Ni基复合材料储氢性能的影响
- Effect of Different Sizes of Nano CuO Catalysts on Hydrogen Storage Properties of Mg2Ni Based Composites
- 材料工程, 2018, 46(7): 151-156
- Journal of Materials Engineering, 2018, 46(7): 151-156.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2017.000727
-
文章历史
- 收稿日期: 2017-06-07
- 修订日期: 2018-02-18
Mg基合金因具有储氢容量高,资源储量丰富,价格低廉等特性而得到了广泛研究。在众多Mg基储氢合金中,尤其以Mg2Ni合金最为重要。首先,Mg2Ni理论储氢容量高,气态储氢量为3.6%(质量分数),折算为理论电化学容量可达999mAh/g;其次,与其他成分合金相比,Mg2Ni合金的原料成本低廉,制备工艺简单,因此是一种极具开发前途的重要储氢材料。尽管与纯Mg相比,Mg2Ni合金性能有了一定改善,但仍存在易腐蚀,循环稳定性低,动力学性能差等缺陷,因此需对合金进一步改进处理。最常见的改善合金性能的方法即为高能球磨法,球磨时将Mg2Ni合金粉与Ni粉混合,在硬度较高的Ni粉作用下,可以有效降低合金晶粒尺寸,提高合金颗粒比表面积,导电性良好的Ni粉还对合金的综合储氢性能起到优化作用[1]。在此基础上,添加少量催化剂可进一步显著提高其电化学及气态吸放氢性能[2]。因此,目前较常用方法是将催化剂与高能球磨技术相结合制备Mg2Ni基复合材料。
通常,催化剂的催化效果主要受其自身的化学特性、晶粒尺寸、添加量及添加工艺等诸多因素的影响。即使对于同一种催化剂,不同的微观结构及晶粒尺寸也会表现出不同的性能。Hanada等[3]和Varin等[4]发现,纳米尺度的Ni,Pd及金属氧化物等可明显提高MgH2的吸放氢性能;Bhat等[5]比较了纳米Nb2O5及商品Nb2O5对MgH2材料的吸氢性能影响,发现具有高比表面积的纳米Nb2O5催化剂可明显提高材料的吸氢速率及降低放氢温度;Polanski等[6]研究发现,当在MgH2纳米晶中加入相同质量而具有不同密度及晶粒尺寸的催化剂时,催化剂在储氢合金表面的覆盖面积明显不同。Singh等[7]比较了不同晶粒尺寸的纳米CeO2催化剂对MgH2储氢性能的影响,发现粒度在10~15nm的CeO2具有更好的催化效果。
CuO具有高催化活性、无毒性和价格低廉等特点而广泛应用于催化剂、太阳能电池、锂离子电池及超级电容器的电极材料等诸多领域[8-11]。研究表明,当CuO的颗粒尺寸控制在纳米尺度时,其催化性能可以进一步得到改善。这是由于CuO纳米材料的高浓度缺陷及大的比表面积,使其通常可具有较高的化学活性[12-14]。在储氢领域,Oelerich等[15]研究发现,CuO作为MgH2的催化剂具有较好的催化效果,但具体催化机理等尚不明确。Zhang等[16]通过球磨将5%(质量分数)的CuO添加到MgNi储氢合金中,发现MgNi-CuO复合材料的放电容量及动力学性能都得到了明显改善。基于以上研究可以发现,尽管CuO已得到广泛研究,但纳米CuO对Mg基储氢材料的催化作用机制尚有待于深入探索。因此,本工作研究了通过化学沉淀法制备不同晶粒尺寸的纳米CuO,将其作为催化剂加入到Mg2Ni合金中球磨而制得复合材料,系统分析了复合材料的热力学及动力学性能,研究了不同晶粒尺寸的CuO催化剂对Mg基合金储氢性能的影响机制。
1 实验材料与方法纳米CuO的制备流程:在搅拌条件下,向400mL的0.25mol/ L的CuCl2·2H2O(分析纯)乙醇溶液中缓慢滴加1mol/L的NaOH乙醇溶液至pH=9.0,此时出现了黑色沉淀,继续缓慢加入100mL蒸馏水,陈化12h后进行过滤、洗涤及干燥处理,然后将所得产物分为3份,分别在300,450℃及600℃条件下空气气氛烧结4h,得到CuO样品。样品名称标记为CuO300,CuO450及CuO600。
球磨Mg2Ni基复合材料的制备流程:将事先通过熔炼法制备得到的铸态Mg2Ni合金粉碎过筛,按照Mg2Ni与Ni粉质量比为1:1比例混合,然后加入相对于Mg2Ni合金5%(摩尔分数)比例的CuO粉末进行混合,在氩气气氛下混合球磨20h。球磨过程中,控制球料比为40:1,球磨转速350r/min,每球磨3h,暂停1h,以防球磨过热。为将纳米CuO催化性能与微米级商品CuO相比较,首先将商品CuO(分析纯)过300目筛,然后以相同比例与Mg2Ni及Ni粉球磨制得复合材料。
纳米CuO的结构采用D/max/2400进行XRD表征,CuKα辐射,扫描速率4(°)/min。球磨样品电化学测试是在三电极电池管中进行,将球磨样品与羰基Ni粉充分混合后压片包装作为负极,以烧结板Ni(OH)2作为正极,参比电极为Hg/HgO,电解液为6mol/L KOH。电化学性能是在LAND程控电池测试仪上以40mA/g的恒电流密度进行充放电测试;高倍率性能是将电极充满后,在放电电流密度分别为:40,80,120,160,200mA/g的条件下进行放电。电化学的动力学性能是在PARSTAT2273电化学工作站上进行。其中交流阻抗测试是将电极充分活化,放电深度为50%的条件下,设置频率范围10kHz~5mHz,电位扰动幅度为5mV进行测试。线性极化及阳极极化也是在放电深度为50%条件下进行,其中线性极化是设置电压扫描范围-5~+5mV,扫描速率为0.1mV/s,通过线性极化曲线的斜率可计算得到交换电流密度I0;阳极极化曲线设置电压-1.2~1.0V,扫描速率5mV,测试所得阳极极化曲线的峰值电流密度即为极限电流密度IL。球磨样品的热分析(DSC)是在NETZSCH热分析仪上进行,首先将复合材料在250℃条件下活化后充分吸氢,然后在氩气中进行差热分析,温度范围为室温至370℃。
2 结果与分析 2.1 XRD表征图 1为在不同烧结温度下所得CuO样品的XRD结果,由图 1可知,样品均为单斜CuO纯相结构(PDF No.89-5898)。CuO的晶粒尺寸通过Scherrer公式计算,随着烧结温度的升高,CuO的粒径逐渐增大,不同烧结温度所得样品的晶粒尺寸分别为7.5nm(300℃),14.4nm (450℃)及23.9nm(600℃)。
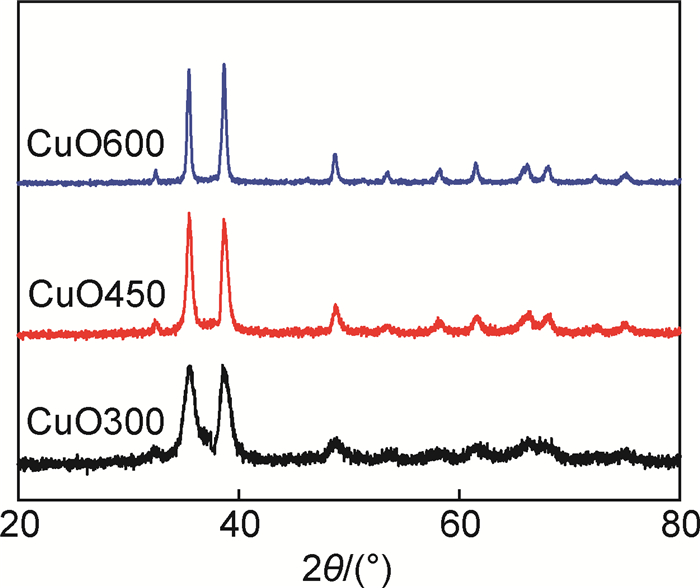
|
图 1 不同温度烧结所得CuO样品的XRD图谱 Fig. 1 XRD patterns of CuO under different calcinationtemperatures |
图 2为不同烧结温度下所得CuO样品的SEM图谱,由图 2可知,样品的团聚较为明显,这是由于CuO均为纳米尺度所致。随着烧结温度的升高,样品的晶粒尺寸逐渐增大,该结果与XRD结果相一致。值得注意的是,烧结温度分别为300℃和450℃时(图 2(a), (b)),样品均为颗粒尺寸较小的球状颗粒,图片中颗粒大小的差别不大,而当烧结温度为600℃时(图 2(c)),大部分样品均为尺寸明显增大的球形颗粒,此外,还出现了少部分的棒状CuO。

|
图 2 CuO样品的SEM图片 (a)CuO300;(b)CuO450;(c)CuO600 Fig. 2 SEM pictures of CuO samples (a)CuO300;(b)CuO450;(c)CuO600 |
最大放电容量、活化性能及循环稳定性是衡量合金电极电化学储氢性能的重要指标。图 3(a)为Mg2Ni-Ni-5%CuO复合材料的放电曲线。由图可知,所有样品都具有一个较为平坦的放电平台,此平台对应于充电后形成的Mg2NiH4合金中H原子的氧化过程,曲线的横坐标对应于合金的放电容量。与无催化剂的Mg2Ni-Ni(615.5mAh/g)样品相比,添加CuO催化剂样品的放电容量均明显增大,其中Mg2Ni-Ni-5%micro-CuO材料的放电容量为708.3mAh/g,而添加纳米尺度CuO催化剂样品分别对应的放电容量为841.7mAh/g (CuO300),901.9mAh/g (CuO450)及828.6mAh/g (CuO600)。同时,添加纳米CuO样品的合金电极几乎表现出相同的平台压,而无催化剂及添加微米CuO两个样品的平台压则明显偏低,不同的放电平台压可能与球磨样品的非晶纳米晶程度不同有关[17]。以上结果表明,CuO具有良好的催化性能,其中具有纳米尺度的CuO催化剂可更加明显提高合金的最大放电容量。这是因为在添加同样摩尔数的CuO情况下,纳米CuO的粒度小,可使合金表面催化剂的覆盖率更高[6],球磨过程中能更好起到对合金的碾磨及包覆作用,使得复合材料表面缺陷浓度提高,允许更多H原子进入合金内部,进而提高合金的最大放电容量。CuO450的放电容量高于CuO300,可能是由于CuO300催化剂的颗粒尺寸只有7.5nm,过小的纳米尺度导致催化剂晶粒团聚严重,无法对合金起到有效的催化作用。
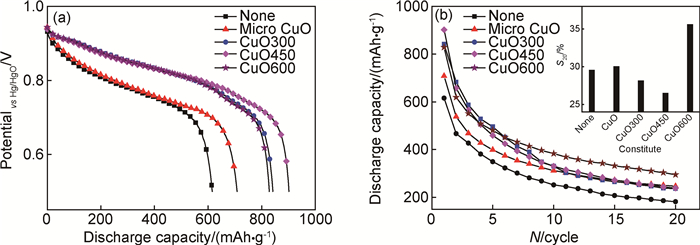
|
图 3 Mg2Ni-Ni-5% CuO复合材料的电化学储氢性能 (a)放电曲线;(b)循环稳定性曲线(插图为循环保持率S20) Fig. 3 Electrochemical hydrogen storage properties of Mg2Ni-Ni-5%CuO composites (a)discharge curve; (b)cycle stabilities curve(inset shows the retention rate S20) |
图 3(b)为Mg2Ni-Ni-5%CuO复合材料的循环稳定性曲线。由图可知,球磨样品的活化性能优良,第一次循环就表现出了最大放电容量。合金电极经过20次充放电循环,其循环稳定性S20%如图 3(b)中的插图所示。与未添加CuO催化剂的样品相比,添加CuO样品在20次放电循环中的容量都显著增大。通过比较各样品经20次充放电循环的容量保持率可知,Mg2Ni-Ni材料的S20%为29.5%,含微米CuO复合材料的S20%为30.2%,CuO300及CuO450材料电极的循环稳定性较差,分别为28.1%及26.4%,而CuO600的循环稳定性有明显提高,达到了35.6%。通常来说,循环稳定性的大小主要与合金的耐腐蚀性等因素有关,合金表面缺陷浓度高,可以促进H原子的进出,因此最大放电容量会得到提升,但缺陷浓度高的样品同样更容易被碱性电解液腐蚀,导致循环稳定性下降,因此CuO450的循环稳定性最低。相对来说,添加CuO600催化剂样品具有较大的放电容量及最高的容量保持率,因此其电化学储氢性能最佳。其原因可能是由于催化剂粒度在20nm左右,一方面可以有效提高合金的表面缺陷浓度而提高放电容量;另一方面,此粒度范围的催化剂能够有效包覆在合金表面,阻止碱液的腐蚀,从而提高了Mg2Ni基复合材料的循环稳定性。
2.4 Mg2Ni-Ni-5%CuO的电化学储氢动力学性能表征储氢材料的高倍率放电性能(High rate discharge, HRD)是衡量其电化学动力学性能的重要指标,其定义式为:HRD=Ci/C40×100%,Ci和C40是电极分别在电流密度为i和40mAh/g时的最大放电容量。图 4为添加不同CuO催化剂复合材料的高倍率放电曲线。可以发现,添加CuO600催化剂样品的高倍率性能明显优于其他3种材料。以放电电流密度200mAh/g时为例,添加微米CuO催化剂复合材料电极的HRD为46.2%,含纳米CuO的复合材料的HRD分别为47.3%(CuO300),53.1%(CuO450)以及70.9% (CuO600)。在碱性KOH电解质溶液中,电极表面的氢原子有可能通过扩散进入储氢材料合金内部,也有可能是表面的氢原子相互结合而成为H2分子。因此,合金表面的氢原子的扩散速率决定了其对充电电流的利用率,即扩散电流与表观电流的比值大小[18]。储氢材料的高倍率放电性能主要与电极材料表面的电荷转移速率及材料内部的氢扩散能力有关。

|
图 4 Mg2Ni-Ni-5%CuO复合材料的高倍率放电性能曲线 Fig. 4 High-rate discharge characteristic curves ofMg2Ni-Ni-5%CuO composites |
电极的电化学储氢动力学主要由电极表面的电荷迁移速率及合金体相内的氢原子扩散能力决定。为了明确催化剂对复合材料电化学动力学性能的催化机理,本工作进一步分析了储氢电极的交流阻抗谱(EIS)及动电位极化曲线,结果如图 5(a), (b)所示。电荷迁移速率的大小主要取决于材料的晶态及电子结构[19]。材料表面成分的不同会对价电子分布产生重要影响,进而决定了氢分解反应的电荷迁移步骤[20]。电极表面的电荷迁移能力可定性从其电化学阻抗谱(EIS)进行衡量。由图 5(a)所示,每个EIS图都包含高频区及中频区的两个变形容抗弧及低频区的直线,高频区的较小圆弧表示合金粉与集流体间的接触电阻,较大圆弧对应于合金表面的电荷迁移电阻,而直线部分对应于合金内部H原子的扩散阻抗[21]。显而易见,中频区圆弧半径越小,则合金电极的电荷迁移电阻越小,表面合金的表面催化活性越高。通过比较材料的中频区圆弧半径,可以发现不同粒度的CuO对合金表面电荷转移的催化活性大小关系依次为micron-CuO < CuO300 < CuO450 < CuO600。
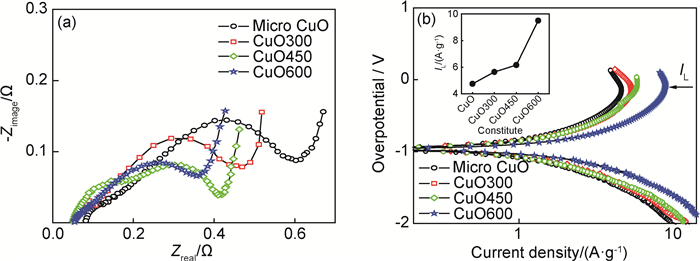
|
图 5 Mg2Ni-Ni-5%CuO复合材料动力学性能 (a)交流阻抗图谱;(b)阳极极化曲线 Fig. 5 Kinetic properties of Mg2Ni-Ni-5%CuO composites (a)AC impendence spectra; (b)anode polarization curves |
通过Tafel阳极极化曲线得到的极限电流密度IL是电化学动力学中的重要参数,可以考察阳极极化过程中H原子在合金体相内部的扩散情况[18]。如图 5(b)中箭头所指,每条阳极极化曲线均存在一个明显拐点,该拐点所对应的电流密度即称为极限电流密度IL。极限电流密度越大,则表示H在合金体相内的扩散能力越强。图 5(b)中,极限电流密度IL的变化趋势同样为micron-CuO < CuO300 < CuO450 < CuO600。合金电极的电化学储氢动力学性能是由合金表面的电荷迁移速率及合金体相内H的扩散能力综合决定。与大颗粒微米CuO催化剂相比,纳米尺度CuO可以有效提高材料的动力学性能,通过比较不同纳米尺度的CuO的催化活性可以发现,晶粒尺寸在23.9nm时,对Mg2Ni合金电化学及动力学性能具有最佳的催化作用。
2.5 材料的气态放氢性能表征Mg2Ni基复合材料的气态放氢反应性能测试通过DSC进行测试。储氢材料放氢速率的快慢主要与材料的活化能即放氢过程中的能垒大小有关。本工作将通过Kissinger法[22]对活化能进行计算。Kissinger公式为:
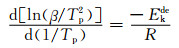
|
(1) |
式中:Ekde为活化能;β为升温速率;Tp表示DSC曲线中对应于最大放氢速率时的绝对温度;R为气体常数(8.314J·mol-1·K-1)。
图 6为Mg2Ni基复合材料氢化物的DSC曲线。其中图 6(a)为无CuO催化剂Mg2Ni-Ni样品的氢化物,图 6(b)为添加了CuO600的复合材料氢化物。图中的放热峰即为样品氢化物的放氢峰,所有样品均显示出了相似的峰形,与无催化剂样品相比,添加纳米CuO600催化剂材料的放氢温度明显降低,在不同升温速率下的放氢温度均降低约50K,说明纳米CuO催化剂能够有效优化复合材料的放氢热力学。通过Kissinger公式计算样品的活化能,如图中插图所示,ln(β/Tp2)与1/Tp之间近似成直线关系,根据斜率计算出活化能分别为86.9kJ/mol和89.3kJ/mol,说明添加了纳米CuO样品的活化能升高,即放氢能垒有所增大。以上结果表明,纳米CuO催化剂可以有效优化复合材料的电化学储氢动力学性能,明显改善材料的气态放氢热力学性能,但对复合材料的气态放氢动力学性能则无明显影响,其原因可能是由于材料在气态及电化学环境下的放氢机理不同,因此主要的速控步不同,纳米CuO催化剂可对电化学储氢动力学中的决速步骤表现出明显的催化作用。
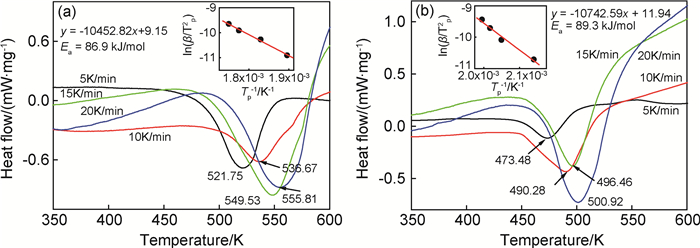
|
图 6 球磨复合材料的DSC曲线 (a)Mg2Ni-Ni;(b)Mg2Ni-Ni-5%CuO600 Fig. 6 DSC curves of the ball milled composites (a) Mg2Ni-Ni; (b)Mg2Ni-Ni-5%CuO600 |
(1) 与微米CuO相比,纳米CuO催化剂可有效提高复合材料的最大放电容量及循环稳定性,其中Mg2Ni-Ni-5%CuO450复合材料具有最大放电容量901.9mAh/g;Mg2Ni-Ni-5%CuO600具有最高的容量保持率35.6%。
(2) 纳米CuO催化剂可有效提高复合材料的电化学动力学性能,电极的表面电荷转移能力及合金体相内的H扩散速率。
(3) CuO600催化剂可明显降低复合材料的放氢温度,但材料的放氢活化能增大。
| [1] | KOHNO T, YAMAMOTO M, KANDA M. Electrochemical properties of mechanically ground Mg-Ni alloy[J]. Journal of Alloys and Compounds, 1999, 293/295 : 643–647. DOI: 10.1016/S0925-8388(99)00358-8 |
| [2] |
张国芳, 张羊换, 许剑轶, 等. Ni-5%RExOy复合添加剂对Mg2Ni电化学储氢性能的影响[J].
材料工程, 2017, 45 (11): 72–77.
ZHANG G F, ZHANG Y H, XU J Y, et al. Effects of Ni-5%RExOy composites additives on electrochemical hydrogen storage performances of Mg2Ni[J]. Journal of Materials Engineering, 2017, 45 (11): 72–77. DOI: 10.11868/j.issn.1001-4381.2016.000345 |
| [3] | HANADA N, HIROTOSHI E, ICHIKAWA T, et al. SEM and TEM characterization of magnesium hydride catalyzed with Ni nano-particle or Nb2O5[J]. Journal of Alloys and Compounds, 2008, 450 : 395–399. DOI: 10.1016/j.jallcom.2006.10.128 |
| [4] | VARIN R A, CZUJKO T, WASMUND E B, et al. Hydrogen desorption properties of MgH2 nanocomposites with nano-oxides and Inco micrometric-and nanometric-Ni[J]. Journal of Alloys and Compounds, 2007, 446/447 : 63–66. DOI: 10.1016/j.jallcom.2006.10.134 |
| [5] | BHAT V V, ROUGIER A, AYMARD L, et al. High surface area niobium oxides as catalysts for improved hydrogen sorption properties of ball milled MgH2[J]. Journal of Alloys and Compounds, 2008, 460 : 507–512. DOI: 10.1016/j.jallcom.2007.05.084 |
| [6] | POLANSKI M, BYSTRZYCKI J. Comparative studies of the influence of different nano-sized metal oxides on the hydrogen sorption properties of magnesium hydride[J]. Journal of Alloys and Compounds, 2009, 486 : 697–701. DOI: 10.1016/j.jallcom.2009.07.042 |
| [7] | SINGH R K, SADHASIVAM T, SHEEJA G I, et al. Effect of different sized CeO2 nano particles on decomposition and hydrogen absorption kinetics of magnesium hydride[J]. International Journal of Hydrogen Energy, 2013, 38 : 6221–6225. DOI: 10.1016/j.ijhydene.2012.12.060 |
| [8] |
李芬, 雷涛, 杨莹, 等. 纳米氧化铜的制备及其室温脱除H2S的性能研究[J].
材料工程, 2015, 43 (10): 1–6.
LI F, LEI T, YANG Y, et al. Preparation of nano-CuO and its removal performance of H2S at room temperature[J]. Journal of Materials Engineering, 2015, 43 (10): 1–6. DOI: 10.11868/j.issn.1001-4381.2015.10.001 |
| [9] | RAMYA V, NEYVASAGAM K, CHANDRAMOHAN R, et al. Studies on chemical bath deposited CuO thin films for solar cells application[J]. Journal of Materials Science:Materials in Electronics, 2015, 26 : 8489–8496. DOI: 10.1007/s10854-015-3520-3 |
| [10] | GAO X P, BAO J L, PAN G L, et al. Preparation and electrochemical performance of polycrystalline and single crystalline CuO nanorods as anode materials for Li ion battery[J]. The Journal of Physical Chemistry B, 2004, 108 : 5547–5551. DOI: 10.1021/jp037075k |
| [11] | LI Y R, WANG X, YANG Q, et al. Ultra-fine CuO nanoparticles embedded in three-dimensional graphene network nano-structure for high-performance flexible supercapacitors[J]. Electrochimica Acta, 2017, 234 : 63–70. DOI: 10.1016/j.electacta.2017.02.167 |
| [12] | SUBBULEKSHMI N L, SUBRAMANIAN E. Nano CuO immobilized fly ash zeolite Fenton-like catalyst for oxidative degradation of p-nitrophenol and p-nitroaniline[J]. Journal of Environmental Chemical Engineering, 2017, 5 : 1360–1371. DOI: 10.1016/j.jece.2017.02.019 |
| [13] | LI B X, HAO Y G, ZHANG B S, et al. A multifunctional noble-metal-free catalyst of CuO/TiO2 hybrid nanofibers[J]. Applied Catalysis A:General, 2017, 531 : 1–12. DOI: 10.1016/j.apcata.2016.12.002 |
| [14] | DU X Q, HUANG J W, FENG Y Y, et al. Flower-like 3D CuO microsphere acting as photocatalytic water oxidation catalyst[J]. Chinese Journal of Catalysis, 2016, 37 : 123–134. DOI: 10.1016/S1872-2067(15)61012-9 |
| [15] | OELERICH W, KLASSEN T, BORMANN R. Metal oxides as catalysts for improved hydrogen sorption in nanocrystalline Mg-based materials[J]. Journal of Alloys and Compounds, 2001, 315 (1/2): 237–242. |
| [16] | ZHANG Y H, JIAO L F, YUAN H T, et al. Study on the electrochemical properties of MgNi-CuO hydrogen storage composite materials[J]. Journal of Alloys and Compounds, 2009, 481 : 639–643. DOI: 10.1016/j.jallcom.2009.03.067 |
| [17] | LI R F, WAN J, WANG F, et al. Effect of non-stoichiometry on microstructure and electrochemical performance of La0.8GdxMg0.2Ni3.15Co0.25Al0.1 (x=0-0.4) hydrogen storage alloys[J]. Journal of Power Sources, 2016, 301 : 229–236. DOI: 10.1016/j.jpowsour.2015.10.017 |
| [18] | RATNAKUMAR B V, WITHAM C, BOEMAN Jr R C, et al. Electrochemical studies on LaNi5-xSnx metal hydride alloys[J]. Journal of The Electrochemical Society, 1996, 143 : 2578–2584. DOI: 10.1149/1.1837050 |
| [19] | KLEPERIS J, WOJCIK G, CZERWINSKI A, et al. Electrochemical behavior of metal hydrides[J]. Journal of Solid State Electrochemistry, 2001, 5 (4): 229–249. DOI: 10.1007/s100080000149 |
| [20] | NOBUHARA K, KASAI H, DINO W A. H2 dissociative adsorption on Mg, Ti, Ni, Pd and La surfaces[J]. Surface Science, 2004, 566/568 : 703–707. DOI: 10.1016/j.susc.2004.06.003 |
| [21] | KURIYAMA N, SAKAI T, MIYAMURA H, et al. Electrochemical impedance and deterioration behavior of metal hydride electrodes[J]. Journal of Alloys and Compounds, 1993, 202 : 183–197. DOI: 10.1016/0925-8388(93)90538-X |
| [22] | KISSINGER H E. Reaction kinetics in differential thermal analysis[J]. Analytical Chemistry, 1957, 29 : 1702–1706. DOI: 10.1021/ac60131a045 |
 2018, Vol. 46
2018, Vol. 46


