文章信息
- 邓城, 漆小鹏, 李倩, 尹从岭, 杨辉
- DENG Cheng, QI Xiao-peng, LI Qian, YIN Cong-ling, YANG Hui
- 沉淀法与水热法合成载银羟基磷灰石及其抗菌性能
- Synthesis and Antibacterial Property of Silver Doped Hydroxyapatite by Precipitation and Hydrothermal Method
- 材料工程, 2017, 45(4): 113-120
- Journal of Materials Engineering, 2017, 45(4): 113-120.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2016.000319
-
文章历史
- 收稿日期: 2016-03-19
- 修订日期: 2016-11-10
HA与哺乳动物牙齿、骨骼的无机质成分相同,结构相似,具有良好的生物活性和生物相容性[1],是一种非常有前景的生物陶瓷材料,已成为医学材料研究的热点[2, 3]。然而,HA易吸附蛋白质、氨基酸和其他有机质,这为细菌的生长提供了丰富的营养物质[4]。细菌在材料表面形成生物膜,继而生长繁殖[5]。研究表明[6],在由生物材料引发的感染中,45%是细菌黏附在材料表面从而破坏材料结构造成的。为解决这一问题,常在材料中引入抗生素,但抗生素易被体液迅速冲洗而不能长期保护材料,而且微生物在抗生素长期作用下可能因基因突变产生耐药性[7]。Ag+具有微动效应[8],即使在10~70 μg/mL浓度范围也能对革兰氏阴性菌和革兰氏阳性菌表现出较强的抗菌活性[9]。从材料表面缓释出的Ag+通过静电力吸附在带负电的细菌细胞壁上,中断跨膜电子传递,还可与—SH结合破坏酶蛋白的活性。接着Ag+从细菌尸体中游离出来,再与其他细菌结合达到循环杀菌的效果。因此,微生物不易对Ag+产生耐药性,Ag+对细菌、真菌和病毒都具有良好的广谱抗菌能力[10]。研究表明[11-13],虽然Ag+对微生物的毒性强,但对人体细胞相对安全。Ag-HA无论是在富营养还是贫营养环境都表现出抗菌性能。近些年,Ag-HA逐渐成为抗菌材料的研究热点。Ag-HA的合成方法主要有离子交换法[14]、水热法[15]、固相合成法[16]、溶胶凝胶法[17]、共沉淀法[18]、微波法[19]、仿生法[20]等。离子交换法的缺点是交换液中的Ag+仅能部分交换,残液中的Ag+不能充分利用;固相合成法载银不均匀,且Ag+与HA结合力弱,快速释放的Ag+影响抗菌长久性,此外,过高的Ag+浓度影响人体健康[21]。Zhang等[22]采用仿生合成路线耗时5 d,且产物均匀性差。Dubnika等[23]用沉淀法合成的Ag-HA抗菌活性强、缓释性好,Ag+一年释放量仅占总银含量的8%。徐伏秋等[24]用水热法合成高载银量的棒状Ag-HA,并将其用于陶瓷釉料,成品放置1年后,其杀菌率仍高达99.9%。
本工作结合银的广谱、高效抗菌性及HA的生物活性、相容性两者的优点,采用共沉淀法及水热法一步合成Ag-HA,研究不同合成温度、银添加量对产物理化性能的影响。通过XRD, SEM, TEM, EDS及FTIR等手段从微观形貌、晶体结构等方面比较两种合成方法并研究其抗菌性能。
1 实验材料与方法 1.1 试剂磷酸氢二铵 ((NH4)2HPO4,AR),十二烷基苯磺酸钠 (SDBS,AR),天津科密欧化学试剂有限公司;硝酸钙 (Ca (NO3)2·4H2O,AR),上海精析化工科技有限公司;氨水 (NH3·H2O,AR),南昌鑫光精细化工厂;硝酸银 (AgNO3,AR),上海试剂一厂;LB固体培养基,LB液体培养基,大肠杆菌,金黄色葡萄球菌,上海鲁微科技有限公司。
1.2 Ag-HA的合成共沉淀法:取一定量的 (NH4)2HPO4和Ca (NO3)2·4H2O配成0.1 mol/L溶液,用氨水调节溶液pH=11。将AgNO3溶解于Ca (NO3)2·4H2O溶液中,用恒流泵将 (NH4)2HPO4溶液缓慢滴加至Ca (NO3)2·4H2O/AgNO3混合溶液中,在磁力搅拌器下恒温水浴反应6h,经离心、洗涤并干燥,得到Ag-HA。
水热法:取一定量的 (NH4)2HPO4和Ca (NO3)2·4H2O配成0.1 mol/L溶液,用氨水调节溶液pH=11。将AgNO3及SDBS溶解于Ca (NO3)2·4H2O溶液中,用恒流泵将 (NH4)2HPO4溶液缓慢滴加至Ca (NO3)2·4H2O/AgNO3混合溶液中,将混合反应液加入到反应釜中,一定温度下置于反应箱中水热6h,经离心、洗涤并干燥,得到Ag-HA。
1.3 结构与形貌表征采用D-Max-2500 X射线衍射仪分析产物物相;用mL-A650F扫描电镜观察产物形貌;用QUANTAX能谱仪分析产物表面元素组成及分布;用ALPHA红外光谱仪分析产物官能团。
1.4 Ag-HA银含量及Ag+释放量银含量:利用Volhard原理[6],以铁铵矾溶液为终点指示剂。当溶液变为血红色,且半分钟不褪色为滴定终点。用Ag+取代Ca2+摩尔分数表示Ag-HA的载银量,计算公式如下:

|
(1) |
式中:x为Ag+取代Ca2+摩尔分数;c为NH4SCN标准溶液浓度,mol/L; V为滴定消耗NH4SCN溶液体积,L;m为称取样品的质量,g;M为Ca10(PO4)6(OH)2相对分子质量,1004 g/mol。
Ag+释放量:在100 mL去离子水中加入0.1 g水热法180 ℃合成的Ag-HA粉末样,摇床中37 ℃、50 r/min条件下摇晃24 h,离心后取上清液,用Agilent 8800型ICP-MS测其Ag+累积释放量。
1.5 抗菌性能测试若一种抗菌材料对芽孢杆菌和葡萄球菌有良好的杀菌效果,那么认为该抗菌材料具有广谱性。因此本实验选用E.coli和S.aureus作为实验菌株,表征抗菌效果。
抑菌圈:制备LB固体培养基和营养琼脂固体培养基,倒平板后接入E.coli和S.aureus两种实验菌,Ag-HA样品置于固体培养基中37 ℃恒温恒湿培养,记录抑菌圈直径。
最小抑菌浓度 (Minimum Inhibitory Concentration, MIC):取16 mg Ag-HA样品和5 mL液体培养基,配成浓度为3200 μg/mL的抗菌粉末悬浊液,用2倍稀释法将其余试管中粉体浓度依次稀释为1600,800,400,200,100,50,25,12.5 μg/mL的抗菌悬浊液。向每个试管中接入0.1 mL浓度为105 cfu/mL的菌液,37 ℃恒温恒湿培养。移取菌液0.1 mL涂平板,确认其最小抑菌浓度。
杀菌率:将0.5gAg-HA样品放入50 mL浓度为105 cfu/mL菌悬液中,振荡均匀,37 ℃恒温恒湿培养。取对照样和培养后的菌液各0.1 mL涂平板观察并计数。计算培养1,3,6,12, 24 h后的杀菌率。

|
(2) |
式中:X为杀菌率;A为空白对照组平均菌落数;B为实验样品平均菌落数。
2 结果与讨论 2.1 XRD分析图 1为不同合成方法的Ag-HA的XRD图谱。可知,两种方法合成的产物均与HA (PDF NO. 09-0432,空间群P63/m) 的结构相同。沉淀法合成的Ag-HA衍射峰强度较低、峰形较宽,而水热法合成的Ag-HA衍射峰强度较高且峰形尖而窄。两种方法合成的Ag-HA均随合成温度升高结晶度增大,这表明较高的合成温度有利于HA相的形成。

|
图 1 不同合成方法的Ag-HA的XRD谱 Fig. 1 XRD patterns of Ag-HA by different synthesis methods |
图 2为水热法180 ℃合成的不同载银量Ag-HA的XRD图谱。可知,不同载银量的Ag-HA衍射峰都较尖锐,峰形一致,强度基本相同。这表明此条件下合成的Ag-HA晶体生长、发育良好且结晶程度高。少量Ag+的加入并不影响HA的特征峰位置及强度。XRD图中未检测出银的化合物,晶体基本由HA相组成。这可能是由于Ag+取代Ca2+在HA晶体中的位置,生成Ca10-xAgx (PO4)6(OH)2离子固溶体。
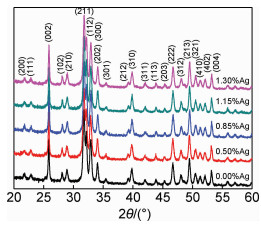
|
图 2 不同载银量Ag-HA的XRD谱 Fig. 2 XRD patterns of Ag-HA with various silver content |
表 1为不同方法合成Ag-HA的晶粒尺寸和晶胞参数。可知,水热法合成的Ag-HA晶胞参数更小、晶粒尺寸更大。升高合成温度,有利于Ag-HA晶体的生长,易得到较大尺寸的晶粒。沉淀法70 ℃和90 ℃时,(002) 晶面相对峰强为65.4%和60.3%,水热法160 ℃和180 ℃时,(002) 晶面相对峰强达76.3%和70.1%,均高于标准卡片 (09-0432) 的40%,表明HA晶体沿着c轴取向生长。
| Method | Crystal size/nm | Cell parameter/nm | |
| a | c | ||
| Precipitation method at 70 ℃ | 22.7±0.7 | 0.9473 | 0.6897 |
| Precipitation method at 90 ℃ | 25.1±0.7 | 0.9450 | 0.6886 |
| Hydrothermal method at 160 ℃ | 37.5±0.8 | 0.9441 | 0.6886 |
| Hydrothermal method at 180 ℃ | 50.7±0.9 | 0.9424 | 0.6886 |
表 2为水热法180 ℃合成的不同载银量Ag-HA的晶粒尺寸和晶胞参数。随载银量增加,Ag-HA晶胞参数及晶粒尺寸均增大。Ca2+离子半径为0.106 nm,Ag+离子半径为0.115 nm,一部分Ca2+被取代后使晶体发生一定的畸变。据文献报道[25],取代量在0~0.055之间,Ag-HA晶体的晶胞参数线性增大。此外,对比载银量1.30% Ag-HA及纯HA,c轴变化量明显大于a轴,这可能是由于HA晶体存在平行于c轴的通道,Ag+沿c轴进入晶胞取代Ca2+位置,沿c轴方向的 (002) 晶面间距变小,即c轴晶胞参数变大,而沿a轴方向的晶面间距变化较小,因而a轴晶胞参数变化相对较小。
| Silver content/% | Crystal size/nm | Cell parameter/nm | |
| a | c | ||
| 0.00 | 47.0±0.8 | 0.9418 | 0.6876 |
| 0.50 | 50.7±0.9 | 0.9427 | 0.6877 |
| 0.85 | 50.7±0.9 | 0.9424 | 0.6886 |
| 1.15 | 52.2±1.0 | 0.9439 | 0.6886 |
| 1.30 | 53.7±0.9 | 0.9465 | 0.6970 |
图 3为用Volhard原理[6]测定水热法180 ℃合成Ag-HA中硝酸银添加量与实际载银量的曲线变化图。可以看出,Ag-HA载银量随硝酸银添加量增加而增大,且增加的趋势逐渐减小。这可能是由于,一方面银添加量达到一定值后,Ag+取代Ca2+的量逐渐趋于饱和;另一方面,HA中Ca2+有2种位置,Ag+取代不同位置的Ca2+受到的空间位阻不同:反应初始阶段,Ag+取代空间位阻较小的Ca (Ⅰ)。随着反应的进行,需要克服更大的位阻才能进行取代。
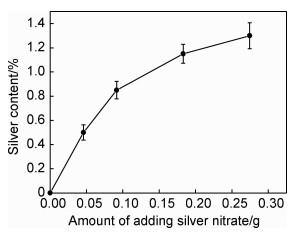
|
图 3 Ag-HA中银含量与硝酸银添加量的关系 Fig. 3 Relationship between the silver content of Ag-HA and the amount of adding silver nitrate |
图 4为不同合成方法下0.85% Ag-HA的SEM像。可以看出,温度及合成方法对晶体形貌有较大影响。沉淀法70 ℃时,结晶度低,主要为团聚的细颗粒,无明显的棒状产物。沉淀法90 ℃时,逐渐长成短棒状晶体,但分散性差,有明显团聚现象。水热法160 ℃时,部分晶体已长成长棒状且分散性较好,但晶粒尺寸不均匀,仍有部分颗粒未完全结晶。水热法180 ℃时,Ag-HA结晶度高,分散性好,长度为500~600 nm,直径为40~60 nm,有较高的长径比。SEM图谱分析结果与图 1的XRD分析结果有较好的吻合,显然,较低的合成温度不利于晶体沿一维方向生长。Ag-HA成核的热力学推动力为过饱和度,合成温度通过过饱和度而影响晶体的成核,合成温度还通过迁移速率而影响晶体的生长。另水热合成法中添加了阴离子表面活性剂,亲水基和亲油基可使Ag-HA颗粒在分散介质中形成稳定的单分散,从而使Ag-HA颗粒表面状态发生部分改变,减小了颗粒间的吸引力。因此,水热法180 ℃合成的Ag-HA分散性更好,结晶度更高,长径比更大。

|
图 4 不同合成方法下0.85% Ag-HA的SEM像 (a) 沉淀法70 ℃; (b) 沉淀法90 ℃; (c) 水热法160 ℃; (d) 水热法180 ℃ Fig. 4 SEM images of 0.85% Ag-HA by different synthesis methods (a) precipitation method at 70 ℃; (b) precipitation method at 90 ℃; (c) hydrothermal method at 160 ℃; (d) hydrothermal method at 180 ℃ |
图 5是水热法180 ℃合成的0.85% Ag-HA的EDS图谱。扫描图 5(a)方框区域,(Ca+Ag)/P约为1.62,接近HA的理论Ca/P比值。经EDS图谱分析其载银量为0.97%,用原子吸收光谱仪定量分析0.85% Ag-HA粉末样品载银量为0.64%,与图 3中Volhard法测得0.85%载银量的结果差距不大。这表明,微量的银均匀分布于Ag-HA颗粒中,这与XRD结果和晶胞参数计算结果吻合。其他载银量的Ag-HA与0.85% Ag-HA的EDS图谱分析结果类似。

|
图 5 0.85% Ag-HA的EDS能谱图 (a),元素总分布图 (b) 和单元素分布图 (c) Fig. 5 EDS spectrum of 0.85% Ag-HA (a), image of all elements distribution (b) and images of single element distribution (c) |
图 6为不同合成方法的Ag-HA的FTIR图谱。可知,565,606,960,1032,1096 cm-1处出现了PO43-的特征吸收峰。其中,565 cm-1和602 cm-1为PO43-基团O—P—O键的弯曲振动峰,960 cm-1为PO43-基团P—O键的对称伸缩振动峰,1032 cm-1和1096 cm-1为PO43-基团P—O键的反对称伸缩振动峰。1640 cm-1为结晶水的伸缩振动峰,630 cm-1为—OH的摆动振动峰。这些特征峰进一步证实合成的产物为羟基磷灰石。877,1415 cm-1和1460 cm-1等为CO32-的特征吸收峰。其中,877 cm-1为CO32-的面外弯曲振动峰,1415 cm-1和1460 cm-1附近的峰为CO32-的反对称伸缩振动峰,这个双峰分裂表明CO32-已经进入Ag-HA晶格中,形成碳酸羟基磷灰石结构,而不是单纯的以自由CO32-或碳酸盐形式存在的单峰[26]。通常,这种取代不会破坏羟基磷灰石的晶体结构,是一种正常的取代[27]。1380 cm-1为NO3-基团的特征峰,这是由前驱体中残余NO3-引起的。此外,随着合成温度升高,NO3-的特征吸收峰减弱。这可能是由于较高的合成温度使得前驱体反应更完全,NO3-残余量更少造成的[28]。图 7为水热法180 ℃合成不同载银量Ag-HA的FTIR图谱。可以看出,不同载银量Ag-HA的FTIR图谱基本一致,含有相同的官能团。
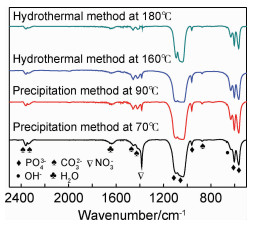
|
图 6 不同合成方法的Ag-HA的FTIR图 Fig. 6 FTIR spectra of Ag-HA by different synthesis methods |

|
图 7 不同载银量Ag-HA的FTIR图 Fig. 7 FTIR spectra of Ag-HA with various silver contents |
水热法180 ℃合成的不同载银量Ag-HA与E.coli和S.aureus培养24 h后的抑菌效果如图 8所示。Ag-HA周围有明显的抑菌圈,而纯HA周围被细菌包围。经48h及72 h培养后Ag-HA表现出的抑菌圈均没有变小的趋势,表明Ag-HA对E.coli和S.aureus具有良好的抑菌效果。图 9为0.85% Ag-HA培养1h的杀菌效果照片。可知纯HA的培养皿中E.coli和S.aureus急剧增殖,而Ag-HA的培养皿中E.coli和S.aureus全部被杀死。培养3,6,12,24 h后,杀菌率依然维持在100%。结果表明,Ag-HA对E.coli和S.aureus具有良好的持续杀菌效果。其他载银量的Ag-HA在1,3,6,12,24 h后的杀菌率也均为100%。但不同载银量Ag-HA的MIC值不同,0.50% Ag-HA的MIC值为50 μg/mL,而1.30% Ag-HA的MIC值低至25 μg/mL。不同载银量Ag-HA的MIC值均远低于抗菌材料800 μg/mL以下的要求。

|
图 8 不同载银量Ag-HA与E.coli (1) 和S.aureus (2) 培养24 h抑菌效果图 (a) 0.00% Ag-HA; (b) 0.50% Ag-HA; (c) 0.85% Ag-HA; (d) 1.15% Ag-HA; (e) 1.30% Ag-HA Fig. 8 Inhibition property images of Ag-HA with various silver content in 24 h (a) 0.00% Ag-HA; (b) 0.50% Ag-HA; (c) 0.85% Ag-HA; (d) 1.15% Ag-HA; (e) 1.30% Ag-HA |

|
图 9 0.85% Ag-HA 1h杀菌效果图 (a) Ag-HA (E.coli); (b) 纯HA (E.coli); (c) Ag-HA (S.aureus); (d) 纯HA (S.aureus) Fig. 9 Antibacterial property images of 0.85% Ag-HA in 1h (a) Ag-HA (E.coli); (b) HA (E.coli); (c) Ag-HA (S.aureus); (d) HA (S.aureus) |
利用ICP-MS测定Ag-HA在去离子水中24 h的Ag+释放量,当Ag-HA载银量为0.50%,0.85%,1.15%,1.30%时,Ag-HA的银释放量分别为 (0.26±0.08),(1.06±0.07),(3.05±0.13),(12.47±0.22)μg/L。可知,随着Ag-HA载银量增大,Ag+释放量增大,但它们在水中的释放量都较低。由XRD及SEM分析结果可知,水热法180 ℃合成的Ag-HA结晶度高,晶形完整,这使得Ag-HA在水中有着更小的溶解度;进入HA晶格的Ag+相对于表面吸附的Ag+有更高的结合能,因而Ag-HA有较低的释放速率。这一结果有益于改善Ag-HA缓释性能,从而提高Ag-HA的抗菌持久性。图 8,9中良好的抑菌及杀菌效果得益于Ag-HA中负载的Ag+,缓慢释放的Ag+穿过细胞壁和细胞膜进入细菌内部后与酶蛋白的巯基—SH结合,使酶丧失活性,中断细菌跨膜电子转移并使DNA分子凝聚失去复制能力,从而达到抑菌及杀菌效果[29]。
3 结论(1) 沉淀法易合成出颗粒状或短棒状Ag-HA,而水热法易合成出高长径比的长棒状Ag-HA。较高的合成温度有利于Ag-HA晶体的生长,获得粒径较大的产物,水热法180 ℃合成的Ag-HA平均晶粒尺寸为 (50.7±0.9) nm。
(2) 银的引入增大了Ag-HA的晶粒尺寸及晶胞参数。当载银量为1.30%时,Ag-HA平均晶粒尺寸为 (53.7±0.9) nm,晶胞参数a=0.9465 nm,c=0.6970 nm。
(3) 水热法合成的Ag-HA对E.coli和S.aureus具有良好的抗菌性,且具有一定的抗菌持久性。不同载银量Ag-HA都具有良好的杀菌效果,在1,3,6,12,24 h后的杀菌率均为100%。
| [1] | HENCH L L. Bioceramics[J]. Journal of the American Ceramic Society, 1998, 81 (7): 1705–1728. |
| [2] | 肖镇昆, 吴磊, 米饶, 等. 碳纳米管对羟基磷灰石基复合材料力学性能的影响[J]. 无机化学学报, 2015, 31 (1): 114–120. XIAO Z K, WU L, MI R, et al. Effect of carbon nanotubes on the mechanical properties of carbon nanotubes/hydroxyapatite composites[J]. Chinese Journal of Inorganic Chemistry, 2015, 31 (1): 114–120. |
| [3] | 刘翠莲, 唐春康. 骨及生物材料中的纳米磷酸钙[J]. 无机化学学报, 2014, 30 (1): 1–9. LIU C L, TANG C K. Calcium phosphate nanoparticles in bone and biomaterials[J]. Chinese Journal of Inorganic Chemistry, 2014, 30 (1): 1–9. |
| [4] | RAMESHBABU N, SAMPATH K T S, PRABHAKAR T G, et al. Antibacterial nanosized silver substituted hydroxyapatite:synthesis and characterization[J]. Journal of Biomedical Materials Research Part A, 2007, 80 (3): 581–591. |
| [5] | STANIC V, JANACKOVIC D, DIMITRIJEVIC S, et al. Synthesis of antimicrobial monophase silver-doped hydroxyapatite nanopowders for bone tissue engineering[J]. Applied Surface Science, 2011, 257 (9): 4510–4518. DOI: 10.1016/j.apsusc.2010.12.113 |
| [6] | 卢志华, 孙康宁. 载银羟基磷灰石的制备与表征[J]. 稀有金属材料工程, 2009, 38 (增刊 1): 56–60. LU Z H, SUN K N. Preparation and characterization of silver loaded hydroxyapatite[J]. Rare Metal Materials and Engineering, 2009, 38 (Suppl 1): 56–60. |
| [7] | IVASHCHENKO O, PROTSENKO L, BUDYLINA O, et al. Influence of silver doping on hydroxyapatite properties[J]. Advanced Science, Engineering and Medicine, 2013, 5 (3): 266–274. DOI: 10.1166/asem.2013.1248 |
| [8] | LARIMER C, OSTROWSKI N, SPEAKMAN J, et al. The segregation of silver nanoparticles in low-cost ceramic water filters[J]. Materials Characterization, 2010, 61 (4): 408–412. DOI: 10.1016/j.matchar.2010.01.006 |
| [9] | DIAZ M, BARBA F, MIRANDA M, et al. Synthesis and antimicrobial activity of a silver-hydroxyapatite nanocomposite[J]. Journal of Nanomaterials, 2009, 2009 : 1–5. |
| [10] | 夏金兰, 王春, 刘新星. 抗菌剂及其抗菌机理[J]. 中南大学学报, 2004, 35 (1): 31–38. XIA J L, WANG C, LIU X X. Research on antimicrobial agents and their mechanisms of actions[J]. Journal of Central South University, 2004, 35 (1): 31–38. |
| [11] | PATTABI R M, SRIDHAR K R, GOPAKUMAR S, et al. Antibacterial potential of silver nanoparticles synthesised by electron beam irradiation[J]. International Journal of Nanoparticles, 2010, 3 (1): 53–64. DOI: 10.1504/IJNP.2010.033221 |
| [12] | SIMON V, ALBON C, SIMON S. Silver release from hydroxyapatite self-assembling calcium-phosphate glasses[J]. Journal of Non-Crystalline Solids, 2008, 354 (15): 1751–1755. |
| [13] | ASMUS S M F, SAKAKURA S, PEZZOTTI G. Hydroxyapatite toughened by silver inclusions[J]. Journal of Composite Materials, 2003, 37 (23): 2117–2129. DOI: 10.1177/002199803036242 |
| [14] | LIM P N, TEO E Y, HO B, et al. Effect of silver content on the antibacterial and bioactive properties of silver-substituted hydroxyapatite[J]. Journal of Biomedical Materials Research Part A, 2013, 101 (9): 2456–2464. |
| [15] | CHEN H X, XUE F, YANG D, et al. Hydrothermal synthesis and characterization of Ag-doped hydroxyapatite antibacterial agent[J]. Acta Chimica Sinica, 2012, 70 (12): 1362–1366. DOI: 10.6023/A1201143 |
| [16] | PRAMANIK S, AGARWAL A K, RAI K N, et al. Development of high strength hydroxyapatite by solid-state-sintering process[J]. Ceramics International, 2007, 33 (3): 419–426. DOI: 10.1016/j.ceramint.2005.10.025 |
| [17] | CHEN W, OH S, ONG A P, et al. Antibacterial and osteogenic properties of silver-containing hydroxyapatite coatings produced using a sol gel process[J]. Journal of Biomedical Materials Research Part A, 2007, 82 (4): 899–906. |
| [18] | MONTERO V M, SHI J. Theoretical and experimental study of the incorporation of tobramycin and strontium-ions into hydroxyapatite by means of co-precipitation[J]. Applied Surface Science, 2014, 314 (24): 376–383. |
| [19] | IQBAL N, KADIR M R A, MALEK N A N N, et al. Rapid microwave assisted synthesis and characterization of nanosized silver-doped hydroxyapatite with antibacterial properties[J]. Materials Letters, 2012, 89 (25): 118–122. |
| [20] | WANG Z, YAN Y, WAN T. Fabrication and characterization of hydroxyapatite/collagen bone-like nanocomposite through a self-assembly method[J]. Science and Engineering of Composite Materials, 2012, 19 (2): 177–182. |
| [21] | 杨辉, 蔡日强, 王栋, 等. 抗菌羟基磷灰石的一步合成及其表征[J]. 功能材料, 2010, 41 (3): 406–109. YANG H, CAI R Q, WANG D, et al. Preparation and characterization of antibacterial hydroxyapatite powder using one step coprecipitation method[J]. Journal of Functional Materials, 2010, 41 (3): 406–109. |
| [22] | ZHANG Y, LU J. A mild and efficient biomimetic synthesis of rodlike hydroxyapatite particles with a high aspect ratio using polyvinylpyrrolidone as capping agent[J]. Crystal Growth and Design, 2008, 8 (7): 2101–2107. DOI: 10.1021/cg060880e |
| [23] | DUBNIKA A, RUDOVICA V. Evaluation of silver ion bioavailability from silver doped hydroxyapatite[J]. Key Engineering Materials, 2014, 604 : 200–203. DOI: 10.4028/www.scientific.net/KEM.604 |
| [24] | 徐伏秋, 陈华军, 丁梧秀. 载银羟基磷灰石抗菌粉体和陶瓷的制备及抗菌性能[J]. 无机化学学报, 2013, 29 (12): 2582–2586. XU F Q, CHEN H J, DING W X. Preparation and antibacterial property of Ag-doped hydroxyapatite antibacterial powders and antibacterial ceramic[J]. Chinese Journal of Inorganic Chemistry, 2013, 29 (12): 2582–2586. |
| [25] | BADROUR L, SADEL A, ZAHIR M, et al. Synthesis and physical and chemical characterization of Ca10-xAgx(PO4)6(OH)2-x2 apatites[J]. Annales de Chimie Science des Matériaux, 1998, 23 (1-2): 61–64. DOI: 10.1016/S0151-9107(98)80012-3 |
| [26] | CAO M, WANG Y, GUO C, et al. Preparation of ultrahigh-aspect-ratio hydroxyapatite nanofibers in reverse micelles under hydrothermal conditions[J]. Langmuir, 2004, 20 (11): 4784–4786. DOI: 10.1021/la0498197 |
| [27] | 廖建国, 刘琼. 微波法合成纳米羟基磷灰石晶体及表征[J]. 稀有金属材料与工程, 2014, 43 (7): 1779–1782. LIAO J G, LIU Q. Synthesis of nano-hydroxyapatite by microwave process and its characterization[J]. Rare Metal Materials and Engineering, 2014, 43 (7): 1779–1782. |
| [28] | RAJENDRAN A, BARIK R C, NATARAJAN D, et al. Synthesis, phase stability of hydroxyapatite-silver composite with antimicrobial activity and cytocompatability[J]. Ceramics International, 2014, 40 (7): 10831–10838. DOI: 10.1016/j.ceramint.2014.03.075 |
| [29] | ISLAM M S, LARIMER C, OJHA A, et al. Antimycobacterial efficacy of silver nanoparticles as deposited on porous membrane filters[J]. Materials Science and Engineering:C, 2013, 33 (8): 4575–4581. DOI: 10.1016/j.msec.2013.07.013 |
 2017, Vol. 45
2017, Vol. 45


