文章信息
- 张传杰, 颜超, 刘云, 崔莉, 朱平
- ZHANG Chuan-jie, YAN Chao, LIU Yun, CUI Li, ZHU Ping
- 过程控制剂对机械球磨法制备壳聚糖微细粉体结构与性能的影响
- Influence of Process Control Agent on Characterization and Structure of Micron Chitosan Powders Prepared by Ball Milling Method
- 材料工程, 2016, 44(12): 54-60
- Journal of Materials Engineering, 2016, 44(12): 54-60.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2016.12.009
-
文章历史
- 收稿日期: 2014-09-12
- 修订日期: 2016-07-09
2. 武汉纺织大学 化学与化工学院, 武汉 430020
2. School of Chemistry and Chemical Engineering, Wuhan Textile University, Wuhan 430020, China
壳聚糖(Chitosan,CS)是天然多糖中唯一带正电荷的碱性多糖,具有优异的生物相容性、抗菌、消炎、免疫和抗肿瘤活性等,而且原料来源丰富,已广泛应用于水处理、生物医学材料、抗菌纺织品、生物降解薄膜以及农业生产等领域[1-7]。将壳聚糖加工成微米级甚至纳米级超细粉体,可以作为药物载体使用,或者添加到湿法纺丝纤维的溶液中制备抗菌功能性纤维,其化学活性、吸附性以及抗菌性能将更加优异。目前,多采用离子凝胶法等化学方法制备壳聚糖纳米粉体[8-16],存在工艺复杂、产量低、成本高、产品中有化学残留等问题,而且环境污染严重,甚至可能影响壳聚糖的抗菌及其他性能。采用机械球磨法制备壳聚糖微米级超细粉体,是通过罐体快速多维摆动式运动,锆珠和物料在罐内产生多向不规则撞击而使物料破碎。这些被破碎的物料粉体在继续冲击磨粉碎过程中再次破碎,如此反复,使物料颗粒均匀的细化。机械球磨法制备壳聚糖微米级粉体可以克服化学存在的弊端,但是,壳聚糖颗粒粉碎后,其比表面积增加,表面能增大,颗粒之间会发生团聚,难以得到微米级超细粉体。如果在壳聚糖机械球磨粉碎过程中加入过程控制剂(Process Control Agent,PCA),则可以避免机械球磨过程中因冷焊作用而造成的粉体粘球、粘罐现象,同时避免或减缓粉体的结块团聚[17-19]。本工作从制备壳聚糖微米级粉体的工艺要求出发,分别以蒸馏水和无水乙醇作为PCA,采用机械球磨法制备壳聚糖超细粉体,通过激光粒度分析仪、扫描电子显微镜、红外光谱仪、X射线衍射仪和热重分析仪等手段,探究PCA的类型和用量对壳聚糖微细粉体的粒径分布、微观形貌、结构以及性能的影响。
1 实验材料与方法 1.1 实验原料壳聚糖:黏均分子量为11.91×105,脱乙酰度为90%,片状,青岛云宙生化有限公司;无水乙醇、氯化钠、醋酸:分析纯,国药集团化学试剂有限公司。
1.2 壳聚糖微细粉体的制备将片状的壳聚糖原料装入CJM-SY-A型高能纳米冲击磨的料罐中,采用直径为8mm的锆珠,球料比为2:1,冲击磨转速为400r/min,功率为4kW,处理时间为2h,由此制得壳聚糖微细粉体。
壳聚糖片状原料命名为CS0,未添加PCA制得的粉体命名为CS1,采用蒸馏水(蒸馏水的体积(mL)/壳聚糖质量(g)=0.5)为PCA制得的粉体命名为CS2;以乙醇为PCA,采用4种添加量(乙醇的体积(mL)/壳聚糖质量(g)= 0.25,0.5,0.75,1.0)制得的粉体分别命名为CS31,CS32,CS33,CS34。
1.3 壳聚糖微细粉体的产率将细化后的壳聚糖粉体从罐体中取出,称重,记为M;然后采用100(154μm),240(61μm),300(48μm),800目(20μm)和2000目(6μm)的筛网进行逐级筛分,2000目筛网筛选出的粉体作为最终样品,称重,记为m,按照式(1)计算样品的产率w。
| $w = \frac{m}{M} \times 100\% $ | (1) |
称取0.5g聚山梨酯-80表面活性剂,添加到100mL乙醇中搅拌溶解,边超声边将称取的1g壳聚糖样品添加到上述溶液中,超声处理1h,然后将悬浮液静置30min,以不产生沉淀为宜。采用Nanotrac激光粒径分析仪测试样品的粒径分布。
将上述溶液倒入培养皿中自然风干,然后双面胶带粘取少量壳聚糖粉体,采用JSM-6510LA 扫描电子显微镜观察样品的SEM形貌。
1.5 粉体的结构与性能表征采用TENSOR 27 红外光谱仪,通过压片法测试样品的红外光谱;采用DMAXRB-Ⅱ X射线衍射仪测试样品的结晶结构;采用TG 209 热重分析仪测试样品的热稳定性;采用黏度法测试壳聚糖的黏均分子量Mη,每个样品测试3次取平均值[20]。
2 结果与分析 2.1 PCA对粉体产率的影响采用不同的PCA制备壳聚糖微细粉体,所得样品的产率如图 1所示。可以看出,不添加PCA时壳聚糖微细粉体的产率为25%,采用蒸馏水为PCA时其产率反而明显下降,而采用乙醇为PCA时其产率则大幅提高。这是因为采用乙醇为PCA时,乙醇分子能够吸附在壳聚糖粉体的表面,并渗透到壳聚糖粉体的裂缝处甚至粉体的内部,拆散或削弱壳聚糖分子之间的作用力,加速颗粒的细化;另外,吸附在壳聚糖粉体表面的PCA形成一层液体保护膜,阻碍细化后颗粒的直接接触,削弱颗粒间的分子作用力,而且降低了粉体颗粒的表面能,从而避免细化后粉体的重新团聚。但是,采用蒸馏水为PCA时,由于水分子的极性比较强,对细化后的壳聚糖粉体有较弱的溶胀作用,甚至对球磨时产生的分子量较小的壳聚糖有溶解作用,把壳聚糖粉体黏结在一起,不利于粉体的细化。采用乙醇为PCA时,得到的壳聚糖微细粉体蓬松,而且罐壁和锆珠表面均较光洁,无粉体黏附现象;而采用蒸馏水为PCA时,得到的壳聚糖粉体密实,且罐壁和锆珠表面存在严重的粉体黏附,这种现象亦验证了上述两种作用的存在。
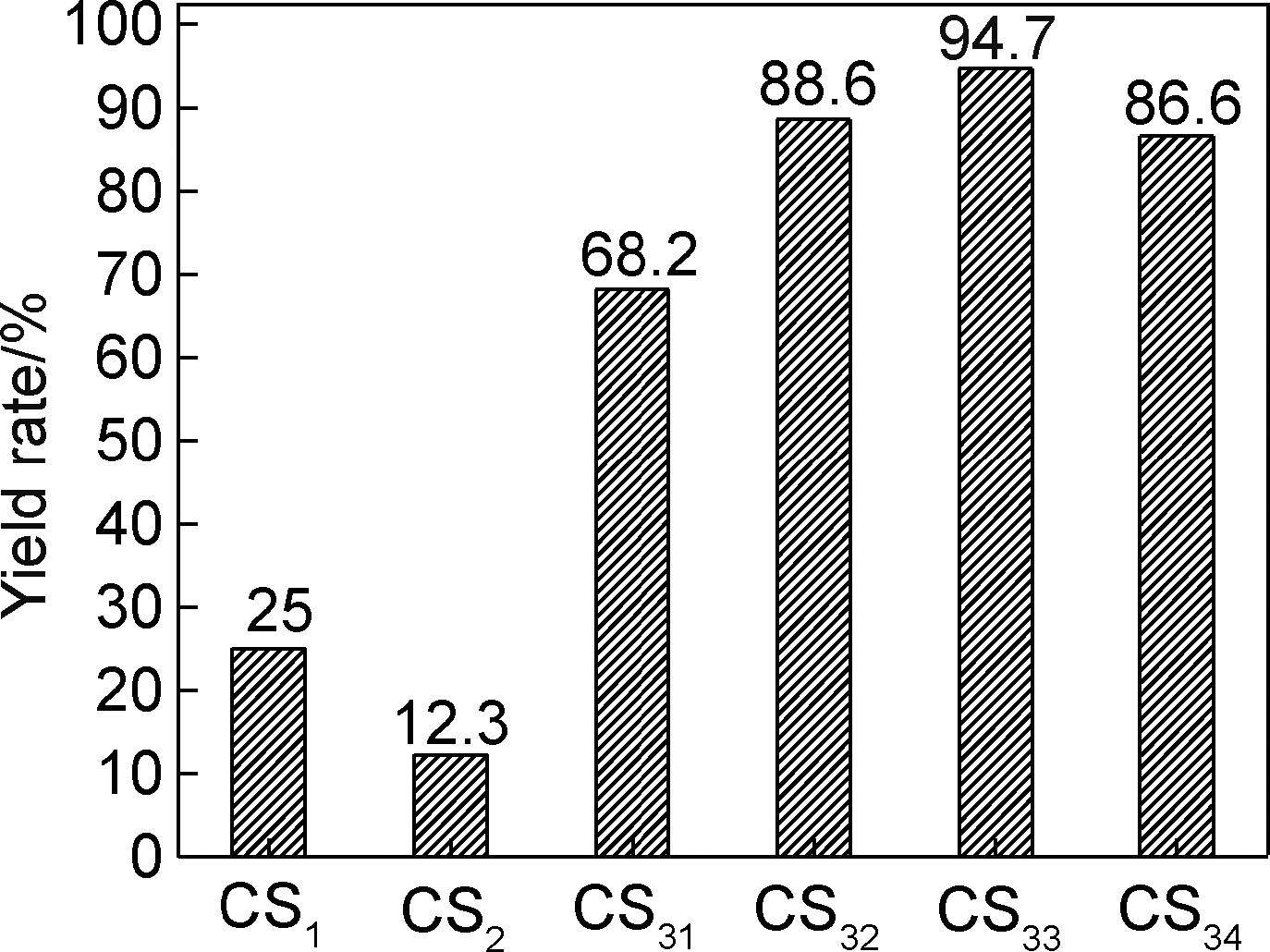
|
图 1 不同PCA制备的壳聚糖微细粉体产率 Fig. 1 Yield rate of micron chitosan powders with different PCA |
另外,从图 1可以看出,随着乙醇用量的增加,壳聚糖粉体的产率呈现先增加后降低的趋势,当乙醇的用量达到0.75mL/g时,壳聚糖超细粉体的产率最高,达到94.7%。这是因为乙醇分子能够在壳聚糖粉体的表面形成一层保护膜,当膜壁太厚时,将减弱锆珠对粉体的冲击作用,导致粉体不能进一步细化,产率下降。PCA用量适中时,在粉末、罐壁、磨球表面均形成一层保护膜,可以缓冲碰撞时产生的能量,调整冷焊与破碎间的平衡,从而起到过程控制的作用[21]。
2.2 PCA用量对粉体粒径分布的影响采用乙醇为PCA制备壳聚糖微细粉体,然后逐级筛分,并测试2000目筛网筛分后样品的粒径分布,结果如图 2所示。可以看出,壳聚糖微细粉体的粒径分布均匀,分散性较好。但是,随着PCA用量的增加,粉体的粒径分布变宽,颗粒粒径变大。4种壳聚糖粉体的D50分别为233,352,824nm和834nm,D90分别为736,1105,1629nm和1650nm。这是因为随着乙醇用量的增加,吸附在壳聚糖表面的液膜厚度逐渐增加,锆珠对壳聚糖的冲击力被液膜阻隔和部分吸收,导致壳聚糖受到的锆珠冲击作用减弱,造成壳聚糖破碎后形成的粉体的颗粒较大,粒径增加,且分布范围变宽。当乙醇的用量为0.75mL/g时,这种减弱作用并不明显,此时制备的壳聚糖粉体粒径范围为0.72~6.54μm,而常用的纺丝喷丝头的孔径尺寸≥70μm,因此仍能满足纺丝加工的要求,在纺丝过程中壳聚糖颗粒不会堵塞喷丝头。
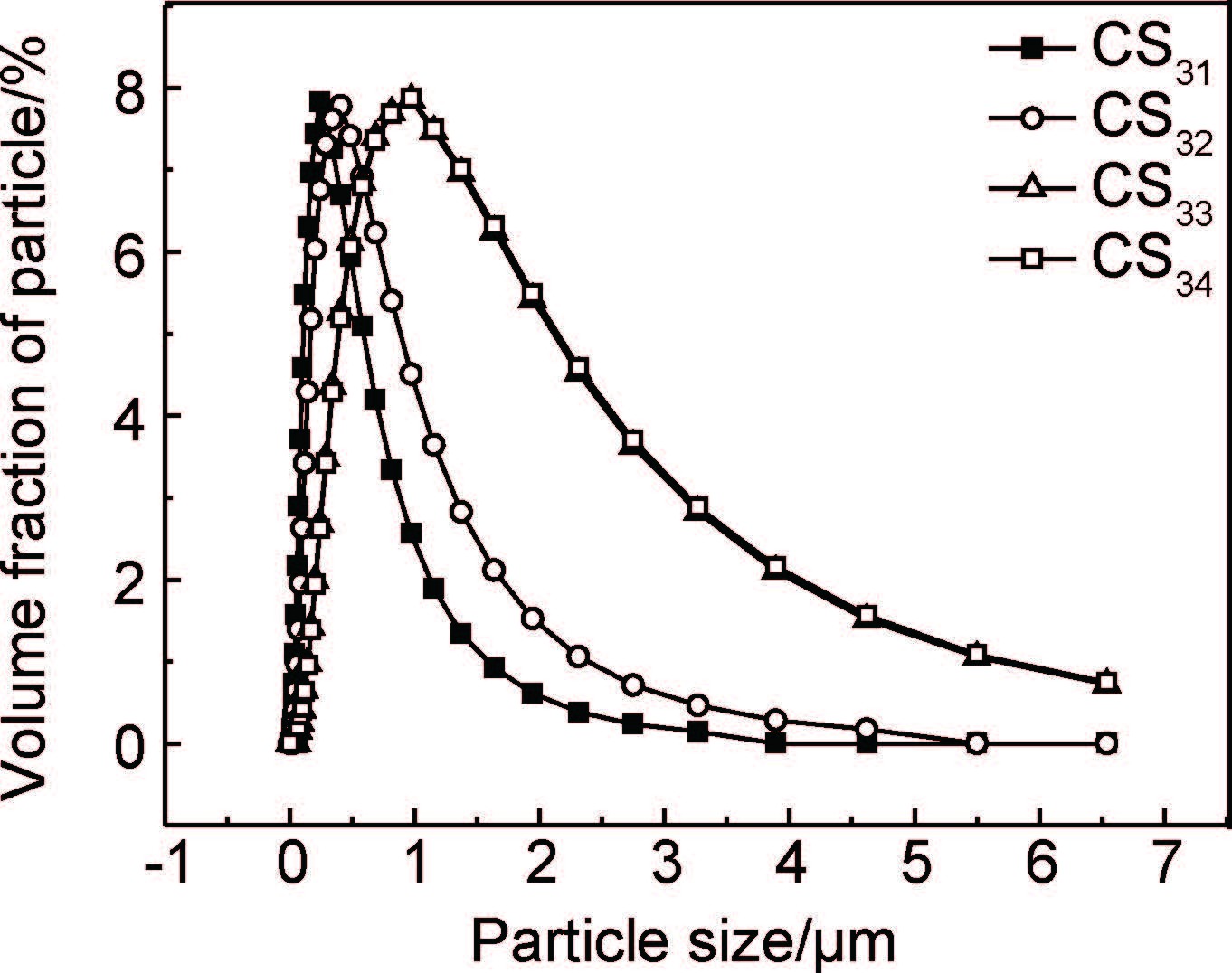
|
图 2 PCA用量对壳聚糖微细粉体粒径分布的影响 Fig. 2 Effect of PCA amount on particle size distribution of micron chitosan powders |
壳聚糖原料及采用不同PCA制备的壳聚糖微细粉体的SEM形貌如图 3所示。可以看出,壳聚糖原料为不规则的片状或棒状,颗粒尺寸为400~1000μm,粉碎后壳聚糖粉体颗粒的尺寸明显变小,但不同PCA制备的样品形貌和颗粒尺寸差别较大。无PCA或蒸馏水作为PCA时,制备的CS粉体颗粒的粒径分布较宽,既有粒径在几个微米甚至更小的颗粒,也有较多粒径≥100μm的颗粒;且CS粉体的形状多为不规则的片状、块状,结构疏松,单个颗粒中有较多的孔隙和裂缝,与揉皱的纸团的外观类似,说明这些大的颗粒是由破碎后的颗粒重新堆积、黏结而成。无水乙醇为PCA时,粉体颗粒的粒径分布范围相对较窄,且粒径明显减小,相同放大倍数下,视野内颗粒的数量明显增大。CS33壳聚糖微细粉体SEM形貌如图 4所示。可以看出,无水乙醇为PCA时,仍然存在少量粒径为几微米的颗粒。细化后的壳聚糖粉体颗粒为不规则的块状,具有类似片岩的结构,结构密实。采用机械球磨法制备壳聚糖微细粉体,原料在锆珠的撞击作用下,发生破裂,剥离形成许多不规则的碎片,添加乙醇为PCA可以避免破碎后的粉体重新黏结和堆积成大颗粒,从而将制备的壳聚糖粉体颗粒的粒径控制在恰当的范围内。

|
图 3 壳聚糖微细粉体的SEM形貌 (a)CS0;(b)CS1;(c)CS2;(d)CS33 Fig. 3 SEM micrographs for micron chitosan powders (a)CS0;(b)CS1;(c)CS2;(d)CS33 |

|
图 4 CS33壳聚糖粉体的SEM形貌 Fig. 4 SEM micrographs of CS33 micron chitosan powders |
壳聚糖原料及采用不同PCA制备的壳聚糖微细粉体的黏均分子量如图 5所示。可以看出,壳聚糖粉体的黏均分子量均发生不同程度的降低。这是因为在锆珠强烈的冲击、剪切和挤压等作用下,壳聚糖大分子之间的作用力被拆散,使得粉体逐步细化,与此同时这种强烈的作用可能导致壳聚糖大分子的部分链段断裂,分子量降低。由于不添加PCA或采用蒸馏水为PCA时,壳聚糖粉体的粒径较大,所以能够耐受的锆珠冲击力较强,在球磨破碎形成微细粉体的过程中,壳聚糖大分子遭受破坏发生断裂的几率减少。因此,相对而言,采用乙醇为PCA时,制备的壳聚糖粉体的分子量下降的最多,降低了23%。
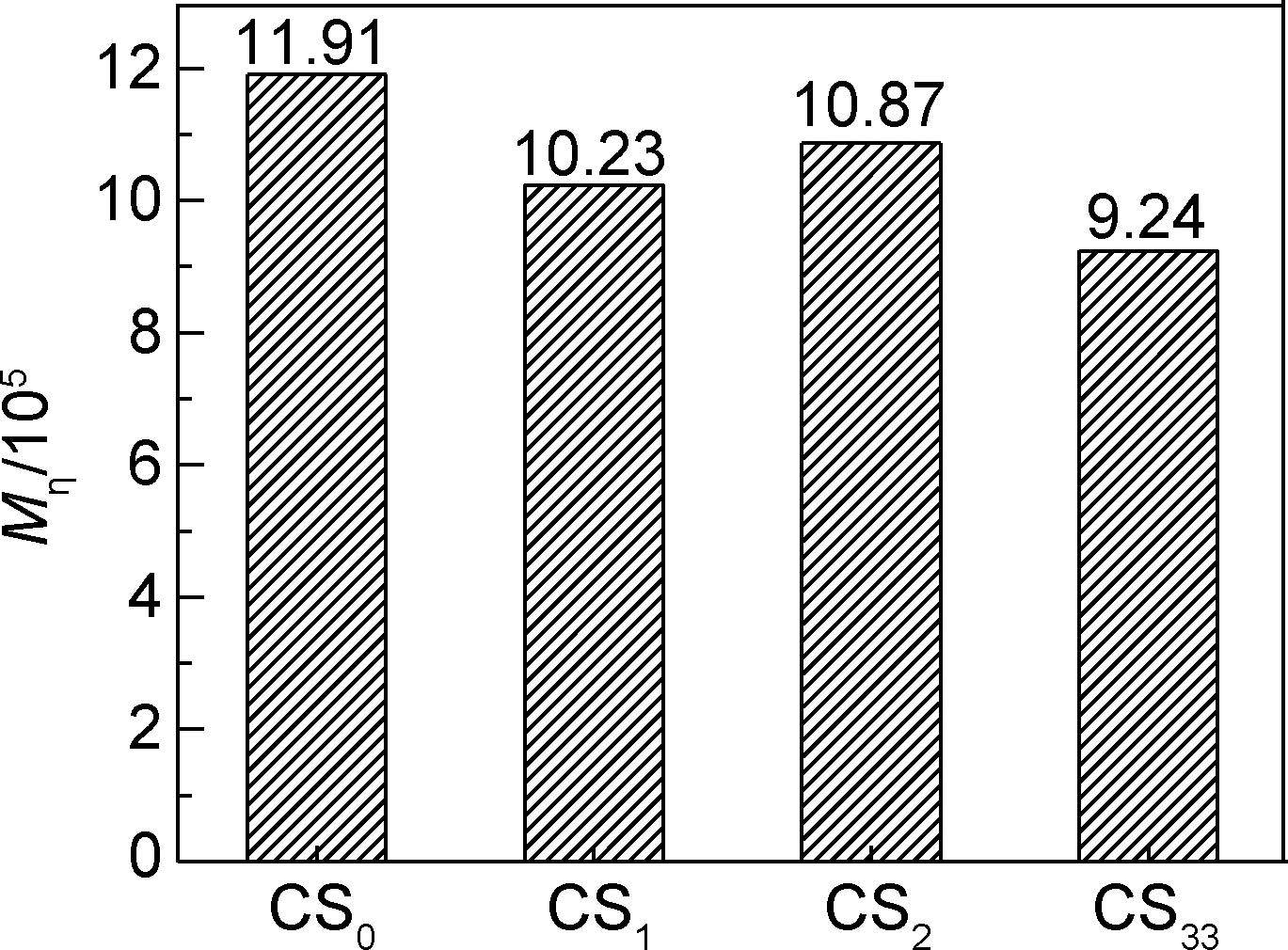
|
图 5 PCA对壳聚糖粉体黏均分子量的影响 Fig. 5 Effect of PCA on viscosity average molecular mass of micron chitosan powders |
壳聚糖原料及采用不同PCA制备的壳聚糖微细粉体的红外光谱如图 6所示。可以看出,采用不同的PCA细化得到的壳聚糖粉体,其红外光谱均与原料壳聚糖的谱图基本一致,均未产生新的吸收峰,也没有吸收峰的消失,这表明壳聚糖的粉碎细化是一个物理过程,在这个过程中壳聚糖大分子之间,以及壳聚糖大分子与PCA之间均未发生化学反应。
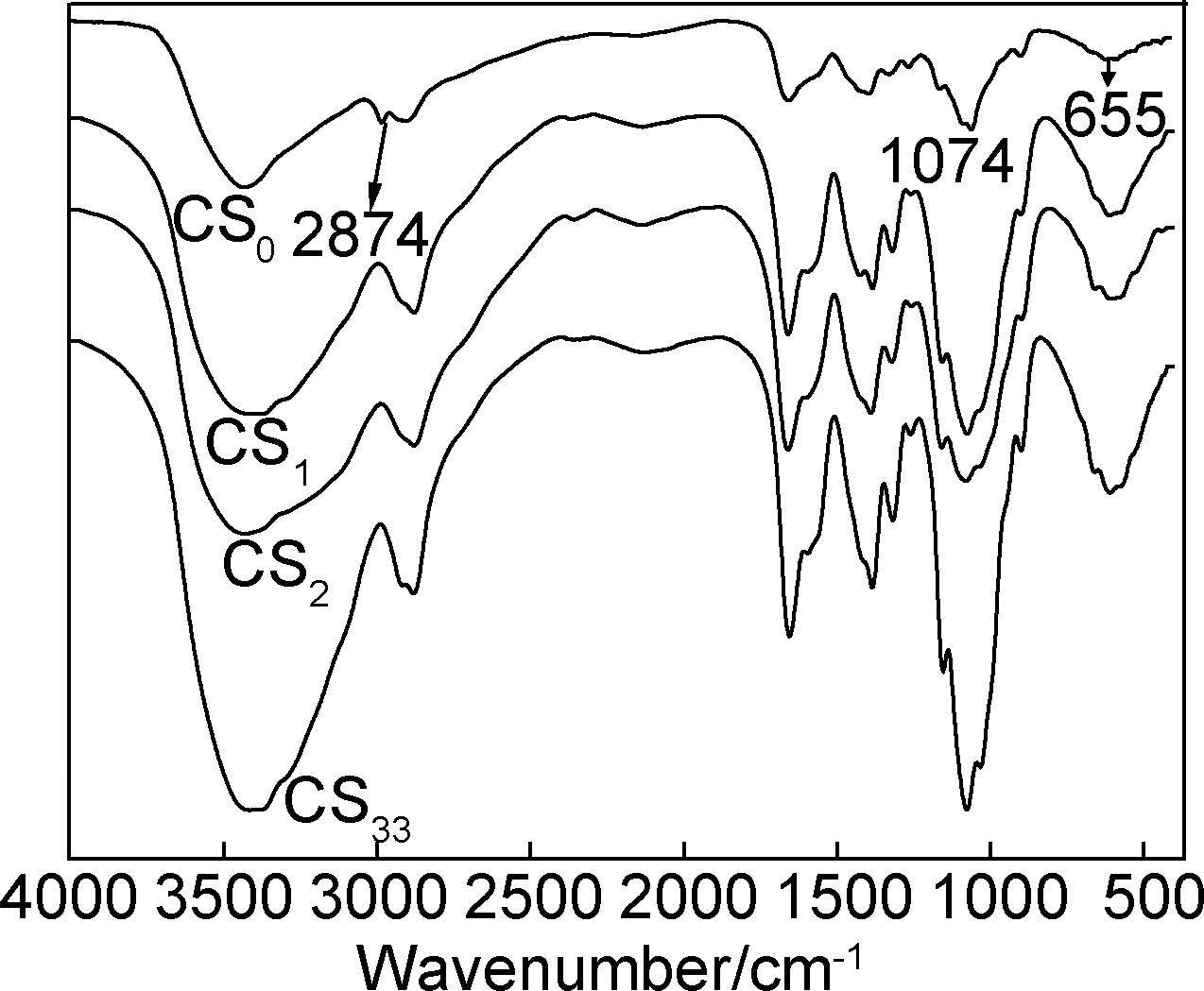
|
图 6 壳聚糖微细粉体的红外光谱 Fig. 6 FTIR spectra of micron chitosan powders |
壳聚糖的红外光谱图中,2960~2840cm-1处的C-H伸缩振动吸收带和655cm-1处的吸收峰可用来判断壳聚糖结晶状态的变化,壳聚糖结晶度的降低会导致C-H伸缩振动峰向高波数移动[22]。从图 6可知,CS0的C-H伸缩振动峰为2874cm-1,而CS1,CS2,CS33的C-H伸缩振动峰分别为2879,2887,2892cm-1,且655cm-1处的吸收峰也有向高波数移动的趋势,表明制备的壳聚糖粉体的结晶度有所降低。从图 6还可以看出,1074cm-1处的振动吸收峰略微变宽,表明部分壳聚糖大分子的β-糖苷键发生了部分断裂,所以制备的壳聚糖粉体的分子量亦有所降低。
2.6 粉体的结晶结构壳聚糖原料及采用不同PCA制备的壳聚糖微细粉体的X射线衍射如图 7所示。可以看出,壳聚糖原料在2θ为19.96°处有明显的衍射吸收峰,在2θ为10.7°处有1个较小的衍射吸收峰,说明在原料壳聚糖分子链内存在一定的晶体结构。
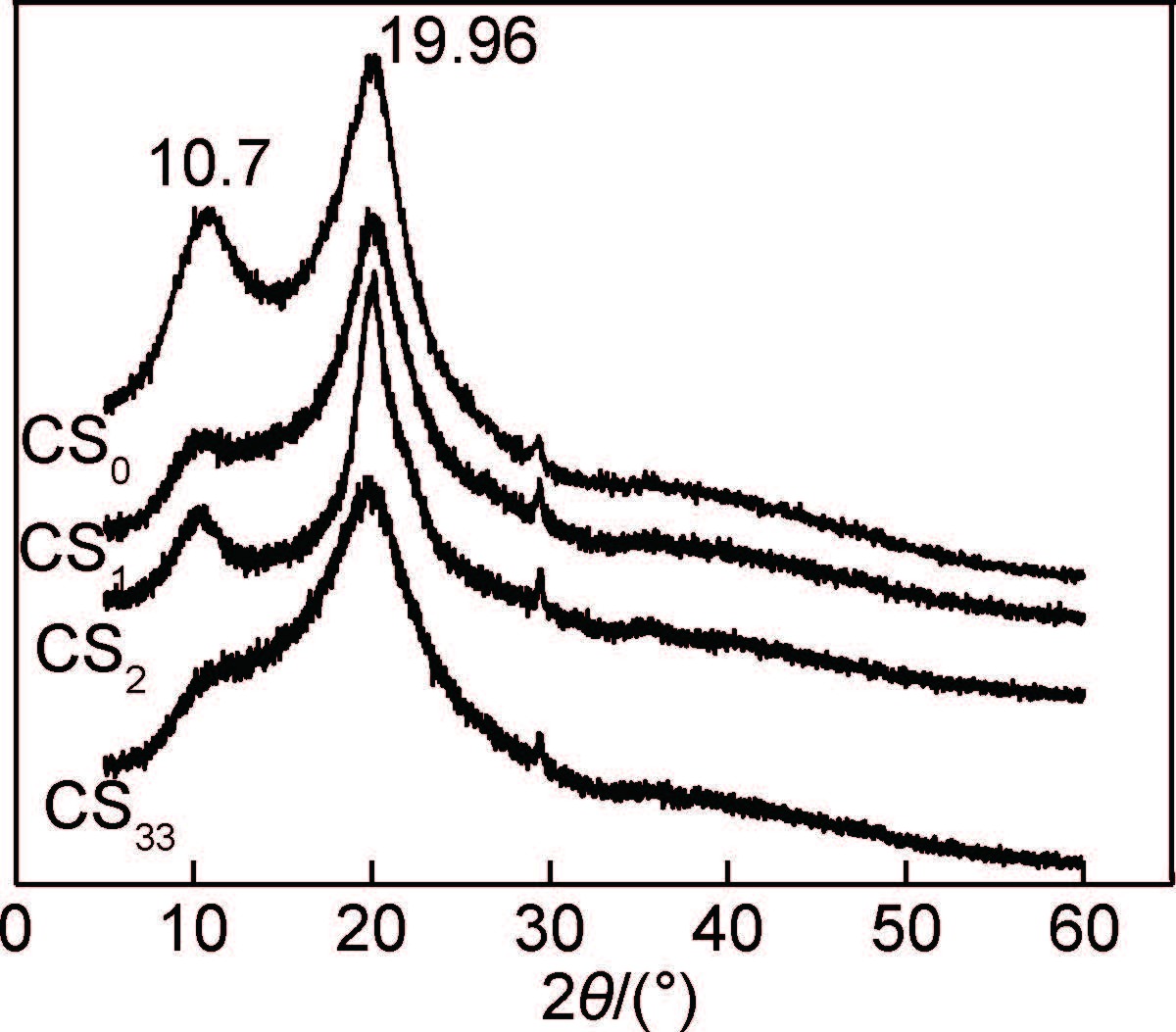
|
图 7 壳聚糖微细粉体的XRD图谱 Fig. 7 XRD patterns of micron chitosan powders |
而粉碎细化后,壳聚糖粉体在上述两处的衍射尖峰明显较弱,特别是CS1和CS33在2θ为10.7°处的衍射峰接近消失,变成了1个馒头峰,成为无定形结构的衍射曲线。由此可以看出,粉碎细化过程中,在锆珠的冲击、剪切和挤压等作用下,壳聚糖大分子原有的晶态结构被破坏,而且粉体的粒径越细小,结晶结构破坏的程度越严重,结晶度越低,这与红外光谱的结论相一致。
2.7 粉体的热性能壳聚糖原料及采用不同PCA制备的壳聚糖微细粉体的TG,DTG曲线如图 8,9所示。从图 8和图 9可以看出,原料壳聚糖和粉碎细化后的壳聚糖粉体的热分解曲线相近。在实验温度范围(50~800℃)内壳聚糖原料及其细化后粉体的热分解均为两个阶段:初始裂解阶段(50~200℃)和主体裂解阶段(200~800℃);4种壳聚糖粉体的初始分解温度(定义为质量损失为5%时的温度)均在270℃左右,最大热分解温度均在300℃左右。4种壳聚糖粉体在300℃之前的热分解曲线完全重合,但是300℃之后的热分解曲线稍有差异。CS0的最大热分解速率Rmax(最大热分解温度对应的分解速率)为1.52%/min,而CS1,CS2,CS33的Rmax分别为1.26,1.24,1.34%/min;在800℃时CS0的残炭量为34.24%,而CS1,CS2,CS33的残炭量分别为31.47%,34.71%,28.23%。由此可知,在高温阶段(200~800℃)制备的壳聚糖粉体的热性能均变差。粉体的热稳定性能与其结晶度和分子量成正比,分子量越大,结晶度越高,分子间的作用力越大,热稳定性越优异,所以粉体CS2的热稳性接近于原料壳聚糖,而粉体CS33的热稳性最差。
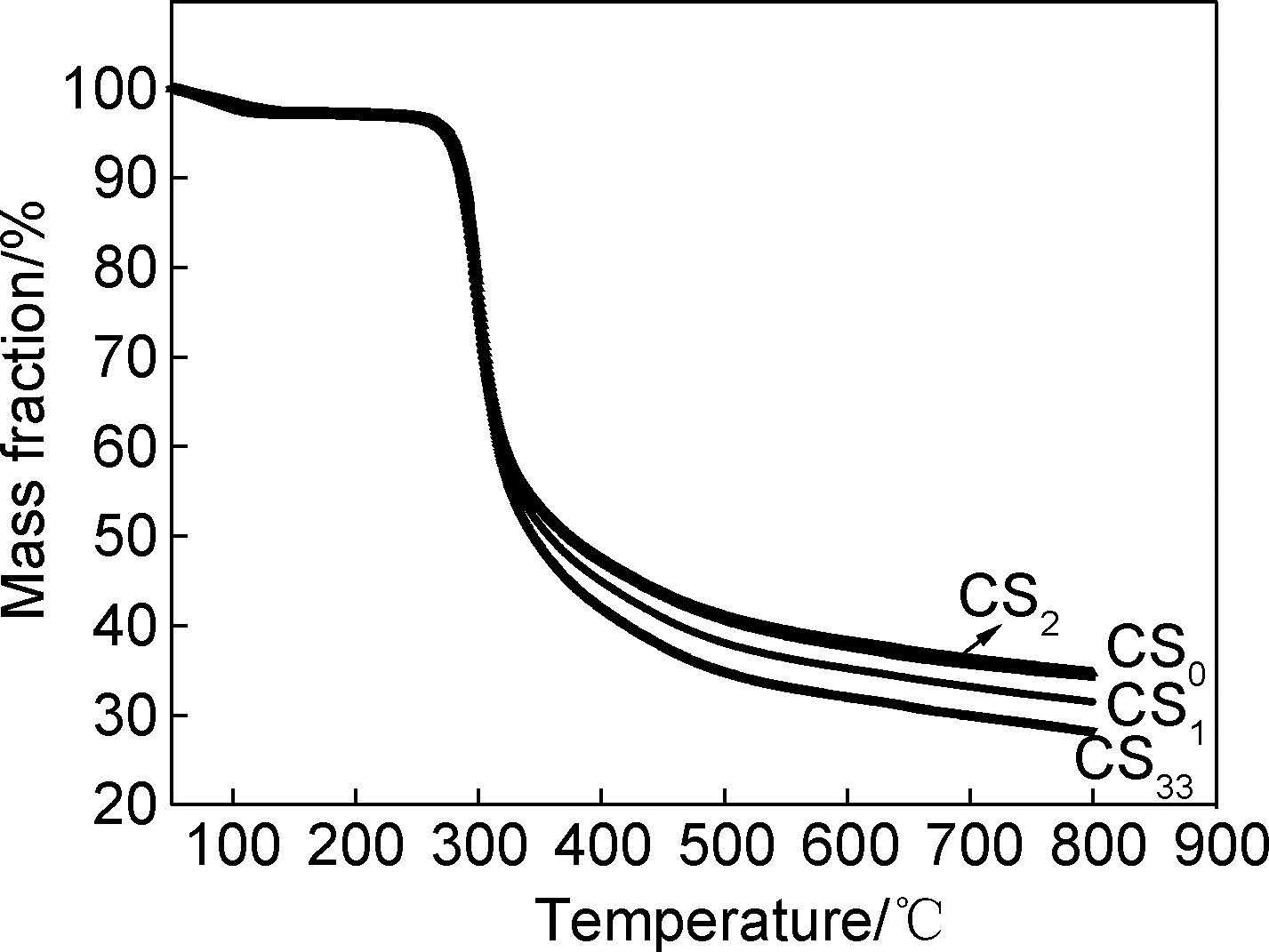
|
图 8 壳聚糖微细粉体的TG曲线 Fig. 8 TG curves for micron chitosan powders |
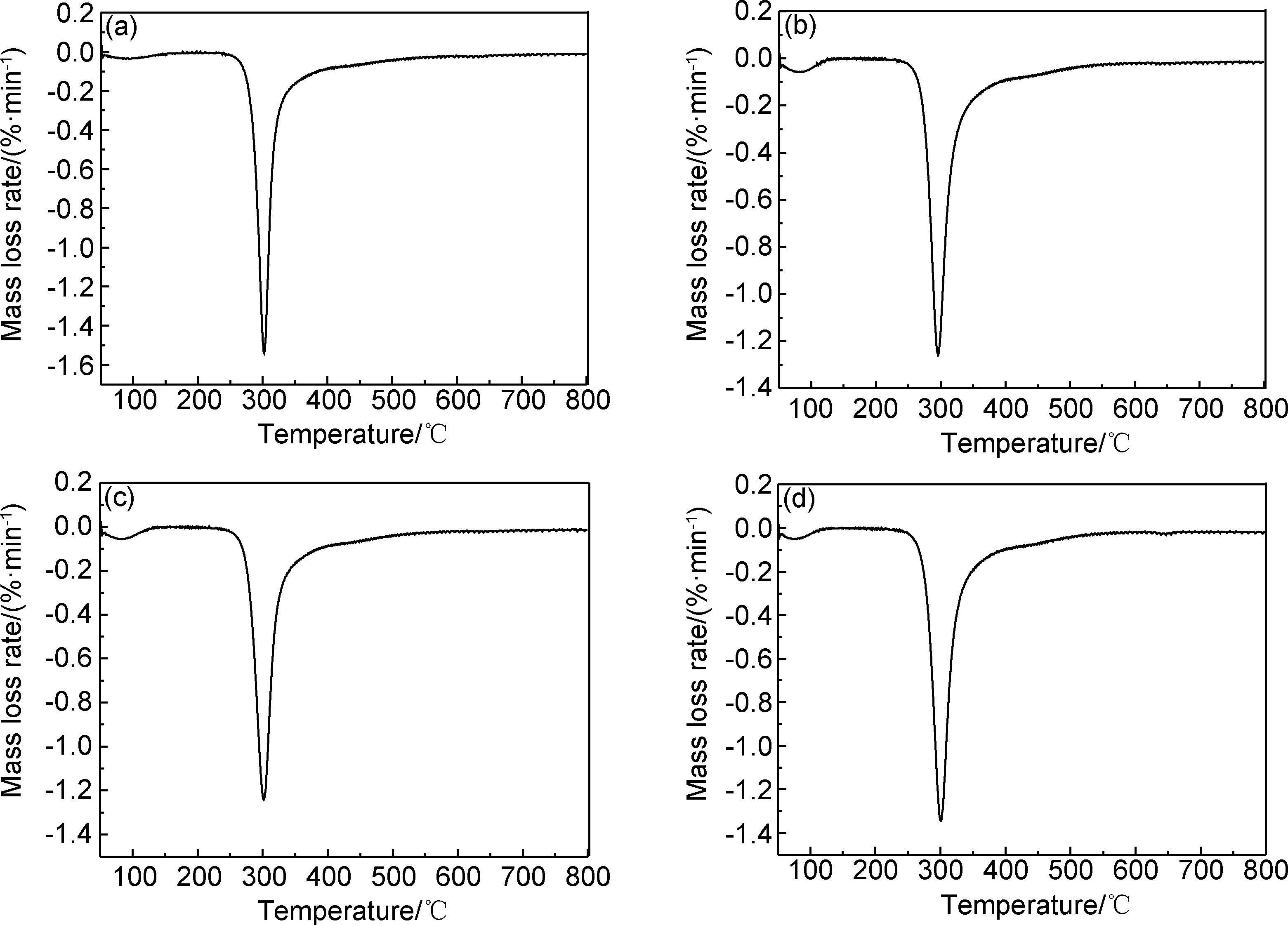
|
图 9 壳聚糖微细粉体的DTG曲线 (a)CS0;(b)CS1;(c)CS2;(d)CS33 Fig. 9 DTG curves for micron chitosan powders (a)CS0;(b)CS1;(c)CS2;(d)CS33 |
(1) 分别以蒸馏水、无水乙醇为PCA,采用机械球磨法制备了壳聚糖微细粉体。采用无水乙醇为PCA效果最好,制备的壳聚糖粉体蓬松,而且罐壁和锆珠表面均较光洁,无粉体黏附现象。当无水乙醇的用量达到0.75mL/g时,壳聚糖超细粉体的产率最高,达到94.7%。
(2) 采用无水乙醇为PCA制备壳聚糖微细粉体时,随着无水乙醇用量的增加,壳聚糖粉体颗粒的粒径增加,粒径分布范围变宽。无水乙醇的最佳用量为0.75mL/g,制备的壳聚糖粉体粒径范围为0.72~6.54μm,壳聚糖粉体的D50为824nm,D90为1629nm,能满足纺丝加工的要求。
(3) 无PCA或蒸馏水为PCA时,制备的壳聚糖粉体的形状多为不规则的片状、块状,结构疏松,单个颗粒中有较多的孔隙和裂缝,与揉皱的纸团的外观类似。无水乙醇为PCA时,可以避免破碎后的粉体重新黏结和堆积成大颗粒,制备的壳聚糖粉体具有类似片岩的结构,结构密实。
(4) 无水乙醇为PCA时,制备的壳聚糖微细粉体的大分子链发生了部分断裂,黏均分子量下降了23%,结晶结构受到部分破坏,结晶度降低,热稳性变差。
| [1] | 马蜂, 陆丰艳, 秦岩, 等. N,O-羧甲基壳聚糖磁性复合微球的制备与表征[J]. 材料工程,2014 (8) : 41 –45. MA F, LU F Y, QIN Y, et al. Preparation and characterization of magnetic N,O-carboxymethyl chitosan composite microspheres[J]. Journal of Materials Engineering,2014 (8) : 41 –45. |
| [2] | 舒静, 冯晓荟, 郑丽娜, 等. 壳聚糖基三元智能水凝胶的制备及其敏感性[J]. 材料工程,2013 (3) : 67 –70. SHU J, FENG X H, ZHENG L N, et al. Preparation and sensitivity behaviors of chitosan-based intelligent hydrogels[J]. Journal of Materials Engineering,2013 (3) : 67 –70. |
| [3] | ANITHA A, SOWMYA S, KUMAR S P T, et al. Chitin and chitosan in selected biomedical applications[J]. Progress in Polymer Science,2014, 39 (9) : 1644 –1667. DOI: 10.1016/j.progpolymsci.2014.02.008 |
| [4] | ITURRIAGA L, OLABARRIETA I, CASTELLAN A, et al. Active naringin-chitosan films:impact of UV irradiation[J]. Carbohydrate Polymers,2014, 110 : 374 –381. DOI: 10.1016/j.carbpol.2014.03.062 |
| [5] | FERRERO F, PERIOLATTO M, VINEIS C, et al. Chitosan coated cotton gauze for antibacterial water filtration[J]. Carbohydrate Polymers,2014, 103 : 207 –212. DOI: 10.1016/j.carbpol.2013.12.037 |
| [6] | TELI M D, SHEIKH J, BHAVSAR P. Multifunctional finishing of cotton using chitosan extracted from bio-waster[J]. International Journal of Biological Macromolecules,2013, 54 : 125 –130. DOI: 10.1016/j.ijbiomac.2012.12.007 |
| [7] | NASR H E, SAYYAH S M, ESSA D M, et al. Utilization of acrylates emulsion terpolymer with chitosan as a finishing agent for cotton fabrics[J]. Carbohydrate Polymers,2009, 76 (1) : 36 –45. DOI: 10.1016/j.carbpol.2008.09.025 |
| [8] | HEBEISH A, SHARAF S, FAROUK A. Utilization of chitosan nanoparticles as a green finish in multifunctionalization of cotton textile[J]. International Journal of Biological Macromolecules,2013, 60 : 10 –17. DOI: 10.1016/j.ijbiomac.2013.04.078 |
| [9] | MORRIS G A, CASTILE J, SMITH A, et al. The effect of prolonged storage at different temperatures on the particle size distribution of tripolyphosphate (TPP)-chitosan nanoparticles[J]. Carbohydrate Polymers,2011, 84 (4) : 1430 –1434. DOI: 10.1016/j.carbpol.2011.01.044 |
| [10] | LIU G G, SHAO L, GE F, et al. Preparation of ultrafine chitosan particles by reverse microemulsion[J]. China Particuology,2007, 5 (6) : 384 –390. DOI: 10.1016/j.cpart.2007.08.002 |
| [11] | WANG M X, SHE Y B, XIAO Z B, et al. The green adsorption of chitosan tripolyphosphate nanoparticles on cotton fiber surfaces[J]. Carbohydrate Polymers,2014, 101 : 812 –818. DOI: 10.1016/j.carbpol.2013.10.023 |
| [12] | GOPALAKRISHNAN L, RAMANA L N, SETHURAMAN S, et al. Ellagic acid encapsulated chitosan nanoparticles as anti-hemorrhagic agent[J]. Carbohydrate Polymers,2014, 111 : 215 –221. DOI: 10.1016/j.carbpol.2014.03.093 |
| [13] | RAMPINO A, BORGOGNA M, BLASI P, et al. Chitosan nanoparticles:preparation,size evolution and stability[J]. International Journal of Pharmaceutics,2013, 455 (1) : 219 –228. |
| [14] | 路艳华, 王漓江, 刘治梅. 用于纺织品整理的低分子质量纳米壳聚糖的制备与表征[J]. 辽东学院学报(自然科学版),2009, 16 (2) : 93 –96. LU Y H, WANG L J, LIU Z M. Preparation and characterization of low molecular weight chitosan nano-particles in textile finishing[J]. Journal of Liaodong University (Natural Science),2009, 16 (2) : 93 –96. |
| [15] | 王薇薇, 何钢, 王琼. 壳聚糖纳米微粒制备条件的优化及其应用[J]. 中南林业科技大学学报,2012, 32 (2) : 95 –99. WANG W W, HE G, WANG Q. Optimization of preparation conditions of chitosan nanometer particles and their application[J]. Journal of Central South University of Forestry & Technology,2012, 32 (2) : 95 –99. |
| [16] | 魏谭军, 董德刚, 裘梁, 等. 离子交联法制备壳聚糖纳米颗粒[J]. 安徽农业科学,2012, 40 (5) : 2885 –2886. WEI T J, DONG D G, QIU L, et al. Preparation of chitosan nanoparticles by ionic cross-linking method[J]. Journal of Anhui Agricultural Sciences,2012, 40 (5) : 2885 –2886. |
| [17] | 宋海霞, 吴运新, 唐传安, 等. 过程控制剂对机械合金化Fe-48Al粉末特性的影响[J]. 材料工程,2007 (8) : 60 –64. SONG H X, WU Y X, TANG C A, et al. Effect of process control agents on characteristics of mechanically alloyed Fe-48Al powders[J]. Journal of Materials Engineering,2007 (8) : 60 –64. |
| [18] | KHAYATI G R, JANGHORBAN K. A investigation on the application of process control agents in the preparation and consolidation behavior of nanocrystalline silver by mechanochemical method[J]. Advanced Powder Technology,2012, 23 (6) : 808 –813. DOI: 10.1016/j.apt.2011.11.001 |
| [19] | 张丹丹, 倪锋, 魏世忠, 等. 过程控制剂对Al2O3/Mo复合粉末细化的影响[J]. 粉末冶金技术,2011, 29 (6) : 403 –407. ZHANG D D, NI F, WEI S Z, et al. Influence of process control agent on the refinement of Al2O3/Mo composite powder[J]. Powder Metallurgy Technology,2011, 29 (6) : 403 –407. |
| [20] | 薛丽群, 陈盛, 林渊智, 等. 不同分子量壳聚糖的制备及其抑菌性能的研究[J]. 福建师大福清分校学报,2013 (2) : 55 –62. XUE L Q, CHEN S, LIN Y Z, et al. Study on preparation and antibacterial properties of chitosan with different molecular weight[J]. Journal of Fuqing Branch of Fujian Normal University,2013 (2) : 55 –62. |
| [21] | 赖金权, 王蕾, 许伯藩, 等. 过程控制剂在高能球磨法制备SiC/Al复合粉末中的作用研究[J]. 武汉科技大学学报(自然科学版),2007, 30 (1) : 20 –22. LAI J Q, WANG L, XU B F, et al. Influence of process control agent in preparation of SiC/Al composite powder by high energy ball milling[J]. Wuhan Uni of Sci & Tech(Natural Science Edition),2007, 30 (1) : 20 –22. |
| [22] | LEE D W, POWERS K, BANEY R. Physicochemical properties and blood compatibility of acylated chitosan nanoparticles[J]. Carbohydrate Polymers,2004, 58 (4) : 371 –377. DOI: 10.1016/j.carbpol.2004.06.033 |
 2016, Vol. 44
2016, Vol. 44


