文章信息
- 吕生华, 李莹, 杨文强, 崔亚亚
- LYU Sheng-hua, LI Ying, YANG Wen-qiang, CUI Ya-ya
- 氧化石墨烯/壳聚糖生物复合材料的制备及应用研究进展
- Research Progress on Preparation and Application of Graphene Oxide/ Chitosan Biocomposites
- 材料工程, 2016, 44(10): 119-128
- Journal of Materials Engineering, 2016, 44(10): 119-128.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2016.10.017
-
文章历史
- 收稿日期: 2015-05-25
- 修订日期: 2016-07-11
石墨烯是由sp2杂化的碳原子形成的单原子平面结构,也是目前发现的唯一以二维自由态存在的原子晶体[1]。2004年,由高定向热解石墨微机械剥离成功获得石墨烯后,其结构、制备方法、性能及应用等引起国内外学术界的高度重视[2]。石墨烯超高的比表面积、优异的力学、热学以及电学性能使其在高强度材料[3]、高性能吸附材料[4]、超级贮能、导电[5]以及生物医学材料[6]等领域具有很大的应用潜力。氧化石墨烯(GO)是石墨烯的派生物,通常是由天然石墨氧化、超声分散制得。与石墨烯相比,GO含有大量的—OH,—C—O—C—,—C—O—和—COOH等含氧官能团,从而赋予其良好的分散性、亲水性、相容性等新的特性[7],因此GO能与聚合物基体之间形成更强的界面相互作用,同时还能被小分子插层或剥离,将其作为纳米增强组分加入聚合物中,能有效改善聚合物的力学[8]、热学[9]、电学[10]等性能。
壳聚糖(CS)是甲壳素脱乙酰化后的产物,具有来源广泛、无毒、易降解等特点。壳聚糖分子结构中含有大量的氨基和羟基,对壳聚糖进行羧基化、酯化、醚化、烷基化、酰化和卤化等多种化学反应,制备出不同的壳聚糖衍生物,从而赋予其更多的特殊功能[11]。此外壳聚糖还具有优异的成膜性[12]、抗菌性[13]以及良好的可降解性和生物相容性[14],使其在复合材料的制备和改性中发挥着不可替代的作用。
近年来随着研究的不断深入,许多科研工作者尝试着将壳聚糖与氧化石墨烯反应,通过不同方法制备了各种壳聚糖/氧化石墨烯复合材料,这种复合材料综合了壳聚糖和氧化石墨烯各自的优异性能,不仅力学性能好,而且作用位点多,在众多领域表现出潜在的应用价值,本文主要对氧化石墨烯/壳聚糖复合材料在高机械强度材料、废水处理、电化学传感器、生物医学材料等领域的应用进行了简要的概述。
1 氧化石墨烯/壳聚糖复合材料的制备方法目前,氧化石墨烯/壳聚糖复合材料的制备方法主要有溶液共混法、静电纺丝法、湿法纺丝法、声化学法、滴落涂布法、冷冻干燥法等[15-20]。氧化石墨烯与壳聚糖的结合不是简单的物理混合,氧化石墨烯上的羧基可与壳聚糖结构中的氨基发生酰胺化反应形成—NHCO—键,实际上两者之间形成了共价键,制备过程如图 1所示。下面主要介绍溶液共混法、冷冻干燥法和湿法纺丝法3种制备氧化石墨烯/壳聚糖复合材料的方法。

|
图 1 氧化石墨烯/壳聚糖复合材料的制备过程 Fig. 1 The preparation of graphene oxide/chitosan composites |
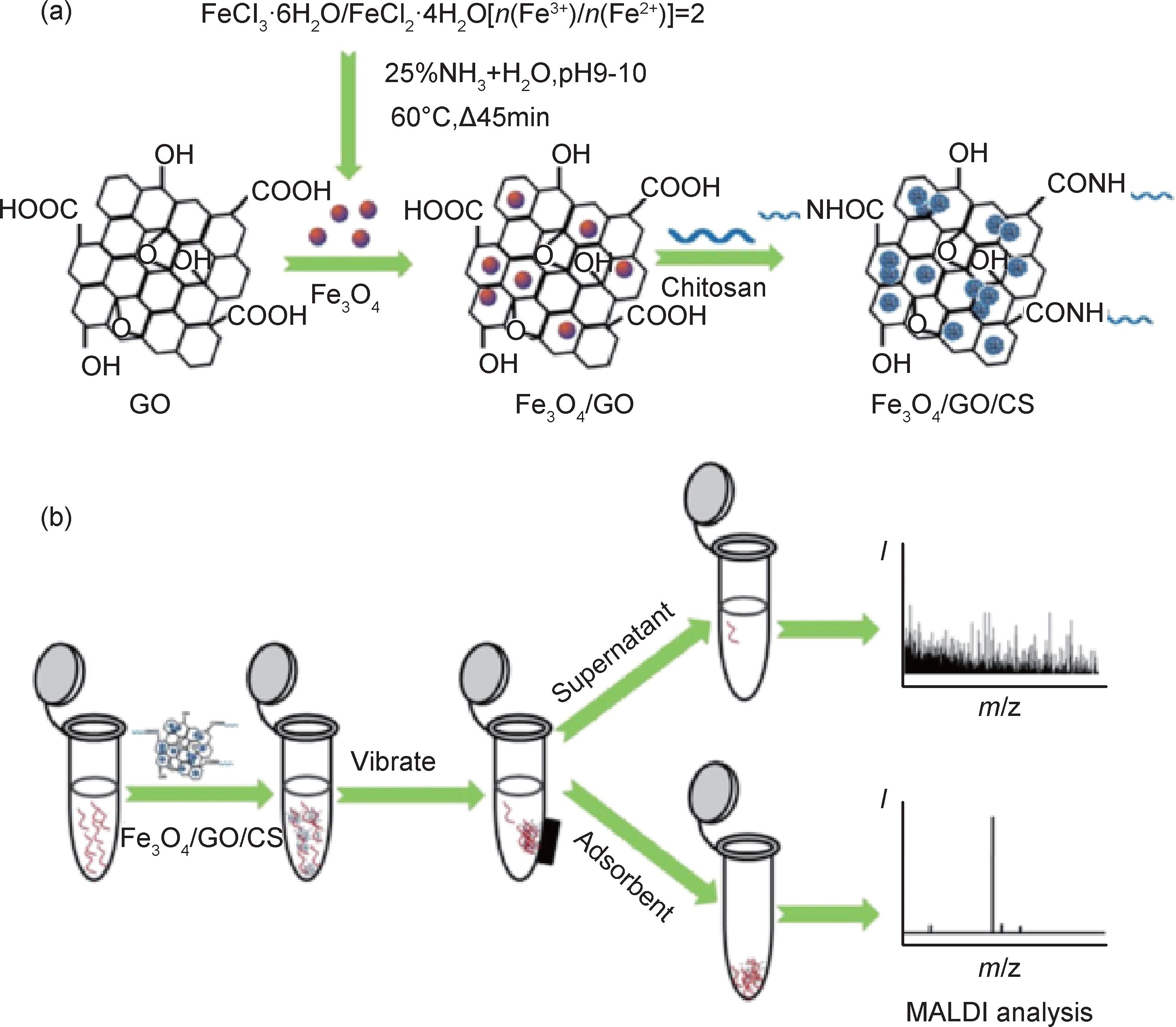
溶液共混法是目前制备氧化石墨烯/壳聚糖复合材料最常用的一种方法,这种方法的优点是制备简便易操作,可以控制氧化石墨烯的体积分数等参数,缺点是氧化石墨烯片层很容易团聚,共混时难以实现粒子的均匀分散。通过溶液共混法制备复合材料的关键是氧化石墨烯片层能否与壳聚糖基质形成均匀稳定的分散液,具体的操作过程一般是将氧化石墨烯分散于壳聚糖酸性溶液中,加入交联剂,采用机械搅拌或超声处理使其混合均匀。Liu等[21]使用乙酸同时分散GO和壳聚糖粉末,通过超声使溶液共混均匀,静置12h后加入3.0%(w/v)的NaOH溶液形成珠状的液体,最后加入交联剂,通过洗涤、干燥等工序得到壳聚糖/氧化石墨烯复合材料(CSGO)。Ye等[22]将Fe3O4和氧化石墨烯复合后分散在壳聚糖酸性溶液中,以戊二醛为交联剂,在60℃下机械搅拌2h,磁性分离、真空干燥后得到Fe3O4/氧化石墨烯/壳聚糖磁性微球。用该复合材料对蛋白细胞色素c进行吸附,吸附过程符合Langmuir模型,在40min就可达到吸附平衡,最大吸附值为13.3mg/g。制备路线及蛋白质富集过程如图 2所示。
|
图 2 Fe3O4/GO/CS复合材料的制备路线及蛋白质富集过程 (a)Fe3O4/GO/CS复合材料的合成路线示意图;(b) Fe3O4/GO/CS复合材料对蛋白质的富集过程[22] Fig. 2 Schematic diagram and enrichment protocol for protein of Fe3O4/GO/CS composite (a)schematic diagram of the synthetic route of Fe3O4/GO/CS composite;(b)enrichment protocol for protein by Fe3O4/GO/CS composite[22] |
冷冻干燥法是一种在低温和真空条件下制备复合材料的新途径,用该方法制备混合物一般分为两步:(1)将聚合物溶液置于低温环境下,由制冷剂间接导热使物料中所含的水分冻结成冰;(2)通过抽真空并加热使冰升华。Wang等[23]将甲醛加入壳聚糖/氧化石墨烯混合溶液中,在50℃下不断搅拌形成水凝胶,在-18℃下冻结后转移至冷冻干燥箱中(设置温度为-55℃,压力为20~30Pa),经过两天形成海绵状的壳聚糖/氧化石墨烯复合块体材料。研究结果表明,加入0.96%(质量分数,下同)的GO,复合材料的孔隙率高达97%,密度仅为0.0436g/cm3。Alhwaige 等[24]系统地研究了加入不同含量氧化石墨烯的壳聚糖气凝胶对CO2的吸附情况。研究发现GO的掺入不仅改变了气凝胶的微观形貌,而且还提高了复合气凝胶的热力学稳定性。当GO的添加量为20%时,该复合气凝胶对CO2的吸附值提高了1倍。
冷冻干燥法不仅可以赋予材料不同尺寸、形貌可控的连续多孔状结构,而且操作简便、经济环保[25],因此近年来广泛用于制备聚合物多孔材料。Zhang等[26]利用定向冻融法制备了壳聚糖-明胶/氧化石墨烯(CGGO)复合块体材料。该复合材料的孔隙率高,能够有效地吸附Cu2+,Pb2+等各种重金属离子。同时该复合块体材料可生物降解、无毒、吸附效率高,还可以用来吸收蛋白质、DNA 等大分子。He等[27]向含有氧化石墨烯和壳聚糖的混合溶液中加入戊二醛交联剂,通过单向冷冻干燥法制备了孔径尺寸为200μm的氧化石墨烯/壳聚糖多孔材料(PGOC)。氧化石墨烯的加入使得混合溶液的黏度增大,在复合材料生长过程中出现了许多微带结构(图 3),这些微带增大了多孔材料的比表面积,使其对Pb(Ⅱ)和Cu(Ⅱ)表现出良好的吸附性。
湿法纺丝法作为纺丝技术的一种主要形式,已广泛应用于各种纤维的制备和生产中,其工序包括:(1)制备纺丝原液;(2)将原液从喷丝孔压出形成细流;(3)原液细流凝固成初生纤维;(4)对初生纤维进行后处理。湿法纺丝技术的特点是喷丝头孔数多,但纺丝速率较慢,通常用来纺制短纤维。Du等[17]以壳聚糖为载体,通过湿法纺丝法制备了氧化石墨烯/壳聚糖/二氧化硅纤维(GO/CS/SI),然后利用HF溶液将SI蚀刻掉得到GO/CS纤维。用该复合纤维去除有机染料刚果红,最大吸附容量达到了294.12mg/g,吸附动力学符合拟二级模型,吸附等温式符合Langmuir模型。Li等[28]制备氧化石墨烯/壳聚糖复合纤维(GO/CS)需要如下步骤:(1)制备出均匀稳定的GO/CS纺丝原液;(2)将纺丝液通过直径为0.5mm的喷丝头注入凝固浴中形成细流;(3)原液细流凝固后形成GO/CS复合纤维。通过SEM图(图 4)可以看出,与纯壳聚糖纤维相比,纺丝后的复合纤维显示出有序规整的微纤排列,并且结构更加密实,实验证明这种排列能够极大地提高复合材料的力学性能。
氧化石墨烯/壳聚糖复合材料作为一种新兴的复合材料,其制备方法也在不断探索、不断改进中,如何采用绿色简便的方法制备出高质量、高性能的氧化石墨烯/壳聚糖复合材料是未来一个重要的研究课题。
2 氧化石墨烯/壳聚糖复合材料的应用前景氧化石墨烯/壳聚糖复合材料是在生物复合材料的特征上叠加了纳米材料的优点,使材料的结构参数及复合效应获得最充分的发挥,从而表现出最佳的宏观性能,因此在高强度材料、废水处理、传感器以及生物医学材料等领域掀起广泛的研究热潮。
2.1 高机械强度材料壳聚糖含有丰富的官能团,生物相容性好,因此在医学材料、膜分离、生物传感器等领域的研究中备受关注,但目前由于力学性能差、强度低而限制了壳聚糖的应用范围。氧化石墨烯作为石墨烯的派生物,力学性能良好,将其作为壳聚糖复合材料的填充剂可以有效改善其力学性能差的缺点。
一方面,氧化石墨烯在壳聚糖基体中的良好分散是提高复合材料力学性能的基础。Pan等[29]将1%氧化石墨烯片层加入到壳聚糖溶液中制得的纳米复合薄膜不仅强度高,而且延展性好,复合膜断层处的弹性模量、拉伸强度、伸长率相比纯的壳聚糖膜分别提高了51%,93% 和 41%。这是由于氧化石墨烯片层均匀分散在壳聚糖基体中,避免了因团聚而引起的应力集中,增大了两者间的界面面积,有利于基体中的应力向单片层递,从而提高了复合材料的力学性能。值得一提的是,氧化石墨烯片层的加入还使得纳米复合材料的光学性能和热学性能显著提高。Yang等[30]通过自组装合成了氧化石墨烯/壳聚糖纳米复合材料,氧化石墨烯以典型的弯曲褶皱形态均匀地分散在壳聚糖基体中(如图 5所示)。加入1% 的氧化石墨烯时,复合材料的抗张强度和弹性模量分别提高了122%和64%,同时伸长率在断裂点处也显著提高。
另一方面,通过改善氧化石墨烯与壳聚糖间的界面相互作用强度,能够使复合材料的力学性能显著提高。Han等[15]通过溶液混合法制备了氧化石墨烯/壳聚糖复合薄膜,氧化石墨烯以分子尺度在壳聚糖基体中分散良好,两者之间通过物理交联以及化学键相结合,氧化石墨烯的引入使得复合材料的内部结构更加密实。力学测试表明,在湿态条件下,壳聚糖/氧化石墨烯复合薄膜的抗拉强度是纯的壳聚糖膜的3倍。另外,当温度升高到200℃时,复合膜有着较高的储能模量。Pandele等[31]加入6%氧化石墨烯于壳聚糖/PVC混合物中,混合薄膜显示出极高的拉伸模量,几乎达到了纯壳聚糖/PVC混合物的两倍。同时该CS/PVA/GO膜还具有良好的热稳定性和生物活性,有望应用于组织工程领域。
此外,复合材料中氧化石墨烯的含量也是影响力学性能的关键因素,加入氧化石墨烯少力学性能提升不明显,加入过多的氧化石墨烯则容易发生团聚,反而使力学性能下降。
2.2 废水处理氧化石墨烯具有超高的比表面积,丰富的含氧官能团,是一种潜在的高效吸附剂;而壳聚糖是一种含氨基和羟基的天然高分子螯合物和阴离子絮凝剂,对重金属离子、有机染料等物质都有很强的吸附能力。
2.2.1 对重金属离子的吸附氧化石墨烯/壳聚糖复合材料与金属离子通过静电引力和配位键结合达到去除效果,对常见的重金属离子如Pb(Ⅱ),Au(Ⅲ),Cu(Ⅱ),Cd(Ⅱ),Cr(Ⅵ)等都有很强的吸附性能。Yu等[32]通过冻干法制备氧化石墨烯/壳聚糖气凝胶,改善了氧化石墨烯片层易团聚的缺点。该复合材料能够快速除去水中的Cu2+,研究还发现在较高pH 值、低离子强度和高温条件更有利于吸附的进行。动力学研究表明,吸附符合拟二级吸附模型,热力学分析表明吸附为自发、吸热过程。Li等[33]通过共价修饰和静电自组装成功合成了壳聚糖/巯基功能化氧化石墨烯复合材料(CS/GO—SH),这种新型复合材料含有—OH,—COOH,—SH和—NH2等多种活性官能团,对Cu(Ⅱ),Pb(Ⅱ),Cd(Ⅱ)表现出不同程度的吸附。
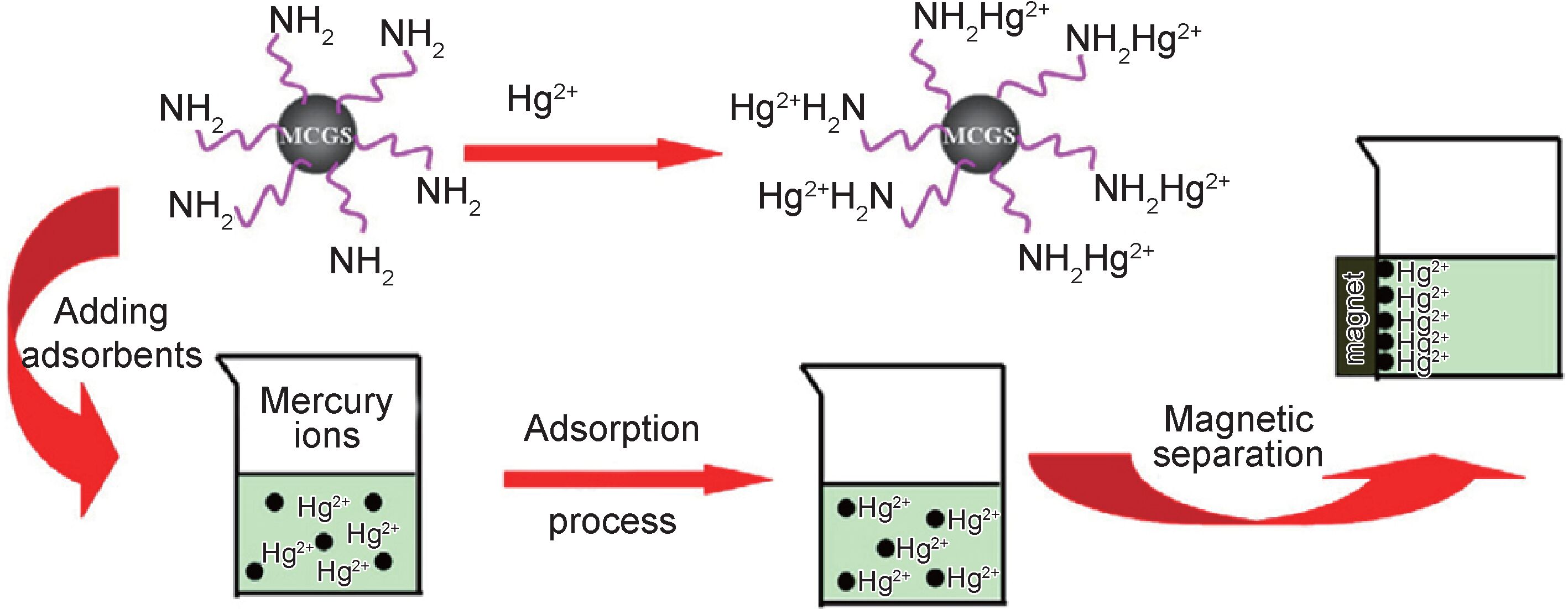
磁性材料易于分离,可改善材料表面性能,因此备受关注。用磁性纳米粒子修饰壳聚糖,进而与氧化石墨烯复合制备成具有磁性的生物纳米复合材料显示出无可比拟的优势,磁性纳米离子的作用如下[34]:(1)能够显著提高壳聚糖在溶液中的稳定性;(2)在外磁场中容易分离和回收(如图 6所示[35]);(3)通过增大壳聚糖的比表面积从而提高其吸附能力。Fan等[36]考察了磁性壳聚糖/氧化石墨烯复合材料(MCGO)对Pb2+的吸附作用,磁性材料Fe3O4的加入可以保证一旦达到饱和吸附,复合材料可以快速从水中分离。研究人员还指出该复合材料的吸附性能主要取决于pH 值,一方面,pH 值较小时MCGO表面的氨基易质子化,从而与Pb2+产生静电排斥;另一方面,pH 值较高时孤对氮的质子化会阻碍其与Pb2+的结合,在pH 值为5时,最高吸附容量达到76.94mg/g。Li等[37]利用一种简单的化学键合的方法合成了环糊精磁性壳聚糖/氧化石墨烯(CCGO)纳米复合材料,探讨了该复合材料对Cr(Ⅵ)的去除机理,认为去除过程主要分为以下几步:(1)带负电荷的Cr(Ⅵ)离子与CCGO表面的氨基通过静电作用相结合;(2)在π电子作用下,Cr(Ⅵ)被还原为Cr(Ⅲ);(3)Cr(Ⅲ)释放到溶液中;(4)环糊精与Cr(Ⅵ)和Cr(Ⅲ)形成稳定的主客体包合物。氧化石墨烯/壳聚糖复合材料对一些重金属离子的吸附容量如表 1所示。
| Pollutant | Adsorption capacity/(mg·g-1) | |
| Heavy metal ion | Pb2+ | 216.92[21],97.6[26],447[33],76.94[36] |
| Au3+ | 1076.65[21] | |
| Cu2+ | 53.69[23],122.0[26], 25.4[32],425[33] | |
| Cr6+ | 67.66[37] | |
| Cd2+ | 177[33] | |
| Hg2+ | 361.0[35] | |
| Organic dye | Congo red | 294.12[17] |
| Basic fuchsin | 67 [34] | |
| Methylene blue | 390[38] | |
| Eosin Y | 326[38] | |
| Methyl orange | 567.07[23],686.89[20] | |
| Amido black 10B | 573.47[20] | |
| Methyl blue | 95.16[39] |
氧化石墨烯/壳聚糖复合材料对有机染料的吸附已在很多文献中被报道,其吸附机理主要包括:(1)复合材料表面丰富的含氧官能团能与有机染料产生静电相互作用;(2)氧化石墨烯结构中的芳香环和有机染料形成π-π键作用。Chen等[38]通过将氧化石墨烯与壳聚糖链进行自组装形成三维网状结构的水凝胶,实现了对亚甲基蓝和曙红Y的吸附,吸附容量分别为390mg/g和326mg/g。Fan等[39]考察了氧化石墨烯改性壳聚糖磁性微球的吸附性能,发现改性后的复合微球对甲基蓝的吸附值提高了1倍。此外该磁性微球稳定性好、易分离可再生,重复利用4次后,吸附能力可恢复至最初饱和吸附容量的 90%。
Wang等[20]用多孔的壳聚糖掺杂少量氧化石墨烯通过交联和低温冷冻制得气凝胶,并将其用于甲基橙和氨基黑10B的去除,最高吸附值分别达686.89mg/g和573.47mg/g,研究结果还表明 GO 的存在显著增强了材料的抗压强度和弹性响应。因制备的多孔气凝胶无毒、高效且具有生物可降解性,对水溶液中重金属污染物的去除效果明显,环境友好,与其他吸附剂相比具有显著优势。氧化石墨烯/壳聚糖复合材料对一些有机染料的吸附容量如表 1所示。
综上所述,氧化石墨烯/壳聚糖复合材料实现了纳米粒子与生物多糖的完美结合,在吸附领域有广阔的使用前景,目前如何制备出高吸附性能、可再生的吸附剂是研究人员急需解决的问题。
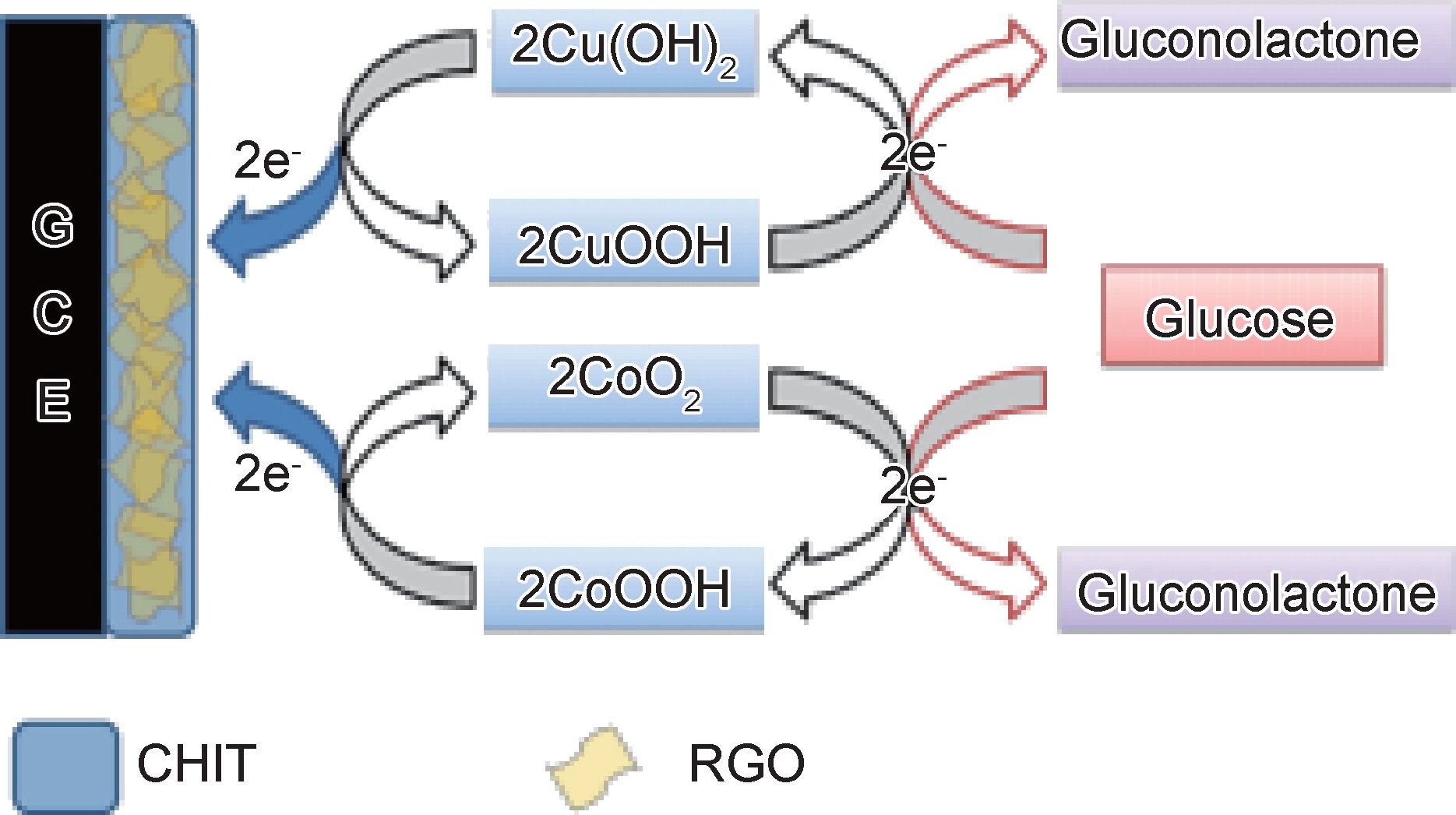
2.3 电化学传感器壳聚糖拥有良好的成膜性和生物相容性,因此可用于构造生物传感器的纳米分散材料和固定酶[40]。用壳聚糖修饰氧化石墨烯,可以同时结合氧化石墨烯高导电性和高比表面积的优势,有望制备出高性能的传感器。Zhou等[41]利用原位还原法制得GR-CS/GCE电极,首次用于4-壬基酚(4-NP)的检测,该检测方法线性范围宽且重现性好,为其他实际样品在电化学领域的检测提供了依据。Wang等[42]用氧化石墨烯/壳聚糖复合材料修饰玻碳电极(GCE)后,再通过电沉积法将摩尔比为2:1的Cu2+ /Co2+固定到GCE上,在牛血清存在下,该修饰的传感器对葡萄糖显示了很好的检测性能,其反应机制如图 7所示。
GO 独特的单原子二维结构加之边缘缺陷所赋予的电催化活性使其具有更高的电子转移速率,使检测更加快速灵敏。Rajabzadeh等[43]采用电化学沉积法用氧化石墨烯和壳聚糖修饰玻碳电极,并将制得的伏安传感器用于天然水体中二甲基二硫化物的检测。进一步研究表明氧化石墨烯的加入极大地改善了电子转移速率,并且提高了电流响应。在优化的实验条件下,该传感器在二甲基二硫醚浓度为1~500mg/g范围内有线性响应,检测下线低至0.9mg/g,并显示出优异的长期稳定性。Shieh等[44]用制备的GO/CNT/sCS膜修饰玻碳电极,实现了对多巴胺、尿酸和抗坏血酸的选择性检测,同时检测的线性范围宽、灵敏度高、响应时间短。
纳米粒子如Au,Ni,Cu,Co,Fe3O4等具有比表面积高、吸附能力强以及生物相容性好等优异特性,可增加酶的吸附量和稳定性,还具有固定生物大分子和增强导电性的功能[45] ,通过电化学沉积法、原位化学还原法、物理吸附法等被负载在氧化石墨烯表面上[46],制成复合杂化材料作为电极修饰材料。Liu等[47]用氧化石墨烯和Au纳米粒子作为掺杂物,制备了壳聚糖/溶胶-凝胶复合材料,并用其修饰玻碳电极得到一种新型的生物传感器。研究发现该传感器独特的夹层结构展现出高导电性和极好的生物相容性,同时极大地增强了对多巴胺和尿酸的电催化活性,并对其呈现出良好的区分能力。此外该传感器具有响应快、稳定性好和选择性高的特点,还能有效排除常见干扰物质对测定的影响。Tiwari等[48]报道了一种新型的电化学基因传感器,他们将合成的氧化石墨烯/氧化铁-壳聚糖纳米复合材料电泳沉积到用玻璃衬底修饰的铟锡氧化物上作为阴极,将平行铂板作为阳极。该修饰传感器对大肠杆菌显示出很好的响应,线性检测范围为10-6~10-14 M,检测限低至1×10-14 M,并且该传感器在使用6次后仍可达到初始活性的90%。Wang等[49]采用滴涂法将石墨烯-壳聚糖负载在玻碳电极上,接着用金纳米粒子修饰该电极,研究结果表明,该修饰电极能同时快速测定SO32-和NO2-,检测的线性范围分别为5~410μmol/L和1~380μmol/ L,检出限(S/N=3)分别为1.0μmol/L和0.25μmol/L。
2.4 生物医学材料 2.4.1 组织工程支架氧化石墨烯拥有独特的平面结构、优异的抗菌性能以及非凡的力学性能,这使其在组织工程领域有很大潜力。据有关报道,氧化石墨烯纳米片层通过破坏细菌的细胞膜而达到抗菌的作用,同时生物相容性好,具有温和的细胞毒性[50]。Liu等[16]用静电纺丝法制备了聚乙烯醇/壳聚糖/氧化石墨烯纳米复合纤维,氧化石墨烯悬浮液作为一种无毒、环保的溶剂加入到聚乙烯醇/壳聚糖混合体系中不仅提高了复合材料的力学性能,而且改善了壳聚糖的亲水性。抗菌实验证明该纳米纤维对大肠杆菌有很好的抗菌性能,加入0.4%的氧化石墨烯就可使纳米复合材料抑菌区的直径增长至8.6mm,因此该复合材料有望在组织工程领域有一定的应用前景。Lim等[19]将氧化石墨烯与壳聚糖复合后,通过简单的滴涂法制成薄膜,抗菌实验表明,该复合物可以有效地抑制绿脓杆菌的生长。
氧化石墨烯/壳聚糖纳米复合材料抗菌活性高、生物相容性好,在组织工程中还可被用于人体支架以及干细胞增殖的模板。Mazaheri等[51]利用化学剥落法制备了具有层状堆叠结构的氧化石墨烯/壳聚糖复合材料,并将其作为纳米模板用于干细胞的增殖,抗菌实验表明,使用氧化石墨烯/壳聚糖复合层对金黄色葡萄球菌的抗菌效果进行观察,发现3h后能使金黄色葡萄球菌数量减少量达77%。
2.4.2 药物释放载体氧化石墨烯易团聚、表面带负电荷,这限制了其在药物传输中的应用,用天然聚合物对其改性可减少氧化石墨烯片层的聚合,并且赋予其特殊的性能,在药物负载领域表现出优异的性能。据报道,活性药物通过π-π堆积、氢键以及静电相互作用而附着在氧化石墨烯表面,进而达到缓释的目的[52]。Hu等[53]通过静电自组装制备了叶酸偶联壳聚糖/氧化石墨烯纳米复合物(FGNCs)并将其作为药物和细胞的负载和释放载体。研究表明,该复合物毒性小、生物相容性好,对阿霉素的负载量为30.9%,可以有效抑制pDNA的迁移。从体外释放曲线可以看出,在24h内该复合材料对阿霉素的累积释放量达33.3%,在72h内对pDNA的累积释放量达31.1%。Wang等[54]报道了将cRGD壳聚糖/氧化石墨烯聚合物作为肝细胞癌靶向治疗的药物释放系统,该系统对阿霉素的负载能力高达1.00mg/mg,在pH值较低时即肿瘤环境下能够很好地识别肝癌细胞并释放药物对其进行吞噬。
Behnaz等[55]通过静电纺丝技术合成了PEO/CS/GO 纳米纤维状支架,研究发现该复合纤维对阿霉素的负载量与pH值大小有关,这主要是由于不同pH条件下阿霉素与复合纤维之间的氢键相互作用强度不同,在pH值为7.4条件下对阿霉素的负载量最大。研究还发现,该复合纤维支架之所以能够对阿霉素起到缓释作用,主要有两方面因素:(1)阿霉素与GO间产生较强的疏水作用,包括π-π堆积、氢键以及静电相互作用;(2)复合纤维结构中的孔洞减缓了阿霉素的扩散。Bao等[56]将制备的氧化石墨烯共价接枝壳聚糖(GO-CS)作为抗癌药物喜树碱的纳米载体,实验发现,该复合材料在72h后对喜树碱的负载量增长至17.5%,同时毒性测试表明,100mg/L的GO-CS没有毒性,但是含量仅仅为29μM时就可对50%的IC50生长产生抑制。
3 结束语氧化石墨烯/壳聚糖复合材料作为一种独特的生物复合材料,在这短短的几年内它的制备和应用研究已取得了长足的发展和进步,在材料改性、污水处理、传感器等领域显示了潜在的应用前景。目前,该研究领域仍面临着巨大的挑战:(1)如何大规模制备结构完整、尺寸和层数可控的氧化石墨烯;(2)如何有效地将氧化石墨烯均匀分散在壳聚糖基体中;(3)如何充分改善氧化石墨烯和壳聚糖之间的界面黏合作用。
综上所述,笔者认为未来氧化石墨烯/壳聚糖复合材料的研究还应从以下几个方面进行展开:(1)改进现有制备方法并不断发展新途径、新技术,实现氧化石墨烯/壳聚糖复合材料的低成本、大规模制备;(2)深入分析氧化石墨烯在壳聚糖中的定向或均匀分散以及氧化石墨烯与壳聚糖的界面结合对复合材料的结构、性质的影响;(3)对氧化石墨烯/壳聚糖复合材料的开发应用应朝着多元化方向发展,使其不仅仅局限在新材料、传感器、污水处理等领域,还应在能源、微电子等领域有所突破。
| [1] | GEIM A K, NOVOSELOV K S. The rise of graphene[J]. Nature Materials,2007, 6 (3) : 183 –191. DOI: 10.1038/nmat1849 |
| [2] | NOVOSELOV K S, GEIM A K, MOROZOV S V, et al. Electric field effect in atomically thin carbon films[J]. Science,2004, 306 (5696) : 666 –669. DOI: 10.1126/science.1102896 |
| [3] | ROBERT J Y, LAN A K, LEI G, et al. The mechanics of graphene nanocomposites:a review[J]. Composites Science and Technology,2012, 72 (12) : 1459 –1476. DOI: 10.1016/j.compscitech.2012.05.005 |
| [4] | RAFAL S, BEATA Z, EWA M. Graphene as a new sorbent in analytical chemistry[J]. TrAC Trends in Analytical Chemistry,2013, 51 : 33 –43. DOI: 10.1016/j.trac.2013.05.011 |
| [5] | 杜彦, 季铁正, 张教强, 等. 石墨烯/高密度聚乙烯导电复合材料的制备与表征[J]. 航空材料学报,2013, 33 (1) : 68 –71. DU Y, JI T Z, ZHANG J Q, et al. Preparation and characterization of graphene nanosheets/high density polyethylene conductive composites[J]. Journal of Aeronautical Materials,2013, 33 (1) : 68 –71. |
| [6] | CHUNG C, KIM Y K, SHIN D, et al. Biomedical applications of graphene and graphene oxide[J]. Accounts of Chemical Research,2013, 46 (10) : 2211 –2224. DOI: 10.1021/ar300159f |
| [7] | QIU L, YANG X W, GOU X L, et al. Dispersing carbon nanotubes with graphene oxide in water and synergistic effects between graphene derivatives[J]. Chemistry-A European Journal,2010, 16 (35) : 10653 –10658. DOI: 10.1002/chem.201001771 |
| [8] | PARK S J, LEE K S, BOZOKLU G, et al. Graphene oxide papers modified by divalent ions-enhancing mechanical properties via chemical cross-linking[J]. ACS Nano,2008, 2 (3) : 572 –578. DOI: 10.1021/nn700349a |
| [9] | SURAJIT K, RATAN B, SWAPAN K D. Studies on conducting polypyrrole/graphene oxide composites as supercapacitor electrode[J]. Journal of Electronic Materials,2011, 40 (11) : 2248 –2255. DOI: 10.1007/s11664-011-1749-z |
| [10] | HAN Y Q, LU Y. Characterization and electrical properties of conductive polymer/colloidal graphite oxide nanocomposites[J]. Composites Science and Technology,2009, 69 (7-8) : 1231 –1237. DOI: 10.1016/j.compscitech.2009.02.028 |
| [11] | PRASHANTH K V H, THARANATHAN R N. Chitin/chitosan:modifications and their unlimited application potentialdan overview[J]. Trends in Food Science & Technology,2007, 18 (3) : 117 –131. |
| [12] | HUANG H, HU N F, ZENG Y H, et al. Electrochemistry and electrocatalysis with heme proteins in chitosan biopolymer films[J]. Analytical Biochemistry,2002, 308 (1) : 141 –151. DOI: 10.1016/S0003-2697(02)00242-7 |
| [13] | NO H K, PARK N Y, LEE S H, et al. Antibacterial acticity of chitosan and chitosan oligomers with different molecular weights[J]. International Journal of Food Microbiology,2002, 74 (1-2) : 65 –72. DOI: 10.1016/S0168-1605(01)00717-6 |
| [14] | PENICHE C, ARGⅡELLES-MONAL W, PENICHE H, et al. Chitosan:An attractive biocompatible polymer for microencapsulation[J]. Macromolecular Bioscience,2003, 3 (10) : 511 –520. DOI: 10.1002/(ISSN)1616-5195 |
| [15] | HAN D L, YAN L F, CHEN W F, et al. Preparation of chitosan/graphene oxide composite film with enhanced mechanical strength in the wet state[J]. Carbohydrate Polymers,2011, 83 (2) : 653 –658. DOI: 10.1016/j.carbpol.2010.08.038 |
| [16] | LIU Y N, PARK M, SHIN H K, et al. Facile preparation and characterization of poly(vinylalcohol)/chitosan/Graphene oxide biocomposite nanofibers[J]. Journal of Industrial and Engineering Chemistry,2014, 20 (6) : 4415 –4420. DOI: 10.1016/j.jiec.2014.02.009 |
| [17] | DU Q J, SUN J K, LI Y H, et al. Highly enhanced adsorption of congo red onto graphene oxide/chitosan fibers by wet-chemical etching off silica nanoparticles[J]. Chemical Engineering Journal,2014, 245 : 99 –106. DOI: 10.1016/j.cej.2014.02.006 |
| [18] | HE L H, WANG H F, XIA G M, et al. Chitosan/graphene oxide nanocomposite films with enhanced Interfacial interaction and their electrochemical applications[J]. Applied Surface Science,2014, 314 : 510 –515. DOI: 10.1016/j.apsusc.2014.07.033 |
| [19] | LIM H N, HUANG N M, LOO C H. Facile preparation of graphene-based chitosan films:Enhanced thermal, mechanical and antibacterial properties[J]. Journal of Non-Crystalline Solids,2012, 358 (3) : 525 –530. DOI: 10.1016/j.jnoncrysol.2011.11.007 |
| [20] | WANG Y, XIA G M, WU C, et al. Porous chitosan doped with graphene oxide as highly effective adsorbent for methyl orange and amido black 10B[J]. Carbohydrate Polymers,2015, 115 : 686 –693. DOI: 10.1016/j.carbpol.2014.09.041 |
| [21] | LIU L, LI C, BAO C L, et al. Preparation and characterization of chitosan/graphene oxide composite for the adsorption of Au(Ⅲ) and Pd(Ⅱ)[J]. Talanta,2012, 93 : 350 –357. DOI: 10.1016/j.talanta.2012.02.051 |
| [22] | YE N S, XIE Y L, SHI P Z, et al. Synthesis of magnetite/graphene oxide/chitosan composite and its application for protein adsorption[J]. Materials Science and Engineering:C,2014, 45 : 8 –14. DOI: 10.1016/j.msec.2014.08.064 |
| [23] | WANG Y, LIU X, WANG H F, et al. Microporous spongy chitosan monoliths doped with graphene oxide as highly effective adsorbent for methyl orange and copper nitrate (Cu(NO3)2) ions[J]. Journal of Colloid and Interface Science,2014, 416 : 243 –251. DOI: 10.1016/j.jcis.2013.11.012 |
| [24] | ALHWAIGE A A, AGAG T, ISHIDA H, et al. Biobased chitosan hybrid aerogels with superior adsorption:role of graphene oxide in CO2 capture[J]. RSC Advances,2013, 3 (36) : 16011 –16020. DOI: 10.1039/c3ra42022a |
| [25] | ARNDT E M, GAWRYLA M D, SCHIRALDI D A. Elastic, low density epoxy/clay aerogel composites[J]. Journal of Materials Chemistry,2007, 17 (33) : 3525 –3529. DOI: 10.1039/b704114d |
| [26] | ZHANG N N, QIU H X, SI Y M, et al. Fabrication of highly porous biodegradable monoliths strengthened by graphene oxide and their adsorption of metal ions[J]. Carbon,2011, 49 (3) : 827 –837. DOI: 10.1016/j.carbon.2010.10.024 |
| [27] | HE Y Q, ZHANG N N, WANG X D. Adsorption of graphene oxide/chitosan porous materials for metal ions[J]. Chinese Chemical Letters,2011, 22 (7) : 859 –862. DOI: 10.1016/j.cclet.2010.12.049 |
| [28] | LI Y H, SUN J K, DU Q J, et al. Mechanical and dye adsorption properties of graphene oxide/chitosan composite fibers prepared by wet spinning[J]. Carbohydrate Polymers,2014, 102 : 755 –761. DOI: 10.1016/j.carbpol.2013.10.094 |
| [29] | PAN Y Z, WU T F, BAO H Q, et al. Green fabrication of chitosan films reinforced with parallel aligned graphene oxide[J]. Carbohydrate Polymers,2011, 83 (4) : 1908 –1915. DOI: 10.1016/j.carbpol.2010.10.054 |
| [30] | YANG X M, TU Y F, LI L. Well-dispersed chitosan/graphene oxide nanocomposites[J]. ACS Applied Materials & Interfaces,2010, 2 (6) : 1707 –1713. |
| [31] | PANDELE A M, IONITA M, CRICA L, et al. Synthesis, characterization, and in vitro studies of graphene oxide/chitosan-polyvinyl alcohol films[J]. Carbohydrate Polymers,2014, 102 : 813 –820. DOI: 10.1016/j.carbpol.2013.10.085 |
| [32] | YU B W, XU J, LIU J H, et al. Adsorption behavior of copper ions on graphene oxide-chitosan aerogel[J]. Journal of Environmental Chemical Engineering,2013, 1 (4) : 1044 –1050. DOI: 10.1016/j.jece.2013.08.017 |
| [33] | LI X Y, ZHOU H H, WU W Q, et al. Studies of heavy metal ion adsorption on chitosan/sulfydryl-function-alizedgraphene oxide composites[J]. Journal of Colloid and Interface Science,2015, 448 : 389 –397. DOI: 10.1016/j.jcis.2015.02.039 |
| [34] | LI L L, FAN L L, LUO C N, et al. Study of fuchsine adsorption on magnetic chitosan/graphene oxide[J]. RSC Advances,2014, 4 (47) : 24679 –24685. DOI: 10.1039/c4ra01784f |
| [35] | ZHANG Y K, YAN T, YAN L G, et al. Preparation of novel cobalt ferrite/chitosan grafted with graphene composite as effective adsorbents for mercury ions[J]. Journal of Molecular Liquids,2014, 198 : 381 –387. DOI: 10.1016/j.molliq.2014.07.043 |
| [36] | FAN L L, LUO C N, SUN M, et al. Highly selective adsorption of lead ions by water-dispersible magnetic chitosan/grapheme oxide composites[J]. Colloids and Surfaces B:Biointerfaces,2013, 103 : 523 –529. DOI: 10.1016/j.colsurfb.2012.11.006 |
| [37] | LI L L, FAN L L, S M, et al. Adsorbent for chromium removal based on graphene oxide functionalized with magnetic cyclodextrin-chitosan[J]. Colloids and Surfaces B:Biointerfaces,2013, 107 : 76 –83. DOI: 10.1016/j.colsurfb.2013.01.074 |
| [38] | CHEN Y Q, CHEN L B, BAI H, et al. Graphene oxide-chitosan composite hydrogels as broad-spectrum adsorbents for water purification[J]. Journal of Materials Chemistry A,2013, 1 (6) : 1992 –2001. DOI: 10.1039/C2TA00406B |
| [39] | FAN L L, LUO C N, LI X J, et al. Fabrication of novel magnetic chitosan grafted with graphene oxide to enhance adsorption properties for methyl blue[J]. Journal of Hazardous Materials,2012 : 215-216 –272-279. |
| [40] | NIU X L, YANG W, REN J, et al. Electrochemical behaviors and simultaneous determination of guanine and adenine based on graphene-ionic liquid-chitosan composite film modified glassy carbon electrode[J]. Electrochimica Acta,2012, 80 : 346 –353. DOI: 10.1016/j.electacta.2012.07.041 |
| [41] | ZHOU W S, ZHAO B, HUANG X H, et al. Electrochemical determination of 4-Nonylphenol based on graphene-chitosan modified glassy carbon electrode[J]. Chinese Journal of Analytical Chemistry,2013, 41 (5) : 675 –680. DOI: 10.1016/S1872-2040(13)60649-0 |
| [42] | WANG L, ZHENG Y L, LU X P, et al. Dendritic copper-cobalt nanostructures/reduced graphene oxide-chitosan modified glassy carbon electrode for glucose sensing[J]. Sensors and Actuators B:Chemical,2014, 195 : 1 –7. DOI: 10.1016/j.snb.2014.01.007 |
| [43] | RAJABZADEH S, ROUNAGHI G H, ZAVAR M H A, et al. Development of a dimethyl disulfide electrochemical sensor based on electrodeposited reduced graphene oxide-chitosan modified glassy carbon electrode[J]. Electrochimica Acta,2014, 135 : 543 –549. DOI: 10.1016/j.electacta.2014.05.064 |
| [44] | SHIEH Y T, JIANG H F. Graphene oxide-assisted dispersion of carbon nanotubes in sulfonated chitosan-modified electrode for selective detections of dopamine, uric acid, and ascorbic acid[J]. Journal of Electroanalytical Chemistry,2015, 736 : 132 –138. DOI: 10.1016/j.jelechem.2014.11.008 |
| [45] | LU W B, LUO Y L, CHANG G H, et al. Synthesis of functional SiO2-coated graphene oxide nanosheets decorated with Ag nanoparticles for H2O2 and glucose detection[J]. Biosensors and Bioelectronics,2011, 26 (12) : 4791 –4797. DOI: 10.1016/j.bios.2011.06.008 |
| [46] | ROOMA D, SHABNAM R. C.S. PUNDIR. Construction of a chitosan/polyaniline/graphene oxide nanoparticles/polypyrrole/Au electrode for amperometric determination of urinary/plasma oxalate[J]. Sensors and Actuators B:Chemical,2013, 196 : 17 –26. |
| [47] | LIU X, XIE L L, LI H L. Electrochemical biosensor based on reduced graphene oxide and Au nanoparticles entrapped in chitosan/silica sol-gel hybrid membranes for determination of dopamine and uric acid[J]. Journal of Electroanalytical Chemistry,2012, 682 : 158 –163. DOI: 10.1016/j.jelechem.2012.07.031 |
| [48] | TIWARI I, SINGH M, PANDEY C M, et al. Electrochemical genosensor based on graphene oxide modified iron oxide-chitosan hybrid nanocomposite for pathogen detection[J]. Sensors and Actuators B:Chemical,2015, 206 : 276 –283. DOI: 10.1016/j.snb.2014.09.056 |
| [49] | WANG X, LI H, WU M, et al. Simultaneous electrochemical determination of sulphite and nitrite by a gold nanoparticle/graphene-chitosan modified electrode[J]. Chinese Journal of Analytical Chemistry,2013, 41 (8) : 1232 –1237. DOI: 10.1016/S1872-2040(13)60673-8 |
| [50] | HU W B, PENG C, LUO W J, et al. Graphene-Based Antibacterial Paper[J]. ACS Nano,2010, 4 (7) : 4317 –4323. DOI: 10.1021/nn101097v |
| [51] | MAZAHERI M, AKHAVAN O, SIMCHI A. Flexible bactericidal graphene oxide-chitosan layers for stem cell proliferation[J]. Applied Surface Science,2014, 301 : 456 –462. DOI: 10.1016/j.apsusc.2014.02.099 |
| [52] | LEE S K, KIM H, SHIM B S. Graphene:an emerging material for biological tissue engineering[J]. Carbon Letters,2013, 14 (2) : 63 –75. DOI: 10.5714/CL.2013.14.2.063 |
| [53] | HU H L, TANG C, YIN C H. Folate conjugated trimethyl chitosan/graphene oxide nanocomplexes as potential carriers for drug and gene delivery[J]. Materials Letters,2014, 125 : 82 –85. DOI: 10.1016/j.matlet.2014.03.133 |
| [54] | WANG C, CHEN B B, ZOU M J, et al. Cyclic RGD-modified chitosan/graphene oxide polymers for drugdelivery and cellular imaging[J]. Colloids and Surfaces B:Biointerfaces,2014, 122 : 332 –340. DOI: 10.1016/j.colsurfb.2014.07.018 |
| [55] | BEHNAZ A, NADIA A A, MOHAMMAD I, et al. Controlled release of doxorubicin from electrospun PEO/chitosan/graphene oxide nanocomposite nanofibrous scaffolds[J]. Materials Science and Engineering:C,2015, 48 : 384 –390. DOI: 10.1016/j.msec.2014.12.039 |
| [56] | BAO H Q, PAN Y Z, PING Y, et al. Chitosan-functionalizedgraphene oxide as a nanocarrier for drug and gene delivery[J]. Small,2011, 7 (11) : 1569 –1578. DOI: 10.1002/smll.v7.11 |
 2016, Vol. 44
2016, Vol. 44