文章信息
- 盛典, 张宝林, 涂志江, 谢松伯, 王茗. 2015.
- SHENG Dian, ZHANG Bao-lin, TU Zhi-jiang, XIE Song-bo, WANG Ming. 2015.
- MPEG修饰的纳米氧化铁粒子的合成及清洗工艺
- Synthesis of Iron Oxide Nanoparticles Coated with MPEG and Washing Method
- 材料工程, 43(2): 47-52
- Journal of Materials Engineering, 43(2): 47-52.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2015.02.008
-
文章历史
- 收稿日期:2013-06-05
- 修订日期:2013-12-25
近年来,磁性纳米颗粒在催化剂[1]、药物载体[2 ,3]、数据存储[4]、磁共振成像[5]等学科领域都发挥着重要的作用,对人类社会产生了深远的影响。纳米Fe3O4作为尖晶石型铁氧体中一个重要的成员[6],因其低毒、易合成及用途广泛而成为研究焦点。
高温热分解法是在含有稳定剂的高沸点有机溶剂中热分解铁有机化合物制备磁性纳米颗粒的一种有效方法[7]。其中,铁有机化合物主要有Fe(CO)5,Fe(acac)3等。Taeghwan等[8]在高温下通过分解Fe(CO)5制得了高结晶度的单分散球形γ-Fe2O3纳米粒子。Gonzalez等[9]在500℃下分解用乙醇稀释的Fe(III)和Fe(II)盐来合成γ-Fe2O3纳米粒子。Xu等[10]在高沸点溶剂中高温热分解Fe(acac)3合成出了7~10nm的Fe3O4纳米粒子。高温热分解法可以通过改变起始反应物的摩尔比、反应温度和时间来控制纳米颗粒的尺寸及形貌,使制备的磁性纳米粒子具有粒径分布窄,尺寸和形貌可控等优点[11]。Jana等[12]用氯仿和丙酮、Sun等[13]用乙醇清洗合成的氧化铁纳米粒子,这些清洗剂的生物毒性影响氧化铁纳米粒子在生物医学上的应用。
聚乙二醇(PEG)是一种通过空间位阻稳定机制,吸附于颗粒表面,形成微胞,使颗粒间产生排斥作用,从而达到分散的目的的非离子型表面活性剂[14],因其具有生物相容性好、无毒、免疫原性低等特点,可通过肾排出体外,在体内不会有积累,常用来修饰蛋白质、多肽、酶等生化药物和生物医用材料[15 ,16]。本研究选用PEG[17]衍生物——具有端甲基的MPEG作为氧化铁纳米粒子的修饰剂,创新性地采用饱和食盐水取代了丙酮、己烷清洗过量的修饰剂,避免了因清洗而造成的有机试剂残留,以更有利于今后在生物医学上的应用。
1 实验 1.1 试剂乙酰丙酮铁(Fe(acac)3),98%,梯希爱化成工业发展有限公司;聚乙二醇单甲醚(MPEG-1000),分析纯,阿拉丁试剂;氯化钠(NaCl),分析纯,西陇化工有限公司;透析袋(截留分子量8000~14000,Biosharp,USA)。
1.2 磁性纳米粒子的合成称取20g MPEG-1000转入50mL三口烧瓶中,在磁力搅拌下加热到120℃,并保温1h除水。降温至80℃,再加入0.74g Fe(acac)3,在80℃下,搅拌10min,使之充分混合。
分别采用分段加热和直接加热方式合成SPIONs。实验A:加热到200℃反应30min,再升温至280℃反应30min;实验B:加热到200℃反应60min。整个实验是在Ar气保护下进行的,气流量为200mL/min,并接上冷凝回流装置,实验加热装置是程序控温炉,升温速率为10℃/min。反应结束后,停止加热,将装置整个移出加热炉,置于空气中降温,待烧瓶中溶液温度降到60℃左右,将产物A,B倒入烧杯中密封放置(分别记作样品A及样品B)。
1.3 盐桥法萃取清洗配置饱和NaCl溶液(常温下溶解度36.5g/100g),分别将样品A,B和饱和NaCl溶液以1∶5的体积比混合,超声分散,用磁性分离方法将粒子收集在烧杯底部,弃去上层溶液。用饱和食盐水如上所述反复清洗样品3~4次,直至上层溶液澄清。将清洗好的样品粒子分散于去离子水中,并进行透析处理(透析2~3天,每隔12h换一次水)用以除去吸附在粒子表面的NaCl。
1.4 表征仪器采用X’Pert Pro X射线粉末衍射仪表征样品的物相;Agilent 7500cx电感耦合等离子体质谱仪测定浓度;JEOL-2010透射电子显微镜观察样品的形貌、粒径以及分散状态;Nicolet Nexus 470傅里叶变换红外光谱仪测定样品的红外谱图;ZEN3690纳米粒度与Zeta电位分析仪测定样品的Zeta电位和流体力学粒径;MPMSXL-7超导量子干涉仪测定样品的磁性能;Q500热重分析仪测定样品的有机物含量。
2 结果与讨论 2.1 X射线衍射分析样品A用饱和食盐水清洗后的样品分成两份,一份进行透析处理,另一份不做处理,将两份样品在常温25℃下鼓风干燥烘干,对得到的粉末进行X射线衍射分析。通过图1中a,b两条谱线对比可知,透析处理后的NaCl衍射峰消失,说明透析后样品基本没有NaCl残留。
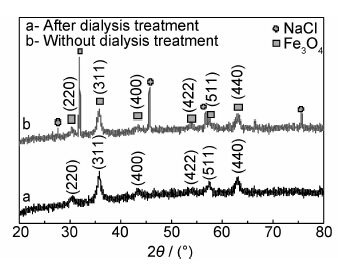 | 图1 MPEG中分段加热合成SPIONs的XRD图谱 Fig.1 XRD patterns of SPIONs synthesized in MPEG | |
图1中b曲线在(220),(311),(400),(422),(511)和(440)处出现衍射峰,与标准的Fe3O4图谱(JCPDS No.01-085-1436)相一致,说明所制备的样品中含有Fe3O4晶相。根据Debye-Scherrer公式D=Kλ/(βcosθ)计算,式中:D为晶粒尺寸;K为晶粒的形状因子,取0.90;λ为入射线波长,取0.15405nm;β,θ分别表示(311)晶面衍射峰的半高宽和衍射角,β=0.588,得SPIONs的平均晶粒为14.0nm。
2.2 ICP-MS测试为确定样品A经清洗透析处理后样品中残留的NaCl的清除程度,用电感耦合等离子体质谱仪(ICP-MS)测定透析后的样品中Fe,Na等元素的含量。结果表明,Na元素的含量为2.03×10-2μg/mL;Fe元素的含量为2.57×103μg/mL。从结果可以看出,Na元素和Fe元素含量相差5个数量级,氧化铁的质量分数为NaCl的6.9×104倍,可以确定,经透析后样品中的NaCl已基本清除。
2.3 TEM分析图2为样品A,B经盐桥萃取清洗透析工艺后的SPIONs TEM图。从图2可看出,在MPEG中制备的SPIONs分散性较好,无团聚现象。对图2(a),(b)中100个粒子的粒径进行测量,统计得出SPIONs平均粒径分别为(4.4±0.9)nm,(12.2±3.1)nm。图2(b)与XRD分析中计算的平均粒径基本符合,表明合成的SPIONs是单个晶体。
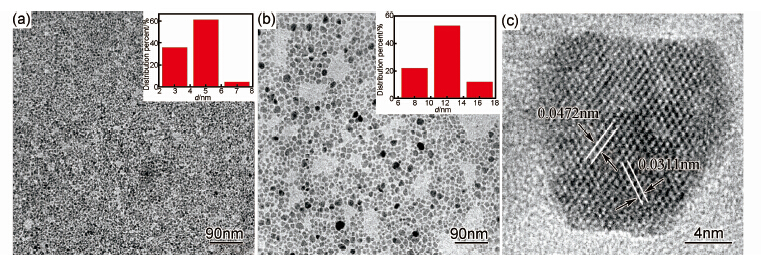 | 图2 MPEG中一阶段加热(a)和分段加热(b)合成的SPIONs的TEM照片和粒径分布图以及单个SPIONs晶粒HRTEM图(c) Fig.2 TEM images and size distribution of SPIONs synthesized in MPEG by one-step heating (a), two-step heating (b) and HRTEM image of a single crystal of SPIONs(c) | |
从分段加热方式反应得到粒子的高分辨图(图2(c))中可看出,晶格点阵整齐有序地网格结构,进一步表明制备的纳米粒子为单晶且具有很高的结晶度,点阵距离0.0472,0.0311nm分别对应的是(111)和(220)晶面[18],并且此结果也与标准的Fe3O4 XRD卡片(JCPDS 01-085-1436)中的0.0484nm(111),0.0296nm(220)基本相符。
由图2(a),(b)对比可以看出,分段加热方式在200℃时,生成的纳米粒子粒径较小,形成晶核,第二阶段280℃随着反应温度的升高,晶粒均匀生长[19],生成粒径较为均匀且晶形良好的SPIONs。
2.4 FT-IR表征图3中谱线a和b分别是样品A经盐桥萃取清洗透析工艺后的SPIONs和纯MPEG的红外谱图,对比谱线a,b,在谱线a中1384cm-1和599cm-1处出现了新的吸收峰,1384cm-1为—COO—基团的不对称伸缩峰,该基团是在高温合成SPIONs过程中有机溶剂MPEG部分—CH2OH被氧化形成的[20 ,21],599cm-1为Fe—O的特征吸收峰[20]。谱线a和b中3417cm-1处是—OH基团的吸收峰,2875cm-1处是C—H基团的吸收峰,1100cm-1处是C—O—C基团的吸收峰,1628cm-1处是C=O基团的吸收峰[21]。根据以上红外分析,说明SPIONs表面修饰上MPEG。
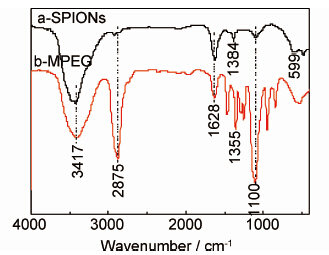 | 图3 MPEG中合成的SPIONs和MPEG的红外光谱图 Fig.3 FT-IR spectra of SPIONs synthesized in MPEG and MPEG | |
图4(a)和图4(b)分别为样品A经盐桥萃取清洗透析工艺后的SPIONs和纯MPEG的热重曲线。从图4(b)可以看出,在氮气气氛保护下,纯MPEG在200℃开始裂解,到440℃基本完全分解。图4(a)中,除去第一阶段水分蒸发失重,SPIONs从220℃到420℃失重阶段与纯MPEG分解阶段基本相符,这说明是产物中包裹在SPIONs表面的MPEG被分解,第三阶段,420℃到700℃温度段的分解失重一方面来源于SPIONs表面已经键合上MPEG基团,只有在较高的温度下才能打破有机物与SPIONs之间形成的较强键合力,使其分解;另一方面可能是由于在高温下有机物分解产生的CO使得存在于SPIONs表面少量γ-Fe2O3还原成Fe3O[22]4而造成的小部分失重。
 | 图4 MPEG中合成的SPIONs(a)和纯MPEG(b)热重曲线 Fig.4 TGA curves of SPIONs synthesized in MPEG (a) and pure MPEG (b) | |
由此分析可以得出,在SPIONs表面的有机物,分为两种:一种是物理吸附于粒子表面;一种是与氧化铁粒子表面键合,这种有机基团与SPIONs结合较为稳定,也是影响粒子化学性能的主要因素。
2.6 磁性能分析图5为样品A经盐桥萃取清洗透析工艺后的SPIONs在300K下的磁滞回线。从图5中可以看出MPEG修饰的SPIONs具有超顺磁性,饱和磁化强度为42.6A·m2·kg-1。SPIONs热重分析的失重率为20.7%。由此可以计算出除去有机物后氧化铁的饱和磁化强度为53.7A·m2·kg-1。制备的SPIONs具有较小的矫顽力(小于20A·m-1),这正是磁性纳米粒子粒径小到一定程度,出现超顺磁性的体现。结果表明所制备的SPIONs具有超顺磁性和较高的饱和磁化强度。
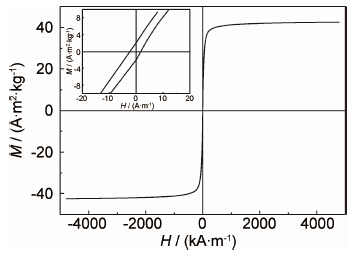 | 图5 MPEG中合成的SPIONs磁滞回线 Fig.5 M-H curve of SPIONs synthesized in MPEG | |
样品A经盐桥萃取清洗透析工艺后的SPIONs在水中分散放置一个月,无团聚和沉淀现象,说明制备的SPIONs能够稳定分散在水中。图6为SPIONs于去离子水和食盐水中的DLS图和Zeta电势图。由图6可见,SPIONs分散于去离子水中的流体力学粒径为46nm,Zeta电位为-9.1mV。说明以MPEG修饰合成的SPIONs流体力学粒径较小且其表面呈一定的负电性,能够在水中形成稳定的胶体溶液。在用饱和食盐水清洗样品的过程中,样品A与饱和食盐水以1∶5的比例超声混合后其流体力学粒径为2318nm,即产生了粒子的聚集。SPIONs与15mmol/L NaCl溶液以1∶5的比例超声混合后的Zeta电位为0.4mV,接近电中性。图7为MPEG中合成的SPIONs分散于饱和食盐水的示意图。由图7可见,SPIONs在与NaCl混合时,氧化铁与阳离子Na+结合形成了链状或网状的盐桥[23],SPIONs聚集在一起,使其流体力学粒径增大,在水中不能稳定分散,易被磁铁吸附。在进行透析处理除去NaCl后,SPIONs能稳定分散在水中,说明SPIONs与Na+相结合产生的作用是可逆的。
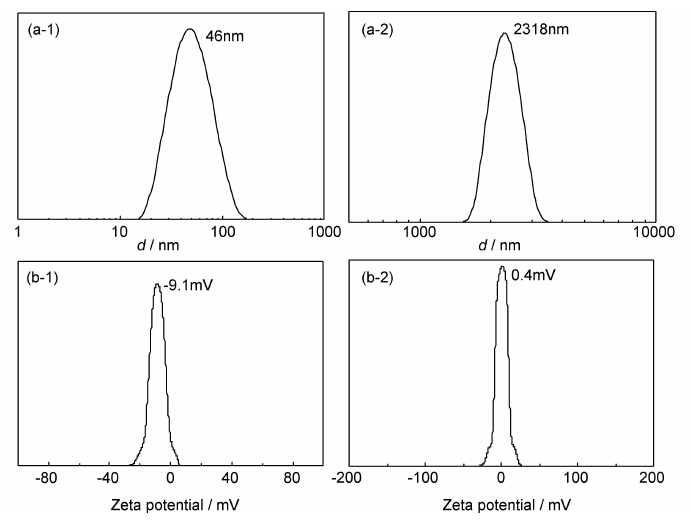 | 图6 SPIONs于去离子水(1)和饱和食盐水(2)中的的DLS图(a)和Zeta电势图(b) Fig.6 DLS plots (a) and Zeta potential (b) of SPIONs dispersed in water(1)and SPIONs dispersed in saturated salt water(2) | |
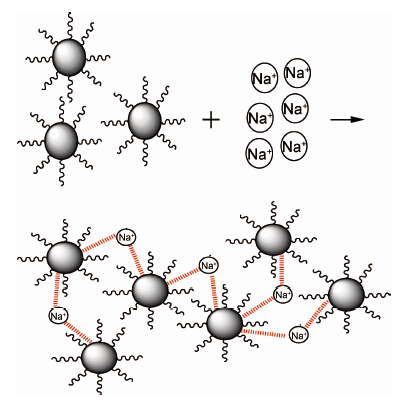 | 图7 MPEG中合成的SPIONs分散于饱和食盐水的示意图 Fig.7 Illustration of SPIONs synthesized in MPEG dispersing in saturated salt water | |
图8为SPIONs分散于不同环境下被磁铁吸附的对比效果图,MPEG中合成SPIONs在饱和食盐水中可以被磁铁收集,过量的MPEG留在清液中而被去除。由于透析除去了残留在表面的NaCl,经透析处理后的SPIONs,能够稳定分散在水中,粒子不能被磁铁吸附分离,而是出现一种稳定的磁流体状态。
 | 图8 SPIONs分散于饱和食盐水(a)和清洗后的SPIONs 分散于去离子水(b)被磁铁吸附的对比效果图 Fig.8 Comparison images of SPIONs dispersed in saturated salt water (a) and SPIONs after washing in water (b) | |
(1)以MPEG为溶剂、还原剂及修饰剂,Fe(acac)3为铁源,通过高温热分解法制备的超顺磁性氧化铁纳米粒子(SPIONs)。在200℃/60min,200℃/30min-280℃/30min制备的粒子粒径分别为(4.4±0.9),(12.2±3.1)nm。
(2)红外分析结果表明具有惰性端基的MPEG有机基团修饰于SPIONs表面,为其提供了良好的水分散性。磁性能测试表明所制备的SPIONs在300K下具有超顺磁性。
(3)MPEG修饰的SPIONs表面呈负电性,与阳离子Na+形成链状或网状的盐桥而聚集在一起,即采用盐桥法萃取清洗工艺可清除过量的MPEG,这种SPIONs与Na+相结合产生的作用是可逆的,可以用透析的方法清除残留的NaCl。
(4)经过透析处理的SPIONs表面残留的NaCl已基本被清除。本工艺避免了使用有机溶剂甲苯、丙酮或酒精清洗之后存在的有机物残留问题,使得制备的SPIONs能更好地应用在生物医学领域中。
| [1] | LU A H, SCHMIDT W, MATOUSSEVITCH N, et al. Nanoengineering of a magnetically separable hydrogenat-ion catalyst[J]. Angewandte Chemie International Edition, 2004, 43(33): 4303-4306. |
| [2] | MAVER U, BELE M, MAKOVEC D, et al. Incorporation and release of drug into/from superparamagnetic iron oxide nanoparticles[J]. Journal of Magnetism and Magnetic Materials, 2009, 321(19): 3187-3192. |
| [3] | GAIHREA B, KHIL S M, LEEC D R, et al. Gelatin-coated magnetic iron oxide nanoparticles as carrier system: Drug loading and in vitro drug release study[J]. International Journal of Pharmaceutics, 2009, 365(1-2): 180-189. |
| [4] | PETER Z, JAMES W M C, MIN G. Five-dimensional optical recording mediated by surface plasmons in gold nanorods[J]. Nature, 2009, 459(7245): 410-413. |
| [5] | LI Z, WEI L, GAO M Y, et al. One-pot reaction to synthe-size biocompatible magnetite nanoparticles[J].Advanced Materials, 2005, 17(8): 1001-1005. |
| [6] | HONG R Y, LI J H, ZHANG S Z, et al. Preparation and characterization of silica-coated Fe3O4 nanoparticles used as precursor of ferrofluids[J]. Applied Surface Science, 2009, 255(6):3485-3492. |
| [7] | 乔瑞瑞, 贾巧娟, 曾剑锋, 等. 磁性氧化铁纳米颗粒及其磁共振成像应用[J]. 生物物理学报, 2011, 27(4): 272-288.QIAO Rui-rui, JIA Qiao-juan, ZENG Jian-feng, et al. Magnetic iron oxide nanoparticles and their applications in magnetic resonance imaging[J]. Acta Biophysica Sinica, 2011, 27(4):272-288. |
| [8] | TAEGHWAN H, SU S L, JONGNAM P, et al. Synthesis of highly crystalline and monodisperse maghemite nanocrystallites without a size-selection process[J]. Journal of the American Chemical Society, 2001, 123(51): 12798-12801. |
| [9] | GONZALEZ C T, MORALES M P, GRACIA M, et al. Preparation of uniform γ-Fe2O3 particles with nanometer size by spray pyrolysis[J]. Materials Letters, 1993, 151(18): 151-155. |
| [10] | XU Z C, SHEN C M, HOU Y L, et al. Oleylamine as both reducing agent and stabilizer in a facile synthesis of magnetite nanoparticles[J]. Chemistry of Materials, 2009, 21(9): 1778-1780. |
| [11] | ZHU Y F, ZHAO W R, CHEN H R,et al. A simple one-pot self-assembly route to nanoporous and monodispersed Fe3O4 particles with oriented attachment structure and magnetic property[J]. The Journal of Physical Chemistry C, 2007, 111(14): 5281-5285. |
| [12] | JANA N R, CHEN Y F, PENG X G. Size-and shape-controlled magnetic (Cr, Mn, Fe, Co, Ni) oxide nanocrystals via a simple and general approach[J]. Chemistry of Materials, 2004, 16(20): 3931-3935. |
| [13] | SUN S H, ZENG H. Size-controlled synthesis of magnetite nanoparticles[J]. Journal of the American Chemical Society, 2002, 124(28): 8204-8205. |
| [14] | 郭兴忠, 杨辉, 王建武, 等. 聚乙二醇表面改性 SiC 粉体的物性表征[J]. 材料工程, 2004,(3):7-10. GUO Xing-zhong, YANG Hui, WANG Jian-wu, et al. The material properties characterization of SiC powder surface modified by polyethylene glycol[J]. Journal of Materials Engineering, 2004, (3): 7-10. |
| [15] | NA H B, LEE I S, SEO H J, et al. Versatile PEG-derivatized phosphine oxide ligands for water-dispersible metal oxide nanocrystals[J]. Chemical Communications, 2007,48: 5167-5169. |
| [16] | XU F, ZHANG X, XIE Y, et al. Morphology control of γ -Fe2O3 nanocrystals via PEG polymer and accounts of its mssbauer study[J]. Journal of Colloid and Interface Science, 2003, 260(1): 160-165. |
| [17] | RYOO S J, KIM J H, KIM J S, et al. Efficient methods of converting hydroxyl groups into amino groups in poly(ethylene glycol)-grafted polystyrene resin[J]. Journal of Combinatorial Chemistry, 2002, 4(3): 187-190. |
| [18] | SONG Y J, WANG R X, RONG R, et al. Synthesis of well-dispersed aqueous-phase magnetite nanoparticles and their metabolism as an MRI contrast agent for the reticuloendothelial system[J]. European Journal of Inorganic Chemistry, 2011,22: 3303-3313. |
| [19] | 丰荣娟, 李敏, 刘家祥. 化学还原法制备小粒径金纳米粒子[J]. 材料工程, 2013,(5): 28-32. FENG Rong-juan, LI Min, LIU Jia-xiang. Preparation of small size Au colloid by chemical reduction[J]. Journal of Materials Engineering, 2013, (5): 28-32. |
| [20] | GONALVES R H, CARDOSO C A, LEITE E R. Synthesis of colloidal magnetite nanocrystals using high molecular weight solvent[J]. Journal of Materials Chemistry, 2010, 20(6): 1167-1172. |
| [21] | ZHAO F Y, ZHANG B L, FENG L Y. Preparation and magnetic properties of magnetite nanoparticles[J]. Materials Letters, 2012, 68(1): 112-114. |
| [22] | MINATI L, MICHELI V, ROSSI B, et al. Application of factor analysis to XPS valence band of superparamagnetic iron oxide nanoparticles[J]. Applied Surface Science, 2011, 257(24): 10863-10868. |
| [23] | XU Y L, QIN Y, PALCHOUDHURY S, et al. Water-soluble iron oxide nanoparticles with high stability and selective surface functionality[J]. Langmuir, 2011, 27(14): 8990-8997. |
 2015,Vol. 43
2015,Vol. 43


