| 基于光谱与光合参量的油菜叶片总初级生产力反演 |
2. 武汉大学遥感农作物表型实验室,湖北 武汉,430079
2. Lab for Remote Sensing and Crop Phenotyping, Wuhan University, Wuhan 430079, China
随着经济社会的快速发展与工业化的不断推进,我国碳排放量连续多年保持增长[1]。逐步增大的碳排放量会进一步加剧温室效应,农作物作为极其常见的生物群落,在吸收与固定二氧化碳、缓解温室效应方面扮演重要角色[2]。总初级生产力(gross primary productivity, GPP)是评价植物吸收固定碳能力的重要指标,它是指在单位时间和单位面积上,绿色植物通过光合作用所固定的有机碳总量(单位:g C·m-2d-1)[3]。因此,作为兼具广大种植面积和生物柴油制备原材料的油料作物,研究油菜总初级生产力估算模型具有重要意义。
目前,国内外研究学者针对植被GPP估算主要提出了气候统计模型(经验模型)、过程模型(机理模型、生物地球化学模型)和光能利用率模型3类模型[4]。气候统计模型考虑气候因子(降水、温度、蒸散量等)对生产力的影响,参数较少易于估算,但是其理论支持不够严密且模型适用性较弱[5]。过程模型综合考虑到植物微观与宏观的生长过程,理论基础严谨,但其所需参数过多限制了该类模型的应用[6]。光能利用率模型通过植物对太阳辐射的有效利用率估算GPP,具有理论严密、结构简单的特点,目前该模型应用最为广泛的是Monteith[7]提出的光能利用率方程:
| $ \mathrm{GPP}=\mathrm{fAPAR} \times \mathrm{PAR} \times \mathrm{LUE} $ | (1) |
式中,fAPRA(fraction of absorbed photosynthesis active radiation)为光合有效辐射吸收比率,即全部入射辐射能量被植物吸收的比率,无量纲;PAR(photosynthetically active radiation)为光合有效辐射(单位:μmol·m-2·s-1),指可被植物吸收并用作光合作用的电磁波;LUE(light use efficiency)为光能利用率(单位:g C·μmol-1),表示植物将吸收的光合有效辐射转化为有机碳化学能的效率。
传统方法观测LUE与fAPAR费时费力,因此国内外研究学者针对寻找LUE与f APAR替代量开展了大量研究。Gitelson等[8]提出可以利用与二者均高度相关的冠层叶绿素含量(chlorophyll, Chl),单位为g·m-2,对GPP进行估算的模型:
| $ \mathrm{GPP} \propto \mathrm{Chl} \times \mathrm{PAR} $ | (2) |
即GPP正比于Chl和PAR的乘积。同时由于利用植被指数估算冠层叶绿素含量的方法已被广泛证实为有效可行,该模型可利用与叶绿素相关的植被指数(vegetation index, VI)进行构造:
| $ \mathrm{GPP} \propto \mathrm{VI}_{\mathrm{Ch}} \times \mathrm{PAR} $ | (3) |
但由于LUE难以观测,现有的估算模型往往简单地将LUE和f APAR视为一体,或将同种植物类型的LUE视为不变的常数,忽视了LUE可能因为植物种类、环境气候及植被生长阶段不同而发生变化的事实[9],在一定程度上导致估算模型的不严谨及准确性下降[10]。因此,本研究将通过对油菜叶片尺度下GPP与植被指数之间关系的研究,寻找可能影响油菜叶片LUE的光合参量,并基于光谱数据、光合参量建立油菜叶片GPP估算模型。
1 实验材料和方法 1.1 实验材料本研究试验田位于湖北省武汉市武汉大学工学部试验田(30.54°N, 114.36°E)。所选取的试验田按照不同的施氮水平设置为高、中、低氮肥3块小区,每块小区面积9 m2(长3 m,宽3 m),各小区间挖有30 cm的空沟用于隔水隔肥。观测对象为“华油杂9号”油菜,在2016年10月初播种育苗,11月下旬移栽,移栽间隔为0.25 m,各小区种植13×13=169株油菜,种植密度为18.7株/m2。除氮肥外,各小区的水分、光照、磷肥、钾肥均保持一致。结合油菜蕾臺期、花期和角果期等生长节点以及观测所需晴朗无云的气象要求,选取2016年3月6日、14日、19日、27日,4月1日、11日6个观测日对油菜进行无损观测。
1.2 光合数据光合数据的获取采用美国LI-COR公司研制的LI-6400便携式光合作用测量系统,该测量系统用于研究植物光合作用,可同时测量入射光合有效辐射(incident Photosynthetically active radiation, PARin),单位为μmol·m-2·s-1;胞间CO2浓度(intercellular CO2concentration, Ci),单位为μmol CO2·mol-1;气孔导度(conductance, Cond),单位为μmol·m-2s-1;以及蒸腾速率(transpiration rate, Trmmol),单位为μmol HO2·m-2s-1等多项光合与水分生理指标。每个测量日在各小区内随机选取一株长势良好、无病虫害的油菜,测量前标记该植株及其叶片序号,从上至下依次观测6片叶片。夹取叶片等待读数稳定后,连续记录5次以上的观测值,取均值作为该叶片光合数据,如数据不够稳定,则需等待数据稳定,并进行10次以上的观测。每测完一株油菜,进行一次设备匹配。
1.3 光谱数据反射光谱数据的采集使用美国ASD公司的ASD Field Spec光谱仪,该仪器可采集的光谱范围为350~2 500 nm,光谱分辨率为1 nm。测量时,选取与测量光合数据的同一植株,按照叶片编号从上至下一次测量叶片的反射光谱。每片叶片用叶片夹夹取4个点位,每个点位记录5条光谱曲线,共记录200条光谱曲线,测量完毕后使用叶片夹自带光源进行白板校正以保证数据质量。后期处理中,剔除误差较大的曲线,取其余曲线平均值作为叶片的光谱反射曲线。
1.4 统计分析 1.4.1 GPP计算将光合作用仪测得每个时刻的净光合速率(photo)与时间进行积分得到二氧化碳日同化量,作为GPP的替代,用来表征油菜碳汇能力的强弱。一般来说,GPP的单位为g C·m-2·d-1,即以天为单位衡量二氧化碳日同化量。具体计算方法为:根据净光合速率日变化的测量值,使用简单积分方法计算油菜在测量日的净同化量[10]。
| $ P=\sum\limits_{i=1}^j\left[\left(\frac{P_{i+1}+P_i}{2}\right) \times\left(t_{i+1}-t_i\right) \times 3600 / 1000\right] $ | (4) |
式中,P为测量日的二氧化碳日同化总量(单位:μmol·m-2); Pi为初测点的瞬时光合作用速率(单位:μmol·m-2·s-1); Pi+1为下一测点的瞬时光合作用速率(单位:μmol·m-2·s-1); ti为初测点的时刻(单位:h), ti+1为下一测点的时刻;j为测量次数。因此,测量日的二氧化碳日同化质量如式:
| $ W_{\mathrm{CO}_2}=P \times 44 / 1000 $ | (5) |
式中,44为CO2的摩尔质量;WCO2为单位种植面积的叶片固定CO2的质量(单位:g·m-2)。
1.4.2 高光谱植被指数计算考虑到现有数据的覆盖性,结合叶绿素与红光、近红外波段有较高相关的原因,本研究选择了归一化差异植被指数(normalized difference vegetation index NDVI)、增强型植被指数(enhanced vegetation index, EVI)、叶绿素指数(chlorophyll index, CI)、绿波段叶绿素指数(CIgreen)、红边叶绿素指数(CIrededge)、宽范围动态植被指数(wide dynamic range vegetation index, WDRVI)、归一化差值红边指数(normalized difference red edge index, NDRE)及梅里斯陆地叶绿素指数(MERIS terrestrial chlorophyll index, MTCI)8种植被指数进行回归建模。其中,近红外波段(ρNIR)取780~800 nm反射率均值,红波段(ρred)取660~680 nm反射率均值,绿波段(ρgreen)取540~560 nm反射率均值,红边波段(ρred edge)取710~730nm反射率均值,ρ750与ρ705分别表示750 nm与705nm处光谱反射率,WDRVI中常数值a取0.2。计算公式如表 1所示。
| 表 1 植被指数计算公式 Tab.1 Formula of Vegetation Indices |
 |
1.5 模型构建及精度验证
根据式(3),在油菜叶片尺度上,分别构建仅使用植被指数VI,同时使用入射光合有效辐射、植被指数二者乘积PARin×VI,和同时使用入射光合有效辐射、植被指数及特定光合参量三者乘积PARin×VI×光合参量作为3组自变量,油菜总初级生产力作为因变量进行模型拟合。比较在引入PARin、特定光合参量前后模型精度的差异。
实验获取的总样本个数为62个,考虑到样本数量较少,如果直接将数据随机切分为建模集与验证集,会因为数据集切分的不均匀或建模集和验证集分布的不均匀导致验证集准确率高于建模集等现象。因此使用K折交叉验证方法对模型进行构建及精度验证。本文取K值为5,即每种模型随机分为5份,每次轮流取4份作为建模集,余下1份作为验证集,直到每份数据均被验证过。最后采用建模集拟合优度R2、均方根误差(root mean squares error, RMSE),预测集拟合优度R2、均方根误差RMSE的平均值对模型的拟合精度进行评价。
2 结果与分析 2.1 光合参量的选取对可能影响净光合速率的光合有效辐射(PARin),胞间CO2浓度(Ci),气孔导度(Cond)以及蒸腾速率(trmmol)4个光合参量,本研究分别与净光合速率进行相关分析,并计算对应Pearson相关系数。由于光合作用与室内部光合有效辐射、胞间CO2浓度、气孔导度、蒸腾速率同时有关,受其中多种因素协同作用影响[18]。本研究在控制其余变量的基础上,逐一对4个光合参量与净光合速率进行偏相关分析。计算结果如表 2所示。
| 表 2 净光合速率和光合参量Pearson相关系数表 Tab.2 The Pearson Correlation Table of Photo and Photosynthetic Parameter |
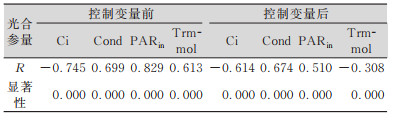 |
可以发现,控制变量前,4个光合参量均与净光合速率表现出较强的相关性,其中入射光合有效辐射、胞间CO2浓度、气孔导度的相关性较高,相关系数达到0.65以上,且表现为在0.01水平双侧显著相关。在控制变量以后,4个光合参量与净光合速率表现出的相关性有一定程度降低,其中蒸腾速率下降最大,说明其受其他光合参量影响较大,对净光合速率影响有限。胞间CO2浓度在控制变量前后均表现出一定相关性,但其大小受叶片周围空气CO2含量、叶片风速、气孔导度、叶肉导度和叶肉细胞的光合活性多种易变因素影响[19],不利于反演模型构建。入射光合有效辐射已被证明是影响光合作用的主要因素之一,在各类模型中被广泛使用。气孔导度相关系数下降最少,受其他光合参量影响有限,表现出较强的相关性。由于使用遥感手段获取农作物气孔导度具备可行性[20],有利于遥感反演模型构建,结合偏相关分析结果,本研究选取气孔导度Cond这一特定光合参量作为可能影响油菜叶片光能利用率的光合生理指标进行模型构建。
2.2 模型比较分析首先以VI作为自变量,GPP作为因变量进行建模,选取各组结果中平均拟合优度R2最高的模型,并记录平均RMSE(见表 3)。
| 表 3 使用植被指数反演GPP模型R2及RMSE Tab.3 R2and RMSE of Model Using VI |
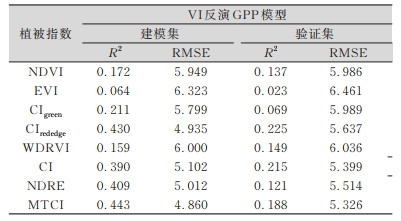 |
由表 3可知,由NDRE、CIrededge、MTCI这3种以红边波段、近红外波段反射率为核心构建的植被指数表现较好,在建模集中拟合优度R2均高于0.40。MTCI模型中RMSE为4.86 g·m-2,表现最优;在CIrededge、NDRE构建的两个模型中,RMSE分别达到了4.935 g·m-2和5.012 g·m-2,表现次之。对于以绿波段、红波段、近红外波段反射率为核心构建的ND-VI、EVI等植被指数,模型效果不佳,拟合优度R2均在0.25以下,对GPP的反演解释程度低。各类模型验证集验证效果略差于建模集效果。
总体来看,在仅使用植被指数构建模型时,所构建的各类模型拟合优度R2较低,而RMSE较高,建模效果不理想。光合器官中叶绿素含量的高低反应了叶片固碳能力的强弱,但是对于一天之中的GPP积累量而言,影响GPP高低的还有光合有效辐射、参与光合作用的二氧化碳等因素[10]。大部分VI以反映植物当前生长状态(如叶绿素、叶黄素等)为核心[21],因此,本研究认为仅利用VI反演油菜叶片GPP模型精度较低,可行性不佳,需要结合其他光合参量进行模型构建。
在植被指数的基础上,考虑光合入射有效辐射和气孔导度这一特定光合参量,以PARin×VI、PARin×VI×Cond分别作为自变量,GPP作为因变量进行建模,选取各组结果中平均拟合优度R2最高的模型,并记录平均RMSE(见表 4)。
| 表 4 引入光合有效辐射及气孔导度反演GPP模型R2及RMSE Tab.4 R2and RMSE of Model Using PAR and Cond |
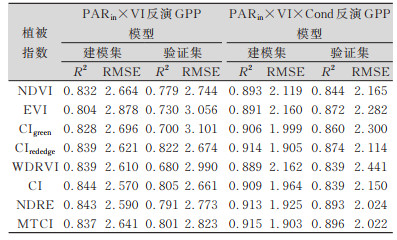 |
由表 4可知,引入光合有效辐射构建模型后,各模型的拟合优度都有较大幅度的提高。在建模集中,8种VI与PAR乘积构建的模型拟合优度R2均达到0.8以上水平,与仅使用植被指数构建模型时比较,RMSE下降至2.5~2.9 g·m-2区间范围。在验证集中可以看出,除WDRVI外,其他预测值与观测值的拟合优度平均值均高于0.70,可见模型精度得到了较大提高。这也符合Monteith提出的光能利用率方程[7]。
为研究光合参量对基于光能利用率方程构建GPP模型的影响,本文从影响净光合速率的4个光合参量中选择了气孔导度Cond作为可能影响光能利用率从而影响模型构建的因素进行建模。从表 4中可看出,本文研究的8个叶绿素有关植被指数,在引入了Cond之后,反演GPP模型精度均得到进一步提升,在建模集中,拟合优度R2均达到了0.88以上,RMSE进一步下降至2.16 g·m-2以下。对于此前反演效果不佳的EVI模型,建模集中拟合优度R2平均值也由0.804提高至0.891。
效果最好的CIrededge、NDRE、MTCI这3个模型,其拟合优度R2可达0.91以上,验证集中拟合优度R2在0.87以上,反演模型的准确度也得到提升。与单独使用VI反演GPP模型趋势一致,但拟合效果有了较大提升。
本文研究表明,随着植物叶片气孔的开闭引发叶片气孔导度的变化,参与光合作用的二氧化碳供给速率会随之发生改变,从而在光合作用原料供给这一方面影响油菜从空气中固定碳的含量,进而影响GPP。
3 结束语本文以油菜叶片的光谱为基础,结合叶片入射光合有效辐射、气孔导度等光合参量,使用8种植被指数,分别构建VI、PARin×VI及PARin×VI×Cond 3类GPP反演模型,对3类模型的反演精度进行评价分析,得出如下结论:
1)光合有效辐射和叶片气孔导度是影响油菜光合作用的重要因素,不考虑二者影响仅使用植被指数反演油菜GPP效果不佳。
2)结合入射光合有效辐射和叶片气孔导度两个光合参量,以CIrededge、NDRE、MTCI这3种以红边波段、近红外波段反射率为核心的植被指数,其构建的反演模型效果良好,满足反演油菜叶片GPP精度要求。
3)结合遥感手段和叶片光合参量对GPP进行反演,精度较高,可弥补单一遥感手段估算GPP易饱和、精度低的不足,对作物GPP评估和估产具有潜在的应用价值。
| [1] |
基于Logistic模型的中国各省碳排放预测[J]. 长江流域资源与环境, 2013(2): 143-151. |
| [2] |
佟磊. 中国南早稻和北方冬小麦O3和CO2吸收通量观测和模型研究[D]. 北京: 中国科学院大学, 2011.
|
| [3] |
刘宝升. 基于MODIS和通量数据的玉米总初级生产力反演研究[D]. 杭州: 电子科技大学, 2013.
|
| [4] |
植被NPP估算的模型方法与机理[J]. 安徽农学通报, 2014, 20(8): 30-33. |
| [5] |
基于统计模型识别气候变化对农业产量贡献的研究进展[J]. 地理学报, 2012, 67(9): 1213-1222. |
| [6] |
浙江东部常绿阔叶林次生演替的随机过程模型[J]. 植物生态学报, 1993, 17(4): 345-351. DOI:10.3321/j.issn:1005-264X.1993.04.006 |
| [7] |
Monteith J L. Solar Radiation and Productivity in Tropical Ecosystems[J]. Journal of Applied Ecology, 1972, 9(3): 747-766. DOI:10.2307/2401901 |
| [8] |
Gitelson A A, Yi P, Arkebauer T J, et al. Relationships Between Gross Primary Production, Green LAI, and Canopy Chlorophyll Content in Maize: Implications for Remote Sensing of Primary Production[J]. Remote Sensing of Environment: An Interdisciplinary Journal, 2014, 144: 65-72. DOI:10.1016/j.rse.2014.01.004 |
| [9] |
植被光能利用率研究进展[J]. 生态学杂志, 2007(9): 1471-1477. |
| [10] |
柴如珲. 基于高光谱数据的典型植被碳汇能力估计研究[D]. 武汉: 武汉大学, 2017.
|
| [11] |
Rouse J W. Monitoring Vegetation Systems in the Great Plains with ERTS[J]. NASA Special Publication, 1974, 351: 309. |
| [12] |
Jiang Z, Huete A R, Didan K, et al. Development of a Two-Band Enhanced Vegetation Index Without a Blue Band[J]. Remote Sensing of Environment, 2008, 112(10): 3833-3845. DOI:10.1016/j.rse.2008.06.006 |
| [13] |
Gitelson A A, ViñaAndrés C V, Rundquist D C, et al. Remote Estimation of Canopy Chlorophyll Content in Crops[J]. Geophysical Research LettersJ, 2005, 32(8): 403-406. |
| [14] |
Buschmann C, Nagel E. In Vivo Spectroscopy and Internal Optics of Leaves as Basis for Remote Sensing of Vegetation[J]. International Journal of Remote Sensing, 1993, 14(4): 711-722. |
| [15] |
Gitelson A A, Merzlyak M N. Quantitative Estimation of Chlorophyll—A Using Reflectance Spectra: Experiments with Autumn Chestnut and Maple Leaves[J]. Journal of Photochemistry & Photobiology B Biology, 1994, 22(3): 247-252. |
| [16] |
Gitelson A A, Merzlyak M N. Spectral Reflectance Changes Associated with Autumn Senescence of Aesculus Hippocastanum L and Acer Platanoides L Leaves Spectral Features and Relation to Chlorophyll Estimation[J]. Journal of Plant Physiology, 1994, 143(3): 286-292. |
| [17] |
Dash J, Curran P J. The MERIS Terrestrial Chlorophyll Index[J]. International Journal of Remote Sensing, 2004, 25(23): 5403-5413. |
| [18] |
Drew E A. Factors Affecting Photosynthesis and Its Seasonal Variation in the Seagrasses Cymodocea Nodosa(Ucria)Aschers, and Posidonia Oceanica(L)Delile in the Mediterranean[J]. Journal of Experimental Marine Biology & Ecology, 1978, 31(2): 173-194. |
| [19] |
Farquhar G D, O′Leary M H, Berry J A. On the Relationship Between Carbon Isotope Discrimination and the Intercellular Carbon Dioxide Concentration in Leaves[J]. Australian Journal of Plant Physiol, 1982, 9(2): 281-292. |
| [20] |
利用遥感信息研究区域冬小麦气孔导度的时空分布[J]. 气象学报, 2000, 58(3): 347-353. |
| [21] |
姜闯道. 植物叶片生长过程中光合活性、光保护机制及光系统Ⅱ热稳定性的研究[D]. 武汉: 中国科学院植物研究所, 2005.
|
 2022, Vol. 47
2022, Vol. 47


