2. 北京化工大学 秦皇岛环渤海生物产业研究院, 秦皇岛 066000
2. Qinhuangdao Bohai Biological Research Institute, Beijing University of Chemical Technology, Qinhuangdao 066000, China
雷公藤(Tripterygium wilfordii Hook F),系卫矛科雷公藤属木质藤本植物,别名黄藤、黄藤木、黄腊藤、断肠草等,分布于中国长江流域以南各地及西南地区[1]。雷公藤作为一种传统中药,其味苦,有大毒,具有活血化瘀、清热解毒、消肿散结、杀虫止血等功效[2]。药理及临床研究证实,雷公藤具有抗炎、抗肿瘤、免疫调节及抗生育等多种特性,被广泛用于治疗类风湿关节炎、肾小球肾炎、红斑狼疮等自身免疫性疾病及各种皮肤病[3]。雷公藤甲素与雷公藤红素是雷公藤中有效以及毒性成分。
小胶质细胞是中枢神经系统中主要的常驻免疫细胞和吞噬细胞[4],各种神经退行性疾病,包括帕金森病(Parkinson's disease,PD)、阿尔茨海默病(Alzheimer disease,AD)和肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS),最显著的共同特征之一是小胶质细胞介导的神经炎症[5]。神经炎症现在被认为是一把双刃剑,对神经元既有害又有益。越来越多的证据表明,中枢神经系统的小胶质细胞活化是不均匀的,可以分为两种相反的类型:促炎的M1表型和免疫抑制的M2表型。M1激活的小胶质细胞表达促炎细胞因子,驱动细胞浸润,而M2激活的小胶质细胞更具有修复性,促进碎片的吞噬作用,促进与细胞稳定性和修复相关的蛋白的表达[6]。
雷公藤提取物已被报道对多种炎症和自身免疫性疾病如类风湿性关节炎有效。雷公藤甲素和雷公藤红素被认为是雷公藤免疫抑制和抗炎作用的主要成分。越来越多的资料表明,雷公藤甲素和雷公藤红素对多种组织具有很强的抗炎作用[4]。
本实验主要探究雷公藤甲素与雷公藤红素对小胶质细胞HMO6的影响,包括它们对细胞增殖、细胞膜完整性以及雷公藤甲素对小胶质细胞M1、M2极化的影响。
1 实验部分 1.1 实验原料和仪器 1.1.1 实验材料雷公藤甲素、雷公藤红素、脂多糖(lipopolysaccharide,LPS)和MTT细胞增殖及细胞毒性检测试剂盒购自北京索莱宝科技有限公司,乳酸脱氢酶细胞毒性检测试剂盒购自上海碧云天生物技术有限公司,人白细胞介素-10(IL-10)ELISA试剂盒和人肿瘤坏死因子α(TNF-α)ELISA试剂盒购自默沙克生物技术有限公司,小胶质细胞(HMO6)购自北京北纳创联生物技术研究院。
1.1.2 实验仪器超净工作台(SW-CJ-1D,苏州净化设备有限公司),离心机(Heraeus Pico 17,Thermo Fisher公司),酶联免疫检测仪(K3 Plus,BIO-DL公司),恒温培养箱(311,Thermo Fisher公司)。
1.2 实验方法 1.2.1 细胞培养HMO6于5% CO2培养箱中培养(含10%胎牛血清的DMEM培养基,温度37 ℃),隔1~2 d传代1次,选取对数生长期细胞进行实验[7]。
1.2.2 细胞增殖实验按MTT细胞增殖及细胞毒性检测试剂盒说明书操作,收集对数期细胞,调整细胞悬液浓度,分于96孔板,每孔180 μL,8 000个细胞/孔。置于37 ℃、5% CO2恒温培养箱中过夜使细胞贴壁[8]。不同浓度雷公藤甲素或雷公藤红素处理的细胞孔设为实验组,未经药物处理的细胞孔为对照组,无细胞的培养液孔为空白组。将96孔板置于培养箱中孵育24 h,小心吸去上清,加入90 μL新鲜培养基,再加入10 μL MTT溶液,继续培养4 h。然后吸掉上清,每孔加入110 μL Formazan溶解液,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪上于490 nm波长处测量各孔的光密度(OD)值。按照式(1)~(2)计算细胞活力(A)和抑制率(B)。
| $ A = (O{D_{\rm{E}}} - O{D_{\rm{B}}})/(O{D_{\rm{C}}} - O{D_{\rm{B}}}) \times 100\% $ | (1) |
| $ B = \left( {1 - A} \right) \times 100\% $ | (2) |
式中,A为细胞活力,B为细胞抑制率,ODE为实验组光密度值,ODB为空白组光密度值,ODC为对照组光密度值。
1.2.3 膜完整性实验本实验通过乳酸脱氢酶细胞毒性检测试剂盒进行HMO6细胞膜完整性的评估[9]。乳酸脱氢酶(LDH)是一种较为稳定的细胞质酶,不能自由通过细胞膜,但当细胞膜受损或细胞死亡时可逃离出细胞膜,被释放到细胞外。LDH释放被看做是评价细胞膜完整性的重要指标,并被广泛用于细胞毒性检测。
按说明书操作,收集对数期细胞,调整细胞悬液浓度,分于96孔板,每孔180 μL,8 000个细胞/孔。置于37 ℃、5% CO2恒温培养箱中过夜使细胞贴壁。然后吸去培养液,用磷酸盐缓冲液(PBS,pH=7.2~7.4)洗涤一次,换新鲜培养基(含1%血清的低血清培养液)200 μL,将各培养孔分为如下几组:对照组(未经药物处理的细胞孔),空白组(无细胞的培养液孔),样品最大酶活性对照组(未经药物处理的用于后续裂解的细胞孔),实验组(药物处理的细胞孔)。按照实验需要给予适当浓度的药物(雷公藤甲素与雷公藤红素)处理,继续按常规培养。培养23 h后,从细胞培养箱里取出细胞培养板,在样品最大酶活性对照孔中加入试剂盒提供的LDH释放试剂20 μL。加入LDH释放试剂后,反复吹打数次混匀,继续在细胞培养箱中孵育1 h,然后用无菌管收集各孔液体并离心,分别取各孔的上清液120 μL,加入到一新的96孔板相应孔中,各孔加入LDH检测工作液60 μL,混匀后在酶联免疫检测仪上于490 nm波长处测量各孔的光密度值,并用600 nm的波长作为参考波长。按照式(3)计算细胞LDH的释放量。
| $ C = (O{D_{{\rm{E/C}}}} - O{D_{\rm{B}}})/(O{D_{\rm{F}}} - O{D_{\rm{B}}}) \times 100\% $ | (3) |
式中,C为LDH释放量(阳性对照的百分比),ODF为样品最大酶活性对照孔的光密度值。
1.2.4 ELISA实验通过ELISA试剂盒检测雷公藤甲素对小胶质细胞的M1、M2极化的影响,实验中LPS质量浓度为0.15 μg/mL。设置对照组(未加LPS和雷公藤甲素的细胞孔),实验组(LPS和不同浓度雷公藤甲素处理的细胞孔)和LPS组(LPS处理的细胞孔)。将经过处理的细胞用无菌管收集,于2 000~3 000 r/min离心20 min左右,仔细收集上清后使用试剂盒检测。
1.2.5 统计学分析实验数据采用Origin统计软件分析,实验结果以平均值±标准差(x±SD)表示,样本均数的比较采用完全随机设计的单因素方差分析,P<0.05说明差异具有统计学意义。
2 结果与讨论 2.1 雷公藤甲素与雷公藤红素对HMO6细胞活力的影响通过MTT实验检测雷公藤甲素与雷公藤红素对HMO6细胞活力的影响,雷公藤甲素选取0、10-10、10-9、10-8、10-7、10-6、10-5 mol/L 7个浓度进行实验,雷公藤红素选取0、10-9、10-8、10-7、10-6、10-5、10-4 mol/L 7个浓度进行实验。
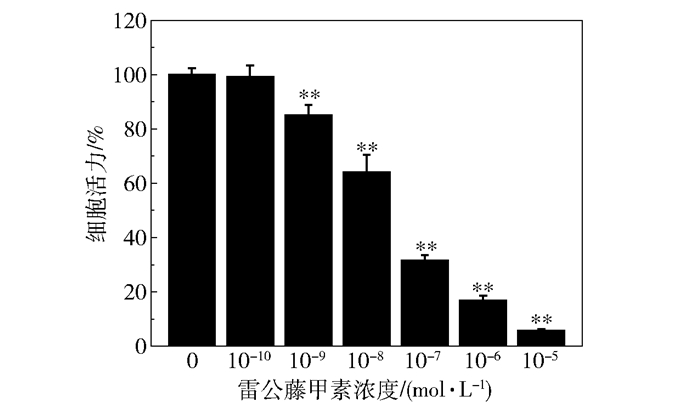
图 1为雷公藤甲素对HMO6细胞活力的影响,与对照组相比,当雷公藤甲素浓度为10-10 mol/L时对HMO6细胞增殖没有明显的抑制作用(P>0.05,n=5),抑制率为(0.70±4.00)%;当雷公藤甲素浓度为10-9~10-5 mol/L时对HMO6细胞增殖有明显的抑制作用(P<0.01,n=5),且细胞活性随雷公藤甲素浓度升高逐渐降低;当药物浓度达到10-7 mol/L时,抑制率为(68.51±2.09)%,与文献基本一致[10],继续增大药物浓度,细胞活性将进一步降低。
|
** P<0.01(与对照组相比) 图 1 雷公藤甲素对HMO6活性的影响 Fig.1 Effect of triptolide on HMO6 viability |
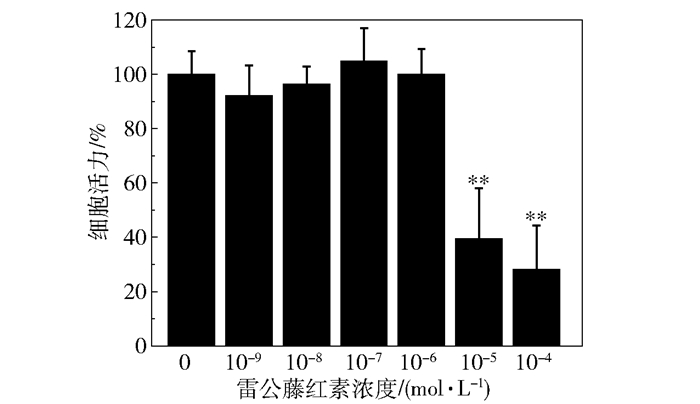
图 2为雷公藤红素对HMO6细胞活力的影响,与对照组相比,雷公藤红素在浓度为0~10-6 mol/L时对HMO6细胞增殖并无明显的抑制作用(P>0.05,n=5);当药物浓度达到10-5 mol/L时,HMO6细胞增殖明显受到抑制(P<0.01,n=5),抑制率为(60.53±18.56)%;当药物浓度达到10-4 mol/L时,抑制率为(71.91±16.28)%。
|
** P<0.01(与对照组相比) 图 2 雷公藤红素对HMO6活性的影响 Fig.2 Effect of celastrol on HMO6 viability |
综上所述,可以发现一定浓度的雷公藤甲素(10-9~10-5 mol/L)与雷公藤红素(10-5、10-4 mol/L)对HMO6的活性有显著的影响,下文进一步探索抑制的分子机制。
2.2 雷公藤甲素与雷公藤红素对HMO6细胞膜完整性的影响在上述实验的基础上,进一步探究雷公藤甲素与雷公藤红素对HMO6细胞膜是否具有破坏作用。雷公藤甲素选取0、10-7、10-4、10-3、10-1 mol/L 5个浓度进行实验,雷公藤红素选取0、10-7、10-6、10-5 mol/L 4个浓度进行实验。
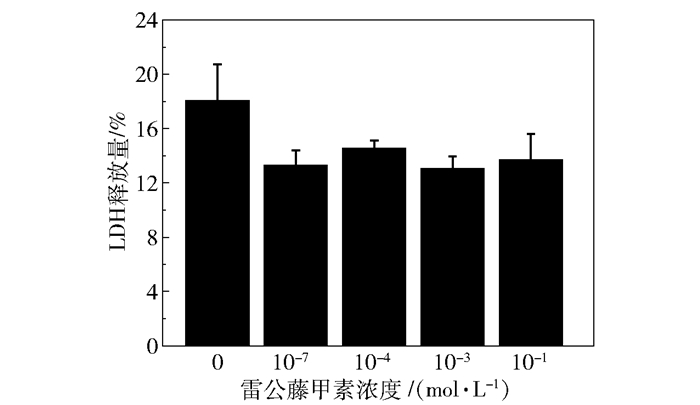
图 3为不同浓度的雷公藤甲素处理细胞后LDH的释放量,与对照组相比,雷公藤甲素处理的细胞LDH释放量并无明显变化(P>0.05,n=4),说明雷公藤甲素对细胞膜无明显的破坏作用。
|
图 3 雷公藤甲素对HMO6细胞LDH释放量的影响 Fig.3 Effect of triptolide on LDH release from HMO6 |
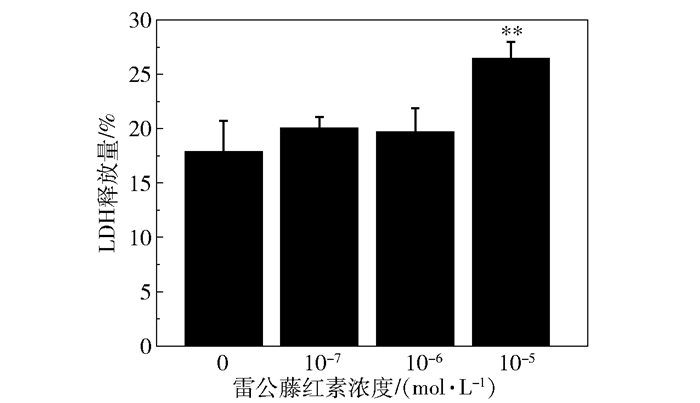
图 4为不同浓度的雷公藤红素处理细胞后LDH的释放量,与对照组相比,当雷公藤红素浓度为10-5 mol/L时,LDH释放量明显增加(P<0.01,n=4),增加量为(8.58±1.56)%,与细胞增殖实验结果基本保持一致,说明当雷公藤红素浓度达到10-5 mol/L时,细胞膜明显受到破坏。
|
** P<0.01(与对照组相比) 图 4 雷公藤红素对HMO6细胞LDH释放量的影响 Fig.4 Effect of celastrol on LDH release from HMO6 |
根据上述实验得出结论:雷公藤甲素(10-7~10-1 mol/L)不会破坏HMO6细胞膜完整性,而当雷公藤红素浓度达到10-5 mol/L时会破坏HMO6细胞膜的完整性。
2.3 雷公藤甲素对HMO6细胞M1、M2极化的影响由2.2节实验可知,雷公藤红素可通过破坏细胞膜的方式影响细胞活性。而雷公藤甲素对HMO6细胞膜并无明显破坏作用,所以进一步探究其是否对HMO6细胞极化有影响,用雷公藤甲素处理经LPS诱导的HMO6细胞,然后选择TNF-α作为衡量M1型极化的指标、IL-10作为衡量M2型极化的指标。
本实验选取4个不同浓度的雷公藤甲素进行测试,探究当雷公藤甲素浓度为0、10-9、10-8、10-7 mol/L时对HMO6细胞M1、M2极化的影响。
图 5为雷公藤甲素对LPS诱导的HMO6细胞释放TNF-α的影响,与LPS组相比,当雷公藤甲素浓度为10-8、10-7 mol/L时,TNF-α释放量显著减少(P<0.01,n=3);当雷公藤甲素浓度为10-8 mol/L时,TNF-α释放量为(521.24±30.07)pg/mL;当雷公藤甲素浓度为10-7 mol/L时,TNF-α释放量为(264.83±64.25)pg/mL。
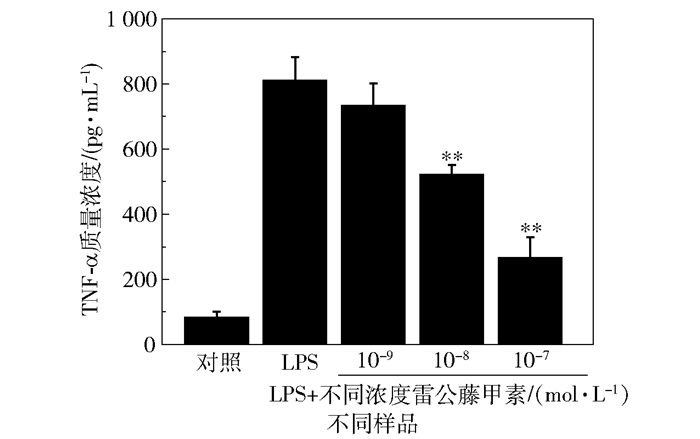
|
** P<0.01(与LPS组相比) 图 5 雷公藤甲素对LPS诱导的HMO6释放TNF-α的影响 Fig.5 Effect of triptolide on LPS-induced release of TNF-α from HMO6 |
图 6为雷公藤甲素对LPS诱导的HMO6细胞释放IL-10的影响,与LPS组相比,当雷公藤甲素浓度为10-8、10-7 mol/L时,IL-10释放量显著减少(P<0.05,n=3);当雷公藤甲素浓度为10-8 mol/L时,IL-10释放量为(70.20±21.81)pg/mL;当雷公藤甲素浓度为10-7 mol/L时,IL-10释放量为(63.48±16.79)pg/mL。
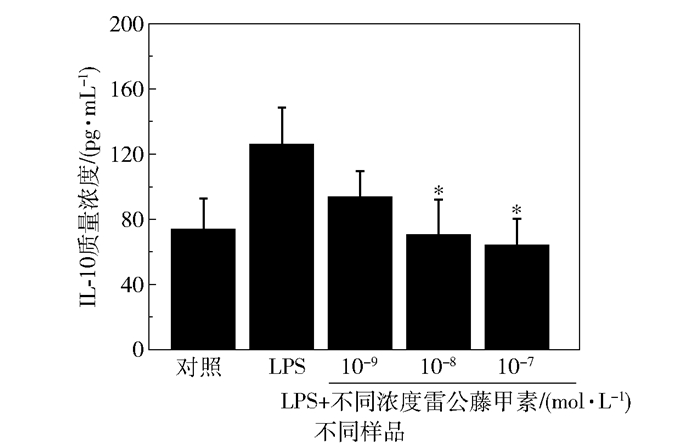
|
* P<0.05(与LPS组相比) 图 6 雷公藤甲素对LPS诱导的HMO6释放IL-10的影响 Fig.6 Effect of triptolide on LPS-induced release of IL-10 from HMO6 |
根据上述实验得出结论:雷公藤甲素浓度为10-8、10-7 mol/L时抑制了小胶质细胞M1、M2的极化,结果表明了雷公藤甲素作用机制的复杂性,与文献结果一致[11-12]。
3 结论当雷公藤甲素浓度为10-9~10-5 mol/L时对小胶质细胞活性有一定的抑制作用;当浓度为10-7~10-1 mol/L时对细胞膜完整性无明显破坏作用;通过ELISA实验可知,当雷公藤甲素浓度为10-8、10-7 mol/L时,对LPS诱导的小胶质细胞TNF-α、IL-10的释放有抑制作用,说明雷公藤甲素虽然起到了一定的抗炎作用,但由于其特殊毒性,作用机理十分复杂。当雷公藤红素浓度达到10-5 mol/L时明显抑制了小胶质细胞的增殖,并且通过破坏细胞膜的方式发挥作用。
作为雷公藤的有效提取物,雷公藤甲素与雷公藤红素在神经免疫性疾病的治疗中发挥了重要作用,可能作为治疗神经性疾病的有效药物,但其特殊的毒副作用也应受到高度重视。
| [1] |
汪元, 刘健. 雷公藤治疗类风湿关节炎的神经内分泌免疫学研究进展[J]. 安徽中医学院学报, 2009, 28(5): 83-85. WANG Y, LIU J. Advances in neuroendocrinology and immunology of tripterygium wilfordii in the treatment of rheumatoid arthritis[J]. Journal of Anhui University of Chinese Medicine, 2009, 28(5): 83-85. (in Chinese) |
| [2] |
高伟, 刘梦婷, 程琪庆, 等. 雷公藤的本草考证[J]. 世界中医药, 2012, 7(6): 560-562. GAO W, LIU M T, CHENG Q Q, et al. Herbal textual research on tripterygium wilfordii[J]. World Chinese Medicine, 2012, 7(6): 560-562. (in Chinese) |
| [3] |
ZHAO Y J, ZHANG Y F, SU P, et al. Genetic transformation system for woody plant tripterygium wilfordii and its application to product natural celastrol[J]. Frontiers in Plant Science, 2018, 8: 2221. DOI:10.3389/fpls.2017.02221 |
| [4] |
WU C F, BI X L, YANG J Y, et al. Differential effects of ginsenosides on NO and TNF-α production by LPS-activated N9 microglia[J]. International Immunopharmacology, 2007, 7(3): 313-320. DOI:10.1016/j.intimp.2006.04.021 |
| [5] |
TANG Y, LE W D. Differential roles of M1 and M2 microglia in Neurodegenerative diseases[J]. Molecular Neurobiology, 2016, 53: 1181-1194. DOI:10.1007/s12035-014-9070-5 |
| [6] |
BENSON M J, MANZANERO S, BORGES K. Complex alterations in microglial M1/M2 markers during the development of epilepsy in two mouse models[J]. Epilepsia, 2015, 56(6): 1-11. |
| [7] |
BI X L, YANG J Y, DONG Y X, et al. Resveratrol inhibits nitric oxide and TNF-α production by lipopolysaccharide-activated microglia[J]. International Immunopharmacology, 2005, 5(1): 185-193. |
| [8] |
CHANG J Y, CHAVIS J A, LIU L Z, et al. Cholesterol oxides induce programmed cell death in microglial cells[J]. Biochemical and Biophysical Research Communications, 1998, 249(3): 817-821. DOI:10.1006/bbrc.1998.9237 |
| [9] |
LI J, SHEN F H, GUAN C W, et al. Activation of Nrf2 protects against triptolide-induced hepatotoxicity[J]. PLoS One, 2014, 9(7): 100685. DOI:10.1371/journal.pone.0100685 |
| [10] |
WANG H L, ZHANG X H, ZHOU X C, et al. Effects of triptolide on inflammatory factors in Alzheimer's disease cell model[J]. Medicinal Plant, 2010, 1(8): 46-48. |
| [11] |
LIU B, ZHANG H Q, LI J, et al. Triptolide downregulates Treg cells and the level of IL-10, TGF-β, and VEGF in melanoma-bearing mice[J]. Planta Medica, 2013, 79(15): 1401-1407. DOI:10.1055/s-0033-1350708 |
| [12] |
ZHOU H F, NIU D B, XUE B, et al. Triptolide inhibits TNF-α, IL-1β and NO production in primary microglial cultures[J]. Neuroreport, 2003, 14(7): 1091-1095. DOI:10.1097/01.wnr.0000073682.00308.47 |








