肝纤维化(hepatic fibrosis)是因慢性肝损伤而导致的渐进性病理过程,可由肝炎、寄生虫、酒精等因素诱发。研究发现,肝细胞受损后释放多种细胞因子,包括转化生长因子-β(transforming growth factor-β,TGF-β)、血小板衍生生长因子(platelet derived growth factor,PDGF)等,激活肝星状细胞(hepatic stellate cells,HSCs)后导致胶原蛋白等细胞外基质(extracellular matrix,ECM)的合成与沉积,造成肝纤维化。因此,HSC是肝纤维化形成的细胞学基础,也是治疗的核心靶点之一[1-2]。
阻止肝纤维化是防治肝硬化和肝癌的重要措施[3],但由于目前尚无有效的临床药物,所以抗肝纤维化药物的研发受到了广泛关注[4-5]。中药柴胡指伞形科植物柴胡(又名北柴胡,Bupleurum chinense DC.)或狭叶柴胡(又名南柴胡,Bupleurum scorzonerifolium Willd.)的干燥根。以柴胡为君药的小柴胡汤被广泛用于多种肝病的临床治疗,如病毒性肝炎、肝纤维化和肝癌等[6-8]。Shimizu[9]证明小柴胡汤可减轻氧化应激和抑制HSC增殖,从而抑制肝纤维化发生。柴胡皂苷d(saikosaponin d,SSd)是柴胡的主要活性成份之一[10-11],可通过诱导凋亡和自噬作用抑制癌细胞的增殖[12-14]。李素婷等[15]报道SSd通过降低α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)含量,抑制HSC活化和酒精性肝纤维化发生;沈艳婷等[16]认为SSd通过雌激素受体β(ERβ)抑制转录激活蛋白-1(AP-1)和核因子NF-κB的表达而抑制HSC活化。本研究以TGF-β1诱导活化的大鼠肝星状细胞系(HSC-T6)为纤维化细胞模型,通过实时荧光定量聚合酶链反应(qRT-PCR)和流式细胞法等技术分析SSd对该细胞模型的作用效果,从而为中药柴胡的现代化应用提供支持。
1 实验部分 1.1 实验原料和仪器大鼠肝星状细胞系HSC-T6购自中国医学科学院肿瘤医院。
SSd(CAS:20874-52-6)购自上海阿拉丁生化科技股份有限公司(纯度≥98%);TGF-β1购自英国Abcam公司;CCK-8细胞增殖试剂盒、总蛋白含量检测试剂盒购自上海碧云天生物技术有限公司;FastKing RT反转录试剂盒(含gDNase)、培养细胞/细菌总RNA提取试剂盒购自天根生化科技(北京)有限公司;Fast SYBR Green Master Mix试剂盒购自美国Thermo Fisher公司;CellTiter-Glo®发光法细胞活力检测试剂盒购自美国Promega公司;Annexin V-FITC/PI凋亡检测试剂盒购自北京索莱宝科技有限公司。
Rotor-GeneQ qRT-PCR仪,德国Qiagen公司;MoFlo XDP高速流式细胞分选仪,美国Beckman Coulter公司;EnSpire多功能酶标仪,美国PerkinElmer公司;DL-CJ-2ND超净台,北京东联哈尔仪器制造有限公司;Forma 3110二氧化碳培养箱,美国Thermo Fisher公司。
1.2 实验方法 1.2.1 SSd母液制备称取1 mg SSd溶解于20 μL二甲基亚砜(DMSO),加入980 μL磷酸盐缓冲液(PBS,pH=7.4)混匀后备用。
1.2.2 HSC-T6培养、活化与增殖率检测细胞培养:使用含10%胎牛血清的DMEM高糖培养基,于37 ℃、5% CO2贴壁培养,每48 h更换培养基。细胞铺满培养皿底80%后使用0.25%胰酶消化传代。后续实验选择对数生长期细胞。
HSC-T6细胞以5 000个/孔接种于96孔板。TGF-β1溶于10 mmol/L柠檬酸(pH=3.0)配制成50 μg/mL母液。细胞培养24 h后去除培养基,用PBS清洗后换用无血清培养基。对照组不加药物,实验组加入TGF-β1或SSd+TGF-β1培养24 h。更换培养基,每孔加入100 μL CCK-8试剂,继续培养2 h后用酶标仪在450 nm波长下测得各复孔光密度值(OD)。通过式(1)计算细胞增殖率(PR)。
| $ PR = (O{D_{\rm{E}}} - O{D_{\rm{C}}})/O{D_{\rm{C}}} \times 100\% $ | (1) |
式中,ODE为实验组OD450均值,ODC为对照组OD450均值。
1.2.3 细胞凋亡分析细胞培养24 h后去除培养基,用PBS清洗后加入无血清培养基和TGF-β1或SSd+TGF-β1继续培养24 h。胰酶消化,800 r/min离心10 min,收集细胞。用预冷的PBS洗涤细胞3次,Binding Buffer洗涤1次。用Binding Buffer重悬细胞至1×106个/mL。取100 μL细胞悬液加入5 μL Annexin V-FITC混匀,室温避光孵育10 min。加入5 μL PI,室温避光孵育5 min后加入390 μL PBS混匀。用流式细胞仪检测,并使用Summit 5.2软件统计和分析数据。
1.2.4 qRT-PCR测定基因转录水平分离纯化细胞总RNA,经体外一步法反转录为cDNA。使用SYBR Green为荧光标记,以甘油醛-3-磷酸脱氢酶(GAPDH)或原癌基因abl-1为内参。每个样品设置3个重复。结果用2-ΔΔCT值法分析mRNA相对含量,并以对照组为1。qRT-PCR引物由苏州金唯智生物科技有限公司合成,序列如表 1所示。
| 下载CSV 表 1 qRT-PCR引物 Table 1 qRT-PCR primers |
使用Graphpad Prism 6软件进行数据分析与绘图,结果表示为x±SE。组间差异分析使用t检验:* P < 0.05,** P < 0.01,*** P < 0.001;n.s.,P>0.05,无显著性差异。重复数N≥3。
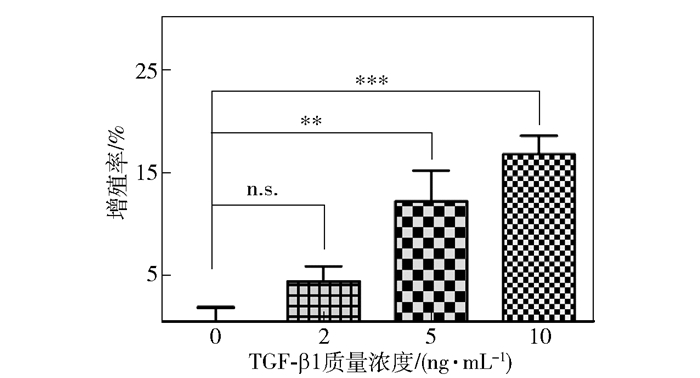
2 结果与讨论 2.1 SSd抑制活化HSC增殖TGF-β1是常用的促纤维化细胞因子,可以诱导HSC-T6细胞活化,表现为细胞增殖与纤维化相关基因表达[17]。为确定本研究中TGF-β1诱导建模的最优浓度,分别使用终质量浓度为2、5 ng/mL和10 ng/mL的TGF-β1处理细胞24 h,使用CCK-8染色法测定增殖率。图 1结果显示,TGF-β1浓度与HSC-T6增殖率呈正相关,且于5 ng/mL开始显著提高细胞增殖率(图 1,11.9%;图 2,11.8%)。
|
图 1 TGF-β1诱导HSC-T6增殖 Fig.1 TGF-β1 stimulates the proliferation of HSC-T6 |
|
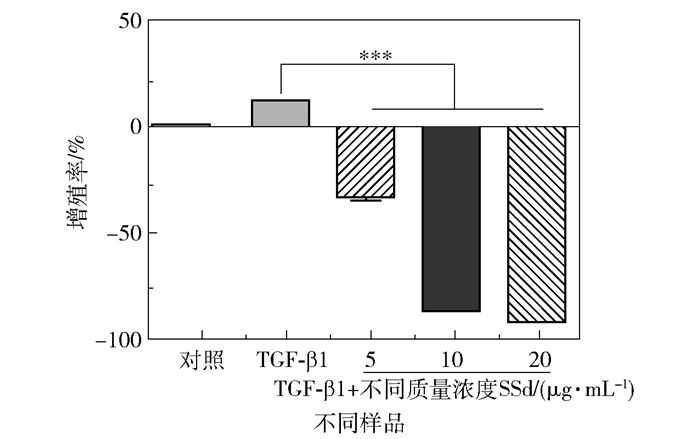
图 2 SSd抑制活化HSC-T6的增殖 Fig.2 SSd inhibits the proliferation of activated HSC-T6 |
将SSd母液稀释至终浓度为5、10 μg/mL和20 μg/mL,分别与5 ng/mL TGF-β1联合处理细胞。经24 h测定细胞增殖率如图 2,发现5 μg/mL SSd显著抑制了HSC-T6增殖(PR=-40.3%)。而10 μg/mL和20 μg/mL SSd浓度组的细胞死亡率分别达到88.4%和92.7%,证明高浓度SSd对HSC具有细胞毒性。由于文献报道中SSd作用于HSC的最优浓度及半数抑制浓度(IC50)均为4 μg/mL左右[18-20],所以本研究选择5 μg/mL SSd与5 ng/mL TGF-β1联合开展后续实验。
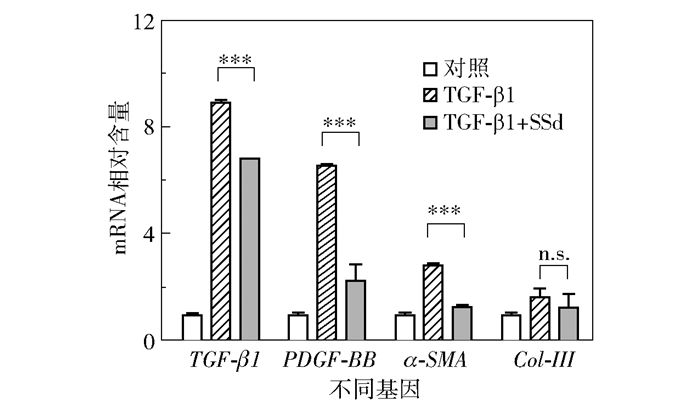
2.2 SSd抑制纤维化相关基因转录使用TGF-β1诱导HSC-T6 24 h后,采用qRT-PCR对胞内TGF-β1、PDGF、α-SMA和Col-III4种纤维化相关基因的mRNA含量进行测定。其中有丝分裂原PDGF能够促进活化HSC增殖分裂[21];α-SMA是HSC活化的主要标志;而Col-Ⅲ是肝纤维化ECM的主要成份之一。结果显示,与空白对照相比4种mRNA含量均有不同程度的上升,证明细胞活化程度增加(图 3)。并且TGF-β1诱导HSC-T6活化可能存在正反馈调节现象,即活化后的细胞会进一步增加TGF-β1的表达。与TGF-β1单独处理相比,SSd+TGF-β1处理显著降低TGF-β1、PDGF和α-SMA的mRNA含量,说明SSd具有抑制HSC-T6活化的作用。但是由于SSd不影响Col-III的mRNA含量,所以推测SSd不抑制ECM生成。
|
图 3 SSd抑制活化HSC-T6的纤维化相关基因转录 Fig.3 SSd inhibits the transcription of the fibrosis related genes of activated HSC-T6 |
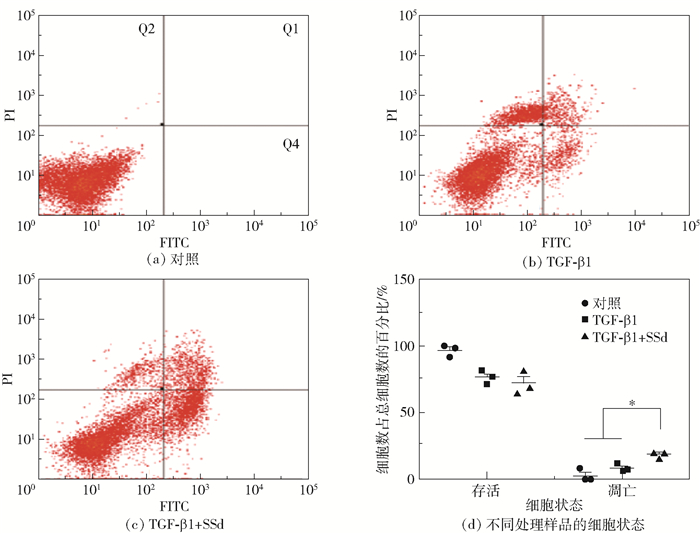
使用TGF-β1或SSd+TGF-β1处理HSC-T6,24 h后采用流式细胞技术分析细胞凋亡情况。结果如图 4所示,SSd能够显著增加早期凋亡的细胞比率(Q4),而单独TGF-β1处理则增加细胞坏死比率(Q2)。两种处理条件下晚期凋亡细胞(Q1)所占比例差别不显著。
|
图 4 SSd诱导活化HSC-T6凋亡 Fig.4 SSd induces apoptosis of activated HSC-T6 |
为探究SSd诱导HSC-T6凋亡的分子机制,使用qRT-PCR检测胞内bad、bax和cas-3 3种促凋亡基因的mRNA水平。尽管SSd+TGF-β1处理组与空白对照组没有统计学差异(图 5,P>0.05),但是SSd仍然表现出增强促凋亡基因转录的趋势。结合流式细胞分析数据,上述结果表明SSd通过激活cas-3凋亡信号通路诱导HSC发生凋亡。
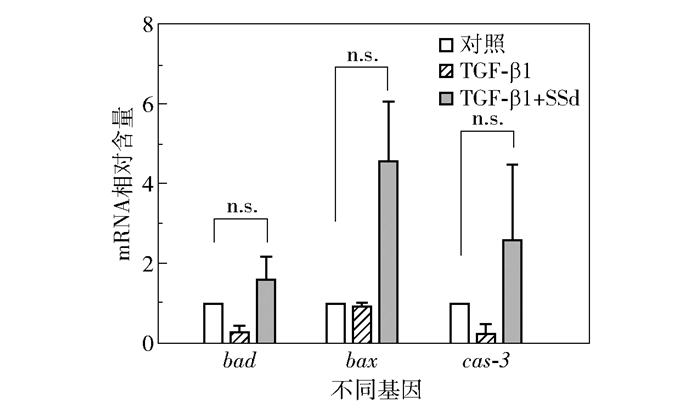
|
图 5 SSd上调促凋亡基因转录水平 Fig.5 SSd up-regulates the transcription of proapoptotic genes |
线粒体功能异常是导致细胞凋亡的重要原因[22],有文献报道SSd能够影响线粒体正常功能并引发HSC凋亡[23]。使用CellTiter-Glo®发光法细胞活力检测试剂盒测定胞内ATP相对含量(将ATP含量与蛋白质浓度的比值进行归一化)分析线粒体状态,结果显示,TGF-β1单独处理不影响ATP相对含量,但SSd+TGF-β1共同处理显著降低了ATP浓度(图 6)。因此,SSd可能会抑制线粒体的能量代谢,这是诱导HSC凋亡的另一原因。
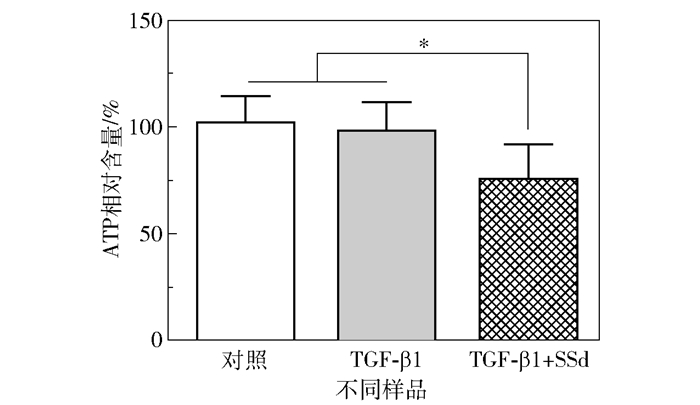
|
图 6 SSd下调活化HSC-T6胞内ATP含量 Fig.6 SSd down-regulates the ATP level in activated HSC-T6 |
综上所述,5 μg/mL SSd能够抑制HSC-T6活化增殖和纤维化相关基因的转录,并且诱导细胞发生凋亡。SSd的作用性质同在研的抗肝纤维化药物相一致,如广谱抗纤维化药物吡非尼酮(pirfenidone)可以降低TGF-β1表达[24];恩利卡生(emricasan)可以抑制caspase活性和HSC活化[25]。在四氯化碳(CCl4)诱导建立的肝纤维化大鼠模型中,多种实验方案均能够抑制HSC活化增殖或诱导活化HSC凋亡[26-28],其中聚乙二醇化肿瘤坏死因子相关凋亡诱导配体(PEGylated TRAIL)治疗能够抑制α-SMA表达;针灸联合姜黄素能有效抑制PDGF产生。由此可见,SSd具有治疗肝纤维化的潜在临床价值。需要注意的是高浓度SSd对HSC具有明显的细胞毒性,因此要对药物安全性进行充分评估。
3 结论柴胡皂苷d(SSd)在体外可以抑制HSC活化和增殖,降低纤维化相关基因的转录水平。同时SSd能够诱导活化HSC发生凋亡,其可能的机制包括激活cas-3介导的凋亡通路和影响线粒体能量代谢两条途径。因此,基于SSd对HSC的作用效果开发抗肝纤维化药物具有较大的潜力。本研究为中药柴胡的现代化应用提供了支持。
| [1] |
BATALLER R, BRENNER D A. Hepatic stellate cells as a target for the treatment of liver fibrosis[J]. Seminars in Liver Disease, 2001, 21(3): 437-451. DOI:10.1055/s-2001-17558 |
| [2] |
黄小莉, 刘莹莹, 丛敏. 以肝星状细胞为靶向的药物载体系统[J]. 临床肝胆病杂志, 2020, 36(1): 208-212. HUANG X L, LIU Y Y, CONG M. Research advances in drug carrier systems targeting hepatic stellate cells[J]. Journal of Clinical Hepatology, 2020, 36(1): 208-212. (in Chinese) |
| [3] |
LI H. Advances in anti hepatic fibrotic therapy with traditional Chinese medicine herbal formula[J]. Journal of Ethnopharmacology, 2020, 251: 112442. DOI:10.1016/j.jep.2019.112442 |
| [4] |
石项天, 欧阳晓晖, 苏秀兰. 抗肝纤维化药物治疗研究进展[J]. 医学综述, 2019, 25(3): 480-484, 489. SHI X T, OUYANG X H, SU X L. Research progress of anti-hepatic fibrosis drug treatment[J]. Medical Recapitulate, 2019, 25(3): 480-484, 489. (in Chinese) |
| [5] |
张文东, 王瑞范, 吴会敏, 等. 抗肝纤维化药物研发进展[J]. 药学学报, 2018, 53(5): 667-675. ZHANG W D, WANG R F, WU H M, et al. Research progress in drugs for anti-hepatic fibrosis[J]. Acta Pharmaceutica Sinica, 2018, 53(5): 667-675. (in Chinese) |
| [6] |
侯飞, 杨志贤, 李浩宇, 等. 小柴胡汤治疗肿瘤的研究进展[J]. 中医药导报, 2019, 25(20): 119-121. HOU F, YANG Z X, LI H Y, et al. Research progress of Xiaochaihu Decoction in the treatment of tumors[J]. Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2019, 25(20): 119-121. (in Chinese) |
| [7] |
王玉芝. 小柴胡汤治疗肝病的临床研究[J]. 中成药, 2000, 22(4): 296-298. WANG Y Z. Clinical study on Minor Bupleurum Decoction for liver disease[J]. Chinese Traditional Patent Medicine, 2000, 22(4): 296-298. (in Chinese) |
| [8] |
汪菊兰. 小柴胡汤治疗肝病的临床研究概况[J]. 医药导报, 2000, 19(5): 488. WANG J L. Overview of clinical research on Xiaochaihu Decoction in the treatment of liver diseases[J]. Herald of Medicine, 2000, 19(5): 488. (in Chinese) |
| [9] |
SHIMIZU I. Sho-saiko-to:Japanese herbal medicine for protection against hepatic fibrosis and carcinoma[J]. Journal of Gastroenterology and Hepatology, 2000, 15(Suppl.): D84-D90. |
| [10] |
史青, 聂淑琴, 黄璐琦. 柴胡属植物化学成分及药理研究新进展[J]. 中国实验方剂学杂志, 2002, 8(5): 53-56. SHI Q, NIE S Q, HUANG L Q. New progression of chemical component and pharmacological studies of Radix Bupleuri[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2002, 8(5): 53-56. (in Chinese) |
| [11] |
吕晓慧, 孙宗喜, 苏瑞强, 等. 柴胡及其活性成分药理研究进展[J]. 中国中医药信息杂志, 2012, 19(12): 105-107. LV X H, SUN Z X, SU R Q, et al. Progress in pharmacological research of Radix Bupleuri and its active components[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2012, 19(12): 105-107. (in Chinese) |
| [12] |
吴勤祥, 李好朝, 乔泽强, 等. 柴胡皂苷D对人肝癌HepG2细胞系增殖和裸鼠肝癌形成的抑制作用[J]. 中国免疫学杂志, 2018, 34(11): 1664-1668. WU Q X, LI H C, QIAO Z Q, et al. Inhibition of saikosaponin D on cell proliferation of HepG2 cells and tumor growth of liver cancer[J]. Chinese Journal of Immunology, 2018, 34(11): 1664-1668. (in Chinese) |
| [13] |
王宗明, 王敏, 肖欢智. 柴胡皂苷D通过调控mTORC信号通路诱发肝癌细胞自噬的作用研究[J]. 中国药学杂志, 2018, 53(19): 1652-1657. WANG Z M, WANG M, XIAO H Z. Effect and mechanism of saikosaponin D on autophagy by regulating mTORC pathway in human hepatocellular carcinoma cells[J]. Chinese Pharmaceutical Journal, 2018, 53(19): 1652-1657. (in Chinese) |
| [14] |
王维, 李海林, 韩光宁, 等. 柴胡皂苷d在肝癌模型大鼠体内的药效学评价[J]. 中国临床药理学杂志, 2015, 31(20): 2027-2030. WANG W, LI H L, HAN G N, et al. Efficacy evaluation of saikosaponin d in treatment of hepatoma model ratin vivo[J]. The Chinese Journal of Clinical Pharmacology, 2015, 31(20): 2027-2030. (in Chinese) |
| [15] |
李素婷, 杨鹤梅, 齐洁敏, 等. 柴胡皂苷-d对酒精性肝纤维化大鼠星形细胞活化的影响[J]. 时珍国医国药, 2008, 19(8): 1897-1898. LI S T, YANG H M, QI J M, et al. Effects of saikosaponin-d on the activation of hepatic stellate cells[J]. Lishizhen Medicine and Materia Medica Research, 2008, 19(8): 1897-1898. (in Chinese) |
| [16] |
沈艳婷, 刘进锴, 阙任烨, 等. 柴胡皂苷d对氧化应激诱导的HSC-T6活化细胞内AP-1、NF-κB表达的影响及其雌激素受体机制[J]. 江苏中医药, 2015, 47(12): 81-84. SHEN Y T, LIU J K, QUE R Y, et al. Effect of saikosaponin d on the expression of AP-1 and NF-κB in HSC-T6 activated cells induced by oxidative stress and its estrogen receptor mechanism[J]. Jiangsu Journal of Traditional Chinese Medicine, 2015, 47(12): 81-84. (in Chinese) |
| [17] |
徐明翠, 张峰, 诸葛宇征. 肝纤维化发生发展机制的研究现状[J]. 临床肝胆病杂志, 2016, 32(9): 1806-1809. XU M C, ZHANG F, ZHUGE Y Z. Current research status of mechanisms of the development and progression of liver fibrosis[J]. Journal of Clinical Hepatology, 2016, 32(9): 1806-1809. (in Chinese) |
| [18] |
林柳兵, 刘进锴, 阙任烨, 等. 柴胡皂苷d对肝星状细胞ERα和ER β mRNA水平的调节[J]. 中药药理与临床, 2016, 32(1): 35-39. LIN L B, LIU J K, QUE R Y, et al. Regulation of saikosaponin-d on levels of ER α, ER β mRNA in rat hepatic stellate cells[J]. Pharmacology and Clinics of Chinese Materia Medica, 2016, 32(1): 35-39. (in Chinese) |
| [19] |
陈懿榕, 阙任烨, 刘进锴, 等. 柴胡皂苷d对肝星状细胞内雌激素受体转录激活的影响[J]. 广州中医药大学学报, 2017, 34(4): 550-555. CHEN Y R, QUE R Y, LIU J K, et al. Effects of saikosaponin-d on transcriptional activation of estrogen receptor in rat hepatic stellate cells[J]. Journal of Guangzhou University of Traditional Chinese Medicine, 2017, 34(4): 550-555. (in Chinese) |
| [20] |
张成刚, 闫凛, 陈诚, 等. 柴胡皂苷d对大鼠肝星状细胞收缩性的影响[J]. 上海中医药大学学报, 2018, 32(6): 61-65. ZHANG C G, YAN L, CHEN C, et al. Effects of saikosaponin d on contractility of rat hepatic stellate cells[J]. Academic Journal of Shanghai University of Traditional Chinese Medicine, 2018, 32(6): 61-65. (in Chinese) |
| [21] |
DOBIE R, CONNELLY J, HENDERSON N C. PDGF-mediated regulation of liver fibrosis[J]. Current Pathobiology Reports, 2015, 3(4): 225-233. DOI:10.1007/s40139-015-0096-9 |
| [22] |
CAO L, QUAN X B, ZENG W J, et al. Mechanism of hepatocyte apoptosis[J]. Journal of Cell Death, 2016, 9: 19-29. |
| [23] |
CHEN M F, HUANG S J, HUANG C C, et al. Saikosaponin d induces cell death through caspase-3-dependent, caspase-3-independent and mitochondrial pathways in mammalian hepatic stellate cells[J]. BMC Cancer, 2016, 16: 532. DOI:10.1186/s12885-016-2599-0 |
| [24] |
FLORES-CONTRERAS L, SANDOVAL-RODRIGUEZ A S, MENA-ENRIQUEZ M G, et al. Treatment with pirfenidone for two years decreases fibrosis, cytokine levels and enhances CB2 gene expression in patients with chronic hepatitis C[J]. BMC Gastroenterology, 2014, 14: 131. DOI:10.1186/1471-230X-14-131 |
| [25] |
BARREYRO F J, HOLOD S, FINOCCHIETTO P V, et al. The pan-caspase inhibitor Emricasan (IDN-6556) decreases liver injury and fibrosis in a murine model of non-alcoholic steatohepatitis[J]. Liver International, 2015, 35(3): 953-966. DOI:10.1111/liv.12570 |
| [26] |
OH Y, PARK O, SWIERCZEWSKA M, et al. Systemic PEGylated TRAIL treatment ameliorates liver cirrhosis in rats by eliminating activated hepatic stellate cells[J]. Hepatology, 2016, 64(1): 209-223. DOI:10.1002/hep.28432 |
| [27] |
ZHANG X P, ZHANG F, ZHANG Z L, et al. Acupuncture combined with curcumin disrupts platelet-derived growth factor β receptor/extracellular signal-regulated kinase signalling and stimulates extracellular matrix degradation in carbon tetrachloride-induced hepatic fibrosis in rats[J]. Acupuncture in Medicine, 2012, 30(4): 324-330. DOI:10.1136/acupmed-2012-010167 |
| [28] |
PENG Y, HUANG K, SHEN L, et al. Cultured mycelium Cordyceps sinensis alleviates CCl4-induced liver inflammation and fibrosis in mice by activating hepatic natural killer cells[J]. Acta Pharmacologica Sinica, 2016, 37(2): 204-216. DOI:10.1038/aps.2015.129 |








