随着全球经济的高速发展以及化石能源的日益匮乏,可再生能源及化学品的生产受到了极大的关注[1]。微生物技术是一种生产能源和化学产品的重要途径,随着人们对微生物领域认识的不断加深,能够实现有机废弃物循环利用的新型生物技术逐渐成为一大研究热点。与化学工艺(如费托合成)相比,新型生物技术具有操作简单、能量消耗少、经济性高和环境可持续性好等优点[2]。其中,厌氧发酵技术以其高负荷、低能耗、低运行成本和产生能源等优点逐渐成为一种替代传统填埋和焚烧的废弃物处理方式[3]。在厌氧微生物的作用下,有机废弃物首先转化为中间产物,包括短链的挥发性脂肪酸(volatile fatty acid,VFA,如乙酸和丙酸)、乳酸、氢气(H2)等,这些中间产物能够被进一步转化为富含甲烷(CH4)的沼气[3]。很多学者指出,甲烷的热值较低(55 MJ/kg)且储存和运输成本高,只能在一定程度上缓解日益严峻的能源危机[4-5]。为了获得更好的经济效益,一些研究选择将VFAs/乙醇作为厌氧发酵的最终产物。但如何高效、经济地从水溶液中分离出高亲水性的VFAs/乙醇仍然是一项重大挑战。相比之下,具有更高疏水性的中链脂肪酸(medium chain fatty acid, MCFA,如己酸和辛酸)便更具有吸引力。
研究表明,基于厌氧发酵系统的微生物可以将VFAs作为电子受体,通过碳链延长途径合成具有更高价值的MCFAs[6-7]。MCFAs是具有6~12个碳原子的一元直链羧酸,能够用于制造动物饲料添加剂、食品添加剂、制药工艺的抗菌剂、植物生长促进剂、香料和药物[8-9]。目前,MCFAs主要来源于化石燃料或天然油料,但这种生产方式成本较高,限制了MCFAs的广泛应用。利用厌氧发酵系统将有机废弃物(如城市固体废弃物、农作物秸秆和厨余垃圾)转化为MCFAs不仅成本低、可再生性强,还能避免生产原料与人类生产生活发生竞争[10]。MCFAs的经济价值和能量密度均高于CH4、H2和VFAs,更长的碳链使得MCFAs疏水性更强,这使得一定浓度的MCFAs会以油状液体的形式浮于反应溶液表面,能够直接从液体表面分离提取[6]。对比现有技术,传统的化工合成过程通常需要高温高压,而厌氧微生物发酵过程能够在常温常压下合成MCFAs。此外,厌氧发酵不需要各种性质复杂的化合物,可以直接利用来源丰富的乙醇或乳酸等含碳化合物作为能量来源和底物用于产物的合成。尽管生物催化比化学催化的转化速率慢,但是能耗和设备成本低、生物酶的选择性高、副产物少、对污染物具有一定的耐受性,因而微生物催化转化技术具有重要的研究价值及意义[11]。
在VFAs实现碳链延长制取MCFAs的过程中,乙酰辅酶A是逆β氧化循环重要的中间体,也是合成细胞物质(包括氨基酸、核苷酸和脂类化合物)的理想前驱体。电子供体和电子受体是碳链延长必不可少的两个重要部分。一般来说,电子供体是碳链延长发生的先决条件。电子供体通过自身氧化形成乙酰辅酶A,为碳链延长过程提供能量和还原当量。乙酰辅酶A与电子受体在微生物的作用下结合,在经过一系列酶作用后完成一次碳链延长循环。每次循环结束后电子受体的碳链增加两个碳原子[8, 12]。电子供体的类型和性质将直接影响最终产物的产量、产率和类型。因此,选择合适的电子供体是实现碳链延长的重要保障。Claassens等[13]提出了一套可用于微生物固碳的电子供体选择标准:1)来源丰富与可持续性;2)具有适合的氧化还原电位(E°′),其中,理想电子供体的E°′小于-400 mV;3)具有较好的溶解性、扩散性,便于储存与运输;4)供体的快速酶利用;5)对微生物毒性低,无环境危害;6)能适用于微生物;7)能够使用成本低、产量高的反应器生产。这些标准也可以作为碳链延长电子供体选择的参考标准。目前,本课题组已经利用混合厌氧菌群实现了合成气(CO和H2)和有机废水转化为VFAs和MCFAs的生物合成过程,并结合宏组学(宏基因组学、宏蛋白组学等)以及实时荧光定量核酸扩增检测(q-PCR)分析等技术揭示了合成气与有机废水制取VFAs和MCFAs的代谢途径和功能微生物[11, 14-18]。
乙醇和乳酸是目前研究最为广泛的电子供体,也有文献利用CO、H2、甲醇、甘油和糖类等作为电子供体实现碳链延长以制取MCFAs[19-21]。本综述将着重介绍几种常用的电子供体,阐明不同电子供体进行碳链延长的作用机制以及该过程中的功能微生物,并对厌氧微生物碳链延长技术的发展做出展望。
1 乙醇作为电子供体的反应机理及研究现状乙醇是在碳链延长方面已有较多研究的一种电子供体。乙醇本身是一种清洁能源, 能够与水完全混溶,在生物燃料工业中通常采用蒸馏的方式获得。但有机废弃物中的乙醇含量普遍很低,不适合采用蒸馏这种昂贵的方式进行回收。如果将乙醇通过碳链延长转化为易于从水中分离的MCFAs,不仅能够减少蒸馏过程中的燃料消耗,还能够获得更高的经济效益:在微生物厌氧发酵体系中,微生物每生成1 mol己酸需要大约2 mol乙醇,而经碳链延长获得的己酸的价格(6 000~10 000美元/吨)远高于生产所需的乙醇的价格(500~1 000美元/吨)[22]。
1.1 乙醇作为电子供体实现碳链延长的机理早期研究中发现克氏梭状芽胞杆菌(Clostridium kluyveri)能够利用乙醇和乙酸生产己酸[23]。随着研究的不断深入,研究者们建立了基于C. kluyveri的碳链延长模型。如图 1所示,碳链延长过程包括电子供体氧化和逆β氧化循环两个部分。当乙醇作为电子供体时,乙醇首先氧化为乙醛,并在乙醛脱氢酶的作用下转化为乙酰辅酶A。此后,约1/6的乙酰辅酶A转化为乙酸,通过底物水平磷酸化以三磷酸腺苷(ATP)的形式为碳链延长过程提供初始能量[24]。剩余的乙酰辅酶A则进入逆β氧化循环。以乙酸延伸到丁酸的过程为例,乙酰辅酶A先与另一个辅酶A衍生物偶联形成增加了两个碳的乙酰乙酰辅酶A,再经过一系列的酶促反应获得丁酰辅酶A。丁酰辅酶A将辅酶A转移到乙酸上从而获得丁酸和乙酰辅酶A。释放的乙酰辅酶A与乙醇氧化提供新的乙酰辅酶A,再次进行逆β氧化循环。目前,由乙醇、乳酸和甲醇等电子供体引导的碳链延长过程主要在电子供体的氧化步骤上存在差异,而逆β氧化循环的步骤是相似的[8-9, 20]。
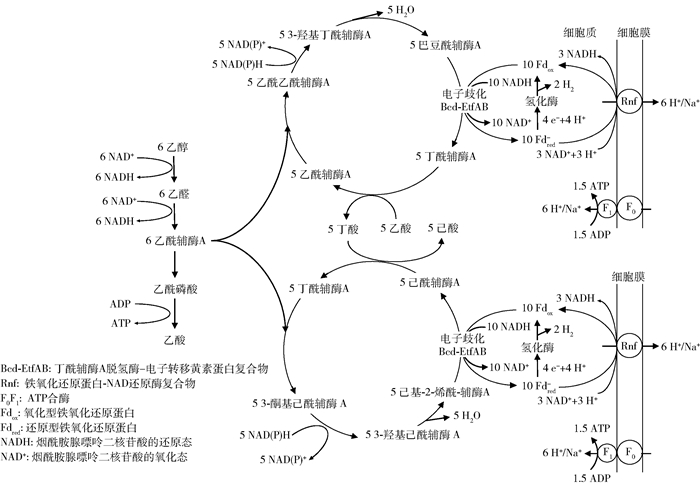
|
图 1 乙醇作为电子供体将乙酸碳链延长为正己酸的代谢途径[6-7] Fig.1 The metabolic pathway of ethanol as an electron donor to extend acetic acid to n-caproic acid[6-7] |
在标准条件下(101.325 kPa,25 ℃),乙醇作为电子供体的碳链延长过程中涉及的主要反应方程式见表 1。反应式(1)表示乙醇氧化途径,反应式(2)~(6)表示乙醇对VFAs的碳链延长。此外,反应式(7)~(11)是羧酸在碳链延长体系中可能发生的氧化反应,在反应过程中应尽量避免发生。
| 下载CSV 表 1 乙醇作为电子供体时主要反应方程式[25] Table 1 The main reaction equations for ethanol as an electron donor[25] |
C. kluyveri是在以乙醇为电子供体的纯菌研究中使用最多且碳链延长效果最好的菌株,最早从大型食草动物瘤胃和河道污泥中分离获得[23]。一般来说,C. kluyveri主要使用乙醇和乙酸作为底物并获得丁酸、己酸和H2。Kenealy等[26]确定了C. kluyveri的最适生长pH值,该值与CO2(H2CO3)和HCO3-的酸度系数(6.3)接近,确保了C. kluyveri能够以CO2为生长营养物。另外,C. kluyveri会因为电子供体与电子受体的组合不同而得到不同产物。如Coma等[25]发现丙醇与乙酸的组合获得了丙酸和戊酸。
早期对于碳链延长的研究主要集中在C. kluyveri等特定菌株的碳链延长上,获得了这些细菌菌株进行碳链延长的最适生长条件。近年来,为了降低生产工艺对特定菌株的依赖并提高系统稳定性,研究人员开始倾向于在混合培养微生物反应器中进行碳链延长。相比于纯培养的反应器,混合培养反应器不需要严格的灭菌,稳定性更强,而且能够处理成分更加复杂的底物。表 2总结了部分文献中的主要功能微生物。可以发现,虽然C. kluyveri在混合培养反应器中发挥着关键作用,但在混合培养反应器中往往表现出一定的优势。例如Weimer等[27]使用C. kluyveri与瘤胃细菌混合培养,缩短了碳链延长时间并提高了己酸产量。此外,还发现脱硫芽孢弯曲菌(Desulfosporosinus meridiei)、颤螺旋菌属(Oscillospira spp.)、伯克氏菌属(Burkholderia spp.)和许多未鉴别菌株都在混合培养的碳链延长中发挥着重要作用[28-29]。这些菌株的最适pH值和最适温度都有一定区别,但绝大部分实验认为pH=7和30 ℃是最适宜的MCFAs生产条件,这与C. kluyveri的最适温度(34 ℃)与pH值都比较接近。
| 下载CSV 表 2 乙醇作为电子供体时的MCFAs产量和其他参数 Table 2 MCFAs yields and other parameters when ethanol is used as the electron donor |
表 2总结了部分文献报道中,使用乙醇作为电子供体的厌氧微生物碳链延长反应器的运行方式与条件参数。pH值是乙醇碳链延长的一个重要的影响参数。首先,pH值会影响微生物的生长。San-Valero等[30]比较了不同pH值下C. kluyveri进行碳链延长的过程,并在pH=7.5下获得了最高微生物生长量和正己酸产量。一般认为,无论是纯菌还是混菌发酵体系,pH值接近7的中性环境都是乙醇碳链延长适宜的条件[7]。对于混菌发酵体系,降低pH值还有利于抑制产甲烷菌的活性,减少抑菌剂的添加[6]。但较低的pH值会导致MCFAs的毒性增强。这是因为MCFAs在水中的溶解度比VFAs的溶解度更低,在低pH值环境下,更多的MCFAs会以油状液体的形式浮于液体表面,这些未解离的MCFAs对微生物具有毒性,少量的积累便会导致功能细菌无法正常生长和代谢,电子供体的氧化和逆β氧化循环过程停止[12, 31]。例如Ge等[24]在利用乙醇进行碳链延长的实验中认为,己酸发生严重抑制的最大未解离浓度仅为7.5 mmol/L(30 ℃,pH=5.5);但他们也充分利用MCFAs溶解度降低的特点,在低pH值条件下加装在线膜萃取,不仅能够保证反应器中的己酸浓度低于估算的MCFAs抑制阈值,还获得了可观的产量。目前,很多研究认为采用更低的pH值(pH≈5.5)来降低MCFAs的溶解度并加装在线提取装置的生产策略是未来实现MCFAs商业化生产最具有前景的一种方式[12]。
热力学计算和模型能够帮助判断碳链延长的可行性、反应条件、产物比例等。González-Cabaleiro等[32]提出的热力学模型不仅能够证明乙酸和乙醇进行碳链延长的动力学和生理学可行性,也能够识别生物反应器在不同操作条件下的反应瓶颈。Angenent等[6]开发了化学计量模型,能够以乙酸和乙醇的初始物质的量比与负荷来计算最终产物中正丁酸、正己酸、H2和ATP的形成。例如在标准状态下低浓度和高浓度乙醇与乙酸生产正丁酸的发酵过程如反应式(12)和(13)所示。
低浓度:
| $ \begin{array}{r} 5 \mathrm{C}_{2} \mathrm{H}_{6} \mathrm{O}+3 \mathrm{C}_{2} \mathrm{H}_{3} \mathrm{O}_{2}^{-} \longrightarrow 4 \mathrm{C}_{4} \mathrm{H}_{7} \mathrm{O}_{2}^{-}+\mathrm{H}^{+}+2 \mathrm{H}_{2}+ \\ 3 \mathrm{H}_{2} \mathrm{O}(+1 \mathrm{ATP}) \end{array} $ | (12) |
高浓度:
| $ \begin{array}{r} 6 \mathrm{C}_{2} \mathrm{H}_{6} \mathrm{O}+4 \mathrm{C}_{2} \mathrm{H}_{3} \mathrm{O}_{2}^{-} \longrightarrow 5 \mathrm{C}_{4} \mathrm{H}_{7} \mathrm{O}_{2}^{-}+\mathrm{H}^{+}+2 \mathrm{H}_{2}+ \\ 4 \mathrm{H}_{2} \mathrm{O}(+2.5 \mathrm{ATP}) \end{array} $ | (13) |
在热力学计算模型的帮助下,一些实验中发现电子供体与电子受体的比例会影响产物的类型与产量。Leng等[21]发现更高的乙醇与乙酸的物质的量比,即更充足的电子供体能够释放的吉布斯自由能总量更多,但单个电子转移平均所能获得的吉布斯自由能并非一直升高。他们通过实验分析与热力学计算认为乙醇与乙酸的最佳物质的量比应保持在3:1左右,此时每个电子转移所能获得的吉布斯自由能最高。这一比例对实现电子供体的高效利用和获得最佳产率具有指导性的意义。除优化产率外,当乙醇与乙酸的物质的量比低于2:1时,最终产物倾向于获得丁酸[7]。当物质的量比高于2:1时,按照反应方程推算乙酸将完全消耗,剩余的乙醇则可以将丁酸进一步延长为己酸[28]。Kucek等[28]甚至通过更高的比值获得了大量辛酸,但要获得碳链更长的MCFAs(如癸酸)依然是微生物碳链延长的一大瓶颈。目前,即使在使用在线提取的系统中,还没有获得10个碳以上的MCFAs。
以乙醇为电子供体实现碳链延长制备MCFAs的工艺仍存在一些挑战。首先,高浓度乙醇(200~400 mmol/L)对微生物具有毒性,需要被稀释才能使用[6]。尽管连续反应器能够在保持低浓度乙醇的情况下获得高效稳定的MCFAs产量,但乙醇浓度的降低势必会牺牲MCFAs产量[29]。其次,当乙醇作为电子供体时,生产MCFAs的微生物需要持续的外源CO2补充来合成蛋白质[41]。Jungermann等[42]在使用C. kluyveri生产正己酸的研究中,发现同化到生物质中的碳有30%是由CO2衍生而来。同时,Roghair等[43]认为CO2负荷是碳链延长体系重要的控制参数。他们发现高CO2负荷会刺激过量乙醇氧化,并在高CO2负荷(2.5 L/(L·d))下获得10.8 g/(L·d)的高己酸盐产量,而在低CO2负荷(0.5 L/(L·d))下仅获得2.9 g/(L·d)的己酸。目前,补充CO2的方式主要是添加碳水化合物或引入CO2,但很多研究认为这两种方式都不经济。最后,乙醇的来源是实现碳链延长技术商业化应用的一个重要瓶颈。由于乙醇本身就是一种清洁能源,直接使用商业乙醇作为电子供体不具有经济可行性。因此,如何充分利用有机废弃物中的剩余乙醇或从废弃物中原位生产乙醇用于碳链延长成为一个研究重点。
实验室通常选择纯物质来探索碳链延伸的最佳运行参数,但对实际有机废弃物的研究具有更大的实用价值。酒精发酵工业的废水中普遍残留了低浓度的乙醇,玉米发酵废液、甘蔗汁发酵尾料、啤酒和白酒生产废水等乙醇含量相对较高的原料已经被大量应用于MCFAs的生产[24]。此外,一些富含碳水化合物的复杂底物,如餐厨垃圾和污水污泥,也可以在水解和发酵过程中获得VFAs和其他碳链延伸所需的前驱体(如表 2中的OFMSW)。
2 乳酸作为电子供体的反应机理及研究现状研究人员发现,当复杂发酵底物中含有高浓度易降解底物时,乳酸往往是初级发酵的主要产物[44]。这些底物中丰富的乳酸也能够作为电子供体应用于MCFAs的生产,有些研究甚至发现乳酸在与乙醇作为混合电子供体时表现出优于单独一种电子供体作用的效果[45-46]。乳酸作为一种广泛应用于MCFAs生产的电子供体,在碳链延长途径、MCFAs产量和产物分布等方面均与乙醇有很大的不同。
2.1 乳酸作为电子供体实现碳链延长的机理乳酸作为电子供体引导碳链延长时,除氧化为乙酰辅酶A的过程和乙醇存在差异外,它们的逆β氧化循环步骤是相似的[7]。图 2为乳酸引导的逆β氧化循环过程,主要分为3个步骤:1)乳酸首先在乳酸脱氢酶的作用下氧化为丙酮酸,如果考虑乳酸的异构体,L-乳酸首先在乳酸消旋酶的作用下异构化为D-乳酸,然后在D-乳酸脱氢酶的作用下形成丙酮酸[45];2)丙酮酸进一步氧化为乙酰辅酶A,并在丙酮酸脱氢酶作用下释放等物质的量的CO2和ATP合成酶,再转化为乙酰辅酶A(表 3,反应式(14));3)一部分乙酰辅酶A氧化为乙酸,剩余的乙酰辅酶A进入逆β氧化循环实现最终的碳链加长。值得注意的是,一部分乳酸可能会形成乳酰辅酶A作为中间产物,经由丙烯酰基辅酶A转化为丙酸(反应式(15)),这被称为丙烯酸酯途径。这是一种不可逆的途径,一旦达到氧化还原平衡便会持续产生丙酰辅酶A,并导致产物中出现大量丙酸。当丙酸积累到一定浓度后,还会以电子受体的角色参与乳酸作用的碳链延长,形成戊酸、庚酸等奇数碳MCFAs,并在最终产物中占有不可忽略的比例[45]。
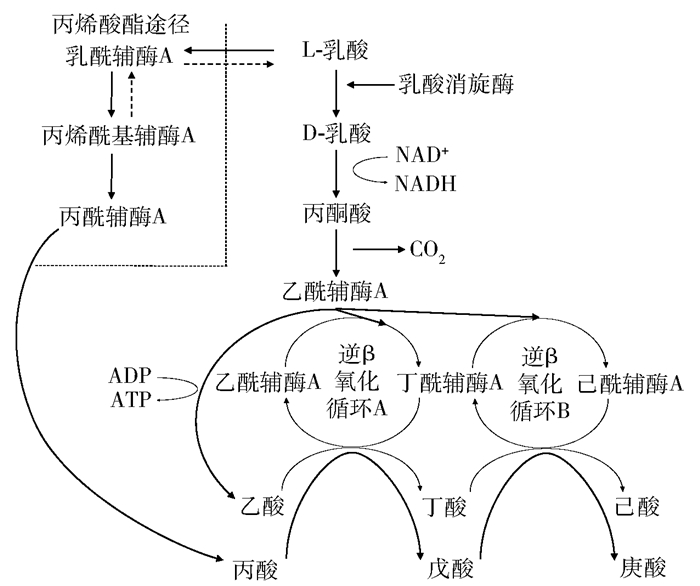
|
图 2 乳酸作为电子供体的碳链延长代谢途径[45] Fig.2 The chain elongation pathway for lactic acid as an electron donor[45] |
| 下载CSV 表 3 乳酸作为电子供体时的主要反应方程式[46] Table 3 The main reaction equations for lactic acid as an electron donor[46] |
埃氏巨球形菌(Megasphaera elsdenii)是一种最初从绵羊瘤胃中分离出来的菌株,可以将包括乳酸、葡萄糖、果糖和乳酸在内的多种碳源转化为VFAs和正己酸,在pH值低于5.5的酸性条件下具有独特的耐受性,在pH=4.7时依然能够代谢乳酸[45]。过去的很长一段时间中,M. elsdenii被认为是唯一能够将乳酸转化为正己酸的微生物[47-48]。Weimer等[48]发现当基质中同时存在乳酸和葡萄糖时,M. elsdenii会优先利用乳酸并产生丙酸和乙酸,但几乎没有发生碳链延长。考虑到乳酸作为电子供体会存在丙烯酸酯途径的特点,Yoshikawa等[49]从猪粪中分离出能够以戊酸为主要产物的M. elsdenii菌株。Zhu等[50]则提出M. elsdenii某些基因的缺失可能会影响丙烯酸酯途径相关酶的活性,并可以实现对MCFAs选择性的控制。随着混合培养发酵技术的发展,梭菌属Clostridium Ⅵ[51]、瘤胃球菌科(Ruminococcaceae)的细菌CPB6[50]和不动杆菌属(Acinetobacter spp.)[45]也被发现在一些乳酸引导的碳链延长体系中发挥着重要作用。表 4总结了部分文献中乳酸作为电子供体的主要功能微生物的类型或所属菌科,以乳酸为电子供体的混合培养群落结构还有待进一步探究。
| 下载CSV 表 4 乳酸作为电子供体的MCFAs产量和其他参数 Table 4 MCFAs yields and other parameters when lactic acid is used as an electron donor |
Marounek等[52]在1989年发现乳酸可以形成乙酰辅酶A并经由逆β氧化过程形成正丁酸和正己酸。但在早期的研究中只能产生微量的正己酸,所以很长一段时间都未将乳酸作为生产MCFAs的底物[48, 52-53]。随着反应条件的调整以及更多能够代谢乳酸的微生物的发现,乳酸逐渐发展为碳链延长的一种重要的电子供体[53]。
与乙醇相比,乳酸作为电子供体的优势在于能够添加更高的浓度却不会对微生物产生毒性抑制,并且不用补充外源CO2。但是乳酸的使用也存在挑战:1)碳源会以CO2的形式分流;如图 2所示,在乳酸氧化为丙酮酸再形成乙酰辅酶A的必经过程中,有1/3的碳会以CO2的形式释放并造成碳源的损失,最终造成MCFAs的产量降低;2)丙烯酸酯途径的发生造成碳源的分流。丙烯酸酯途径与逆β氧化循环为竞争关系,而丙烯酸酯途径的不可逆性会大大降低MCFAs的选择性[45]。例如Str uber等[54]和Kucek等[45]发现乳酸负荷过高时会发生丙酸和戊酸的积累。为控制丙烯酸酯途径,Prabhu等[53]选择将乳酸保持在低浓度状态,Kucek等[45]通过控制残留乳酸浓度、pH值、水力停留时间(HRT)和在线提取等措施有效提高了正己酸的产量和产率。然而,Zhu等[50]在使用瘤胃球菌科细菌Ruminococcaceae CPB6对乳酸进行碳链延长时,发现即使使用高浓度乳酸(45.1 g/L)也不会发生丙烯酸酯途径,他们认为这与该菌株不含丙烯酸酯途径相关的基因有关。
乳酸作为厌氧分解的重要中间产物,在城市污水中约占化学需氧量(COD)的18%,在一些食品加工废水中约占COD的70%[55]。富含乳酸的底物包括玉米青贮、微藻、污泥、酸性乳清、酒糟、木质纤维素发酵废液和中国白酒废水等都是可以用于MCFAs生产的理想原料。Xu等[56]从酸性乳清获得乳酸,并得到了1.68 g/(L·d)的己酸产率。Zhu等[51]使用从白酒窖泥中获得的乳酸代谢微生物,获得的正己酸的最大生产速率和最大浓度能够达到2.97 g/(L·d)和23.41 g/L。其他实验中使用乳酸进行碳链延长的底物与反应条件总结见表 4。
3 合成气作为电子供体的反应机理及研究现状目前,通过热化学的方法将沼渣和其他难以生物降解的生物质(例如秸秆)转化为合成气(主要成分为CO、CO2和H2),再将合成气转化为其他燃料和化学品(CH4和VFA)的方式引起了人们的广泛关注。研究表明,H2/H+(E°′~-410 mV)[13]和CO/CO2(E°′~-520 mV)[61]具有较低的氧化还原电位,可以作为电子供体实现MCFAs的制备。需要特别注意的是,合成气厌氧发酵的主要产物是乙醇和乙酸。一些研究先将合成气转化为乙醇和乙酸的混合物,再由乙醇引导碳链延长;也有研究认为合成气可以直接作为电子供体[19, 62]。尽管一些文献基于C. kluyveri的热力学分析认为合成气(如H2)不能直接作为电子供体,但在混菌体系中或许是可以实现的[26, 63]。
由于将合成气转化为MCFAs可实现生物质能最大限度的利用,因而具有巨大的应用前景。虽然目前国内已经能够实现合成气生产乙醇、乙酸的工业化应用,但微生物转化制取MCFAs的技术还尚未在工业上得到推广。为加强对合成气转化制取MCFAs过程的认识,本文结合前人的文献和本课题组的研究成果,总结了合成气生产MCFAs的代谢途径、功能微生物和关键酶[11]。
3.1 合成气作为电子供体实现碳链延长的机理乙酰辅酶A的形成是合成气碳链延长过程的关键步骤。研究表明厌氧微生物可以通过Wood-Ljungdahl途径,利用CO和H2提供还原力并消耗ATP,经甲基分支或羰基分支催化转化为乙酰辅酶A。随后,生成的乙酰辅酶A进一步转化为乙酸和乙醇。其具体合成途径见图 3。
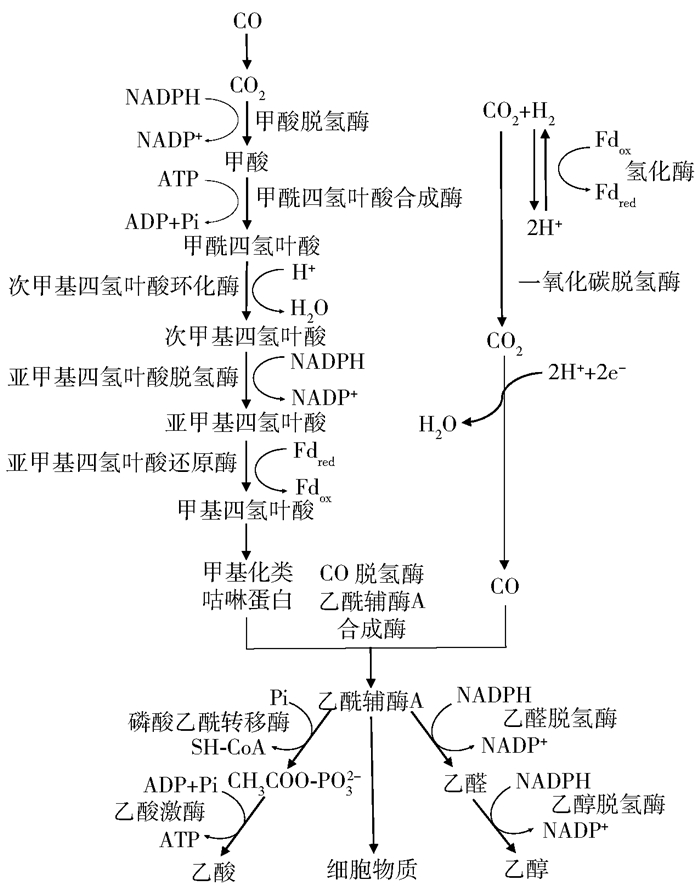
|
图 3 合成气作为电子供体形成乙醇和乙酸的代谢途径[64] Fig.3 Metabolic pathway of syngas as an electron donor to form ethanol and acetic acid[64] |
一般来说,利用CO的微生物也有能力通过Wood-Ljungdahl途径所包含的同一套酶和转化机制代谢CO2和CO2/H2[64]。在Wood-Ljungdahl途径的甲基支链中,CO在一氧化碳脱氢酶和氢化酶的共同作用下转化为CO2,再由甲酸脱氢酶催化的可逆反应将CO2还原为甲酸(反应式(22))。
| $ \mathrm{CO}_{2}+\mathrm{NADPH} \longrightarrow \mathrm{HCOO}^{-}+\mathrm{NADP}^{+} $ | (22) |
产生的甲酸盐是甲基支链合成乙酰辅酶A重要的前驱体。随后,甲酸盐被四氢叶酸(tetrahydrofolic acid, THF)活化,并在甲酰四氢叶酸合成酶的催化下生成甲酰四氢叶酸(HCO-THF)(反应式(23))。
| $ \mathrm{HCOOH}+\mathrm{THF}+\mathrm{ATP} \longrightarrow \mathrm{HCO}-\mathrm{THF}+\mathrm{ADP}+\mathrm{P}_{\mathrm{i}} $ | (23) |
甲酰四氢叶酸进而在一系列酶的作用下被还原为甲基四氢叶酸。在甲基分支的最后一步,甲基四氢叶酸与还原性的类咕啉蛋白在转甲基酶的作用下形成甲基化的类咕啉蛋白(反应式(24))。
| $ \left[\mathrm{Co}^{+}-\mathrm{E}\right]+\mathrm{CH}_{3}-\mathrm{THF} \longrightarrow\left[\mathrm{CH}_{3}-\mathrm{Co}-\mathrm{E}\right]+ \\ THF $ | (24) |
在羰基分支中,一氧化碳脱氢酶将CO2还原为CO(反应式(25))。
| $ \mathrm{CO}_{2}+2 \mathrm{H}^{+}+2 \mathrm{e}^{-} \longrightarrow \mathrm{CO}+\mathrm{H}_{2} \mathrm{O} $ | (25) |
在最后合成乙酰辅酶A的反应中,羰基、甲基化的类咕啉蛋白和辅酶A在一氧化碳脱氢酶/乙酰辅酶A合成酶催化下合成乙酰辅酶A(反应式(26))。
| $ \begin{array}{r} {\left[\mathrm{CH}_{3}-\mathrm{Co}-\mathrm{E}\right]+\mathrm{CO}+\mathrm{HS}-\mathrm{CoA} \longrightarrow \mathrm{CH}_{3} \mathrm{COS}} \\ \mathrm{CoA}+[\mathrm{Co}-\mathrm{E}] \end{array} $ | (26) |
在合成代谢途径中,乙酰辅酶A可用作细胞碳或细胞能量的来源。而在分解代谢途径中,一部分乙酰辅酶A通过转化为乙酰磷酸作为中间体进而转化为乙酸,另一部分在乙醛脱氢酶的存在下先形成乙醛再转化为乙醇。
CO通过两种途径参与碳链延长。一种是微生物直接利用CO并转化为H2、CO2、乙酸和丁酸等(表 5,反应式(28)~(31))。另一种是通过水煤气反应先转化为H2和CO2(反应式(27)),由CO耐受微生物利用H2和CO2生产乙醇/乙酸后,再进入逆β氧化循环获得MCFAs(表 5,反应式(32)~(35))[65]。
需要特别注意的是,CO/CO2具有比H2/H+更低的氧化还原电位,这使CO不仅具有更好的提供电子的能力,还能够单独驱动铁氧化还原蛋白的还原而不需要分叉机制[61]。Claassens等[13]认为CO更低的氧化还原电位将使细胞电子载体处于还原性更强的环境中,从而能够获得还原性更强的产物——即能够获得碳链更长的MCFAs。
目前,关于CO和H2作为电子供体实现碳链延伸的作用机理还存在争议,即CO和H2能否直接作为碳链延长的电子供体的问题[66]。以H2为例,有文献表明在仅使用C. kluyveri菌株进行碳链延长时,H2无法替代乙醇作为电子供体制取MCFAs[26]。González-Cabaleiro等[32]通过热力学模型分析,认为H2直接作为电子供体实现碳链延长过程存在热力学瓶颈(反应式(36)),即使在极高的H2分压条件下也难以实现H2和CO2向MCFAs的直接转化。但Zhang等[67]在中空纤维膜反应器中利用厌氧混合微生物转化H2和CO2并成功实现了己酸和辛酸的合成,认为H2是可以作为电子供体实现碳链延长的。存在这一争论的原因主要是因为目前还无法说明是H2直接作用于电子受体还是需要形成乙醇后才能实现碳链延长。但这一争论也是基于C. kluyveri的代谢途径,混合培养体系中的其他微生物是否能直接以H2作为电子供体进行碳链延长还需要更多的研究。
| $ \begin{aligned} &3 \mathrm{C}_{2} \mathrm{H}_{3} \mathrm{O}_{2}^{-}+2 \mathrm{H}^{+}+4 \mathrm{H}_{2} \longrightarrow \mathrm{C}_{6} \mathrm{H}_{11} \mathrm{O}_{2}^{-}+4 \mathrm{H}_{2} \mathrm{O}\\ &\Delta G^{0}=-176.2 \mathrm{kJ} / \mathrm{mol} \end{aligned} $ | (36) |
合成气目前主要通过混合培养的方式作为电子供体进行碳链延长。Richter等[62]建立了扬氏梭菌(Clostridium ljungdahlii)和C. kluyveri的共培养体系:CO首先在C. ljungdahlii的作用下转化为乙酸和乙醇,然后在C. kluyveri的作用下进行碳链延长获得MCFAs。类似地,Diender等[68]建立了由乙醇梭菌(Clostridium autoethanogenum)和C. kluyveri组成的利用CO的共发酵体系,其中,C. autoethanogenum也是一种典型合成气代谢的菌株;其最终获得的丁酸和己酸产率分别为(8.5±1.1)mmol/(L·d)和(2.5±0.63) mmol/(L·d)。Liu等[16]发现当CO为电子供体、乙酸/正丁酸为电子受体时,黏液真杆菌(Eubacterium limosum)是碳链延长制取正己酸的功能微生物。目前,还没有文献提及直接以H2作为电子供体进行碳链延长的微生物菌株。在使用C. kluyveri的实验中,已经发现较高的氢分压会抑制微生物活性,但这种抑制作用是否同样存在于混合微生物碳链延长体系中尚不明确[69]。此外,由于混合培养体系利用合成气生产MCFAs的过程高度复杂,目前还缺乏对相应的微生物和代谢途径的认识。
Perez等[70]发现CO能在一氧化碳营养细菌作为生物催化剂时获得还原性更强的产物,他们使用Clostridium ljungdahlii ERI-2和拉氏梭菌(Clostridium ragsdalei) P11这两种一氧化碳营养的细菌,在CO和H2的合成气环境下成功将VFAs还原为对应的醇。在探究了VFAs生产醇的可行性之后,Richter等[62]希望在碳链延长的体系中获得碳链更长的醇产物,他们使用C. ljungdahlii和C. kluyveri在合成气环境下进行了碳链延长与酸还原为醇的连续生产。在获得丁酸和己酸的碳链延伸产物的同时,还能够获得丁醇(0.725 g/(L·d))、己醇(0.465 g/(L·d))和辛醇(0.57 mg/(L·d))。此外,C. autoethanogenum也是一种能够在CO环境中将MCFAs转化为对应的高级醇的梭菌,从而进一步丰富了碳链延长的产物种类,对于拓展链延长体系的适用范围具有重要的意义[71]。
3.3 合成气作为电子供体的研究进展生物质热解气化产生的合成气组分随热解气化工艺条件的变化而变化。例如以氧气或者水蒸气为气化剂时,气态产物的主要成分为CO和H2。而目前国内通常选择更为经济的空气作为气化剂,通常获得的是具有不同比例的CO、CO2和H2的混合气体。但需要注意的是,CO和H2参与碳链延长的途径有区别,对碳链延长的过程也具有不同的影响。在此,对CO和H2分别进行总结与讨论。
3.3.1 氢气作为电子供体H2和乙醇均被称为第二代生物质产品,H2在作为电子供体时,一般认为需要先与CO2经Wood-Ljungdahl途径转化为乙酰辅酶A、乙酸和乙醇,然后再进行碳链延长。由于需要先转化为乙醇才能被用作电子供体,H2作为电子供体的反应器通常需要更长的反应时间。此外,H2的溶解度低、爆炸极限范围广,这使得它在生物反应器中的应用仍具有挑战性。在H2作为电子供体的发酵过程中,氢分压的升高能够提高合成气发酵过程的产物中乙醇与乙酸的比例,这有利于后续MCFAs的生产。已经发现过高的氢分压可抑制C. kluyveri活性,但在混菌体系中这种抑制作用却并不明显。例如在Steinbusch等[9]使用1.5×105 Pa氢分压的实验中,发现混合培养菌群在H2与乙醇的混合电子供体组中获得了产量更高的己酸和辛酸,并认为pH=7应该是H2与乙醇作为混合电子供体的适合环境。对于这些实验现象的原因和过程机理,还有待进一步研究。本课题组前期探究了合成气(CO和H2)与不同有机废水耦合发酵制取有机酸的潜力,结合16S rRNA高通量测序、qPCR分析和非标记定量蛋白质组学,从基因和蛋白质的层面揭示了该发酵系统的内在机理。结果表明,产乙酸菌在合成气与碳水化合物丰富的废水(5 g/L葡萄糖)联合发酵过程中得到更多的富集,不仅提高了CO、H2的转化率和利用速率,还获得了具有较长碳链的脂肪酸[17]。
在无外源H2添加时,厌氧发酵过程的H2产量极低,只是底物水解酸化以及VFA产生过程中的副产物,但顶空中少量H2的存在被认为是非常重要的[72]。首先,Grootscholten等[37]认为保持3×10-2 atm(1 atm=101 325 Pa)以上的氢分压能够抑制过量乙醇的氧化。由于乙醇氧化为乙酸产生ATP是为碳链延伸提供能量的关键步骤,如果过多的乙醇被氧化,碳链延伸过程不能有效地捕获过剩能量,反而会造成乙酰辅酶A含量的降低。此外,Agler等[73]和Zinder等[74]认为一定的氢分压的存在能够防止羧酸盐的氧化,避免MCFAs产物的损失。
当添加外源H2进入顶空时,氢分压的增高还可能将MCFAs转化为还原性更强的产物。例如Arslan等[75-76]在以马铃薯废水为底物并添加了2 bar(1 bar=105 Pa) H2顶空的发酵罐中,以及Steinbusch等[9]在添加了1.5×105 Pa H2的反应器中,均发现某些微生物能够在这样的环境下将乙酸和丁酸还原为乙醇和丁醇。同时,他们通过热力学分析发现,H2将酸转化为醇的过程与氢分压和pH值密切相关(反应式(37))[77]。随着氢分压的升高和pH值的降低,酸容易被还原为醇。Sarkar等[78]对这一过程的解释为H2可影响电子转移速率和氧化还原介质(NAD+/NADH、黄素蛋白和铁硫簇)催化活性,胞内胞外H2的不平衡状态导致厌氧细菌改变种间H2传递途径,从而导致了醇的生成。此外,Weimer等[79]发现在仅使用乙醇和乙酸作为底物时,CO2分压和氢分压可以控制产物选择性。Weimer等[79]认为高氢分压能够影响碳链延长产物中奇偶数碳链分布。丙酮酸形成丙酸能产生比形成丁酸更多的NAD+,而在氢气产量高的产酸条件下,NADH的可用性更高[80]。因此,在氢分压较高的反应器中为了维持NADH/NAD+比例,丙酮酸产丁酸的途径被生产丙酸的代谢途径所取代。目前采用的控制H2分压的方法包括使用真空泵[81]或者使用耗氢的微生物(氢营养的产甲烷菌,同型产乙酸菌)消耗H2。
| $ \begin{array}{l} \mathrm{C}_{2} \mathrm{H}_{3} \mathrm{O}_{2}^{-}+\mathrm{H}^{+}+2 \mathrm{H}_{2} \longrightarrow \mathrm{C}_{2} \mathrm{H}_{6} \mathrm{O}+\mathrm{H}_{2} \mathrm{O} \\ \Delta G^{0}=-49.5 \mathrm{kJ} / \mathrm{mol} \end{array} $ | (37) |
作为合成气的主要成分,CO能够参与多种微生物的同化与异化途径[82]。在过去数十年里,将CO作为碳链延长的电子供体和碳源引起人们的注意,CO已经在多种合成气厌氧发酵模型中扮演底物。
在生产MCFAs过程中,如何在抑制产甲烷菌的同时不影响其他微生物的活性一直是一大难题。Steinbusch等[9]和Vasudevan等[40]将产甲烷菌称为碳链延伸中的电子陷阱,未控制产甲烷菌活性的反应器会造成电子与碳源损失,并最终导致MCFAs产量降低。目前,实验室采用的解决方法包括缩短HRT、降低pH值或添加2-溴乙烷磺酸来达到抑制产CH4的目的[83]。Esquivel-Elizondo等[65]认为这些方法不具有经济和环境可行性,并且持续抑制产甲烷菌的能力不足,他们认为CO不仅能够作为电子供体,还能够抑制产甲烷菌的活性。Luo等[83]、Ferry[84]和Sipma等[85]的实验中发现CO对产甲烷菌的抑制作用大于对产氢菌和产乙酸菌的抑制作用。Esquivel-Elizondo等[65]发现在pCO≥0.11 atm时就已经可以部分抑制产甲烷菌的活性。在进一步的实验中发现,CO分压的增高能够改变微生物代谢途径,使电子流由产乙酸途径偏向碳链延长途径。这种既能作为电子供体与碳源,又能实现对产CH4的控制是目前其他碳链延长的电子供体所不具备的[86]。
CO作为电子供体的另一个优势表现为CO具有较低的氧化还原电位,可以在不添加还原剂的情况下获得短链醇和长链脂肪醇。但过低的氧化还原电位也可能破坏生物体的氧化还原平衡,需要辅助因子的再氧化以避免细胞完全还原[61]。需要注意的是,CO的毒性常导致这一类碳链延长反应启动缓慢,需要长时间的培养与驯化才能够获得高效转化CO的微生物菌群。为解决这一问题,Fox等[87]提出可以通过基因工程培育出对CO具有更高耐受性的菌株和酶。除此之外,如何提高CO的气液传质速率是其作为电子供体的一大挑战。CO难溶于水,CO压力的提高能够缓解其供应量的不足,但过高的CO压力可能会降低碳链延长过程的效率。本课题组探究了CO作为电子供体与不同浓度的乙酸/丁酸作为电子受体进行碳链延长制取MCFAs的可行性,结果表明当CO作为电子供体时,正丁酸比乙酸更适宜作电子受体来提高MCFAs的产量并缩短正己酸生成停滞期[16]。关于CO作为电子供体的其他产物参考表 6。
| 下载CSV 表 6 CO作为电子供体时的主要产物和其他参数 Table 6 Main products and other parameters when CO is used as an electron donor |
MCFAs作为一种具有高能量密度和经济价值的新型生物技术产物,既能够实现对废弃生物质的综合利用,也能够减少对化石能源的依赖。但是到目前为止,很多研究依旧处于实验室阶段,距离达到商业化还存在诸多限制。为实现将MCFAs的生产从当前实验室规模扩大到工业水平,未来的研究还需要克服的挑战和相应的建议如下。
(1) 拓展电子供体的类型。除文章中提及的4种电子供体外,目前还发现甲醇、葡萄糖、乳糖和丙酮酸能够作为碳链延长的电子供体[88-89]。借鉴Claassens等[13]提出的电子供体选择标准,完善电子供体的选择指南可以帮助研究者们快速选择合适的电子供体。例如具有低氧化还原电位的亚磷酸酯(E°′~-650 mV)就成为电子供体的候选者,但目前还未被用于厌氧微生物碳链延长。此外,Tremblay等[90]发现在电化学系统中一些自养微生物能够绕过电子供体,直接从阴极接收电子。尽管这些微生物是借助某些中间载体如H2和甲酸盐还是直接通过电极传递给微生物还存在争议,但如果碳链延长微生物也能够直接从电极捕获电子,不仅能够减少电子供体类型对碳链延长的影响,还能够大大提高碳链延长的效率,这将为碳链延长打开一个全新的领域。此外,混合电子供体的使用在MCFAs的生产上可能更具有优势。依靠混合电子供体可以克服单一电子供体的缺陷,提高最终产物的选择性或产量,还能够拓展碳链延长产物的种类,提高整体收益。例如,以乳酸和乙醇作为混合电子供体时,乳酸氧化过程中释放的CO2能满足乙醇碳链延长微生物的生长需求。同时,将乳酸作为补充的电子供体可降低对乙醇的需求,避免过高的乙醇浓度造成微生物抑制[46]。
(2) 提高MCFAs的产物选择性。首先,避免分散碳源的竞争途径,这是确保MCFAs纯度的一个重要前提,开发更为经济和稳定的方式控制产甲烷和丙烯酸酯途径对提高产物的收益具有重要意义。其次,提高电子供体与电子受体比例以及安装在线提取设备能够提高MCFAs整体的产量与选择性,但还需要进一步探究不同电子供体和电子受体的组合方式、微生物群落结构和操作参数等对产量和选择性的影响。另外,利用逆β氧化循环每次增加两个碳的规律,通过控制电子受体碳链的奇偶数,可以获得相对单一的MCFAs(例如:乙醇和乙酸组合获得己酸,乙醇和丙酸组合获得庚酸)。但实际厌氧发酵过程的产物复杂,通过控制水解酸化过程可以获得相对单一的VFAs作为电子受体。
(3) 在线提取系统的开发对实现MCFAs的工业生产至关重要。对碳链延长产物进行在线提取有利于提高MCFAs的产量、产率和产物选择性。目前采用的提取技术主要有在线膜液-液萃取和膜电解等。针对复杂的可生物降解底物,采用不同在线提取策略对提高MCFAs的产量具有重要的意义。应用数学模型和精确的自动化控制设备对MCFAs在线提取系统进行精确的pH值和提取时间控制,既保证微生物活性又确保系统效率的操作环境,对避免产品抑制、实现产量最大化、优化提取方式和效率具有非常重要的意义。
(4) 合成气发酵的反应器优化。从应用前景来看,利用H2和CO这样的气体电子供体生产生物化学品的方法是具有一定潜力的。通过改进进气装置、增大进气接触面积、增加填料进行微生物固定化或改进搅拌等方式可以提高合成气的利用率。但是,如何提高气液传质速率、缩短驯化时间、优化MCFAs产量和选择性还有待进一步研究。
(5) 提高对实际生产废弃物的利用。城市垃圾中的有机成分,如厨房垃圾、食物垃圾和污水污泥是可利用的基质。然而,各种有机废弃物的成分不同,复杂的组分使得它们很难用于MCFAs生产。根据不同的成分和性质,对每种基质确定具体的预处理方式和工艺参数,这样可以大大拓展生产MCFAs的原料范围、减少副产物、提高MCFAs的选择性。如果作为底物的废弃物能够满足电子供体或电子受体的需求(例如酒糟废水),还可以大大降低MCFAs的生产成本[60]。但要实现这些目标,并最终实现这项技术的商业应用,还有许多挑战需要解决。
| [1] |
WU Q L, GUO W Q, BAO X, et al. Enhancing sludge biodegradability and volatile fatty acid production by tetrakis hydroxymethyl phosphonium sulfate pretreatment[J]. Bioresource Technology, 2017, 239: 518-522. DOI:10.1016/j.biortech.2017.05.016 |
| [2] |
YU F, LIN T J, WANG X X, et al. Highly selective production of olefins from syngas with modified ASF distribution model[J]. Applied Catalysis A: General, 2018, 563: 146-153. DOI:10.1016/j.apcata.2018.07.006 |
| [3] |
AGLER M T, WERNER J J, ITEN L B, et al. Shaping reactor microbiomes to produce the fuel precursor n-butyrate from pretreated cellulosic hydrolysates[J]. Environmental Science & Technology, 2012, 46(18): 10229-10238. |
| [4] |
CHEN W S, STRIK D P B T B, BUISMAN C J N, et al. Production of caproic acid from mixed organic waste: an environmental life cycle perspective[J]. Environmental Science & Technology, 2017, 51(12): 7159-7168. |
| [5] |
ZUPAN ČI ČG D, STRAŽIŠČAR M, ROŠM. Treatment of brewery slurry in thermophilic anaerobic sequencing batch reactor[J]. Bioresource Technology, 2007, 98(14): 2714-2722. DOI:10.1016/j.biortech.2006.09.044 |
| [6] |
ANGENENT L T, RICHTER H, BUCKEL W, et al. Chain elongation with reactor microbiomes: open-culture biotechnology to produce biochemicals[J]. Environmental Science & Technology, 2016, 50(6): 2796-2810. |
| [7] |
SPIRITO C M, RICHTER H, RABAEY K, et al. Chain elongation in anaerobic reactor microbiomes to recover resources from waste[J]. Current Opinion in Biotechnology, 2014, 27: 115-122. DOI:10.1016/j.copbio.2014.01.003 |
| [8] |
AGLER M T, SPIRITO C M, USACK J G, et al. Chain elongation with reactor microbiomes: upgrading dilute ethanol to medium-chain carboxylates[J]. Energy & Environmental Science, 2012, 5(8): 8189-8192. |
| [9] |
STEINBUSCH K J J, HAMELERS H V M, PLUGGE C M, et al. Biological formation of caproate and caprylate from acetate: fuel and chemical production from low grade biomass[J]. Energy & Environmental Science, 2011, 4(1): 216-224. |
| [10] |
CASSMAN K G, LISKA A J. Food and fuel for all: realistic or foolish?[J]. Biofuels Bioproducts & Biorefining, 2007, 1(1): 18-23. |
| [11] |
刘超, 罗刚, 王雯, 等. 微生物转化合成气制取生物燃料和化学品的研究进展[J]. 北京化工大学学报(自然科学版), 2017, 44(5): 2-12. LIU C, LUO G, WANG W, et al. Research progress in biofuel and biochemicals production from syngas fermentation[J]. Journal of Beijing University of Chemical Technology (Natural Science), 2017, 44(5): 2-12. (in Chinese) |
| [12] |
DE ARAÙJO CAVALCANTE W, LEITÃO R C, GEHRING T A, et al. Anaerobic fermentation for n-caproic acid production: a review[J]. Process Biochemistry, 2017, 54: 106-119. DOI:10.1016/j.procbio.2016.12.024 |
| [13] |
CLAASSENS N J, SÁNCHEZ-ANDREA I, SOUSA D Z, et al. Towards sustainable feedstocks: a guide to electron donors for microbial carbon fixation[J]. Current Opinion in Biotechnology, 2018, 50: 195-205. DOI:10.1016/j.copbio.2018.01.019 |
| [14] |
刘辉, 王雯, 魏晓明, 等. 工业副产煤气的资源化利用研究进展[J]. 现代化工, 2016, 36(4): 46-52. LIU H, WANG W, WEI X M, et al. Research progress of utilization of industrial by-product gas[J]. Modern Chemical Industry, 2016, 36(4): 46-52. (in Chinese) |
| [15] |
陈铭, 刘超, 王雯, 等. 温度和pH对厌氧微生物转化合成气定向产乙酸的影响[J]. 环境工程, 2019, 37(12): 183-187, 206. CHEN M, LIU C, WANG W, et al. Effect of temperature and pH on acetate production by syngas bio-transformaion in fermentation[J]. Environmental Engineering, 2019, 37(12): 183-187, 206. (in Chinese) |
| [16] |
LIU C, LUO G, LIU H P, et al. CO as electron donor for efficient medium chain carboxylate production by chain elongation: microbial and thermodynamic insights[J]. Chemical Engineering Journal, 2020, 390: 124577. DOI:10.1016/j.cej.2020.124577 |
| [17] |
LIU C, WANG W, O-THONG S, et al. Microbial insights of enhanced anaerobic conversion of syngas into volatile fatty acids by co-fermentation with carbohydrate-rich synthetic wastewater[J]. Biotechnology for Biofuels, 2020, 13: 53. DOI:10.1186/s13068-020-01694-z |
| [18] |
LIU C, LUO G, WANG W, et al. The effects of pH and temperature on the acetate production and microbial community compositions by syngas fermentation[J]. Fuel, 2018, 224: 537-544. DOI:10.1016/j.fuel.2018.03.125 |
| [19] |
HE P J, HAN W H, SHAO L M, et al. One-step production of C6—C8 carboxylates by mixed culture solely grown on CO[J]. Biotechnology for Biofuels, 2018, 11(1): 4. |
| [20] |
CHEN W S, YE Y, STEINBUSCH K J J, et al. Methanol as an alternative electron donor in chain elongation for butyrate and caproate formation[J]. Biomass & Bioenergy, 2016, 93: 201-208. |
| [21] |
LENG L, YANG P X, MAO Y P, et al. Thermodynamic and physiological study of caproate and 1, 3-propanediol co-production through glycerol fermentation and fatty acids chain elongation[J]. Water Research, 2017, 114: 200-209. DOI:10.1016/j.watres.2017.02.023 |
| [22] |
GOLDEMBERG J, COELHO S T, NASTARI P M, et al. Ethanol learning curve—the Brazilian experience[J]. Biomass & Bioenergy, 2004, 26(3): 301-304. |
| [23] |
BARKER H A, KAMEN M D, BORNSTEIN B T. The synthesis of butyric and caproic acids from ethanol and acetic acid by Clostridium kluyveri[J]. Proceedings of the National Academy of Sciences, 1945, 31(12): 373-381. DOI:10.1073/pnas.31.12.373 |
| [24] |
GE S J, USACK J G, SPIRITO C M, et al. Long-term n-caproic acid production from yeast-fermentation beer in an anaerobic bioreactor with continuous product extraction[J]. Environmental Science & Technology, 2015, 49(13): 8012-8021. |
| [25] |
COMA M, VILCHEZ-VARGAS R, ROUME H, et al. Product diversity linked to substrate usage in chain elongation by mixed-culture fermentation[J]. Environmental Science & Technology, 2016, 50(12): 6467-6476. |
| [26] |
KENEALY W R, WASELEFSKY D M. Studies on the substrate range of Clostridium kluyveri; the use of propanol and succinate[J]. Archives of Microbiology, 1985, 141(3): 187-194. DOI:10.1007/BF00408056 |
| [27] |
WEIMER P J, NERDAHL M, BRANDL D J. Production of medium-chain volatile fatty acids by mixed ruminal microorganisms is enhanced by ethanol in co-culture with Clostridium kluyveri[J]. Bioresource Technology, 2015, 175: 97-101. DOI:10.1016/j.biortech.2014.10.054 |
| [28] |
KUCEK L A, SPIRITO C M, ANGENENT L T. High n-caprylate productivities and specificities from dilute ethanol and acetate: chain elongation with microbiomes to upgrade products from syngas fermentation[J]. Energy & Environmental Science, 2016, 9(11): 3482-3494. |
| [29] |
LIU Y H, HE P J, SHAO L M, et al. Significant enhancement by biochar of caproate production via chain elongation[J]. Water Research, 2017, 119: 150-159. DOI:10.1016/j.watres.2017.04.050 |
| [30] |
SAN-VALERO P, ABUBACKAR H N, VEIGA M C, et al. Effect of pH, yeast extract and inorganic carbon on chain elongation for hexanoic acid production[J]. Bioresource Technology, 2020, 300: 122659. DOI:10.1016/j.biortech.2019.122659 |
| [31] |
DESBOIS A P, SMITH V J. Antibacterial free fatty acids: activities, mechanisms of action and biotechnological potential[J]. Applied Microbiology and Biotechnology, 2010, 85(6): 1629-1642. DOI:10.1007/s00253-009-2355-3 |
| [32] |
GONZÁLEZ-CABALEIRO R, LEMA J M, RODRÍGUEZ J, et al. Linking thermodynamics and kinetics to assess pathway reversibility in anaerobic bioprocesses[J]. Energy & Environmental Science, 2013, 6(12): 3780-3789. |
| [33] |
GROOTSCHOLTEN T I M, STEINBUSCH K J J, HAMELERS H V M, et al. Chain elongation of acetate and ethanol in an upflow anaerobic filter for high rate MCFA production[J]. Bioresource Technology, 2013, 135: 440-445. DOI:10.1016/j.biortech.2012.10.165 |
| [34] |
XIONG B, RICHARD T L, KUMAR M. Integrated acidogenic digestion and carboxylic acid separation by nanofiltration membranes for the lignocellulosic carboxylate platform[J]. Journal of Membrane Science, 2015, 489: 275-283. DOI:10.1016/j.memsci.2015.04.022 |
| [35] |
GROOTSCHOLTEN T I M, STEINBUSCH K J J, HAMELERS H V M, et al. Improving medium chain fatty acid productivity using chain elongation by reducing the hydraulic retention time in an upflow anaerobic filter[J]. Bioresource Technology, 2013, 136: 735-738. DOI:10.1016/j.biortech.2013.02.114 |
| [36] |
GROOTSCHOLTEN T I M, DAL BORGO F K, HAMELERS H V M, et al. Promoting chain elongation in mixed culture acidification reactors by addition of ethanol[J]. Biomass & Bioenergy, 2013, 48: 10-16. |
| [37] |
GROOTSCHOLTEN T I M, STRIK D P B T B, STEINBUSCH K J J, et al. Two-stage medium chain fatty acid (MCFA) production from municipal solid waste and ethanol[J]. Applied Energy, 2014, 116: 223-229. DOI:10.1016/j.apenergy.2013.11.061 |
| [38] |
KENEALY W R, CAO Y, WEIMER P J. Production of caproic acid by cocultures of ruminal cellulolytic bacteria and Clostridium kluyveri grown on cellulose and ethanol[J]. Applied Microbiology and Biotechnology, 1995, 44(3/4): 507-513. |
| [39] |
GROOTSCHOLTEN T I M, STEINBUSCH K J J, HAMELERS H V M, et al. High rate heptanoate production from propionate and ethanol using chain elongation[J]. Bioresource Technology, 2013, 136: 715-718. DOI:10.1016/j.biortech.2013.02.085 |
| [40] |
VASUDEVAN D, RICHTER H, ANGENENT L T. Upgrading dilute ethanol from syngas fermentation to n-caproate with reactor microbiomes[J]. Bioresource Technology, 2014, 151: 378-382. DOI:10.1016/j.biortech.2013.09.105 |
| [41] |
SEEDORF H, FRICKE W F, VEITH B, et al. The genome of Clostridium kluyveri, a strict anaerobe with unique metabolic features[J]. Proceedings of the National Academy of Sciences, 2008, 105(6): 2128-2133. DOI:10.1073/pnas.0711093105 |
| [42] |
JUNGERMANN K, THAUER R K, DECKER K. The synthesis of one-carbon units from CO2 in Clostridium kluyveri[J]. European Journal of Biochemistry, 1968, 3(3): 351-359. DOI:10.1111/j.1432-1033.1968.tb19536.x |
| [43] |
ROGHAIR M, HOOGSTAD T, STRIK D P B T B, et al. Controlling ethanol use in chain elongation by CO2 loading rate[J]. Environmental Science & Technology, 2018, 52(3): 1496-1505. |
| [44] |
RUSSELL J B, HINO T. Regulation of lactate production in Streptococcus bovis: a spiraling effect that contributes to rumen acidosis[J]. Journal of Dairy Science, 1985, 68(7): 1712-1721. DOI:10.3168/jds.S0022-0302(85)81017-1 |
| [45] |
KUCEK L A, NGUYEN M, ANGENENT L T. Conversion of L-lactate into n-caproate by a continuously fed reactor microbiome[J]. Water Research, 2016, 93: 163-171. DOI:10.1016/j.watres.2016.02.018 |
| [46] |
WU Q L, GUO W Q, BAO X, et al. Upgrading liquor-making wastewater into medium chain fatty acid: insights into co-electron donors, key microflora, and energy harvest[J]. Water Research, 2018, 145: 650-659. DOI:10.1016/j.watres.2018.08.046 |
| [47] |
ELSDEN S R, VOLCANI B E, GILCHRIST F M C, et al. Properties of a fatty acid forming organism isolated from the rumen of sheep[J]. Journal of Bacteriology, 1956, 72(5): 681-689. DOI:10.1128/JB.72.5.681-689.1956 |
| [48] |
WEIMER P J, MOEN G N. Quantitative analysis of growth and volatile fatty acid production by the anaerobic ruminal bacterium Megasphaera elsdenii T81[J]. Applied Microbiology and Biotechnology, 2013, 97(9): 4075-4081. DOI:10.1007/s00253-012-4645-4 |
| [49] |
YOSHIKAWA S, ARAOKA R, KAJIHARA Y, et al. Valerate production by Megasphaera elsdenii isolated from pig feces[J]. Journal of Bioscience and Bioengineering, 2018, 125(5): 519-524. DOI:10.1016/j.jbiosc.2017.12.016 |
| [50] |
ZHU X Y, ZHOU Y, WANG Y, et al. Production of high-concentration n-caproic acid from lactate through fermentation using a newly isolated Ruminococcaceae bacterium CPB6[J]. Biotechnology for Biofuels, 2017, 10(1): 102. |
| [51] |
ZHU X Y, TAO Y, LIANG C, et al. The synthesis of n-caproate from lactate: a new efficient process for medium-chain carboxylates production[J]. Scientific Reports, 2015, 5: 14360. DOI:10.1038/srep14360 |
| [52] |
MAROUNEK M, FLIEGROVA K, BARTOS S. Metabolism and some characteristics of ruminal strains of Megasphaera elsdenii[J]. Applied and Environmental Microbiology, 1989, 55(6): 1570-1573. DOI:10.1128/AEM.55.6.1570-1573.1989 |
| [53] |
PRABHU R, ALTMAN E, EITEMAN M A. Lactate and acrylate metabolism by Megasphaera elsdenii under batch and steady-state conditions[J]. Applied and Environmental Microbiology, 2012, 78(24): 8564-8570. DOI:10.1128/AEM.02443-12 |
| [54] |
STRÄUBER H, LUCAS R, KLEINSTEUBER S. Metabolic and microbial community dynamics during the anaerobic digestion of maize silage in a two-phase process[J]. Applied Microbiology and Biotechnology, 2016, 100(1): 479-491. DOI:10.1007/s00253-015-6996-0 |
| [55] |
RAUNKJÆR K, HVITVED-JACOBSEN T, NIELSEN P H. Measurement of pools of protein, carbohydrate and lipid in domestic wastewater[J]. Water Research, 1994, 28(2): 251-262. DOI:10.1016/0043-1354(94)90261-5 |
| [56] |
XU J J, HAO J X, GUZMAN J J L, et al. Temperature-phased conversion of acid whey waste into medium-chain carboxylic acids via lactic acid: no external e-donor[J]. Joule, 2018, 2(2): 280-295. DOI:10.1016/j.joule.2017.11.008 |
| [57] |
ANDERSEN S J, CANDRY P, BASADRE T, et al. Electrolytic extraction drives volatile fatty acid chain elongation through lactic acid and replaces chemical pH control in thin stillage fermentation[J]. Biotechnology for Biofuels, 2015, 8: 221. DOI:10.1186/s13068-015-0396-7 |
| [58] |
KHOR W C, ANDERSEN S, VERVAEREN H, et al. Electricity-assisted production of caproic acid from grass[J]. Biotechnology for Biofuels, 2017, 10(1): 180. DOI:10.1186/s13068-017-0863-4 |
| [59] |
DUBER A, JAROSZYNSKI L, ZAGRODNIK R, et al. Exploiting the real wastewater potential for resource recovery n-caproate production from acid whey[J]. Green Chemistry, 2018, 20(16): 3790-3803. DOI:10.1039/C8GC01759J |
| [60] |
CARVAJAL-ARROYO J M, CANDRY P, ANDERSEN S J, et al. Granular fermentation enables high rate caproic acid production from solid-free thin stillage[J]. Green Chemistry, 2019, 21(6): 1330-1339. DOI:10.1039/C8GC03648A |
| [61] |
DIENDER M, STAMS A J M, SOUSA D Z. Pathways and bioenergetics of anaerobic carbon monoxide fermentation[J]. Frontiers in Microbiology, 2015, 6: 1275. |
| [62] |
RICHTER H, MOLITOR B, DIENDER M, et al. A narrow pH range supports butanol, hexanol, and octanol production from syngas in a continuous co-culture of Clostridium ljungdahlii and Clostridium kluyveri with in-line product extraction[J]. Frontiers in Microbiology, 2016, 7: 1773. |
| [63] |
DING H B, AMY TAN G Y, WANG J Y. Caproate formation in mixed-culture fermentative hydrogen production[J]. Bioresource Technology, 2010, 101(24): 9550-9559. DOI:10.1016/j.biortech.2010.07.056 |
| [64] |
MOHAMMADI M, NAJAFPOUR G D, YOUNESI H, et al. Bioconversion of synthesis gas to second generation biofuels: a review[J]. Renewable & Sustainable Energy Reviews, 2011, 15(9): 4255-4273. |
| [65] |
ESQUIVEL-ELIZONDO S, MICELI J Ⅲ, TORRES C I, et al. Impact of carbon monoxide partial pressures on methanogenesis and medium chain fatty acids production during ethanol fermentation[J]. Biotechnology and Bioengineering, 2018, 115(2): 341-350. DOI:10.1002/bit.26471 |
| [66] |
SONG Y, SHIN J, JIN S, et al. Genome-scale analysis of syngas fermenting acetogenic bacteria reveals the translational regulation for its autotrophic growth[J]. BMC Genomics, 2018, 19(1): 837. DOI:10.1186/s12864-018-5238-0 |
| [67] |
ZHANG F, DING J, ZHANG Y, et al. Fatty acids production from hydrogen and carbon dioxide by mixed culture in the membrane biofilm reactor[J]. Water Research, 2013, 47(16): 6122-6129. DOI:10.1016/j.watres.2013.07.033 |
| [68] |
DIENDER M, STAMS A J M, SOUSA D Z. Production of medium-chain fatty acids and higher alcohols by a synthetic co-culture grown on carbon monoxide or syngas[J]. Biotechnology for Biofuels, 2016, 9(1): 82. |
| [69] |
SCHOBERTH S, GOTTSCHALK G. Considerations on the energy metabolism of Clostridium kluyveri[J]. Archiv für Mikrobiologie, 1969, 65(4): 318-328. DOI:10.1007/BF00412211 |
| [70] |
PEREZ J M, RICHTER H, LOFTUS S E, et al. Biocatalytic reduction of short-chain carboxylic acids into their corresponding alcohols with syngas fermentation[J]. Biotechnology and Bioengineering, 2013, 110(4): 1066-1077. DOI:10.1002/bit.24786 |
| [71] |
ABRINI J, NAVEAU H, NYNS E J. Clostridium autoethanogenum, sp. nov., an anaerobic bacterium that produces ethanol from carbon monoxide[J]. Archives of Microbiology, 1994, 161(4): 345-351. DOI:10.1007/BF00303591 |
| [72] |
LI C L, FANG H H P. Fermentative hydrogen production from wastewater and solid wastes by mixed cultures[J]. Critical Reviews in Environmental Science and Technology, 2007, 37(1): 1-39. DOI:10.1080/10643380600729071 |
| [73] |
AGLER M T, SPIRITO C M, USACK J G, et al. Development of a highly specific and productive process for n-caproic acid production: applying lessons from methanogenic microbiomes[J]. Water Science & Technology, 2014, 69(1): 62-68. |
| [74] |
ZINDER S H, ANGUISH T, CARDWELL S C. Selective inhibition by 2-bromoethanesulfonate of methanogenesis from acetate in a thermophilic anaerobic digestor[J]. Applied and Environmental Microbiology, 1984, 47(6): 1343-1345. DOI:10.1128/AEM.47.6.1343-1345.1984 |
| [75] |
ARSLAN D, STEINBUSCH K J J, DIELS L, et al. Selective carboxylate production by controlling hydrogen, carbon dioxide and substrate concentrations in mixed culture fermentation[J]. Bioresource Technology, 2013, 136: 452-460. DOI:10.1016/j.biortech.2013.03.063 |
| [76] |
ARSLAN D, STEINBUSCH K J J, DIELS L, et al. Effect of hydrogen and carbon dioxide on carboxylic acids patterns in mixed culture fermentation[J]. Bioresource Technology, 2012, 118: 227-234. DOI:10.1016/j.biortech.2012.05.003 |
| [77] |
STEINBUSCH K J J, HAMELERS H V M, BUISMAN C J N. Alcohol production through volatile fatty acids reduction with hydrogen as electron donor by mixed cultures[J]. Water Research, 2008, 42(15): 4059-4066. DOI:10.1016/j.watres.2008.05.032 |
| [78] |
SARKAR O, BUTTI S K, MOHAN S V. Acidogenesis driven by hydrogen partial pressure towards bioethanol production through fatty acids reduction[J]. Energy, 2017, 118: 425-434. DOI:10.1016/j.energy.2016.12.017 |
| [79] |
WEIMER P J, KOHN R A. Impacts of ruminal microorganisms on the production of fuels: how can we intercede from the outside?[J]. Applied Microbiology and Biotechnology, 2016, 100(8): 3389-3398. DOI:10.1007/s00253-016-7358-2 |
| [80] |
RODRÍGUEZ J, KLEEREBEZEM R, LEMA J M, et al. Modeling product formation in anaerobic mixed culture fermentations[J]. Biotechnology and Bioengineering, 2006, 93(3): 592-606. DOI:10.1002/bit.20765 |
| [81] |
RAJHI H, PUYOL D, MARTÍNEZ M C, et al. Vacuum promotes metabolic shifts and increases biogenic hydrogen production in dark fermentation systems[J]. Frontiers of Environmental Science & Engineering, 2016, 10(3): 513-521. |
| [82] |
RYTER S W, OTTERBEIN L E. Carbon monoxide in biology and medicine[J]. BioEssays, 2004, 26(3): 270-280. DOI:10.1002/bies.20005 |
| [83] |
LUO G, WANG W, ANGELIDAKI I. Anaerobic digestion for simultaneous sewage sludge treatment and CO biomethanation: process performance and microbial ecology[J]. Environmental Science & Technology, 2013, 47(18): 10685-10693. |
| [84] |
FERRY J G. CO in methanogenesis[J]. Annals of Microbiology, 2010, 60(1): 1-12. |
| [85] |
SIPMA J, LENS P N L, STAMS A J M, et al. Carbon monoxide conversion by anaerobic bioreactor sludges[J]. FEMS Microbiology Ecology, 2003, 44(2): 271-277. |
| [86] |
MICELI Ⅲ J F, TORRES C I, KRAJMALNIK-BROWN R. Shifting the balance of fermentation products between hydrogen and volatile fatty acids: microbial community structure and function[J]. FEMS Microbiology Ecology, 2016, 92(12): 195. DOI:10.1093/femsec/fiw195 |
| [87] |
FOX J D, KERBY R L, ROBERTS G P, et al. Characterization of the CO-induced, CO-tolerant hydrogenase from Rhodospirillum rubrum and the gene encoding the large subunit of the enzyme[J]. Journal of Bacteriology, 1996, 178(6): 1515-1524. DOI:10.1128/JB.178.6.1515-1524.1996 |
| [88] |
SHARAK GENTHNER B R, DAVIS C L, BRYANT M P. Features of rumen and sewage sludge strains of Eubacterium limosum, a methanol- and H2—CO2-utilizing species[J]. Applied and Environmental Microbiology, 1981, 42(1): 12-19. |
| [89] |
ZHANG Z P, TAY J H, SHOW K Y, et al. Biohydrogen production in a granular activated carbon anaerobic fluidized bed reactor[J]. International Journal of Hydrogen Energy, 2007, 32(2): 185-191. DOI:10.1016/j.ijhydene.2006.08.017 |
| [90] |
TREMBLAY P L, ZHANG T. Electrifying microbes for the production of chemicals[J]. Frontiers in Microbiology, 2015, 6: 201. |








