为了解决我国环境污染和能源匮乏的问题,使用清洁型能源来代替燃料很有必要。氢气的热值高且能量产率是碳氢燃料的2.75倍[1],是一种很有发展前景的能源。目前,由于如石油重整、煤气化和电解水等制氢技术成本高、消耗额外能量(电能、光能等),所以更倾向于采用暗发酵制氢[2]。暗发酵是微生物在无光的厌氧环境中发酵的过程[3]。暗发酵产氢是在传统厌氧生物处理基础上发展起来的绿色能源制备技术,具有微生物比产氢速率高、不受光照限制、工艺简单和可利用有机物范围广等优势,是农业固体废物能源化利用的理想途径[4]。我国是一个农业大国,据统计,全国2018年玉米秸秆产量达到2.57亿吨[5],会产生大量的秸秆废弃物,而它是一种富含碳的原料。因此,利用玉米秸秆通过暗发酵产氢是一种潜在环境效益高和可持续的方法[6],可同时达到可再生能源回收和废物处理的目的。
目前,相比于污泥、藻类和餐厨,关于秸秆产氢的研究较少。玉米秸秆主要是由纤维素、半纤维素和木质素紧密结合在一起组成的复杂有机体,微生物降解底物的效率很低,所以需要通过对秸秆进行预处理来破坏木质纤维素的紧密结构,释放可以被微生物捕获的易发酵的物质,从而提高制氢效率[7]。研究人员利用各种物理和化学预处理方法来提高木质纤维素原料的生物转化率以及破坏刚性木质素结构。He等[8]对稻草秸秆进行210 ℃水热预处理,单位挥发性固体(VS)产氢量能达到28 mL/g。但是过高的温度会导致有机物的过度降解,或者形成难降解的化合物,从而抑制厌氧发酵。化学预处理包括酸预处理和碱预处理。在高温条件下,通常使用质量分数范围在0.5%~6%的H2SO4。Park等[9]探究了不同质量分数(0.5%~1.5%)H2SO4和不同温度(120~180 ℃)下水解红藻的产氢性能,发现温度是主要影响因素,并且在0.5% H2SO4和161~164 ℃的水解条件下产氢量最多。在Nasirian等[10]的研究中,麦秸经过0.02 g/mL H2SO4在120 ℃下预处理90 min,单位VS产氢量可以达到37.11 mL/g。而碱预处理通常需要低温和较长的时间[11]。Liu等[12]利用在质量分数2% NaOH、50 ℃下浸泡48 h的玉米秸秆和活性污泥发酵产氢,单位VS产氢量可以达到13.4 mL/g。Monlau等[4]用0.04 g/mL NaOH在55 ℃下预处理向日葵秸秆24 h,单位VS产氢量达到了4.4 mL/g,而在170 ℃下预处理1 h时的单位VS产氢量明显提高,达到了20.6 mL/g。
最合适的预处理方式是针对不同木质纤维素生物质的特性而作相应调整。酸、碱预处理通常在室温下使用,结合热预处理可以提高效率,但采用的温度会因处理方法的不同而有很大的差异。所以本文以玉米秸秆为原料,考察采用H2SO4和NaOH在不同预处理温度和不同预处理时间下的产氢性能,并通过分析暗发酵后体系的pH值以及代谢产物(挥发性脂肪酸即VFAs和乙醇)含量来比较不同预处理温度的暗发酵制氢效果。
1 材料与方法 1.1 实验原料玉米秸秆,取自北京市延庆区,经自然风干后,切至长度3~4 cm,然后用粉碎机研磨至粒度0.83~0.85 mm备用。接种物来源于以猪粪为原料的厌氧消化后的沼液,经自然沉降后去除上清液备用。使用前将沉淀的接种物在100 ℃下煮沸1 h,以抑制产甲烷菌的活性[13]。玉米秸秆和接种物的基本性质如表 1所示。硫酸、氢氧化钠,分析纯,北京化工厂。
| 下载CSV 表 1 玉米秸秆和接种物的基本性质 Table 1 Characteristics of corn stover and inoculum |
本文实验的预处理装置包括HWS-26型恒温水浴锅(上海齐欣科学仪器有限公司)和WZC-100型磁力高压反应釜(五洲鼎创科技有限公司),其中预处理温度为120 ℃以下的装置采用恒温水浴锅,120 ℃以上采用WZC-100型高压反应釜。暗发酵产氢实验装置由恒温水箱、500 mL血清瓶、100 mL量筒、输液针管和水槽组成。采用排水集气法收集气体。产氢实验装置示意图如图 1所示。

|
图 1 产氢实验装置示意图 Fig.1 Schematic of hydrogen production experiments |
在500 mL可密封血清瓶中进行批式实验,工作体积为300 mL,用1%(质量分数,下同) H2SO4和2% NaOH预处理9 g秸秆(TS,以秸秆干重计),预处理温度分别为40、80、120、160 ℃和200 ℃,除了200 ℃下预处理10 min以外,其余温度下分别预处理10 min和60 min。加水量为玉米秸秆干重的10倍。冷却后,将预处理的玉米秸秆和15 g/L(TS)煮沸的接种物混合于血清瓶中。用稀释的Ca(OH)2 (或HCl)将混合液调节至pH值为6.0,然后加入自来水以保持相同的工作体积,摇匀后用丁基胶塞密封,之后放入(37±1)℃的恒温水箱中进行暗发酵实验。同时设置未预处理组,每组3个平行。不同预处理组实验结果为扣除只添加接种物对照组产氢量后的3个平行实验的平均值。
1.4 分析方法气体成分(H2、N2、CH4和CO2)的测定采用配备热导检测器和TDX-01柱的SP-2100型气相色谱仪(北京北分瑞利分析仪器有限公司)。总固体(TS)和挥发性固体(VS)的测定采用APHA标准方法[14]。碳元素的质量分数(TC),氮元素的质量分数(TN)和氢元素的质量分数(TH)采用vairo EL CUBE型元素分析仪(德国Elementar Analysensysteme GmbH公司)测定。纤维素、半纤维素和木质素含量使用A2000Ⅰ型纤维分析仪(美国ANKOM公司)测定。玉米秸秆产氢后的pH值采用FE28-S型pH计(梅特勒-托利多公司)测量。暗发酵的代谢产物(VFAs和乙醇)含量由GC-2014型气相色谱仪(日本岛津公司)测定。
1.5 动力学分析本文中,除了采用1% H2SO4、温度120 ℃以上的预处理组,以及采用2% NaOH、温度200 ℃的预处理组外,其他预处理组均分别采用修正Gompertz模型(式(1))和Cone模型(式(2))[15]对产氢过程进行拟合。
| $ H = {P_{\rm{m}}}\exp \left\{ { - \exp \left[ {(\lambda - t){R_{\rm{m}}}{\rm{e}}/{P_{\rm{m}}} + 1} \right]} \right\} $ | (1) |
| $ H = \frac{{{P_{\rm{m}}}}}{{1 + {{\left( {{K_{{\rm{hyd}}}}} \right)}^{ - n}}}} $ | (2) |
式中,H是t时刻的累积产氢量,mL;Pm是产氢潜能,mL;λ是延滞期,h;Rm是最大产氢速率,mL/h;Khyd是水解速率常数,h-1;n是形状因子。
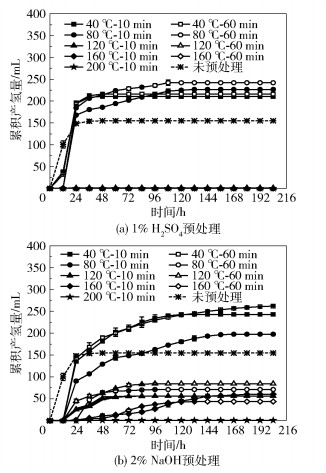
2 结果与分析 2.1 氢气产量在暗发酵阶段,不同温度下采用1% H2SO4和2% NaOH预处理玉米秸秆的累积产氢量和单位TS产氢量如图 2和图 3所示。可以看出,各预处理组累积产氢量的变化趋势是一致的。开始时,产氢量逐渐增加,随着暗发酵的进行,产氢量逐渐趋于平稳。当温度在120 ℃以下时,采用1% H2SO4预处理的累积产氢量随着预处理温度的升高和预处理时间的增加而增大,累积产氢量在温度为40 ℃、预处理10 min和60 min的条件下分别达到211.6 mL和216.8 mL,单位TS产氢量分别为23.5 mL/g和24.1 mL/g;在温度为80 ℃、预处理10 min和60 min的条件下累积产氢量分别达到227.7 mL和243.0 mL,单位TS产氢量分别为25.3 mL/g和27.0 mL/g,其中在温度80 ℃、预处理60 min的条件下获得最高的单位TS产氢量(27.0 mL/g),比未预处理玉米秸秆的单位TS产氢量(17.3 mL/g)提高了56.27%(P < 0.05)。当预处理温度相同时,预处理时间对产氢量无显著性差异(P>0.05)。采用2% NaOH预处理,当温度为40 ℃、预处理10 min和60 min时的累积产氢量分别为244.2、263.5 mL,其中在温度为40 ℃、预处理60 min的条件下获得最高单位TS产氢量29.3 mL/g,比未预处理玉米秸秆的单位TS产氢量提高了69.42%(P < 0.05)。当温度升高到80 ℃时,在预处理10 min的条件下,累积产氢量下降至198.8 mL(P < 0.05)。其他预处理条件下的产氢量均低于未预处理玉米秸秆(P < 0.05),甚至不产气。
|
图 2 玉米秸秆在不同预处理条件下的累积产氢量 Fig.2 Cumulative hydrogen production of corn stover with different pretreatment conditions |

|
H代表采用1% H2SO4预处理,OH代表采用2% NaOH预处理。 图 3 玉米秸秆在不同预处理条件下的单位TS产氢量 Fig.3 Hydrogen production per TS of corn stover with different pretreatment conditions |
为了衡量不同预处理条件下暗发酵产氢的效率,使用暗发酵累积产氢量达到总氢气产量90%所用的产氢时间(t90)来进行评价[16]。采用1% H2SO4预处理的各实验组的t90为24~72 h,而采用2% NaOH预处理的各实验组的t90为36~144 h,1% H2SO4预处理比2% NaOH预处理的t90提前了33.33%~50.00%,所以1% H2SO4预处理的暗发酵效率更高。
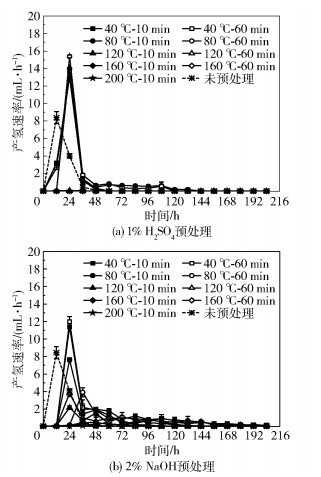
2.2 产氢速率不同预处理条件下秸秆产氢速率如图 4所示。可以看出,产氢主要集中在前48~96 h。当温度在120 ℃以下时,采用1% H2SO4预处理的前48 h平均产氢速率为3.89~4.52 mL/h,高于未预处理组的平均产氢速率(3.24 mL/h)。而采用2% NaOH预处理组在温度为40 ℃、预处理60 min时的平均产氢速率最高仅为3.80 mL/h,低于1% H2SO4预处理组。
|
图 4 玉米秸秆在不同预处理条件下的产氢速率 Fig.4 Hydrogen production rate of corn stover with different pretreatment conditions |
各预处理组的最大产氢速率基本上出现在暗发酵前24 h内,这与Liu等[12]用HCl和NaOH预处理玉米秸秆产氢的趋势一致。而未预处理组在12 h时出现了产氢高峰,这是由于产氢菌优先利用了未预处理秸秆表面上可直接被微生物降解的小分子化合物。采用1% H2SO4在温度为40 ℃下预处理10 min和60 min时的最大产氢速率分别为13.03 mL/h和13.71 mL/h,在温度为80 ℃下预处理10 min和60 min时的最大产氢速率分别为14.02 mL/h和15.42 mL/h,均比未预处理组高出55.12%~83.57%。采用2% NaOH进行预处理,仅在温度为40 ℃、预处理10 min和60 min的条件下达到最大产氢速率11.35 mL/h和11.94 mL/h,均高于未预处理组。这是由于1% H2SO4和2% NaOH预处理有利于被包裹有机物的释放、大分子的断裂、底物水解速率的增加,从而提高产氢性能。并且从中可以看到当预处理温度相同时,最大产氢速率随着预处理时间的增加而增大。
随着厌氧发酵的进行,经过1% H2SO4预处理的玉米秸秆的产气速率逐渐降低,48 h之后停止产气。这可能是由于:1)反应器内易降解的有机底物被微生物大量利用,残留的有机物不适合制氢,从而延缓了制氢过程;2)发酵过程中代谢中间体的积累和反应器中pH值的降低限制了产氢菌的活性,进一步降低了产氢速率[17]。虽然经过2% NaOH预处理的玉米秸秆最大产氢速率均低于采用1%H2SO4在温度为40 ℃和80 ℃时的预处理组,但前者在产氢高峰后会持续产生少量的氢气,而后者则没有这种现象。这可能是由于经过碱预处理的秸秆有木质素溶出,纤维素的结晶度遭到破坏[18],所以有机物会被微生物不断地水解为还原糖,直至产氢菌可以降解的底物逐渐被消化利用完毕。
2.3 产氢动力学分析为了进一步分析不同预处理温度对玉米秸秆产氢性能的影响,采用修正后的Gompertz和Cone动力学模型分析玉米秸秆暗发酵产氢性能,相关动力学参数如表 2所示,拟合相关系数R2均在0.93~0.99之间,说明两种模型均适合于玉米秸秆暗发酵产氢过程。采用1% H2SO4在40 ℃和80 ℃下预处理10 min和60 min的最大产氢量(Pm)在211.5~236.2 mL间,采用2% NaOH在40 ℃下预处理10 min和60 min,以及在80 ℃预处理10 min的Pm在192.6~247.0 mL之间,均比未预处理组高出23.86%~58.84%,与实验得到的累积产氢量结果相近。另外在相同预处理温度下,预处理时间越长,产氢量越高。同样地,在相同预处理温度下,最大产氢速率基本上也是与预处理时间呈正比。经过2%NaOH预处理玉米秸秆的Pm和最大产氢速率(Rm)随着温度的升高和预处理时间的增加而降低,Pm和Rm的降低可能不仅是因为产生了酚类抑制物,还有可能是预处理后为了中和体系而产生了大量的NaCl,Na+会影响微生物生物膜上的渗透压,高浓度Na+会抑制厌氧过程,导致生成脂肪酸的量高于氢气量[19]。延滞期(λ)代表了启动速度,除采用2%NaOH在温度80 ℃预处理10 min的条件外,未预处理玉米秸秆的启动时间比经过预处理玉米秸秆的启动时间要短,从3.1 h增加到4.8~45.4 h。Yin等[20]利用酸碱预处理藻类产氢时也发现了部分预处理组延滞期长于未预处理组;造成这种现象的原因是预处理一方面会造成有机物如多糖的分解,当有机物的分解程度大于溶解程度时会导致厌氧初期产氢量低于未预处理组,另一方面是预处理产生的抑制物如乙酸、酚类等会导致厌氧初期产氢量低。经过酸预处理的水解速率常数(Khyd)在0.050~0.064 h-1,均高于碱预处理的0.014~0.037 h-1,但所有预处理组的Khyd均低于未预处理组,这和Yang等[15]得到的结论一致。结合最大产氢量和最大产氢速率来看,最佳的预处理方法是在温度80 ℃下,采用1%H2SO4预处理60 min,可以明显提高产氢性能。
| 下载CSV 表 2 动力学参数 Table 2 Kinetic parameters |
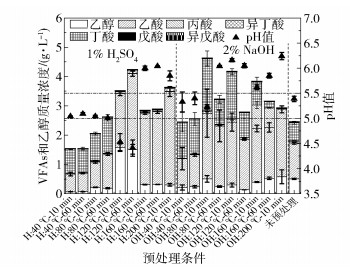
氢气主要是由产氢细菌代谢有机物产生,产氢细菌适宜的pH值范围为4.5~6.0[21]。因此,控制pH值在产氢细菌适宜的范围内有利于更好地产氢。玉米秸秆产氢过程中会伴随产生VFAs和乙醇代谢产物,pH值和这些代谢产物有一定的关联,能反映出代谢产物的类型,是评价预处理效果的重要参数之一[4]。不同预处理条件对于玉米秸秆产氢后pH值和代谢产物的影响如图 5所示,玉米秸秆在不同预处理条件下产氢后的pH值不同,代谢产物也有所不同。采用1% H2SO4在40 ℃和80 ℃下预处理,产氢后的VFAs和乙醇的总质量浓度随着预处理组温度的升高和预处理时间的增加从1 532.46 mg/L增加到2 615.86 mg/L,系统的pH值在5.01~5.09之间,其中采用1% H2SO4在40 ℃预处理10 min和60 min条件下,产氢后的乙酸和丁酸的质量浓度之和分别占VFAs和乙醇总质量浓度的94.23%、94.06%,在80 ℃预处理10 min和60 min条件下,产氢后的乙酸和丁酸的质量浓度之和分别占VFAs和乙醇总质量浓度的86.32%、92.01%,均比未预处理组中的相应值(74.62%)高。这是因为pH>5.0时,代谢产物主要为丁酸和乙酸,属于典型的丁酸型发酵[22],该发酵类型的产氢效果好,单位TS产氢量为23.5~27.0 mL/g(图 3)。温度为120 ℃,预处理10 min和60 min后的VFAs和乙醇的总质量浓度分别为3 513.39 mg/L和4 234.91 mg/L,比1% H2SO4、40 ℃下的预处理组高出34.31%~129.26%,比1% H2SO4、80 ℃下的预处理组高出61.89%~176.35%。当系统的pH值在4.41~4.53之间时,代谢产物主要是乙醇和乙酸,因为pH<4.5属于典型的乙醇型发酵[23],被认为是低产氢量的标志[24]。温度为160 ℃和200 ℃的1% H2SO4预处理组体系中的代谢产物主要是乙酸,产氢后的pH值(5.85~6.04)与初始pH值(6.0)相比基本上没有变化,不在适宜的pH值范围内(5.0~5.5),所以产氢效果不佳。2% NaOH预处理组中除了200 ℃预处理温度组不产氢外,其他温度条件下产物均以丁酸和乙酸为主,其中温度为40 ℃预处理10、60 min和80 ℃预处理10 min的实验组的pH值在5.23~5.40之间,它们的丁酸和乙酸质量浓度之和分别占VFAs和乙醇质量浓度之和的90.81%、90.02%和86.96%,均高于未预处理组,属于丁酸型发酵,该条件下的产氢效果较好,单位TS产氢量为22.1~29.3 mL/g(图 3)。而其他预处理条件下的pH值均在5.62~6.24之间,产氢效果较差,单位TS产氢量仅为0.1~9.4 mL/g(图 3)。说明产氢菌适合在pH值为5.0~5.5的环境下生长代谢,和Paudel等[25]研究中的产氢反应器所维持的pH值相吻合。当不在此pH值范围内时,产氢效果较差或不产生氢气。此外不同预处理温度会对产酸量和产酸的组分造成影响,其中丁酸型发酵的产氢效果最好。
|
H代表采用1% H2SO4预处理,OH代表采用2% NaOH预处理。 图 5 玉米秸秆在不同预处理条件下的代谢产物和pH值 Fig.5 Metabolites of corn stover and pH with different pretreatment conditions |
(1) 玉米秸秆在不同温度条件下预处理后,最佳的产氢条件为温度80 ℃、1% H2SO4预处理60 min,此时单位TS产氢量可达27 mL/g,比未预处理玉米秸秆的产氢量提高了56.27%,最大产氢速率达15.42 mL/h,比未预处理玉米秸秆提高了83.57%。
(2) 玉米秸秆产氢最适宜的pH值范围为5.0~5.5,不同预处理温度会对产酸量和产酸的组分造成影响,在较高产氢量条件下,乙酸和丁酸质量浓度之和占VFAs和乙醇质量浓度之和的86.32%~94.06%,均高于未预处理组中的相应值,其产氢过程均属于丁酸型发酵。不同预处理温度下产氢后的pH值和发酵类型会对其产氢性能产生不同的影响,因此,预处理温度是影响暗发酵制氢性能的重要因素之一,其中低温预处理效果更好。
| [1] |
YUAN T G, BIAN S W, KO J H, et al. Enhancement of hydrogen production using untreated inoculum in two-stage food waste digestion[J]. Bioresource Technology, 2019, 282: 189-196. DOI:10.1016/j.biortech.2019.03.020 |
| [2] |
ZHANG T, JIANG D P, ZHANG H, et al. Comparative study on bio-hydrogen production from corn stover:photo-fermentation, dark-fermentation and dark-photo co-fermentation[J]. International Journal of Hydrogen Energy, 2020, 45(6): 3807-3814. DOI:10.1016/j.ijhydene.2019.04.170 |
| [3] |
WANG J L, YIN Y N. Fermentative hydrogen production using various biomass-based materials as feedstock[J]. Renewable and Sustainable Energy Reviews, 2018, 92: 284-306. DOI:10.1016/j.rser.2018.04.033 |
| [4] |
MONLAU F, SAMBUSITI C, BARAKAT A, et al. Predictive models of biohydrogen and biomethane production based on the compositional and structural features of lignocellulosic materials[J]. Environmental Science and Technology, 2012, 46(21): 12217-12225. DOI:10.1021/es303132t |
| [5] |
国家统计局. 中国统计年鉴2019[M]. 北京: 中国统计出版社, 2019. National Bureau of Statistics of China. China statistical yearbook 2019[M]. Beijing: China Statistics Press, 2019. (in Chinese) |
| [6] |
FU S F, LIU R, SUN W X, et al. Enhancing energy recovery from corn straw via two-stage anaerobic digestion with stepwise microaerobic hydrogen fermentation and methanogenesis[J]. Journal of Cleaner Production, 2020, 247: 119651. DOI:10.1016/j.jclepro.2019.119651 |
| [7] |
KANG J, IRMAK S, WILKINS M. Conversion of lignin into renewable carboxylic acid compounds by advanced oxidation processes[J]. Renewable Energy, 2019, 135: 951-962. DOI:10.1016/j.renene.2018.12.076 |
| [8] |
HE L L, HUANG H, LEI Z F, et al. Enhanced hydrogen production from anaerobic fermentation of rice straw pretreated by hydrothermal technology[J]. Bioresource Technology, 2014, 171: 145-151. DOI:10.1016/j.biortech.2014.08.049 |
| [9] |
PARK J H, CHEON H C, YOON J J, et al. Optimization of batch dilute-acid hydrolysis for biohydrogen production from red algal biomass[J]. International Journal of Hydrogen Energy, 2013, 38(14): 6130-6136. DOI:10.1016/j.ijhydene.2013.01.050 |
| [10] |
NASIRIAN N, ALMASSI M, MINAEI S, et al. Development of a method for biohydrogen production from wheat straw by dark fermentation[J]. International Journal of Hydrogen Energy, 2011, 36(1): 411-420. DOI:10.1016/j.ijhydene.2010.09.073 |
| [11] |
REILLY M, DINSDALE R, GUWY A. Mesophilic biohydrogen production from calcium hydroxide treated wheat straw[J]. International Journal of Hydrogen Energy, 2014, 39(30): 16891-16901. DOI:10.1016/j.ijhydene.2014.08.069 |
| [12] |
LIU D, LI R Y, JI M, et al. Enhanced hydrogen and methane production from sewage sludge by addition of cornstalk in two-stage fermentation process[J]. Asian Journal of Chemistry, 2013, 25(12): 6535-6539. DOI:10.14233/ajchem.2013.14347 |
| [13] |
ZHANG K, REN N Q, GUO C H, et al. Effects of various pretreatment methods on mixed microflora to enhance biohydrogen production from corn stover hydrolysate[J]. Journal of Environmental Sciences, 2011, 23(12): 1929-1936. DOI:10.1016/S1001-0742(10)60679-1 |
| [14] |
American Public Health Association/American Water Works Association/Water Environment Federation. Standard methods for the examination of water and wastewater[M]. 21st ed. Washington, D.C.: American Public Health Association/American Water Works Association/Water Environment Federation, 2005.
|
| [15] |
YANG G, WANG J L. Ultrasound combined with dilute acid pretreatment of grass for improvement of fermentative hydrogen production[J]. Bioresource Technology, 2019, 275: 10-18. DOI:10.1016/j.biortech.2018.12.013 |
| [16] |
LI Y Q, LIU C M, WACHEMO A C, et al. Serial completely stirred tank reactors for improving biogas production and substance degradation during anaerobic digestion of corn stover[J]. Bioresource Technology, 2017, 235: 380-388. DOI:10.1016/j.biortech.2017.03.058 |
| [17] |
PU Y H, TANG J L, WANG X C, et al. Hydrogen production from acidogenic food waste fermentation using untreated inoculum:effect of substrate concentrations[J]. International Journal of Hydrogen Energy, 2019, 44(50): 27272-27284. DOI:10.1016/j.ijhydene.2019.08.230 |
| [18] |
CAO G L, GUO W Q, WANG A J, et al. Enhanced cellulosic hydrogen production from lime-treated cornstalk wastes using thermophilic anaerobic microflora[J]. International Journal of Hydrogen Energy, 2012, 37(17): 13161-13166. DOI:10.1016/j.ijhydene.2012.03.137 |
| [19] |
BUNDHOO M A Z, MOHEE R. Inhibition of dark fermentative bio-hydrogen production:a review[J]. International Journal of Hydrogen Energy, 2016, 41(16): 6713-6733. DOI:10.1016/j.ijhydene.2016.03.057 |
| [20] |
YIN Y N, WANG J L. Hydrogen production and energy recovery from macroalgae Saccharina japonica by different pretreatment methods[J]. Renewable Energy, 2019, 141: 1-8. |
| [21] |
XIAO B Y, HAN Y P, LIU J X. Evaluation of biohydrogen production from glucose and protein at neutral initial pH[J]. International Journal of Hydrogen Energy, 2010, 35(12): 6152-6160. DOI:10.1016/j.ijhydene.2010.03.084 |
| [22] |
崔悦.利用Fe和Fe/C提高餐厨垃圾甲烷产量的研究[D].北京: 北京化工大学, 2018. CUI Y. Improving methane production from food waste by using Fe and Fe/C[D]. Beijing: Beijing University of Chemical Technology, 2018. (in Chinese) http://cdmd.cnki.com.cn/Article/CDMD-10010-1018323999.htm |
| [23] |
陈雪, 李秀金, 张文海, 等. 酸化相发酵类型对甲烷相产甲烷性能的影响[J]. 环境工程学报, 2017, 11(11): 6007-6013. CHEN X, LI X J, ZHANG W H, et al. Effects of fermentation type of acidogenic phase on biomethane yield of methanogenic phase[J]. Chinese Journal of Environmental Engineering, 2017, 11(11): 6007-6013. (in Chinese) DOI:10.12030/j.cjee.201612153 |
| [24] |
CHU Y B, WEI Y L, YUAN X Z, et al. Bioconversion of wheat stalk to hydrogen by dark fermentation:effect of different mixed microflora on hydrogen yield and cellulose solubilisation[J]. Bioresource Technology, 2011, 102: 3805-3809. DOI:10.1016/j.biortech.2010.11.092 |
| [25] |
PAUDEL S, KANG Y, YOO Y S, et al. Effect of volumetric organic loading rate (OLR) on H2 and CH4 production by two-stage anaerobic co-digestion of food waste and brown water[J]. Waste Management, 2017, 61: 484-493. DOI:10.1016/j.wasman.2016.12.013 |








