2. 北京化工大学 化工资源有效利用国家重点实验室, 北京 100029
2. State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Technology, Beijing 100029, China
多壁碳纳米管(MWCNTs)由于具备独特的物理和化学性质,如特殊的电子特性、出色的导热性和卓越的机械强度[1-2],被认为是一种可促进各科学领域发展的新材料。近年来,将多壁碳纳米管应用于催化剂领域引起了越来越多科研人员的兴趣,尤其是将其作为非均相催化剂的载体材料。多壁碳纳米管负载金属复合材料时由于存在独特的金属/载体间相互作用,具备作为催化材料的潜力。已有研究显示,采用多壁碳纳米管为载体的催化剂比采用传统材料为载体的催化剂具备更好的催化性能[3],这种采用多壁碳纳米管的复合型催化剂可能具有较好的应用前景。
非晶态合金材料的短程有序和长程无序结构、独特的各向同性结构、热力学的亚稳状态使其具有较高体系自由能、高度不饱和性和较高的表面能等特征[4],这些特征均有助于吸附和表面反应,因此非晶态合金材料非常适合作为各类化学催化反应的活性催化剂。其中,非晶态镍-磷(Ni- P)尤其是纳米级非晶态合金材料由于在许多加氢反应中表现出高的催化活性和良好的选择性从而被认为是一种优异的加氢催化剂[5]。然而,由于纳米级非晶态合金极差的热稳定性限制了其实际应用。近年来,为了提高纳米级非晶态镍-磷合金的热稳定性和应用范围,研究者们尝试将其负载到不同载体上以提升其热稳定性和催化性能,如SiO2[6]、γ-Al2O3[7]和炭黑[8]等。然而,将多壁碳纳米管作为非晶态镍-磷合金的载体,尤其是作为纳米级镍-磷合金粒子的载体并应用于催化剂领域的研究较为少见[9],且大部分研究都集中于碳纳米管和镍磷复合镀层及其摩擦性能研究方面[10-11]。
为结合和发挥多壁碳纳米管和非晶态合金两种材料的优势并应用于催化领域,本文基于前期研究中对反应预处理步骤和时间控制步骤进行改良的化学镀沉积工艺[12],实现了在多壁碳纳米管表面负载高度分散的纳米级非晶态镍-磷合金粒子。镍-磷纳米粒子均匀地分散在多壁碳纳米管的表面,呈形状规整的球形,尺寸分布较窄。为进一步研究材料的催化性能,本文在实验室规模下选取苯的加氢催化反应评价了其催化性能。
1 实验部分 1.1 原料和试剂NiSO4 ·6H2O、NaH2PO2 ·H2O、C6H5Na3O7、(NH4)2SO4、SnCl2、PdCl2、NaOH、苯、乙醇,分析纯,国药集团化学试剂有限公司;HCl、H2SO4、HNO3,分析纯,北京现代东方精细化学品有限公司;聚二烯丙基二甲基氯化铵(PDMA),分析纯,Sigma Aldrich Fluka公司。
1.2 催化剂制备本文中使用的多壁碳纳米管通过催化剂辅助化学气相沉积法(CVD,Showa Denko公司)合成,然后在2800℃下氩气流热处理30min。得到的MWCNTs直径为50~80nm,长度为10~20μm。
在化学镀沉积之前,对多壁碳纳米管进行预处理:首先,为了在MWCNTs惰性表面引入活性位点,将MWCNTs在浓硝酸和硫酸的混合物中进行酸洗(体积比1 :3),然后用去离子水彻底洗涤至pH值为7;其次,进行化学镀沉积的两步法处理,第一步将多壁碳纳米管在含有9×10-3mol/L SnCl2、2.4×10-3mol/L HCl和0.01g PDMA的20mL水溶液中敏化30min,第二步在含有1.2×10-3mol/L PdCl2、1.2×10-2mol/L HCl和0.01g PDMA的20mL水溶液中活化30min,最后用去离子水彻底洗涤。
Ni- P/MWCNTs催化剂的制备方法如下:将50mg活化后MWCNTs加入含有0.01g PDMA的10mL去离子水中,形成液体A;配制30mL镀液B,镀液B的组成为NiSO4 ·6H2O(0.1mol/L)、NaH2PO2 ·H2O (0.2mol/L)、C6H5Na3O7(0.5mol/L)、(NH4)2SO4(0.5mol/L)和NaOH(0.3mol/L);在90℃条件下,磁力搅拌混合液体A和镀液B,混合后进行化学镀沉积反应10min,过滤所得催化剂,去离子水充分洗涤,最后在80℃真空干燥器中干燥。
1.3 催化剂表征通过电感耦合等离子体质谱(IC P- MS,7700 series,Agilent Technologies)、X射线能谱仪(EDS,INC A- Pent a- FE T- X3,Oxford)测定多壁碳纳米管上负载镍-磷纳米粒子的组成和负载量。通过比表面分析仪(BET,Quadrasorb S I- M P- 9,Quantachrome)测定催化剂比表面积。通过傅里叶变换红外光谱仪(F T- IR,8700/continuum XL,Nicolet)表征多壁碳纳米管的表面化学状态。通过扫描电子显微镜(F E- SEM,JS M- 6701F,JEOL)和高分辨率透射电子显微镜(H R- TEM,JE M- 2000FE,JEOL)观察Ni- P/MWCNTs催化剂表面形态。通过X射线衍射仪(XRD,RINT 2200V/PC,Rigaku)(CuKα,波长1.54178)和选择区域电子衍射仪(SAED,Hitachi H- 800,Hitachi)测定催化剂的晶体结构。通过差示热分析仪(DTA,Therm plus EVO TG8120,Rigaku)研究催化剂非晶态相变过程和温度。通过X射线光电子能谱仪(XPS,ThermoVG RSCAKAB 250X,Thermo Electron)测定催化剂表面元素的电子态。
1.4 催化剂活性测试苯催化加氢反应在装有磁力搅拌器和电加热系统的100mL不锈钢高压釜中进行。将Ni- P/MWCNTs催化剂(0.1g)、苯(2.0g)和乙醇(32mL)放入高压釜中。密封后,在密闭通风橱中用微量氢气吹扫高压釜内3次以上除去空气。然后加入不同压力(2.0~4.0MPa)的H2气体,缓慢加热(60℃/h)至需要温度(100~200℃),剧烈搅拌(500r/min)下进行不同反应时间的苯加氢反应。通过配备有火焰离子化检测器(FID)的气相色谱仪(GC,GC 14C,Shimadzu)测定反应产物成分。
2 结果与讨论 2.1 催化剂的化学组成和比表面积为了表征Ni- P/MWCNTs催化剂的化学和物理特性,通过IC P- MS测定催化剂中镍-磷纳米粒子的元素组成,并通过多点Brunaue r- Emmet t- Teller(BET)方法测量其比表面积(SSA)。IC P- MS和BET分析结果表明,催化剂的组成为Ni73.8P26.2,比表面积SBET为25.4m2/g,远大于无载体的Ni- P材料(SBET=3.3m2/g)[13],这表明多壁碳纳米管载体可以减少纳米粒子的团聚,得到更好的分散度和更高的比表面积(SSA)。通过EDS分析得到Ni负载量(质量分数)为84.4%,按照催化剂化学组成计算得到P负载量(质量分数)为15.8%。
2.2 多壁碳纳米管预处理步骤效果通过F T- IR表征了多壁碳纳米管的表面化学状态。比较图 1中未预处理、酸处理后的多壁碳纳米管F T- IR谱图可以发现,经过HNO 3- H2SO4混合酸处理改性后的多壁碳纳米管表面在1714cm-1、1572cm-1和1382cm-1处出现了新的吸收峰,分别对应着羧酸基团的C[FY=, 1]O拉伸[14]、碳纳米管的碳环平面振动[15]和—COOH基团的OH弯曲变形[15]。通过预处理引入的这些含氧官能团可增加多壁碳纳米管的表面反应性,有助于通过相对较强的静电相互作用牢固地锚定镍-磷纳米粒子。此外,在3434cm-1和1630cm-1处观察到的强峰来源于KBr基质吸收的水(3434cm-1和1630cm-1分别是H2O的拉伸和变形振动)。水诱导吸收峰的存在使得通常可观察到的源于羧基的—OH伸缩振动峰不可见。比较图 1中酸处理后和敏化-活化后的多壁碳纳米管F T- IR谱图可以发现,敏化-活化处理后,1714cm-1、1572cm-1和1382cm-1处与含氧官能团相关的峰强度相对降低,表明部分含氧官能团被引入的微量的钯(Pd)纳米粒子取代,这将有助于化学镀沉积过程。
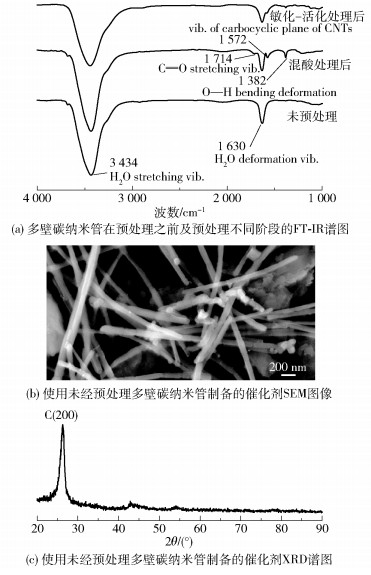
|
图 1 多壁碳纳米管预处理步骤的作用 Fig.1 The effect of the pretreatment step for MWCNTs |
图 1(b)和(c)分别是通过相同实验方法,但采用未预处理多壁碳纳米管制备的催化剂的SEM图和XRD谱图。从SEM图可以看出,多壁碳纳米管表面未见镍-磷纳米粒子,保持了最初的表面形态。该结果也可被图 1(c)所证实,即图中结果表明只检测到对应于多壁碳纳米管的几个衍射峰,这证明无法将镍-磷纳米粒子负载到未处理过的多壁碳纳米管载体的表面。此研究结果证明了多壁碳纳米管预处理步骤的重要性。
2.3 催化剂的形态特征图 2(a)为Ni- P/MWCNTs催化剂的SEM图像,从图中可观察到镍-磷纳米粒子均匀分布在多壁碳纳米管的表面,平均尺寸约100nm。与其他的研究工作[9]相比,本文制备的镍-磷纳米粒子分散更为均匀,无明显团聚现象。这表明本文中采用的化学镀沉积工艺对于制备纳米级镍-磷催化剂是切实有效的。图 2(a)的插图为多壁碳纳米管上单个镍-磷粒子的高放大倍率SEM图像。与课题组前期制备的Ni- B/MWCNTs表面形态相比[12],镍-磷纳米粒子的表面更为平滑,但由许多凸起的亚基组成。该子单元的结构据我们所知尚未有报道,它可能有助于镍-磷纳米粒子形成较大的表面积,以改善催化剂的活性。

|
图 2 Ni- P/MWCNTs催化剂表面形态 Fig.2 Surface morphology of the Ni- P/MWCNTs catalysts |
图 2(b)为Ni- P/MWCNTs催化剂的H R- TEM图像。可以看出镍-磷纳米粒子呈球形,且均匀负载在多壁碳纳米管的侧壁上,平均尺寸为100nm。与课题组之前研究的Ni- B纳米粒子的“花状”形状[12]不同,此Ni- P纳米粒子为实心结构,未见孔道状结构。镍-磷纳米粒子的高倍率H R- TEM图像(图 2(b)插图)也证实了纳米粒子为实心结构。
2.4 催化剂的晶体结构图 3(a)为Ni- P/MWCNTs催化剂的XRD谱图。在2θ=26°处的衍射峰为多壁碳纳米管的石墨化碳C(002)。2θ=45°处的宽化峰对应于镍-磷晶体中的第一相邻距离,证明了镍-磷纳米粒子的非晶态结构,此结果与其他研究人员的报道一致[13, 15]。此外,SAED检测结果(图 3(a)插图)显示出源自镍-磷纳米粒子无定形结构的模糊特征环,证明了制备的Ni- P/MWCNTs催化剂的无定形特征,图案中的几个亮点源自碳纳米管。
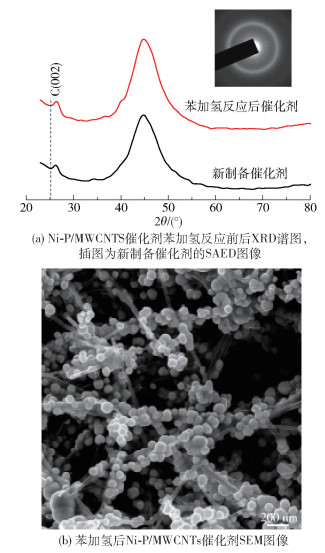
|
图 3 Ni- P/MWCNTs催化剂的晶体结构和稳定性 Fig.3 Crystal structure and stability of the Ni- P/MWCNTs catalyst |
非晶态催化剂在高温和高压加氢反应中的热稳定性是评价其应用效果的重要指标,因此分别通过XRD、SEM和DTA分析评价了非晶态镍-磷纳米粒子作为加氢催化剂的结构稳定性和热稳定性。
苯加氢反应后催化剂XRD谱图见图 3(a),可以看出加氢反应后,镍-磷催化剂仍保持为非晶态。图 2(a)和图 3(b)分别为苯加氢反应前后催化剂的SEM图,从图 3(b)可以看出,催化剂表面形态在加氢反应前后基本保持不变,镍-磷纳米粒子仍然均匀分散,未观察到明显的团聚现象。根据前人的研究[16],镍-磷非晶态合金氢化活性的降低主要源自其结构性质的变化,其中非晶态特征的损失、纳米粒子聚集成块状物导致的表面积减小、镍-磷纳米粒子在表面上均匀分布状态的消失是导致镍-磷非晶合金活性降低的最重要因素。以上结果表明苯加氢后Ni- P/MWCNTs催化剂的催化活性仍同反应前催化剂保持在同一水平。
图 4为Ni- P/MWCNTs催化剂在10℃/min加热速率下的DTA曲线。在整个温度区域(100~500℃)观察到的宽峰可能与结晶镍的短程原子运动和初级结晶有关[17]。在359℃观察到的尖峰为Ni3P金属间化合物的结晶峰[18]。因此,镍-磷纳米粒子的非晶结构在359℃下热转变为晶体结构。同时,在DTA曲线中没有观察到源自多壁碳纳米管的放热峰,这是因为石墨化多壁碳纳米管在低于500℃时是热力学稳定的[19]。因此可以得出结论,Ni- P/MWCNTs催化剂在低于359℃时热稳定较好。与未负载的镍-磷纳米粒子的晶化温度(282℃)[16]相比,本文合成的Ni- P/MWCNTs催化剂的晶化温度提高了77℃,证明了多壁碳纳米管载体对提高催化剂热稳定性有显著作用。
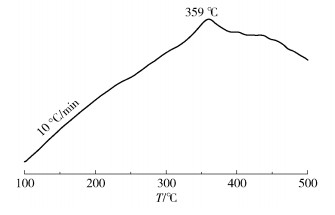
|
图 4 Ni- P/MWCNTs催化剂的差热分析曲线 Fig.4 DTA curve of Ni- P/MWCNTs catalyst |
图 5(a)为热处理过程中Ni- P/MWCNTs催化剂的相态变化过程。与图 1(a)相同,图 5(a)中所有曲线在2θ=26°处的峰均为多壁碳纳米管的石墨化C(002)峰。图 5(a)新制备的Ni- P/MWCNTs催化剂中约2θ=45°处的宽峰对应于Ni- P晶体中的第一相邻距离,表明镍-磷合金为非晶态结构。当在350℃下处理Ni- P/MWCNTs催化剂后,对应于Ni和Ni3P各种晶体衍射峰开始同时出现在350℃下热处理后的催化剂中(图 5(a))。通过比较发现,Ni3P相的出现温度(350℃)远高于其他研究人员报道的温度(307℃)[6],表明本文制备的催化剂具有较高的热稳定性,在350℃仍处于非晶态,但镍-磷纳米粒子中已开始出现少量的微晶。当处理温度从350℃增加到400℃时,结晶Ni和Ni3P的峰强度逐渐增大,如图 5(a)中400℃下热处理后的催化剂所示。最后,当温度升高到800℃时,基线平坦且XRD图中非晶态结构消失,结晶过程最终完成。图 2(a)和图 5(b)分别为热处理前的Ni- P/MWCNTs催化剂和热处理至800℃催化剂的SEM图像。可以观察到,800℃热处理后,晶体结构的变化导致了催化剂表面形态的变化,纳米粒子团聚形成直径约为300~500nm的较大粒子。

|
图 5 不同温度热处理前后催化剂的XRD谱图和热处理后的表面形貌 Fig.5 XRD of Ni- P/MWCNTs catalyst before and after heat treatment at different temperatures and surface morphology after heat treatment |
通过以上研究可知,Ni- P/MWCNTs催化剂晶化过程中晶态Ni和Ni3P相在350℃下开始同时形成。因此,Ni- P/MWCNTs催化剂在350℃以下热稳定较好,纳米级镍-磷粒子能保持非晶态结构,这与DTA结果一致。
2.6 催化剂表面电子状态通过XPS表征分析了Ni- P/MWCNTs催化剂的表面电子态,结果如图 6所示。在图 6(a)的Ni2p谱图中,Ni2p3/2在853.2eV和856.4eV处观察到的两个峰分别为元素态Ni和氧化态Ni[20],根据峰面积可知非晶态Ni- P合金表面镍主要以元素态存在。在图 6(b)的P2p谱图中,在130.2eV和133.5eV处观察到的两个峰分别为元素态P和氧化态P。同Ni(853eV)和纯P(130eV)的标准结合能(BE)相比,催化剂中Ni和P的BE值几乎没有变化,说明镍-磷纳米粒子中镍元素和磷元素之间的电子相互作用可以忽略不计。Li等[6]揭示了镍-磷合金中电子转移的方向主要依赖于P含量,当P含量非常高时,Ni向P提供电子;然而当P含量非常低时,Ni接受来自P的电子。Tamaki和Imanaka[21]发现当P含量(原子数分数)显著低于25%时,P向Ni提供电子;当P含量显著高于25%时,Ni向P提供电子;当P含量在25%左右时,Ni和P之间没有电子转移。在本文的研究工作中,催化剂的组成对应于Ni73.8P26.2,P含量约为25%,这也侧面验证了XPS的结论。
如图 6(c)的C1s谱图所示,284.6eV、285.6eV和288.5eV处存在的3个峰可归属于广泛离域的sp2-杂化碳(C=C)、羟基碳(C—OH)[22]和纳米管表面上的羧基碳(OC=O)[22]。结果表明,用浓酸预处理可以将含氧官能团引入到多壁碳纳米管的惰性侧壁上,引入的官能团有利于随后的化学镀沉积过程中镍-磷纳米粒子在多壁碳纳米管上的附着,有助于纳米粒子的均匀分散。
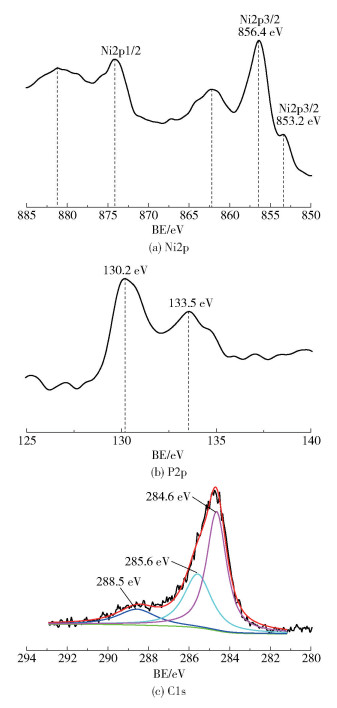
|
图 6 Ni- P/MWCNTs催化剂的XPS谱图 Fig.6 XPS spectra of Ni- P/MWCNTs catalysts |
苯加氢在石油工业和环境保护中具有重要意义[23]。环己烷是尼龙- 6和尼龙- 66的前体,主要通过苯加氢方法生产[24]。近来,苯加氢技术引起了人们对石油产品,特别是溶剂油中芳烃去除的重新关注[23]。本文以苯加氢作为反应模型,评价了Ni- P/MWCNTs催化剂的催化性能。通过气相色谱(GC)对加氢后所有产物进行测定和分析。根据GC分析结果,在不同反应条件下,虽然苯的转化率不同,但环己烷均为唯一的反应产物,证明了催化剂对于苯加氢形成环己烷具有良好的选择性。
为了优化氢化条件,通过改变3个参数即反应温度、氢气压力和反应时间来研究苯的转化率。图 7(a)为反应温度对苯转化率的影响,可以看出转化率随着反应温度升高而增大,并且在180℃附近达到约58.3%的最大值,最后在200℃时降至49.4%。据报道[25],在VIII族金属催化剂的芳族氢化中,总是观察到一个最大值,并且镍催化剂的转化率最大值对应的温度为450K。原因可归结如下:首先,在低温区域,动力学效应起到促进转化的作用,但随着反应温度的提升,反应的热力学效应占优势,导致转化率降低;其次,芳香族是通过π键吸附在镍粒子表面,随着反应温度的升高,芳香族表面覆盖率降低,这在某些时候可能导致反应概率的降低;最后,观察到的温度最大值也可以通过苯和氢反应物分子的竞争吸附来解释[25-26]。
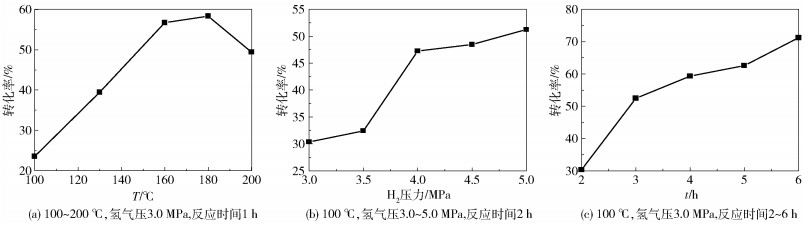
|
图 7 XPS spectra of Ni- P/MWCNTs catalysts Fig.7 Benzene conversion under various reaction conditions |
苯转化率和氢气压力之间的关系如图 7(b)所示。随着在3.5~4.0MPa范围内氢气压力的增加,转化率急剧增大,最终达到最大值约51.2%。图 7(c)展示了苯转化率随反应时间的变化,表明转化率在反应时间为6h时达到最大值71.2%。如果反应时间继续延长,预计苯转化率会进一步增大。
综合以上,采用Ni- P/MWCNTs催化剂的苯加氢反应可以通过适当地改变反应温度、氢气压力和反应时间而对条件进行优化,转化率可高达71.2%。与在相似反应条件下报道的Ni- P/CNT催化剂催化苯加氢转化率[9]相比,本文催化剂的最高转化率(71.2%)比文献中的最高转化率高约10%。Liu等[27]报道在5MPa氢气压力,1h反应时间和140℃条件下,非晶态R u- L a- B/ZrO2催化剂催化反应中苯加氢转化率达到85.9%,同本文工作中相似条件下获得的数据(2MPa氢气压力,1h反应时间和160℃下转化率56.7%)相比,转化率高出29.2%,但环己烷的选择性得率仅为53.2%,而本文研究中催化剂对于苯加氢制备环己烷选择性得率为100%,证明我们的催化剂具有更好的选择性。Arun等[28]的研究表明,当利用[RuII(L)(Cl)(H2O)2] ·H2O和[NiII(L)(Cl)(H2O)2] ·H2O催化苯加氢反应时,在5MPa氢气压力,2h反应时间和140℃条件下可实现苯的最高转化率和环己烷的最高选择性产率,分别为[RuII(L)(Cl)(H2O)2] ·H2O的20.7%、82%,[NiII(L)(Cl)(H2O)2] ·H2O的3.6%、43%,加氢性能均远低于本文结果。综上,本文制备的Ni- P/MWCNTs非晶态催化剂显示出较高的催化活性,对于苯选择性加氢转化至环己烷显示出良好的选择性。
催化剂表现出良好的催化活性,载体的作用不可忽视,利用碳纳米管为非晶态合金载体的复合催化剂表现出比运用传统载体材料制备的催化剂更好的催化性能,其主要在以下几个方面表现出优势:①碳纳米管的长径比大,导致其比表面积较大,因此采用碳纳米管作为催化剂的载体会使得催化剂整体的比表面积大大提高(2.1节),为各种催化反应提供充足的反应场所;②碳纳米管具有很好的化学反应和电化学反应的稳定性[29];③碳纳米管表面具有高的表面能,经酸化预处理后其表面会引入很多含氧的官能团(如—OH、—COOH等)和表面缺陷,为催化反应提供了众多的活性点(2.2节);④与传统碳材料相比,碳纳米管具有更好的电子传递的动力学能力,采用碳纳米管作为催化剂载体可以促进反应的电子传递速率[30];⑤当碳纳米管作为非晶态合金的载体材料时,其会向非晶态合金中的金属元素,例如镍系非晶态合金中的Ni元素转移电子而形成富集电子,有助于提高其催化性能[4, 31];⑥碳纳米管的比表面积大,机械强度高,热稳定性高的特点,正好同非晶态催化剂形成了互补,特别适合为非晶态催化剂的优良载体。胡长员等[31]研究对比了多种载体材料,结果表明碳纳米管载体促进了催化剂对氢气的吸附并减弱了对乙炔的吸附,提高了加氢活性和选择性,效果最佳。
3 结论(1) 通过碳纳米管的混酸处理、敏化和活化预处理步骤,采用化学镀工艺成功制备了镍-磷/多壁碳纳米管(Ni- P/MWCNTs)催化剂,得到平均尺寸约为100nm的纳米级镍-磷合金粒子。纳米粒子为实心结构,化学组成为Ni73.8P26.2(Ni3P),均匀分散并附着在MWCNTs载体表面。XRD和SAED分析结果表明镍-磷纳米粒子为非晶态结构,且催化剂在350℃以下热稳定性较好。
(2) 在适当的反应条件下,Ni- P/MWCNTs催化剂对于苯加氢的转化率可以达到71.2%,苯可100%选择性地转化为环己烷。
本文结果证明了化学镀工艺可在多壁碳纳米管上有效负载纳米级非晶态镍-磷合金粒子,所得催化剂在苯加氢反应中表现出较高的催化活性及稳定性。
| [1] |
OBERLIN A, ENDO M, KOYAMA T. Filamentous growth of carbon through benzene decomposition[J]. Journal of Crystal Growth, 1976, 32(3): 335-349. |
| [2] |
LIJIMA S, ICHIHASHI T. Single-shell carbon nanotubes of 1-nm diameter[J]. Nature, 1993, 363: 603-605. |
| [3] |
WANG F, ARAI S, ENDO M. Preparation of nickel-carbon nanofiber composites by a pulse-reverse electrodeposition process[J]. Electrochemistry Communications, 2005, 7(7): 674-678. |
| [4] |
LI H X, XU Y P, LI H, et al. Gas-phase hydrogenation of adiponitrile with high selectivity to primary amine over supported Ni-B amorphous catalysts[J]. Applied Catalysis A:General, 2001, 216(1/2): 51-58. |
| [5] |
GUILLOU N, GAO Q M, FORSTER P M, et al. Nickel(Ⅱ) phosphate VSB-5:a magnetic nanoporous hydrogenation catalyst with 24-ring tunnels[J]. Angewandte Chemie International Edition, 2001, 40(15): 2831-2834. |
| [6] |
LI H X, WANG W J, LI H, et al. Crystallization deactivation of Ni-P/SiO2 amorphous catalyst and the stabilizing effect of silica support on the Ni-P amorphous structure[J]. Journal of Catalysis, 2000, 194(2): 211-221. |
| [7] |
JEON J K, PARK S K, PARK Y K. Effects of phosphorous promoters on catalytic performance for oligomerization of butene over Ni-based catalysts[J]. Catalysis Today, 2004, 93-95: 467-470. |
| [8] |
SHU Y Y, OYAMA S T. Synthesis, characterization, and hydrotreating activity of carbon-supported transition metal phosphides[J]. Carbon, 2005, 43(7): 1517-1532. |
| [9] |
JU Y, LI F Y. A novel carbon nanotube-supported NiP amorphous alloy catalyst and its hydrogenation activity[J]. Journal of Natural Gas Chemistry, 2006, 15(4): 313-318. |
| [10] |
ALISHAHI M, MONIRVAGHEFI S M, SAATCHI A, et al. The effect of carbon nanotubes on the corrosion and tribological behavior of electroless Ni-P-CNT composite coating[J]. Applied Surface Science, 2012, 258(7): 2439-2446. |
| [11] |
YANG Z, XU H, SHI Y L, et al. The fabrication and corrosion behavior of electroless Ni-P-carbon nanotube composite coatings[J]. Materials Research Bulletin, 2005, 40(6): 1001-1009. |
| [12] |
LIU Z, LI Z L, WANG F, et al. Electroless preparation and characterization of Ni-B nanoparticles supported on multi-walled carbon nanotubes and their catalytic activity towards hydrogenation of styrene[J]. Materials Research Bulletin, 2012, 47(2): 338-343. |
| [13] |
LEE S P, CHEN Y W. Selective hydrogenation of furfural on Ni-P, Ni-B, and Ni-P-B ultrafine materials[J]. Industrial and Engineering Chemistry Research, 1999, 38(7): 2548-2556. |
| [14] |
KIM B, SIGMUND W M. Functionalized multiwall carbon nanotube/gold nanoparticle composites[J]. Langmuir, 2004, 20(19): 8239-8242. |
| [15] |
LI C S, TANG Y P, YAO K F, et al. Decoration of multiwall nanotubes with cadmium sulfide nanoparticles[J]. Carbon, 2006, 44(10): 2021-2026. |
| [16] |
LI H X, CHEN H Y, DONG S Z, et al. Study on the crystallization process of Ni-P amorphous alloy[J]. Applied Surface Science, 1998, 125(1): 115-119. |
| [17] |
KEONG K G, SHA W, MALINOV S. Crystallization and phase transformation behaviour of electroless nickel-phosphorus deposits with low and medium phosphorus contents under continuous heating[J]. Journal of Materials Science, 2002, 37: 4445-4450. |
| [18] |
WANG F, ARAI S, ENDO M. The preparation of multi-walled carbon nanotubes with a Ni-P coating by an electroless deposition process[J]. Carbon, 2005, 43(8): 1716-1721. |
| [19] |
ENDO M, KOYAMA T. Heat resistance properties of vapor-grown carbon fiber in air[J]. Tanso, 1980, 101: 59-62. |
| [20] |
DENG J, YANG J, SHENG S, et al. The study of ultrafine Ni-B and Ni-P amorphous alloy powders as catalysts[J]. Journal of Catalysis, 1994, 150(2): 434-438. |
| [21] |
TAMAKI J, IMANAKA T. Surface state of amorphous nickel phosphide films prepared by RF sputtering[J]. Chemistry Letters, 1986, 5: 679-682. |
| [22] |
KOVTYUKHOVA N I, MALLOUK T E, PAN L, et al. Individual single-walled nanotubes and hydrogels made by oxidative exfoliation of carbon nanotube ropes[J]. Journal of the American Chemical Society, 2003, 125(32): 9761-9769. |
| [23] |
QIAO M H, XIE S H, DAI W L, et al. Ultrafine Ni-Co-W-B amorphous alloys and their activities in benzene hydrogenation to cyclohexane[J]. Catalysis Letters, 2001, 71(3/4): 187-192. |
| [24] |
LIU S C, LIU Z Y, ZHAO S H, et al. Study on the nanosized amorphous Ru-Fe-B/ZrO2 alloy catalyst for benzene selective hydrogenation to cyclohexene[J]. Journal of Natural Gas Chemistry, 2006, 15(4): 319-326. |
| [25] |
MOLINA R, PONCELET G. Hydrogenation of benzene over alumina-supported nickel catalysts prepared from Ni(Ⅱ) acetylacetonate[J]. Journal of Catalysis, 2001, 199(2): 162-170. |
| [26] |
LINDFORS L P, SALMI T. Kinetics of toluene hydrogenation on a supported nickel catalyst[J]. Industrial and Engineering Chemistry Research, 1993, 32: 34-42. |
| [27] |
LIU S C, LIU Z Y, WANG Z, et al. Characterization and study on performance of the Ru-La-B/ZrO2 amorphous alloy catalysts for benzene selective hydrogenation to cyclohexene under pilot conditions[J]. Chemical Engineering Journal, 2008, 139(1): 157-164. |
| [28] |
ARUN V, SRIDEVI N, ROBINSON P P, et al. Ni(Ⅱ) and Ru(Ⅱ) schiff base complexes as catalysts for the reduction of benzene[J]. Journal of Molecular Catalysis A:Chemical, 2009, 304(1/2): 191-198. |
| [29] |
WANG F, ARAI S, ENDO M. Metallization of multi-walled carbon nanotubes with copper by an electroless deposition process[J]. Electrochemistry Communications, 2004, 6(10): 1042-1044. |
| [30] |
NUGENT J M, SANTHANAM K S V, RUBIO A, et al. Fast electron transfer kinetics on multiwalled carbon nanotube microbundle electrodes[J]. Nano Letters, 2001, 1(2): 87-91. |
| [31] |
胡长员, 李凤仪, 张荣斌, 等. 碳纳米管对非晶态NiB合金催化剂性能的影响[J]. 分子催化, 2005, 19(5): 346-350. HU C Y, LI F Y, ZHANG R B, et al. The effect of CNTs on performance of amorphous NiB catalyst[J]. Journal of Molecular Catalysis(China), 2005, 19(5): 346-350. (in Chinese) |








