厌氧消化是近年来我国餐厨垃圾处理领域的热点技术之一。有机物的厌氧微生物代谢过程可分为水解、产酸和产甲烷三大阶段,其中产酸阶段速率最快,不易控制[1]。由于餐厨垃圾富含易降解的有机质、油脂含量高[2]等特点,当厌氧消化过程的系统运行参数发生快速变化,尤其是在高负荷下,产酸阶段产生的大量挥发性脂肪酸(VFA)难以在产甲烷阶段被及时消耗,不仅酸积累导致体系pH值快速下降,而且过量的VFA抑制产甲烷菌的活性,从而导致系统失稳甚至酸败。因此,厌氧系统失稳状态的诊断和预警一直是工程化推广中的难题。
目前在研究和实际生产中常用pH值、产气量、产气成分、碱度、VFA等作为厌氧过程稳定性的指示性参数。何清明[3]在餐厨垃圾厌氧消化冲击试验中定义甲烷产率连续下降幅度达到50%的首日时间为系统失稳时间;彭绪亚等[4]选取碳酸氢盐碱度(DBA)与总碱度(DTA)的比值及挥发性脂肪酸总浓度(DVFA)与碳酸氢盐碱度的比值作为酸化抑制的指示性指标,提出当DVFA/DBA >0.8及DBA/DTA < 0.4时,系统的缓冲能力下降,标志着酸化的发生;Polag等[5]在线监测甲烷的稳定碳同位素(δ13CCH4),发现δ13CCH4值比传统指标提前5~10d发生变化;Li等[6]则建议使用厌氧生物产气中甲烷与二氧化碳的体积比作为工程应用的厌氧消化预警指标。然而,这些参数在用于表征厌氧微生物的活性时通常存在一定的滞后性,往往在微生物代谢已经失衡后才表现出明显的波动。在工程上,若能提早发现系统失稳并做出相应调整,能够大大减少不必要的损失,同时提高体系运行效率。因此,开发一种能够及时反映系统酸化状态的方法及确立新型预警指标显得尤为重要。
胞外聚合物(EPS)是微生物在一定环境条件代谢过程中产生的一种用于自我保护和相互粘附的有机大分子聚合物。EPS的组成包括微生物代谢分泌物、细胞自溶物以及大分子物质的水解产物[7],多糖和蛋白质约占EPS总质量的70% ~80%。EPS与微生物细胞的生长状态紧密相关,它在帮助微生物抵御外界不良环境的同时也加强了微生物细胞之间的沟通与社会合作,提高了微生物对于干燥以及有毒环境的耐受性[8-9],在一定程度上可以反映系统状态。
目前对EPS的研究主要集中在好氧颗粒污泥EPS聚集、解离与污泥理化性质的关系上[10],例如胞外多糖对于增强细胞膜的机械稳定性效果[8]、胞外蛋白对于改善微生物在高浓度乙酸环境中的适应性效果[11],以及EPS对环境污染物的富集效应。目前,对于厌氧消化过程中EPS组分变化与微生物系统稳定性之间的关联关系研究仍然很少。
本研究针对餐厨垃圾厌氧消化在高负荷下容易酸化且缺乏有效预警指标的问题,在中温条件下进行简单体系的批式厌氧消化实验。本文模拟了高负荷体系下餐厨垃圾的厌氧酸化过程并提取EPS,分析其多糖、蛋白质质量浓度变化规律。通过分析对比厌氧消化过程的pH值、产气量、VFA质量浓度以及EPS成分等指标变化,探讨使用EPS来诊断和预警厌氧消化系统失稳酸败的可能性。
1 实验部分 1.1 实验原料和装置 1.1.1 实验原料为减少原料带来的干扰,实验采用复配的简单底物(无水葡萄糖,分析纯,国药集团化学试剂有限公司;蛋白胨,分析纯,北京奥博星生物技术有限公司;油脂,食用级,金龙鱼植物园)模拟餐厨垃圾进行厌氧消化实验。按照餐厨垃圾中主要成分的比例即葡萄糖:蛋白质:油脂=6 :3 :2(质量比)的配比分别投加葡萄糖、蛋白胨与植物油[12]。接种污泥取自顺义大孙各庄东华山村沼气站,其总固体含量(TS)为10.05%±0.08%,挥发性固体含量(VS)为6.12%±0.05%。接种污泥经自然沉降2h后倒去上清液,存于4℃冰箱备用。污泥使用前置于35℃恒温水箱中培养1d活化。
1.1.2 实验装置厌氧反应器选用2.5L下口出料瓶,其有效容积为1.5L。出料瓶的上口用乳胶管陆续连至1L广口瓶和1L烧杯,采用排水集气法计量厌氧系统的产气量。装置如图 1所示。
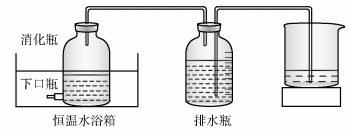
|
图 1 厌氧消化装置 Fig.1 Experiment apparatus for anaerobic digestion |
实验采用加热-阳离子树脂法提取EPS[13]。取10mL出料,以4000r/min离心5min,弃去上清液后加入0.85%NaCl补给到10mL;将样品置于水浴锅70℃加热20min后,在其中添加10g阳离子树脂(Dowex Marathon C sodium form,Sigma公司)并在三联搅拌器中以200r/min速率搅拌2h;取出样品,搅拌均匀后放入离心机中10000r/min离心10min,过滤膜(尼龙66,0.45μm,津腾公司)后得到EPS提取物。
1.2 实验设计本实验选定污泥接种量为15g/L(VS,即每L液体中含有的挥发性固体的克数)。按照底物与接种污泥的负荷比F/M(单位质量的活性污泥承受的有机物质量)=0.5、3、4(F/M=0.5称为低负荷组,F/M=3、4称为高负荷组,每个负荷比下设置3组平行实验)分别在一系列相同的反应器中添加初始进料并使用蒸馏水补充反应体积为1.5L;将物料充分摇匀后,置于35℃恒温水箱,每隔2h测定产气量与产气成分,并在摇匀后取出10mL物料,测定出料的pH值和VFA质量浓度,提取出料的EPS并测定成分。实验持续36h,36h之后体系不再产气,彻底酸化并且不再恢复。
1.3 分析方法pH值使用Therm o- 868型pH计(美国Thermo Orion公司)配合玻璃电极进行测定。气体组分使用S P- 2100气相色谱仪(北分瑞利)配合填充色谱柱和TCD检测器进行测定,测试条件为:载气使用氩气(20mL/min),填充柱柱温140℃,TCD温度150℃,进样口温度150℃。VFA使用岛津GC2014气相色谱仪配合毛细色谱柱(Agilent,D B- WAX)和FID检测器进行测定,测试条件为FID温度250℃,使用高纯氮气作为载气(30mL/min),自动进样温度250℃。气体产量用如图 1所示的排水集气法进行测定。EPS中的多糖质量浓度使用蒽酮硫酸法进行测定[14];EPS中蛋白质的质量浓度使用改进的Lowry法进行测定[15]。
2 结果与讨论 2.1 厌氧消化过程中的pH值变化图 2为3个不同F/M下厌氧消化过程的pH值变化曲线。可以看出当F/M=0.5时,pH值在15h以内小幅下降,之后趋于稳定并在6.85附近上下波动,直至36h实验结束;高负荷F/M=3、4的两个体系的pH值下降则非常明显,在实验开始的26h之内持续快速下降,在第15~22h之间尤其迅速,直至pH值降到5.5以下才变为缓慢下降,直至系统失稳。黄安寿等[16]在餐厨垃圾高温厌氧消化中发现pH值降低到6.5时,系统出现酸化。李蕾[17]在中温厌氧消化反应中则发现当pH值下降至5.5以下时,严重背离了产甲烷菌的适宜pH值范围,体系停止产气。由于体系pH值的变化受到碱度、挥发性脂肪酸等多种因素的影响,系统酸化并没有统一的pH值标准。
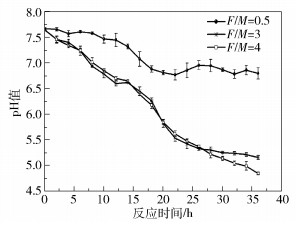
|
图 2 厌氧消化过程pH值变化 Fig.2 Variation in pH value during anaerobic digestion |
不同的物料负荷对产气量的影响较为明显,负荷越高对产甲烷过程的抑制越明显(图 3)。负荷低时厌氧消化3个阶段底物与产物代谢速率较为平衡,单位挥发性固体累积产气量处于稳定上升阶段;而对于F/M=3和F/M=4两个高负荷组,累积产气量在第16h存在明显的转折点,与图 2中pH值的急速下降处于同一时期,说明水解产物的迅速积累导致微生物反应受到抑制,致使厌氧消化产气效率下降;在高负荷反应进行到22h,累积产气量分别达到68.8mL/g(VS)和49.7mL/g(VS)后,系统几乎停止产气,甲烷产率在反应开始12h后始终非常低,实验结束时的累积产甲烷量分别为6.0mL/g(VS)和4.7mL/g(VS),只达到总产气量的12.73%。曹秀芹等[18]在餐厨垃圾中温单相有机负荷梯度实验中发现,容积沼气产率在第48d降低至1.88L/(L ·d)时系统失稳。韩国然[19]在中温批式反应中发现以累积产甲烷量作为酸化失稳预警指标时,系统在30h左右发生酸化。在不同体系中,因接种泥与进料来源的不同,产气量所对应的体系酸化情况也不尽相同,难以得出普适于不同工况的系统酸败判断法。此外,将图 2与图 3对比,发现pH值的急速下降期与累积产气量的转折点几乎同时开始,反映出产气量对系统酸败失稳的预警作用也相对滞后。
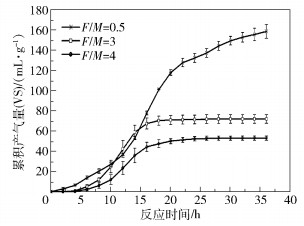
|
图 3 厌氧消化过程产气量变化 Fig.3 Variation in cumulative gas volume during anaerobic digestion |
C4及以下的挥发性有机酸和乙醇在本文中统称为VFA,是大分子有机物经水解为单糖、氨基酸等小分子后再经产酸阶段的产物,也是产甲烷阶段的主要底物。厌氧消化系统中稳定的VFA质量浓度可以体现水解、产酸和产甲烷代谢反应速率之间的平衡[20]。因此,VFA质量浓度的突然变化及变化趋势通常被用于预测厌氧过程的稳定性[21]。本文实验中,不同负荷比下的乙醇产量和VFAs的转化率如表 1所示。可以看出,高负荷下体系的乙醇产量和VFAs转化率提高。
| 下载CSV 表 1 不同负荷下乙醇产量和VFAs的转化率 Table 1 Yield of ethanol and conversion of VFAs for different F/M values |
高负荷下体系的乙醇和VFAs产生情况如图 4所示。由图 4(a)和4(b)可以看出,在反应末期系统乙酸质量浓度可达到4442mg/L,丁酸质量浓度可达5199mg/L。因此,可判断出高负荷下的厌氧消化类型为混合消化,以乙酸和丁酸为主,并伴随有少量的乙醇、丙酸产生。黄小英[22]以VFA质量浓度超出13000mg/L时作为失稳标志,曹秀芹等[18]则以2500mg/L作为阀值。在本文实验中,在距反应开始大约22h时发现pH值明显下降,产气受到严重抑制,甲烷产量几乎为零,此时VFA质量浓度超过10000mg/L,因此单纯以VFA质量浓度值作为失稳指标不具有普遍性。
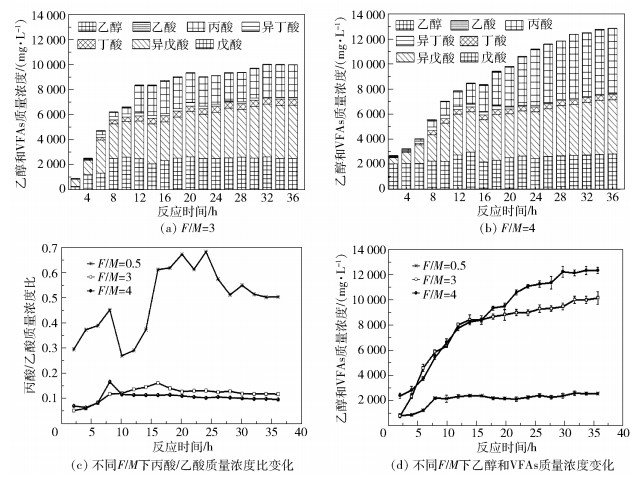
|
图 4 厌氧消化过程中的乙醇和VFAs质量浓度变化 Fig.4 Variation in amounts of ethanol and VFAs during anaerobic digestion |
丙酸由于其代谢时间较长,在体系中的留存时间比较久,对系统环境变化较为敏感。研究表明,丙酸/乙酸质量浓度比可作为厌氧消化系统的预警指标:当丙酸/乙酸质量浓度比大于1.4时,认为系统即将酸化失稳[23]。图 4(c)及(d)中,丙酸/乙酸质量浓度比始终小于1.4,然而两个高负荷系统已经明显发生酸败。F/M=3的体系在第16h达到最高峰0.16,F/M=4在第8h达到0.15,这两个时间点分别为各自的产气上升期与产气高峰期,系统运行正常。因此,限于体系底物与运行条件的不同,以VFA作为酸化失稳指标存在较多局限性。
2.4 EPS成分变化图 5所示为本文EPS中多糖(PS)和蛋白质(PN)随反应进程的变化趋势。如图 5(a)所示,EPS中多糖质量浓度呈现先大幅增长后下降,再小幅增长后持续下降的趋势。F/M=3体系EPS中多糖质量浓度在第10h出现第一个峰值,达到最高值1.01mg/mL,第二个峰值出现在第25h,为0.75mg/mL。F/M=4体系EPS中多糖质量浓度在第10h出现第一个峰值,达到最高值0.99mg/mL,第二个峰值出现在第24h,为0.74mg/mL,变化规律很接近。在实验末期,F/M=4体系的EPS中多糖质量浓度降得更低,达到0.5mg/mL。EPS中多糖具有一定的生物降解性,可作为碳源物质被利用[24]。前10h,在厌氧体系启动后由于微生物处于活跃状态,微生物对碳的利用率较高,因此胞外聚合物中的多糖质量浓度会随之增加,之后系统开始大量产气消耗碳源,多糖质量浓度随之下降[12]。第24h后,随着体系中VFA的大量积累,尤其是乙酸和丁酸,系统产气几乎停滞,pH值迅速下降,多糖质量浓度下降明显。
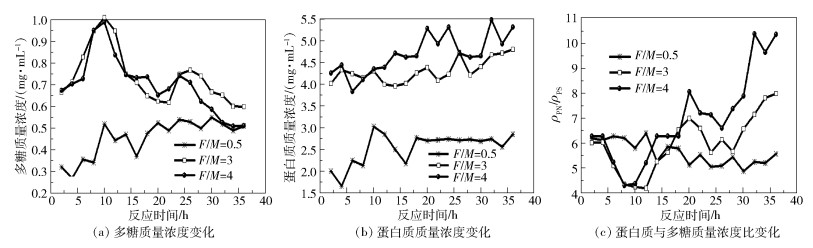
|
图 5 厌氧消化过程中的各EPS指标变化 Fig.5 Variation in amount of EPS during anaerobic digestion |
EPS中蛋白质质量浓度变化如图 5(b)所示。两组高负荷体系中蛋白质的浓度一直存在上下浮动,但总体呈上升趋势,这与许之扬等[11]的研究结果相似,说明厌氧消化中蛋白质比多糖更难被降解。F/M=4体系上升趋势更为明显,从第16h至第20h出现明显增长,对应的此时间段pH值下降速率最大,产气率明显减小,系统失稳。蛋白质本身含有疏水空腔,当乙酸浓度较高,细胞生命活动受影响时,疏水空腔能在一定程度上阻止乙酸的渗入,所以胞外聚合物中蛋白质质量浓度的提高可能是微生物主动适应高乙酸浓度环境的结果。王浩宇等[25]的研究发现,当微生物处于不利环境时会分泌大量的酶蛋白物质,从而使得胞外蛋白增加,进而提高蛋白质与多糖比值。在本文中,随着乙酸浓度不断上升,蛋白质质量浓度呈现波动式上升。该现象可能是由于微生物在环境恶化情况下的自我保护反应或是更多的微生物随着环境恶化而凋亡导致。F/M=3体系相对于F/M=4体系蛋白质质量浓度明显偏低,蛋白质增长速率也更为平缓,与此对应的VFA质量浓度值也相对较低,pH值较高,产气也相对较多,F/M=0.5体系蛋白质浓度则一直处于较低水平。以上结果再一次证明了微生物在厌氧消化过程中对于环境恶化的响应作用。
EPS中蛋白质与多糖质量浓度比值(ρPN/ρPS)变化如图 5(c)所示。F/M=4体系与F/M=3两个体系的ρPN/ρPS变化趋势基本一致,各自经历了两次小幅下降,又大幅度上升。两个体系的ρPN/ ρPS经历了短暂的下降后,分别在第12h和第10h开始上升,并且在第18~20h增幅最快,其中F/M=4体系的ρPN/ρPS在第18~20h增幅达到18.78%。Adav等[26]认为好氧颗粒污泥中EPS的ρPN/ρPS正常范围是3.4~6.2。本文实验在第18h ρPN/ρPS超过6.2,在第20h两体系同时达到第一个峰值,分别为7.01和8.03,证明了体系开始出现恶化。与此同时,在比值上升并达到峰值的阶段,两个体系pH值迅速降到6以下(图 2);产气速率也迅速下降,产甲烷过程受到抑制(图 3)。第26h后ρPN/ρPS持续上升,F/M=3体系最高达到8.0,F/M=4体系达到10.4,之后系统产气停止,彻底酸化。而F/M=0.5体系由于负荷较低,体系产酸与产甲烷代谢平衡,EPS中的多糖和蛋白质质量浓度相对稳定,ρPN/ρPS处于稳定波动状态。因此,根据ρPN/ρPS值的变化可以说明第18~20h微生物体系彻底酸败。
为了准确比较几种指标对体系酸化的预警作用,本文比较了pH值、产气量、乙醇和VFA产生量及ρPN/ρPS的相对变化量随反应时间的变化情况(图 6)。pH值、产气量、乙醇和VFA产生量变化在20h以后趋于平缓,这些指标预警酸化的时间均大于20h。而ρPN/ρPS值在18~20h处达到峰值,该峰值可以指示微生物系统的EPS状态变化,从而实现提前预警。因此,与传统的pH值、产气量、乙醇和VFA产生量等指标相比,ρPN/ρPS值可以提前、直观地预警酸化。
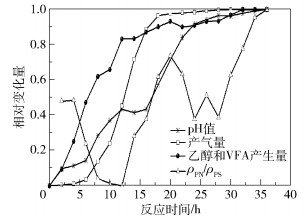
|
图 6 各指标随反应时间的相对变化量 Fig.6 Comparison of the variation of different parameters during anaerobic digestion |
(1) 研究了模拟餐厨垃圾厌氧消化过程中pH值、产气量、VFA质量浓度及EPS成分随反应时间的变化情况。在F/M=3与F/M=4两种高负荷体系下,传统指标pH值、单位VS产气量及VFA的预警时间分别为26、24h及22h。3种指标受实验体系差异的影响较大,均不能单一作为体系酸化失稳的有效衡量指标。
(2) 进一步研究表明,EPS成分在体系酸化前后变化,ρPN/ρPS值整体趋势持续上升,直至系统彻底酸化。以蛋白质与多糖质量浓度比作为酸化预警指标大约能在第18~20h做出预警,比其他常用指标提前约5h,可作为酸化预警的有效指标。
| [1] |
吴云.餐厨垃圾厌氧消化影响因素及动力学研究[D].重庆: 重庆大学, 2009. WU Y. Study on influence factors and kinetics in anaerobic digestion of kitchen wastes[D]. Chongqing: Chongqing University, 2009. (in Chinese) |
| [2] |
余杰, 杨红军. 我国城市餐厨垃圾特性及资源化利用途径[J]. 低碳世界, 2018(5): 22-23. YU J, YANG H J. Characteristics and utilization of urban kitchen waste in China[J]. Low Carbon World, 2018(5): 22-23. (in Chinese) |
| [3] |
何清明.餐厨垃圾厌氧消化过程稳定性检测系统开发与研究[D].重庆: 重庆大学, 2014. HE Q M. Research and design of process stability detection system in anaerobic digestion of food wastes[D]. Chongqing: Chongqing University, 2014. (in Chinese) |
| [4] |
彭绪亚, 贾传兴, 潘坚, 等. 餐厨垃圾单相厌氧消化系统酸化预警指标[J]. 土木建筑与环境工程, 2011, 33(4): 146-150. PENG X Y, JIA C X, PAN J, et al. Early-warning indicators of acidification in the single-phase anaerobic digestion process for food wastes[J]. Journal of Civil, Architectural & Environmental Engineering, 2011, 33(4): 146-150. (in Chinese) |
| [5] |
POLAG D, MAY T, MVLLER L, et al. Online monitoring of stable carbon isotopes of methane in anaerobic digestion as a new tool for early warning of process instability[J]. Bioresource Technology, 2015, 197: 161-170. |
| [6] |
LI D, RAN Y, CHEN L, et al. Instability diagnosis and syntrophic acetate oxidation during thermophilic digestion of vegetable waste[J]. Water Research, 2018, 139: 263-271. |
| [7] |
SHENG G P, YU H Q, LI X Y. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems:a review[J]. Biotechnology Advances, 2010, 28(6): 882-894. |
| [8] |
FLEMMING H C, WINGENDER J. The biofilm matrix[J]. Nature Reviews Microbiology, 2010, 8(9): 623-633. |
| [9] |
FLEMMING H C, WINGENDER J, SZEWZYK U, et al. Biofilms:an emergent form of bacterial life[J]. Nature Reviews Microbiology, 2016, 14(9): 563-575. |
| [10] |
DAI X H, LUO F, DAI L L, et al. Degradation of extracellular polymeric substances (EPS) in anaerobic digestion of dewatered sludge[J]. Procedia Environmental Sciences, 2013, 18: 515-521. |
| [11] |
许之扬, 周慧敏, 赵明星, 等. 挥发性有机酸对餐厨垃圾产沼气过程中胞外多聚物影响研究[J]. 食品与生物技术学报, 2014, 33(10): 1044-1049. XU Z Y, ZHOU H M, ZHAO M X, et al. Effects of volatile fatty acids on extracellular polymeric substances (EPS) during the biogas process from food wastes[J]. Journal of Food Science and Biotechnology, 2014, 33(10): 1044-1049. (in Chinese) |
| [12] |
李文, 魏晴, 马宁宁, 等. 校园餐厨垃圾组成及热解特性分析[J]. 甘肃科技, 2017, 33(13): 65-67. LI W, WEI Q, MA N N, et al. Composition and pyrolysis analysis of kitchen waste in campus[J]. Gansu Science and Technology, 2017, 33(13): 65-67. (in Chinese) |
| [13] |
杨飘, 康得军, 谢丹瑜, 等. 不同方法组合对活性污泥胞外聚合物的提取[J]. 净水技术, 2016, 35(6): 88-92. YANG P, KANG D J, XIE D Y, et al. Extraction of extracellular polymeric substances from activated sludge by different combination of methods[J]. Water Purification Technology, 2016, 35(6): 88-92. (in Chinese) |
| [14] |
路苹, 于同泉, 王淑英, 等. 蛋白质测定方法评价[J]. 北京农学院学报, 2006, 21(2): 65-69. LU P, YU T Q, WANG S Y, et al. A review on determination of protein[J]. Journal of Beijing Agricultural College, 2006, 21(2): 65-69. (in Chinese) |
| [15] |
孟玲, 王兰英, 梁大勇, 等. 桦褐孔菌多糖测定方法的比较[J]. 食品研究与开发, 2010, 31(4): 108-110. MENG L, WANG L Y, LIANG D Y, et al. The comparison of polysaccharide determination methods about Phaeoporus obliquus[J]. Food Research and Development, 2010, 31(4): 108-110. (in Chinese) |
| [16] |
黄安寿, 何永全, 曾祖刚. 餐厨垃圾高温厌氧消化过程参数研究[J]. 中国沼气, 2019, 37(2): 34-39. HUANG A S, HE Y Q, ZENG Z G. Study on parameters of high temperature anaerobic digestion of kitchen waste[J]. China Biogas, 2019, 37(2): 34-39. (in Chinese) |
| [17] |
李蕾.餐厨垃圾厌氧消化过程失稳的动力学特征及微生物机理研究[D].重庆: 重庆大学, 2016. LI L. Study on kinetics characteristics and microbial mechanism of process instability during anaerobic digestion of food waste[D]. Chongqing: Chongqing University, 2016. (in Chinese) |
| [18] |
曹秀芹, 袁海光, 丁浩, 等. 餐厨垃圾湿式厌氧消化最优有机负荷及失稳指标[J]. 环境工程学报, 2018, 12(7): 2123-2131. CAO X Q, YUAN H G, DING H, et al. Exploration of optimal organic loading rates and instability indicators in wet anaerobic digestion of kitchen waste[J]. Chinese Journal of Environmental Engineering, 2018, 12(7): 2123-2131. (in Chinese) |
| [19] |
韩国然.餐厨垃圾厌氧体系酸化失稳监测指标的比较和香豆素荧光探针方法研究[D].北京: 北京化工大学, 2018. HAN G R. Comparison of monitoring indicators instability inanaerobic digestion of food waste and study on fluorescence probe method[D]. Beijing: Beijing University of Chemical Technology, 2018. (in Chinese) |
| [20] |
LI D, CHEN L, LIU X F, et al. Instability mechanisms and early warning indicators for mesophilic anaerobic digestion of vegetable waste[J]. Bioresource Technology, 2017, 245: 90-97. |
| [21] |
WU D, LI L, ZHAO X F, et al. Anaerobic digestion:a review on process monitoring[J]. Renewable and Sustainable Energy Reviews, 2019, 103: 1-12. |
| [22] |
黄小英.餐厨垃圾混合厌氧消化产气预测研究[D].成都: 西南交通大学, 2018. HUANG X Y. Biogas production prediction from anaerobic co-digestion of food waste[D]. Chengdu: Southwest Jiaotong University, 2018. (in Chinese) |
| [23] |
贾传兴, 彭绪亚, 黄媛媛, 等. 有机垃圾厌氧消化系统失稳预警指标的研究进展[J]. 中国给水排水, 2011, 27(24): 30-35. JIA C X, PENG X Y, HUANG Y Y, et al. Research progress in early-warning indicators for imbalance of anaerobic digestion system of organic wastes[J]. China Water & Wastewater, 2011, 27(24): 30-35. (in Chinese) |
| [24] |
宋悦, 魏亮亮, 赵庆良, 等. 活性污泥胞外聚合物的组成与结构特点及环境行为[J]. 环境保护科学, 2017, 43(2): 35-40. SONG Y, WEI L L, ZHAO Q L, et al. Chemical structure and environmental behavior of extracellular polymeric substances in sludge:a review[J]. Environmental Protection Science, 2017, 43(2): 35-40. (in Chinese) |
| [25] |
王浩宇, 苏本生, 黄丹, 等. 好氧污泥颗粒化过程中Zeta电位与EPS的变化特性[J]. 环境科学, 2012, 33(5): 1614-1620. WANG H Y, SU B S, HUANG D, et al. Profiles of Zeta potential and EPS in granulation process of aerobic sludge[J]. Environmental Science, 2012, 33(5): 1614-1620. (in Chinese) |
| [26] |
ADAV S S, LEE D J. Extraction of extracellular polymeric substances from aerobic granule with compact interior structure[J]. Journal of Hazardous Materials, 2008, 154(1-3): 1120-1126. |








