2. 北京石油化工学院 燃料清洁化及高效催化减排技术北京市重点实验室, 北京 102617;
3. 北京化工大学 化工资源有效利用国家重点实验室, 北京 100029;
4. 黄骅市信诺立兴精细化工股份有限公司, 黄骅 061100
2. Beijing Key Laboratory of Fuels Cleaning and Advanced Catalytic Emission Reduction Technology, Beijing Institute of Petrochemical Technology, Beijing 102617;
3. State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Technology, Beijing 100029;
4. Huanghua Xinnuo Lixing Fine Chemical Stock Co., Ltd, Huanghua 061100, China
化石资源的大量消耗以及由此引发的资源与环境问题促使人们探索廉价、可再生的替代资源,这其中包括储量丰富且日益增长的生物质能源[1]。生物质是一类储量最为丰富的可再生资源,能够吸收太阳能和大气中的二氧化碳,具备合成化学中间品的巨大潜能[2]。碳水化合物占生物质总量的四分之三,在自然界中分布广泛,其主要由碳、氢、氧元素组成,被视为未来绿色化学的主要原料[3-4]。以碳水化合物为原料,能够合成多种有潜力的、可用于燃料、化学品及多功能材料等领域的平台化合物,包括乙醇、正丁醇、甲酸、乳酸、乙酰丙酸、山梨醇、戊内酯、羟甲基呋喃和二甲基呋喃等[4]。其中,乳酸(α-羟基丙酸)(又称作二羟基丙酸)是最简单的羟基酸,其二号碳为手性碳,包含L(+)乳酸和D(-)乳酸两种旋光异构体,可由可再生的生物质原料制备,是一种具有广阔应用前景的平台化合物[5-6]。在目前的工业生产中,90%以上的乳酸是由淀粉或葡萄糖为原料经生物发酵法直接制备[7]。然而由于生物发酵法制备乳酸的工艺产率低、副产物复杂、后期分离纯化工艺繁琐,生产过程中需要加入碱来中和强酸性的发酵液,这会伴随生成大量的乳酸钙沉淀,污染环境[8]。因此,探索高效的化学方法分解糖类来制备乳酸成为当前学术研究的一大热点[9]。
早在20世纪初,研究人员即发现碱催化能够使葡萄糖及果糖转化为乳酸[10]。NaOH、Ca(OH)2及Ba(OH)2等在水热处理葡萄糖和生物质中应用广泛[11]。以NaOH及Ca(OH)2为催化剂时,300 ℃反应60 s得到的乳酸收率为20%~27%[12]。以Ca(OH)2作为催化剂,延长反应时间,乳酸收率可达到40%以上[13]。Esposito等[14]研究了使用Ba(OH)2替代Ca(OH)2用于生物质的碱水解,以葡萄糖作为反应物,在水热条件下乳酸收率达到了57%,并且以纤维素为反应物时的乳酸收率也能够达到42%。Qi等[15]研究发现,在室温下Ba(OH)2能够催化碳水化合物的转化,以葡萄糖及纤维素为底物反应48 h的乳酸收率分别达95%及42.2%;然而,Ba(OH)2可溶于水,在均相催化的条件下不利于产物分离,并且在强碱性水溶液体系中溶液会腐蚀反应器。因此,探究非均相固体碱催化剂很有必要。
以水为溶剂,323 K时,Mg/Al水滑石催化葡萄糖反应8 h能够得到20.3%的乳酸收率[16]。在甲醛溶剂中,以葡萄糖为反应物,MgO为催化剂,在200 ℃下反应20 h得到的乳酸甲酯收率接近30%[17]。CaO也可作为固体碱催化剂催化甘油制乳酸,乳酸的摩尔收率能够达到40.8%[18]。直接以纤维素为反应物更符合当前所倡导的可持续能源策略[19],然而以固体碱为催化剂直接催化分解纤维素的反应体系鲜有报道。
本文系统研究了不同种类均相碱及固体碱催化剂催化糖转化制乳酸的性能,优选出了以市售Ba(OH)2为原料通过简易焙烧方法得到的粉末状BaO固体碱催化剂,对其催化纤维素转化制乳酸的反应条件进行了优化,探讨了反应温度、催化剂用量及反应物浓度对乳酸收率的影响,进而推导了催化活性中心的来源及催化作用机制。
1 实验部分 1.1 实验原料和仪器 1.1.1 实验原料纤维素,分析纯,国药集团化学试剂有限公司;氢氧化钡,分析纯,阿拉丁试剂有限公司;三氯乙烯,分析纯,上海麦克林生化科技有限公司。
1.1.2 实验仪器高压反应釜,美国Parr公司;SX-G07123马弗炉,天津市中环实验电炉有限公司;AL204电子分析天平,瑞士梅特勒-托利多有限公司;R1-201H高效液相色谱,大连伊利特分析仪器有限公司;SETSYS Evolution TGA-DTA/DSC热重分析系统,法国Setaram仪器公司;TENSOR 27红外光谱仪,德国Bruker科技有限公司。
1.2 实验方法将10 g市售氢氧化钡研磨后于550 ℃焙烧6 h(升温速率3 ℃/min),自然降温得到绿色粉末状BaO催化剂。将一定量催化剂、纤维素与去离子水加入反应釜中,充入0.6 MPa N2,设置搅拌转速600 r/min,定时取样进行高效液相色谱检测。色谱检测条件:折光示差检测器,Biorad Aminex HPX-87H色谱柱,35 ℃,流动相(0.005 mol/L H2SO4)0.5 mL/min。
热重分析使用SETSYS Evolution TGA-DTA/DSC热重分析系统,样品10 mg,升温速率5 ℃/min。傅里叶红外光谱分析采用TENSOR 27红外光谱仪,RT-InGaAs检测器,测试范围400~4 000 cm-1,采用定制透过反应池对样品进行前处理及水气氛处理,反应池连接真空系统进行真空脱附。使用德国Bruker公司的D5005型X射线衍射仪对样品的晶型结构进行表征,扫描范围10°~80°。
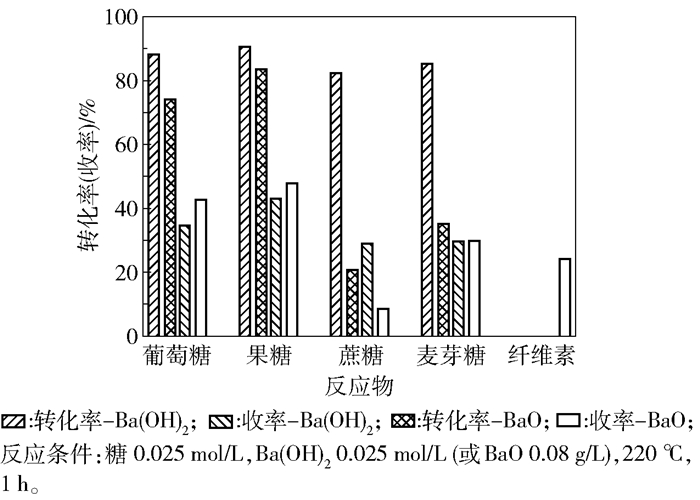
2 结果与讨论 2.1 碱催化糖转化制乳酸水热条件下碱催化葡萄糖转化的体系早有报道,本文首先通过对一定条件下碱类型的筛选优选出了Ba(OH)2催化剂(表 1),与文献[14]报道一致。二价金属阳离子的存在更利于乳酸的生成,乳酸收率达到了35%左右。氨水体系中几乎无乳酸生成,可能是由于氨水在反应条件下挥发导致。显然,碱催化有利于葡萄糖向果糖的异构化反应。以NaOH为催化剂时果糖收率达到52.9%,而Ca(OH)2及Ba(OH)2催化葡萄糖转化仅生成约23%的果糖。由图 1可知,当Ba(OH)2用于果糖的催化反应时,乳酸收率得到进一步的提升,达到42%,而对于蔗糖及麦芽糖的反应乳酸收率则基本一致,均为30%左右。然而,当Ba(OH)2直接用于复杂碳水化合物纤维素的催化转化时,几乎无乳酸生成,说明本文所购买市售Ba(OH)2基本无催化纤维素转化活性。
| 下载CSV 表 1 不同碱催化葡萄糖转化制乳酸效果 Table 1 Effect of different bases on the conversion of glucose into lactic acid |
|
图 1 Ba(OH)2和BaO催化不同反应物转化制备乳酸 Fig.1 Conversion of various reactants to lactic acid by Ba(OH)2 and BaO obtained by calcination of Ba(OH)2 |
在葡萄糖催化转化的反应中(表 1),以固体碱MgO为催化剂时,葡萄糖转化率不到10%,而仅有1.2%的乳酸生成;以CaO为催化剂时,葡萄糖转化率也仅21.2%,乳酸收率则为7.3%;以BaO为催化剂时,葡萄糖转化率达到了74.1%,相应乳酸收率则达到42.5%。对比表 1中Ba(OH)2和BaO的结果可知,Ba(OH)2更有利于葡萄糖的异构化反应,但是生成的乳酸收率明显低于BaO体系。
图 1给出了BaO催化不同反应物的反应结果。相较于Ba(OH)2体系,葡萄糖及果糖转化制乳酸的收率有了一定提高,麦芽糖的乳酸收率基本不变,而蔗糖则降到8.5%。当以纤维素为反应物时,得到了24%的乳酸收率,明显优于直接以市售Ba(OH)2为催化剂的反应体系。因此,下文将围绕BaO固体粉末催化纤维素转化的反应条件优化及机理研究展开。
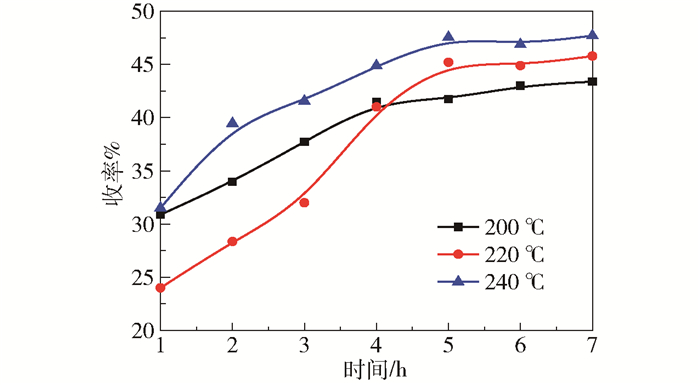
2.2 反应条件对纤维素转化制乳酸收率的影响 2.2.1 温度图 2为反应温度对乳酸收率的影响。由图可知,升高温度更有利于纤维素转化制乳酸,且在反应5 h时乳酸收率基本稳定,进一步延长反应时间,乳酸收率略有升高。在本文所考察的3个温度中,240 ℃时的乳酸收率最高,达到了48%。
|
反应条件: 0.45 g纤维素, 0.8 g催化剂, 100 mL H2O, 0.6 MPa N2。 图 2 不同温度下乳酸收率随时间的变化 Fig.2 Yield of lactic acid at different temperatures |
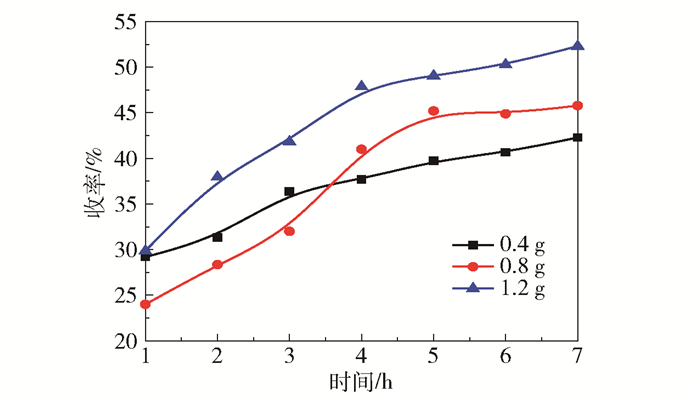
由图 3可知,随着催化剂用量的增大,乳酸收率明显提高。当催化剂用量为1.2 g时,反应7 h后乳酸收率最高达52%。然而在反应初始阶段,催化剂用量为0.4 g时的乳酸收率明显高于0.8 g,但乳酸收率提高缓慢。结合反应温度考察结果,表明催化剂用量少、反应温度低时的反应速率较低。
|
反应条件: 0.45 g纤维素, 100 mL H2O, 220 ℃, 0.6 MPa N2。 图 3 催化剂用量对乳酸收率的影响 Fig.3 Yield of lactic acid with different amounts of catalyst |
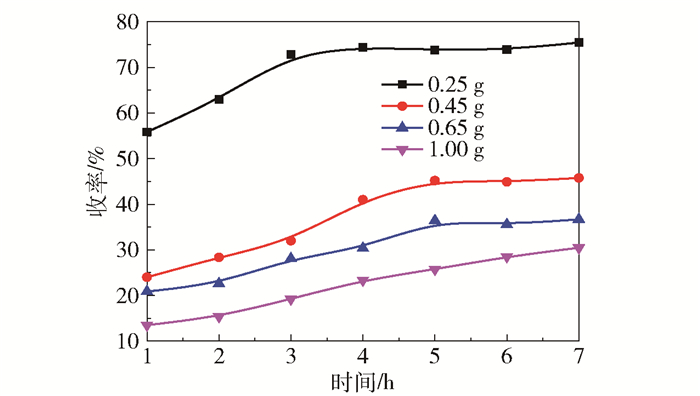
图 4给出了纤维素量对乳酸收率的影响。在所考察的4个纤维素量影响实验中,随着时间的进行,乳酸收率均逐渐升高,在反应进行7 h后,各反应的乳酸收率均达到最高。并且纤维素用量越少,乳酸收率越高,当纤维素用量为0.25 g时,乳酸收率可达75%,该收率明显优于以玉米芯为反应物的碱催化体系中的乳酸收率(约45%)[20]。
|
反应条件: 0.8 g催化剂, 100 mL H2O, 220 ℃, 0.6 MPa N2。 图 4 纤维素量对乳酸收率的影响 Fig.4 Yield of lactic acid with different amounts of cellulose |
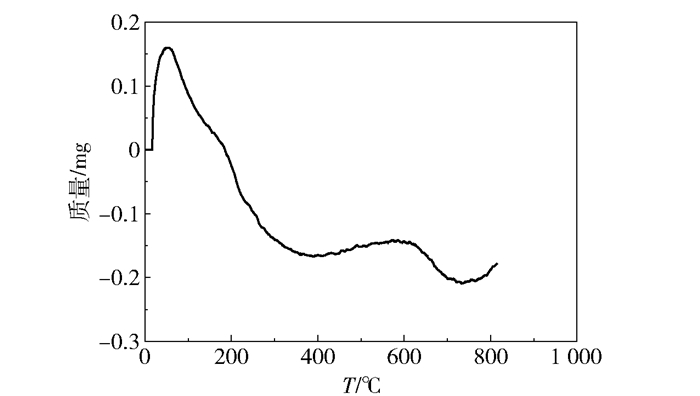
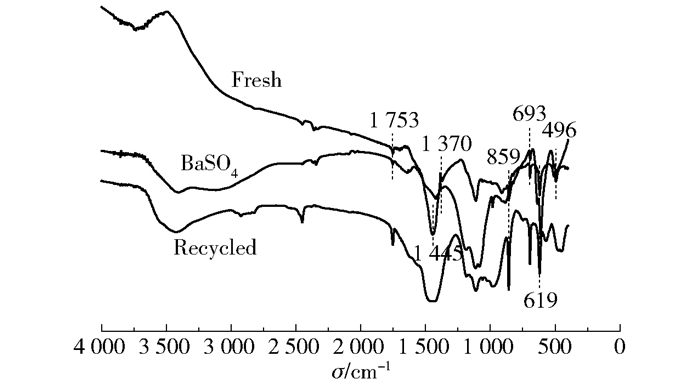
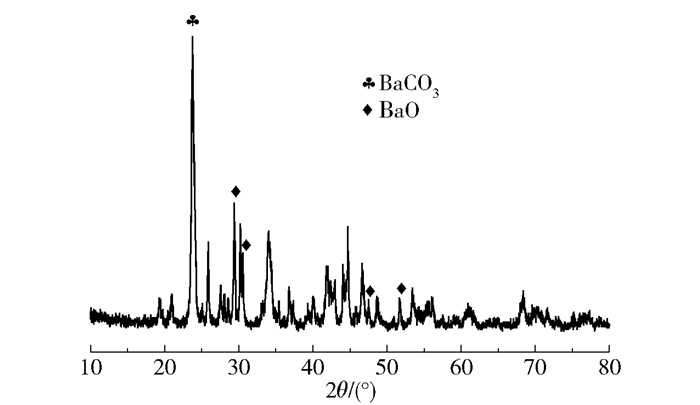
对Ba(OH)2焙烧所得催化剂进行热重分析,如图 5所示,焙烧产物在从室温加热至800 ℃的过程中,723.4 ℃时失重0.207 mg,最大失重率仅为1.81%,由此说明焙烧产物在比焙烧温度更高的温度下也只有少量失重。由于BaCO3在1 100 ℃的高温下才开始发生明显的热分解,因此推测焙烧产物为BaO及BaCO3的混合物(图 5)。由图 6的傅里叶红外光谱分析可得,催化剂兼具BaO及BaCO3的特征峰,其中,1 370 cm-1、619 cm-1及496 cm-1处峰归属于BaO,1 753 cm-1、1 445 cm-1、859 cm-1、693 cm-1处峰归属于BaCO3,说明该催化剂是二者的混合物(图 6,Fresh)。BaCO3源于BaO吸收水及CO2的反应,XRD表征进一步确定了二者共存的状态(图 7)。在反应过程中,部分BaO会与水反应生成Ba(OH)2,同时放出热量,有利于纤维素的分解。实验证明,将不溶于水的BaO催化剂加入稀硫酸后离心,仅可检测到BaSO4的特征峰(图 6,BaSO4),说明在反应过程中随着酸性乳酸的生成,催化剂中BaO及BaCO3会逐渐转化为Ba2+。反应结束后过滤回收剩余催化剂,经傅里叶红外光谱分析发现,所回收催化剂呈现为典型的BaCO3光谱,进一步说明催化剂中含有一定量的BaCO3。
|
图 5 催化剂热重表征结果 Fig.5 TG trace of the catalyst |
|
图 6 催化剂红外光谱图 Fig.6 FT-IR spectra of the catalyst |
|
图 7 催化剂XRD表征结果 Fig.7 XRD pattern of the catalyst |
为进一步确定催化剂活性来源,本文对比了纯BaCO3的催化性能,结果见表 2。可以看出,葡萄糖与果糖转化率均在70%左右,相应的乳酸收率不到10%,显然低于Ba(OH)2及其焙烧产物催化剂。而以纤维素为反应物时,乳酸收率仅3.2%,说明本文催化剂的活性中心主要源于BaO。
| 下载CSV 表 2 BaCO3催化不同糖制乳酸效果 Table 2 Conversion of different sugars to lactic acid by BaCO3 |
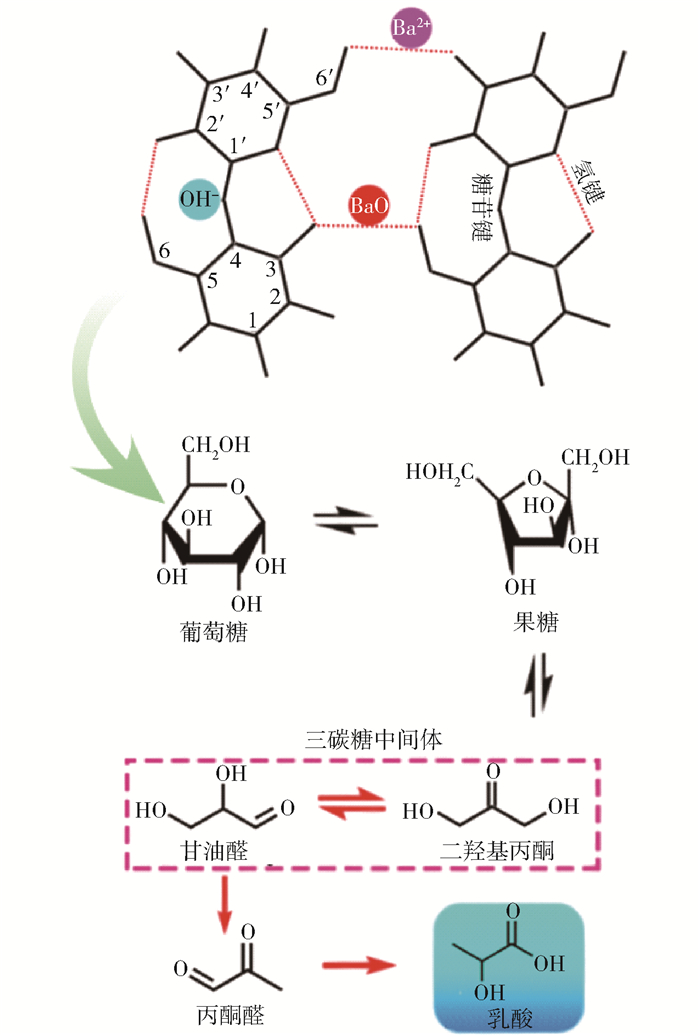
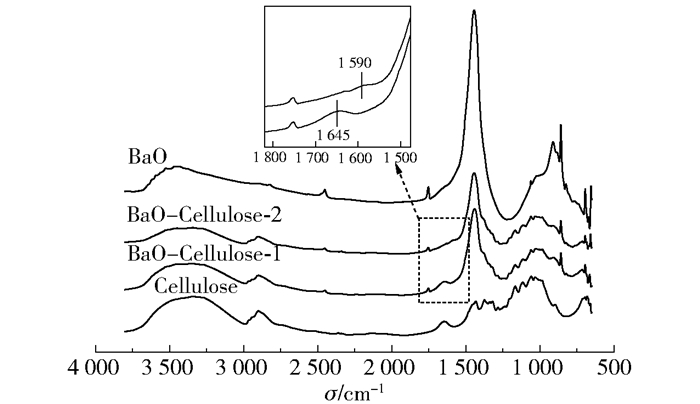
在催化反应过程中,BaO会水合生成Ba(OH)2,进而在碱催化的作用下纤维素水解转化。因此,本文提出在该BaO固体碱催化体系中,部分BaO能够直接作用于纤维素大分子的氢键结构,且BaO与BaCO3的协同作用促进了纤维素的转化。如图 8所示,BaO及其水解产物Ba(OH)2解离出的Ba2+共同作用于纤维素分子间及分子内氢键,促进其断裂。同时,Ba(OH)2解离出的OH-则作用于纤维素分子单体间的1,4-糖苷键,促进其水解生成葡萄糖[21]。进而,葡萄糖在碱催化的作用下异构生成果糖[22],果糖随后发生C3—C4键断键的逆醇醛缩合反应生成三碳糖中间体(二羟基丙酮和甘油醛),最后发生脱水、水合及氢转移反应生成乳酸[23]。图 9给出了BaO催化剂、纤维素及二者混合物的红外光谱图。通过对比可知,BaO催化剂在3 500 cm-1处存在游离水的吸收峰,峰型较宽,而纤维素在3 200~3 500 cm-1处存在氢键吸收峰。需要说明的是,BaO-Cellulose-2为BaO-Cellulose-1于室温下在水气氛中处理30 min后,于220 ℃保持1 h后的样品。相较于BaO-Cellulose-1,BaO-Cellulose-2的氢键特征峰明显减弱,同时纤维素在1 645 cm-1处的羟基弯曲振动吸收峰消失,伴随出现1 590 cm-1处的C═O吸收峰,说明催化剂吸水后作用于纤维素分子,破坏其氢键结构。C═O双键则可能源于纤维素分解产生的葡萄糖单体等后续转化产物。
|
图 8 纤维素分子内/间氢键及1,4-糖苷键断键及葡萄糖转化制乳酸反应机制 Fig.8 Proposed mechanisms for the cleavage of intra-/inter molecular hydrogen bonds and 1, 4-glycosidic bond of cellulose, followed by the conversion of glucose to lactic acid |
|
图 9 BaO、纤维素及二者混合物的红外光谱图 Fig.9 FT-IR spectra of BaO, cellulose and their mixtures |
通过以上分析可知,BaO作为催化剂活性组分起到了缓释碱中心的作用,而BaCO3的作用则可能体现在与有机酸反应以维持反应体系的碱性质。本文所报道的BaO催化剂有效整合了均相碱催化及非均相碱催化体系,对新型碳水化合物催化体系的开发具有重要的借鉴意义。
3 结论本文在碱催化研究基础上优选出了Ba(OH)2催化剂,进而发现了一种由市售Ba(OH)2制备高效固体碱BaO催化纤维素转化制乳酸的简易方法,通过水热法直接催化纤维素得到了优异的乳酸收率。反应条件优化结果表明,升高反应温度、加大催化剂用量、降低纤维素用量均有利于乳酸的生成,在0.25 g纤维素、0.8 g催化剂、100 mL去离子水、220 ℃、0.6 MPa N2压力的条件下反应7 h,乳酸收率可达75%。该催化剂活性组分源于BaO,在纤维素的转化过程中,BaO及其水合产生的Ba(OH)2共同作用于氢键,促进纤维素的水解,而Ba(OH)2解离出的OH-则对纤维素分子内1,4-糖苷键的断裂及单体葡萄糖的转化起到催化作用。后续研究将进一步围绕纤维素的高效水解及转化展开,尝试通过溶剂体系的优化来提高纤维素的转化效率。
| [1] |
LANGEVELD H, SANDERS J, MEEUSEN M. The biobased economy:biofuels, materials, and chemicals in the post-oil era[M]. London: Earthscan, 2010.
|
| [2] |
CORMA A, IBORRA S, VELTY A. Chemical routes for the transformation of biomass into chemicals[J]. Chemical Reviews, 2007, 107: 2411-2502. DOI:10.1021/cr050989d |
| [3] |
DENG L, LI J, LAI D M, et al. Catalytic conversion of biomass-derived carbohydrates into γ-valerolactone without using an external H2 supply[J]. Angew Chemie-International Ed, 2009, 48: 6529-6532. DOI:10.1002/anie.200902281 |
| [4] |
KISHIDA H, JIN F M, YAN X Y, et al. Formation of lactic acid from glycolaldehyde by alkaline hydrothermal reaction[J]. Carbohydrate Research, 2006, 341: 2619-2623. DOI:10.1016/j.carres.2006.06.013 |
| [5] |
QI X H, WATANABE M, AIDA T M, et al. Catalytic dehydration of fructose into 5-hydroxymethylfurfural by ion-exchange resin in mixed-aqueous system by microwave heating[J]. Green Chemistry, 2008, 10: 799-805. DOI:10.1039/b801641k |
| [6] |
TEN DAM J, HANEFELD U. Renewable chemicals:dehydroxylation of glycerol and polyols[J]. ChemSusChem, 2011, 4: 1017-1034. DOI:10.1002/cssc.201100162 |
| [7] |
ZHANG Z G, JACKSON J E, MILLER D J. Effect of biogenic fermentation impurities on lactic acid hydrogenation to propylene glycol[J]. Bioresource Technology, 2008, 99: 5873-5880. DOI:10.1016/j.biortech.2007.10.027 |
| [8] |
JOHN R P, NAMPOOTHIRI K M, PANDEY A. Fermentative production of lactic acid from biomass:an overview on process developments and future perspectives[J]. Applied Microbiology and Biotechnology, 2007, 74: 524-534. DOI:10.1007/s00253-006-0779-6 |
| [9] |
MÄKI-ARVELA P, SIMAKOVA I L, SALMI T, et al. Production of lactic acid/lactates from biomass and their catalytic transformations to commodities[J]. Chemical Reviews, 2013, 114: 1909-1971. |
| [10] |
BAMFORD C H, BAMFORD D, COLLINS J R. Kinetic studies on carbohydrates in alkaline conditions. Ⅱ. The kinetics of the rearrangements of glucose and fructose in alkaline solution[J]. Proceedings of the Royal Society A:Mathematical, Physical and Engineering Sciences, 1950, 204: 85-98. DOI:10.1098/rspa.1950.0163 |
| [11] |
汪亚美, 王新承, 李顺杰, 等. 聚合离子液体在催化转化果糖制备乳酸中的应用[J]. 有机化学, 2015, 35: 404-410. WANG Y M, WANG X C, LI S J, et al. Application of polymeric ionic liquids in the catalytic conversion of fructose to lactic acid[J]. Chinese Journal of Organic Chemistry, 2015, 35: 404-410. (in Chinese) |
| [12] |
YAN X Y, JIN F M, TOHJI K, et al. Hydrothermal conversion of carbohydrate biomass to lactic acid[J]. AIChE Journal, 2010, 56(10): 2727-2733. DOI:10.1002/aic.12193 |
| [13] |
石宁, 唐石云, 罗文艳, 等. 生物质基碳水化合物催化转化制备乳酸的研究进展[J]. 新能源进展, 2018, 6(2): 102-113. SHI N, TANG S Y, LUO W Y, et al. Advances in catalytic conversion of biomass derived carbohydrates into lactic acid[J]. Advances in New and Renewable Energy, 2018, 6(2): 102-113. (in Chinese) DOI:10.3969/j.issn.2095-560X.2018.02.004 |
| [14] |
ESPOSITO D, ANTONIETTI M. Chemical conversion of sugars to lactic acid by alkaline hydrothermal processes[J]. ChemSusChem, 2013, 6: 989-992. DOI:10.1002/cssc.201300092 |
| [15] |
LI L Y, SHEN F, SMITH R L, et al. Quantitative chemocatalytic production of lactic acid from glucose under anaerobic conditions at room temperature[J]. Green Chemistry, 2017, 19: 76-81. DOI:10.1039/C6GC02443B |
| [16] |
ONDA A, OCHI T, KAJIYOSHI K, et al. Lactic acid production from glucose over activated hydrotalcites as solid base catalysts in water[J]. Catalysis Communications, 2008, 9: 1050-1053. DOI:10.1016/j.catcom.2007.10.005 |
| [17] |
LIU Z, LI W, PAN C Y, et al. Conversion of biomass-derived carbohydrates to methyl lactate using solid base catalysts[J]. Catalysis Communications, 2011, 15: 82-87. DOI:10.1016/j.catcom.2011.08.019 |
| [18] |
CHEN L, REN S J, YE X P. Lactic acid production from glycerol using CaO as solid base catalyst[J]. Fuel Processing Technology, 2014, 120: 40-47. DOI:10.1016/j.fuproc.2013.11.019 |
| [19] |
KNILL C J, KENNEDY J F. Degradation of cellulose under alkaline conditions[J]. Carbohydrate Polymers, 2003, 51: 281-300. DOI:10.1016/S0144-8617(02)00183-2 |
| [20] |
SÁNCHEZ C, EGÜÉS I, GARCÍA A, et al. Lactic acid production by alkaline hydrothermal treatment of corn cobs[J]. Chemical Engineering Journal, 2012, 181/182: 655-660. DOI:10.1016/j.cej.2011.12.033 |
| [21] |
FABIĚOVICOVÁ K, MALTER O, LUCAS M, et al. Hydrogenolysis of cellulose to valuable chemicals over activated carbon supported mono- and bimetallic nickel/tungsten catalysts[J]. Green Chemistry, 2014, 16: 3580-3588. DOI:10.1039/C4GC00664J |
| [22] |
WANG X C, SONG Y L, HUANG C P, et al. Lactic acid production from glucose over polymer catalysts in aqueous alkaline solution under mild conditions[J]. Green Chemistry, 2014, 16: 4234-4240. DOI:10.1039/C4GC00811A |
| [23] |
WANG X C, SONG Y L, HUANG C P, et al. Crystalline niobium phosphates with water-tolerant and adjustable Lewis acid sites for the production of lactic acid from triose sugars[J]. Sustainable Energy & Fuels, 2018, 2: 1530-1541. |








