地下水氟离子严重超标的情况普遍存在于亚洲、非洲和美国的很多地区[1]。水是人体摄入氟的主要来源,人体摄入过量氟元素会引发氟斑牙和氟骨病[2],因此去除饮用水中的过量氟离子对人类健康有重要意义。目前常用的氟离子去除方法包括吸附法、电化学法、膜分离法和混凝沉淀法等[3],其中吸附法具有技术成熟、操作简单、运行成本低、吸附效果好等优点,从而得到广泛运用[4]。吸附剂对吸附质的吸附能力是吸附过程的关键之一,常用的吸附剂有活性氧化铝、离子交换树脂、稀土金属氧化物、骨炭、沸石等[5],其中含铝和铝基吸附剂一直是研究的热点[6]。
近年来,众多研究者对含铝除氟材料吸附过程的动力学和热力学进行了研究。Biswas等[7]制备出铁/铝混合氧化物粉末,并研究其对氟离子的吸附效果,结果表明铁/铝混合氧化物对氟离子的吸附动力学遵循拟二阶模型,吸附平衡符合Redlich-Peterson模型。Tchomgui-Kamga等[8]用盐溶液浸渍木材,随后在500、650、900℃下碳化,合成含有分散的铝和铁氧化物的木炭吸附剂,进行除氟研究发现,不同吸附剂的吸附动力学均服从拟二阶动力学模型,Langmuir模型可很好地描述吸附等温线。Gong等[9]在不同的pH和煅烧温度下合成了5种氧化铝,并对其除氟性能进行了研究;研究发现,Langmuir和Freundlich模型都能很好地拟合吸附等温线,拟二阶模型能很好地描述过程的动力学,热力学计算表明该吸附是一个自发的吸热过程。Chai等[10]开发了一种新型的硫酸盐掺杂的Fe3O4/Al2O3磁分离纳米颗粒吸附剂,用于去除饮用水中的氟化物;吸附实验结果表明,吸附过程遵循Elovich模型,吸附等温曲线很好地吻合了双位点Langmuir模型。
与上述吸附剂相比,颗粒活性氧化铝作为一种更为常见的除氟吸附剂,较慢的吸附速率和较小的吸附量限制了其更为广泛的应用,而采用硫酸铁对颗粒活性氧化铝进行改性能很好地解决这一问题[11-13]。本文根据硫酸铁改性活性氧化铝颗粒(FMAA)在静态吸附实验中的除氟效果,研究吸附除氟的动力学和热力学,以期揭示吸附所涉及的吸附机理和吸附速率的控制步骤。
1 实验部分 1.1 实验试剂及仪器活性氧化铝, 河南省巩义市宏达滤料厂;氟化钠, 硝酸钾, 国药集团化学试剂公司;硫酸铁, 西陇化工股份有限公司。所用试剂均为分析纯, 实验用水为去离子水。
PHS-3C型pH计, PF-1型氟离子选择电极, 上海康仪仪器有限公司;85-2型数显恒温磁力搅拌器, 金坛市江南仪器厂;HZQ-X100型恒温振荡培养箱, 太仓市实验设备厂。
1.2 改性活性氧化铝的制备活性氧化铝颗粒粒径为1~2mm,BET比表面积为270~285m2/g,表观密度ρ=1337.5g/L。硫酸铁改性活性氧化铝颗粒制备步骤如下:用去离子水配置质量分数为3%的硫酸铁溶液;向溶液中加入1000g活性氧化铝颗粒,浸泡6h后用去离子水洗净;将洗净后的颗粒放入100℃的烘箱中干燥12h后放入干燥器中备用。
1.3 实验方法 1.3.1 吸附动力学实验控制固液比为2g/L,调节初始氟离子浓度分别为5、10和15mg/L,吸附时间为0.1~72h。吸附过程中控制摇床温度为25℃,转速180r/min,吸附剂吸附量根据式(1)计算。
| $ {q_t} = ({\rho _0} - {\rho _t})V/m $ | (1) |
式中,qt为t时间内吸附剂的吸附量, mg/g;ρ0和ρt分别为水中初始氟离子质量浓度和t时刻氟离子质量浓度,mg/L;V为氟溶液体积, L;m为投加吸附剂的质量, g。
1.3.2 吸附热力学实验控制固液比为2g/L,初始氟离子质量浓度为3~50mg/L。在初始氟离子质量浓度为15mg/L的条件下,设计吸附温度为15、25、35℃的3组实验,其余初始浓度下吸附温度为25℃,转速180r/min,吸附时间48h,吸附剂平衡吸附量由式(1)获得。
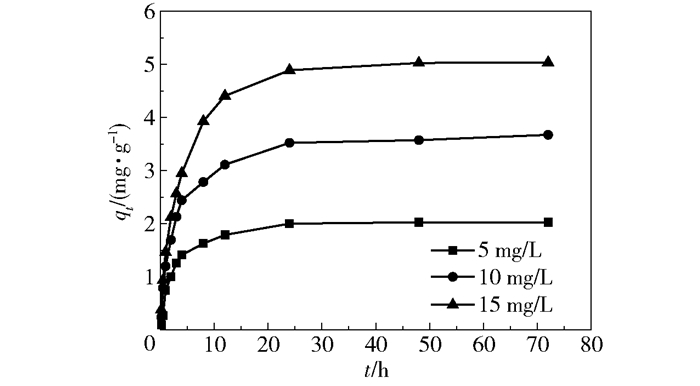
2 结果与讨论 2.1 吸附动力学吸附剂FMAA在不同初始氟离子浓度下的吸附量随时间变化曲线如图 1所示。吸附剂对氟离子的吸附过程可分为快速吸附、慢速吸附和平衡阶段。前4h内吸附剂的吸附速率很高,吸附量达到平衡吸附量的60%以上;4h后吸附速率明显降低,24h后吸附量没有明显变化,最终达到吸附平衡。利用拟一阶动力学模型、拟二阶动力学模型和Elovich模型分别对实验数据进行拟合。
|
图 1 不同初始氟浓度下FMAA吸附动力学曲线 Fig.1 FMAA adsorption kinetic curves with different initial fluorine concentrations |
拟一阶动力学模型表示为
| $ {\rm{ln}}({q_{\rm{e}}} - {q_t}) = {\rm{ln}}{q_{\rm{e}}} - {k_{{\rm{s1}}}}t $ | (2) |
拟二阶动力学模型表示为
| $ \frac{t}{{{q_t}}} = \frac{1}{{{k_{{\rm{s2}}}}q_{\rm{e}}^2}} + \frac{1}{{{q_{\rm{e}}}}}t $ | (3) |
Elovich模型表示为
| $ {q_t} = \frac{1}{b}{\rm{ln}}\left( {ab} \right) + \frac{1}{b}{\rm{ln}}t $ | (4) |
式中,qe和qt分别为达到吸附平衡时吸附剂的吸附量和t时间内吸附剂的吸附量,mg/g;ks1为拟一阶速率常数, h-1;ks2为拟二阶速率常数, g/(mg·h);a和b为Elovich常数,分别代表初始吸附速率(g/(mg·min))和解吸常数(g/mg)。
由表 1可知,根据拟一阶动力学模型计算的理论值qe与实验值相差较大,而在不同初始氟离子浓度下拟二阶动力学模型计算的理论值qe都非常接近于实验值,且拟二阶动力学模型对动力学实验数据拟合的相关系数R2均大于0.99,说明FMAA吸附除氟过程为拟二阶动力学反应。拟二阶动力学模型考虑了吸附过程中的液膜扩散、内扩散和表面吸附反应等,所以能很好地描述整个吸附过程。拟二阶速率常数ks2随着初始氟离子浓度的增大而减小,主要原因是低浓度条件下,氟离子在吸附剂表面上吸附位点的竞争较小,吸附速率较高; 而在高浓度条件下,吸附质在吸附剂表面上吸附位点的竞争激烈,导致吸附速率下降。
| 下载CSV 表 1 FMAA吸附氟的动力学参数 Table 1 Kinetic parameters for adsorption of fluorine on FMAA |
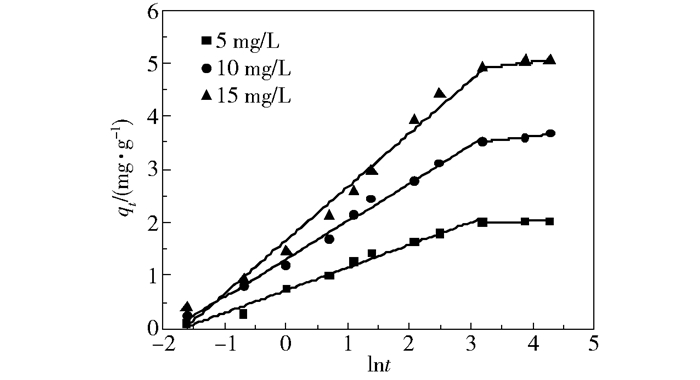
Elovich模型通常被用于描述固体表面发生的化学吸附过程[14-16],方程假设吸附能随固体表面覆盖率的增大而线性增大,吸附速率随固体表面吸附量增加而呈指数降低,这与动力学实验中吸附速率变化情况吻合。结果显示,Elovich模型对本文动力学实验数据也有较好的拟合度,由此可知吸附过程中存在化学吸附。由图 2可见,qt对lnt的拟合曲线在整个吸附过程并非为单一的线性关系,不同初始氟离子浓度下的拟合曲线均是在快速和慢速吸附阶段呈线性期,平衡阶段呈平台期,这说明吸附过程中存在多种因素影响吸附速率。
|
图 2 FMAA吸附氟的Elovich模型拟合曲线 Fig.2 Elovich model plots for adsorption of fluorine on FMAA |
多孔颗粒吸附剂上发生的化学吸附过程通常分为4个阶段[17],即容积扩散、液膜扩散、颗粒内扩散和吸附反应。吸附反应速率较快,且吸附实验发生在高速旋转的摇床内,因此可以忽略吸附反应和容积扩散对吸附速率的影响。为探究吸附过程中的速率控制步骤,用Boyd模型对实验数据进行拟合。
Boyd模型表示为
| $ F = 1 - \frac{6}{{{{\rm{ \mathsf{ π} }}^2}}}\sum\limits_{n = 1}^\infty {} \frac{1}{{{n^2}}}{\rm{exp}}( - {n^2}Bt){\rm{ }} $ | (5) |
| $ F = \frac{{{q_t}}}{{{q_{\rm{e}}}}} $ | (6) |
式中,F为t时刻的吸附质分数;B是与吸附剂颗粒半径和内扩散系数相关的系数。
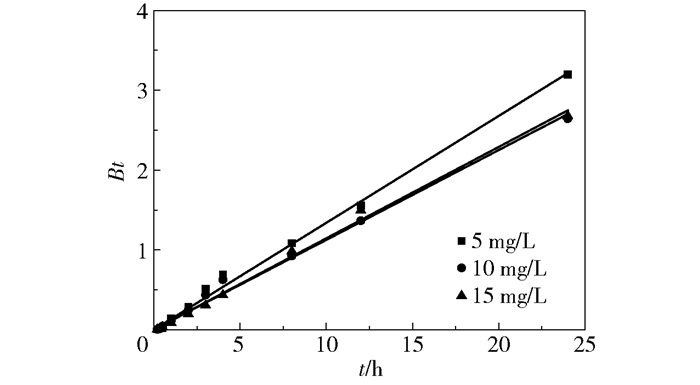
Boyd模型包括液膜扩散模型和内扩散模型。式(5)为内扩散模型方程,颗粒内扩散速率与吸附速率相等。模型假设颗粒内扩散传质系数为常数,因此当动力学实验数据吻合Boyd模型且B为常数时,内扩散为吸附速率的控制步骤[18]。由图 3可见,在快速吸附阶段和慢速吸附阶段Bt对t的拟合曲线为一条过原点的直线,且不同初始氟离子浓度下拟合的线性相关系数R2均大于0.99,可知在快速吸附阶段和慢速吸附阶段FMAA对氟离子吸附的速率控制步骤是内扩散。在平衡阶段由于溶液中氟离子浓度较低,化学吸附速率和解吸速率达到平衡,没有表观吸附速率。
|
图 3 Bt与t的关系曲线 Fig.3 Plots of Bt and t |
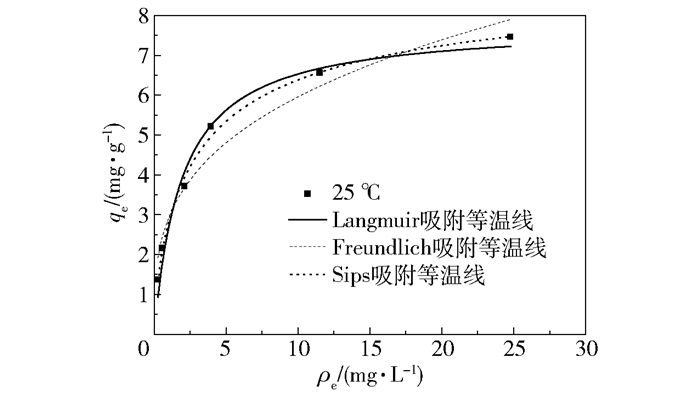
吸附等温线是描述一定温度下吸附平衡时的吸附特性曲线。用Langmuir、Freundlich和Sips吸附等温线模型对25℃下的实验数据进行拟合,拟合曲线见图 4,拟合相关参数列于表 2。
|
图 4 不同模型拟合的吸附等温线 Fig.4 Adsorption isotherms of different models |
| 下载CSV 表 2 吸附等温线参数 Table 2 Adsorption isotherm parameters |
Langmuir模型表示为
| $ {q_{\rm{e}}} = {q_{\rm{m}}}\frac{{{K_{\rm{L}}}{\rho _{\rm{e}}}}}{{1 + {K_{\rm{L}}}{\rho _{\rm{e}}}}} $ | (7) |
Freundlich模型表示为
| $ {q_{\rm{e}}} = {K_{\rm{F}}}\rho _{\rm{e}}^{\frac{1}{n}} $ | (8) |
Sips模型表示为
| $ {q_{\rm{e}}} = {q_{{\rm{max}}}}\frac{{{{({K_{\rm{S}}}{\rho _{\rm{e}}})}^\gamma }}}{{1 + {{({K_{\rm{S}}}{\rho _{\rm{e}}})}^\gamma }}} $ | (9) |
式中, qe、qm分别为平衡吸附量和饱和吸附量,mg/g; ρe为吸附平衡时溶液中氟离子质量浓度,mg/L;KL为Langmuir常数,h-1;KF和n均为Freundlich常数;KS为Sips常数, L/mg;γ为非均一系数。
Langmuir模型的建立基于固体表面吸附质单分子层吸附的假设,而Freundlich模型的建立基于固体表面多分子层吸附假设。与Freundlich模型相比,本文实验数据用Langmuir模型拟合结果更好(R2=0.976),说明FMAA对氟离子的吸附为单分子层吸附。Langmuir模型假定吸附位点均匀地分布在吸附剂表面,且每个吸附位点上吸附能相同,这与FMAA表面的实际情况不符。Sips模型是在Langmuir模型基础上考虑了吸附剂表面吸附位点的非均一性而得出的[19-20],γ即为描述非均一性的系数,其值越大则说明吸附剂表面均一程度越高,当γ=1时说明吸附剂表面吸附位点分布均一。采用Sips吸附等温线拟合平衡实验数据的相关系数R2=0.992,非均一系数γ=0.712,说明氟离子在FMAA上的吸附为非均一的单分子层吸附。这与先前的研究结果[21],即硫酸铁改性后为活性氧化铝表面带来新的活性位点的结论一致。
Langmuir模型和Sips吸附等温线模型不能判断吸附的类型。根据范特霍夫方程[22],由式(10)、(11)、(12)可求得吸附过程的焓变ΔH0、吉布斯自由能变ΔG0和熵变ΔS0,通过这些热力学参数可以判断吸附类型。
| $ {K^0} = \frac{{{q_{\rm{e}}}\rho }}{{{\rho _{\rm{e}}}}} $ | (10) |
| $ \Delta {G^0} = \Delta {H^0} - T\Delta {S^0} $ | (11) |
| $ {\rm{ln}}{K^0} = - \frac{{\Delta {H^0}}}{{RT}} + \frac{{\Delta {S^0}}}{{R{\rm{ }}}} $ | (12) |
式中,K0为吸附平衡常数;qe为平衡时吸附量,mg/g;ρe为平衡浓度, mol/L;ρ为吸附剂表观密度, g/L;T为绝对温度, K;R为气体常数,8.314J/(K·mol)。
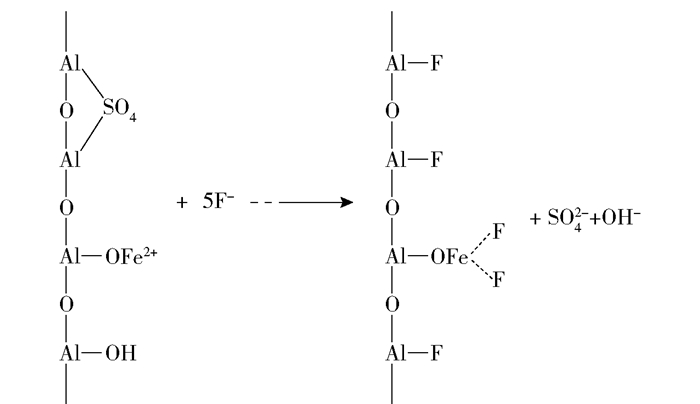
初始氟离子质量浓度为15mg/L时,不同温度下吸附的吉布斯自由能变ΔG0、焓变ΔH0和熵变ΔS0数据见表 3。可以看出,吉布斯自由能变ΔG0均为负数,且随温度升高绝对值增大,说明FMAA对氟离子的吸附过程为自发过程,温度升高对吸附过程有利。吸附焓变ΔH0=30.39kJ/mol,在固体吸附剂对水溶液内离子的化学吸附过程中吸附焓变主要由化学反应产生,氟离子在活性氧化铝表面的化学反应主要是与活性氧化铝表面水化生成的羟基发生置换反应[23]。假设活性氧化铝表面水化产生的羟基被氟离子完全置换,根据物质的标准摩尔生成焓得到的理论吸附焓变为21.35kJ/mol,且化学吸附焓变一般大于20kJ/mol[24],温度升高不利于物理吸附的进行[25],说明氟离子在FMAA上的吸附以化学吸附为主,化学吸附主要是由离子交换引起的。充分水化后的活性氧化铝表面同时具有Lewis和Bronsted酸性中心, 改性后SO42-替换掉部分表面水化形成的羟基,表面部分羟基质子化与Fe3+形成络合物。改性吸附剂吸附F-时,F-与吸附剂表面形成的配位羟基和改性后带有的SO42-发生置换,化学吸附过程如图 5所示[21]。
| 下载CSV 表 3 吸附过程热力学参数 Table 3 Thermodynamic parameters of adsorption |
|
图 5 氟在FMAA上的化学吸附 Fig.5 Chemisorption of fluorine on FMAA |
(1) 动力学研究表明,FMAA对氟离子的吸附过程分为快速吸附阶段、慢速吸附阶段和平衡阶段,拟二阶动力学模型能较好地描述此过程。吸附动力学数据与Boyd扩散模型吻合较好,颗粒内扩散是吸附速率的控制步骤。
(2) 本文的热力学吸附实验数据能较好地吻合Langmuir吸附等温模型和Sips模型,与Sips模型拟合的相关系数最高,且非均一系数γ=0.712,说明吸附过程为非均一的单分子层吸附。
(3) 由范特霍夫方程求得氟离子在FMAA上的吸附焓变ΔH0=30.39kJ/mol,大于化学反应焓变,说明吸附过程主要是化学吸附,与Elovich模型所得结论一致。热力学分析表明吸附为自发过程,且温度升高对吸附有利。
| [1] |
LOGANATHAN P, VIGNESWARAN S, KANDASAMY J, et al. Defluoridation of drinking water using adsorption processes[J]. Journal of Hazardous Materials, 2013, 248/249: 1-19. DOI:10.1016/j.jhazmat.2012.12.043 |
| [2] |
ASAWA K, SINGH A, BHAT N, et al. Association of temporomandibular joint signs & symptoms with dental fluorosis & skeletal manifestations in endemic fluoride areas of Dungarpur District, Rajasthan, India[J]. Journal of Clinical and Diagnostic Research, 2015, 9(12): 18-21. |
| [3] |
HABUDA-STANIĆ M, RAVANČIĆ M E, FLANAGAN A. A review on adsorption of fluoride from aqueous solution[J]. Materials, 2014, 7(9): 6317-6366. DOI:10.3390/ma7096317 |
| [4] |
SRIVASTAV A L, SINGH P K, SRIVASTAVA V, et al. Application of a new adsorbent for fluoride removal from aqueous solutions[J]. Journal of Hazardous Materials, 2013, 263: 342-352. DOI:10.1016/j.jhazmat.2013.04.017 |
| [5] |
TRIPATHY S S, BERSILLON J L, GOPAL K. Removal of fluoride from drinking water by adsorption onto alum-impregnated activated alumina[J]. Separation and Purification Technology, 2006, 50(3): 310-317. DOI:10.1016/j.seppur.2005.11.036 |
| [6] |
DU J Y, SABATINI D A, BUTLER E C. Synthesis, characterization, and evaluation of simple aluminum-based adsorbents for fluoride removal from drinking water[J]. Chemosphere, 2014, 101: 21-27. DOI:10.1016/j.chemosphere.2013.12.027 |
| [7] |
BISWAS K, SAHA S K, GHOSH U C. Adsorption of fluoride from aqueous solution by a synthetic iron(Ⅲ)-aluminum(Ⅲ) mixed oxide[J]. Industrial & Engineering Chemistry Research, 2007, 46(16): 5346-5356. |
| [8] |
TCHOMGUI-KAMGA E, ALONZO V, NANSEU-NJIKI C P, et al. Preparation and characterization of charcoals that contain dispersed aluminum oxide as adsorbents for removal of fluoride from drinking water[J]. Carbon, 2010, 48(2): 333-343. DOI:10.1016/j.carbon.2009.09.034 |
| [9] |
GONG W X, QU J H, LIU R P, et al. Adsorption of fluoride onto different types of aluminas[J]. Chemical Engineering Journal, 2012, 189/190: 126-133. DOI:10.1016/j.cej.2012.02.041 |
| [10] |
CHAI L Y, WANG Y Y, ZHAO N, et al. Sulfate-doped Fe3O4/Al2O3 nanoparticles as a novel adsorbent for fluoride removal from drinking water[J]. Water Research, 2013, 47(12): 4040-4049. DOI:10.1016/j.watres.2013.02.057 |
| [11] |
DANG D, DING W M, CHENG A G, et al. Isotherm equation study of F adsorbed from water solution by Fe2(SO4)3-modified granular activated alumina[J]. Chinese Journal of Chemical Engineering, 2011, 19(4): 581-585. DOI:10.1016/S1004-9541(11)60025-6 |
| [12] |
程安国, 丁文明, 钮佰杰, 等. 改性活性氧化铝吸附除氟的连续试验研究[J]. 北京化工大学学报(自然科学版), 2012, 39(3): 86-90. CHENG A G, DING W M, NIU B J, et al. Column adsorption of fluoride ions by modified activated alumina[J]. Journal of Beijing University of Chemical Technology(Natural Science), 2012, 39(3): 86-90. (in Chinese) DOI:10.3969/j.issn.1671-4628.2012.03.017 |
| [13] |
霍亚坤, 黄霞, 丁文明, 等. 铁-镧复合氧化物颗粒吸附剂除氟性能研究[J]. 现代化工, 2010, 30(2): 57-59. HUO Y K, HUANG X, DING W M, et al. A study of fluoride removal by granular iron-lanthanum complex hydroxide adsorbent[J]. Modern Chemical Industry, 2010, 30(2): 57-59. (in Chinese) |
| [14] |
ÖZACAR M, ŞENGIL İ A, TÜRKMENLER H. Equilibrium and kinetic data, and adsorption mechanism for adsorption of lead onto valonia tannin resin[J]. Chemical Engineering Journal, 2008, 143(1): 32-42. |
| [15] |
SIVASANKAR V, RAMACHANDRAMOORTHY T, CHANDRAMOHAN A. Fluoride removal from water using activated and MnO2-coated tamarind fruit (Tamarindus indica) shell:batch and column studies[J]. Journal of Hazardous Materials, 2010, 177(1/2/3): 719-729. |
| [16] |
WU F C, TSENG R L, JUANG R S. Characteristics of Elovich equation used for the analysis of adsorption kinetics in dye-chitosan systems[J]. Chemical Engineering Journal, 2009, 150(2): 366-373. |
| [17] |
DJERIBI R, HAMDAOUI O. Sorption of copper(Ⅱ) from aqueous solutions by cedar sawdust and crushed brick[J]. Desalination, 2008, 225(1): 95-112. |
| [18] |
KETELLE B H, BOYD G E. The exchange adsorption of ions from aqueous solutions by organic zeolites[J]. Journal of the American Chemical Society, 1947, 69(11): 2800-2812. DOI:10.1021/ja01203a062 |
| [19] |
MALIYEKKAL S M, SHUKLA S, PHILIP L, et al. Enhanced fluoride removal from drinking water by magnesia-amended activated alumina granules[J]. Chemical Engineering Journal, 2008, 140(1/2/3): 183-192. |
| [20] |
HO Y S, PORTER J F, MCKAY G. Equilibrium isotherm studies for the sorption of divalent metal ions onto peat:copper, nickel and lead single component systems[J]. Water, Air, and Soil Pollution, 2002, 141: 1-33. DOI:10.1023/A:1021304828010 |
| [21] |
徐雷, 马培根, 丁文明. 硫酸铁改性活性氧化铝除氟性能及机理探究[J]. 北京化工大学学报(自然科学版), 2017, 44(6): 18-24. XU L, MA P G, DING W M. Defluorination performance of activated alumina modified by ferric sulfate[J]. Journal of Beijing University of Chemical Technology(Natural Science), 2017, 44(6): 18-24. (in Chinese) |
| [22] |
GARCIA-DELGADO R A, COTORUELO-MINGUEZ L M, RODRIGUEZ J J. Equilibrium study of single-solute adsorption of anionic surfactants with polymeric XAD resins[J]. Separation Science and Technology, 1992, 27(7): 975-987. DOI:10.1080/01496399208019736 |
| [23] |
安德森 M A, 鲁宾 A J. 水溶液吸附化学[M]. 北京: 科学出版社, 1989: 4-6. ANDERSON M A, RUBIN A J. Aqueous adsorption chemistry[M]. Beijing: Science Press, 1989: 4-6. (in Chinese) |
| [24] |
GU B H, SCHMITT J, CHEN Z H, et al. Adsorption and desorption of natural organic matter on iron oxide:mechanisms and models[J]. Environmental Science & Technology, 1994, 28(1): 38-46. |
| [25] |
魏建文, 韦真周, 廖雷, 等. 氨基修饰介孔分子筛SBA-15对水中Pb2+吸附性能[J]. 环境工程学报, 2014, 8(5): 1825-1830. |








