双吲哚及其衍生物是一类重要的有机小分子,因其是生物活性物质中的核心结构而引起了人们的研究兴趣[1-3]。在这些生物活性结构中,从海洋无脊椎动物海绵中提取到的双吲哚生物碱具有抗细菌和真菌的作用[4],且已有文献报导双吲哚生物碱具有抗白血病细胞毒性的作用[5]。目前研究人员已合成出双吲哚中心带有噻唑[6]、吡嗪[7]、嘧啶[7]、噻吩[8]等杂环结构的化合物,且报导了它们的生物活性。近年来,在双吲哚中心引入链状结构的研究引起了学者们的广泛兴趣,其中有很多课题组报导了双吲哚甲烷衍生物的合成。目前合成双吲哚甲烷衍生物的方法主要是使用质子酸[9]、路易斯酸[10-11]、固体酸[12]、杂多酸[13]和离子液体[14]等作为催化剂,催化羰基化合物与吲哚及其衍生物发生缩合反应。
本课题组近期研究了一些硫元素参与的烯丙位碳氢键官能团化反应:使用活化的亚砜与烯烃发生ene反应后,进一步转化实现相应的烷基化[15]和氨基化[16]。本文在前期工作的基础上,研究了吲哚作为亲核试剂与烯基亚砜的反应。采用乙基乙烯基亚砜或叔丁基乙烯基亚砜在三氟乙酸酐的活化下与吲哚及其衍生物发生反应,得到双吲哚甲烷硫醚衍生物。
1 实验部分 1.1 实验原料和仪器 1.1.1 实验原料三氟乙酸酐,化学纯,Alfa Aesar公司;2-氯吡啶,化学纯,萨恩化学技术(上海)有限公司;乙基乙烯基硫醚,化学纯,梯希爱(上海)化成工业发展有限公司;间氯过氧化苯甲酸、吲哚、N-甲基吲哚、2-甲基吲哚,化学纯,北京偶合科技有限公司;N-对甲苯磺酰吲哚,化学纯,天津希恩思生化科技有限公司;乙烯基溴化镁的四氢呋喃溶液,化学纯,北京百灵威科技有限公司;叔丁基亚磺酰氯,化学纯,Sigma-Aldrich公司。
1.1.2 实验仪器85-2型恒温磁力搅拌器,上海司乐仪器有限公司;RE5299旋转蒸发仪,巩义市予华仪器有限责任公司;AV400核磁共振波谱仪,德国布鲁克公司;MODEL205傅里叶红外光谱仪,美国Nicolet公司;XEVO G2 QTOF液相色谱-质谱联用仪,美国Waters公司。
1.2 合成方法 1.2.1 乙基乙烯基亚砜
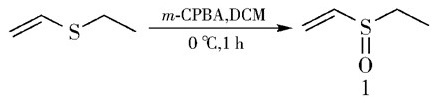
|
图 1 乙基乙烯基亚砜的合成 Fig.1 The synthesis of ethyl vinyl sulfoxide |
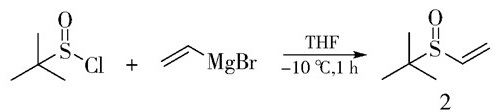
|
图 2 叔丁基乙烯基亚砜的合成 Fig.2 The synthesis of tert-butyl vinyl sulfoxide |
真空条件下,对10 mL反应管火焰干燥1 min。在氮气保护下,依次加入乙基乙烯基亚砜1(60 μL, 0.5 mmol)、2-氯吡啶(94 μL, 1.0 mmol)和2 mL的重蒸二氯甲烷,放入冰水浴中,搅拌,加入三氟乙酸酐(70 μL, 0.5 mmol),反应0.5 h,升至室温继续反应2 h。在-78 ℃下,将新配制的吲哚(176 mg, 1.5 mmol)的二氯甲烷溶液3 mL缓慢滴加到体系中,由-78 ℃逐渐升至室温,反应50 h。用饱和碳酸氢钠溶液淬灭,水相用二氯甲烷萃取3次,有机相用饱和食盐水洗涤1次,无水硫酸钠干燥。用石油醚与乙酸乙酯(体积比10: 1) 作洗脱剂进行柱层析分离(图 3)。
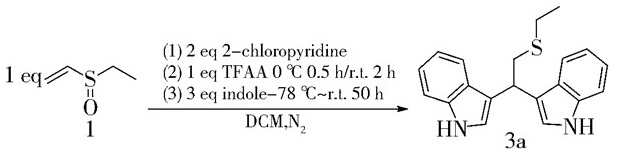
|
图 3 双吲哚硫醚衍生物的合成 Fig.3 The synthesis of the bis(indole)sulfide derivative |
(1) 化合物3a结构式为
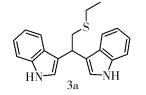
|
Rf=0.16 (V(石油醚): V(乙酸乙酯)= 5:1),Y=41%,无色油状液体。
1H NMR (400 MHz, CDCl3) δ 7.84 (s, 2H), 7.62 (d, J=8.0 Hz, 2H), 7.31 (d, J=8.0 Hz, 2H), 7.19 (dd, J=7.5, 7.5 Hz, 2H), 7.10 (dd, J=7.5, 7.5 Hz, 2H), 6.94 (s, 2H), 4.82 (t, J=7.2 Hz, 1H), 3.41 (d, J=7.2 Hz, 2H), 2.58 (q, J=7.4 Hz, 2H), 1.27 (t, J=7.4 Hz, 3H)。
13C NMR (101 MHz, CDCl3) δ 136.5, 126.8, 122.0, 121.8, 119.3, 119.2, 118.5, 111.2, 37.7, 35.0, 27.0, 14.9。
IR (KBr)ν (cm-1) 3400, 2957, 2920, 2849, 1654, 1645, 1457, 1094, 743。
HPLC-MS (ESI) m/z (M)+ C20H20N2S+理论值:343.1239,实验值:343.1240。
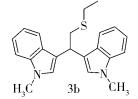
(2) 化合物3b结构式为
|
Rf= 0.47 (V(石油醚): V(乙酸乙酯)=5:1),Y=18%,浅粉色油状液体。
1H NMR (400 MHz, CDCl3) δ 7.60 (d, J=7.6 Hz, 2H), 7.29 (d, J=8.0 Hz, 2H), 7.21 (dd, J=7.6, 7.6 Hz,2H), 7.06 (dd, J=7.4, 7.4 Hz, 2H), 6.90 (s, 2H), 4.79 (t, J=7.4 Hz, 1H), 3.73 (s, 6H), 3.36 (d, J=7.2 Hz, 2H), 2.56 (q, J=7.2 Hz, 2H), 1.25 (t, J=7.2 Hz, 3H)。
13C NMR (101 MHz, CDCl3) δ 137.3, 127.3, 126.7, 121.4, 119.5, 118.7, 117.3, 109.2, 38.1, 34.9, 32.71, 27.1, 14.9。
IR (KBr)ν (cm-1) 2957, 2920, 2850, 1655, 1648, 1469, 1374, 1328, 1262, 1242, 738。
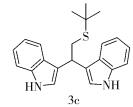
(3) 化合物3c结构式为
|
Rf= 0.26 (V(石油醚): V(乙酸乙酯)= 5:1),Y=33%,浅黄色油状液体。
1H NMR (400 MHz, CDCl3) δ 7.86 (s, 2H), 7.63 (d, J=8.0 Hz, 2H), 7.31 (d, J=8.0 Hz, 2H), 7.19 (dd, J=7.5, 7.5 Hz, 2H), 7.10 (dd, J=7.5, 7.5 Hz, 2H), 6.94 (s, 2H), 4.80 (t, J=7.4 Hz, 1H), 3.39 (d, J=7.4 Hz, 2H), 1.39 (s, 9H)。
13C NMR (101 MHz, CDCl3) δ 136.5, 126.8, 122.1, 121.8, 119.3, 119.2, 118.8, 111.2, 42.3, 35.4, 33.9, 31.0。
IR (KBr)ν (cm-1) 3411, 2959, 2924, 1487, 1456, 1418, 1364, 1338, 1124, 742。
HPLC-MS (ESI) m/z (M)+C22H24N2SH+理论值: 349.1733,实验值: 349.1719。
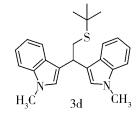
(4) 化合物3d结构式为
|
Rf=0.51 (V(石油醚): V(乙酸乙酯)=5:1),Y=13%,黄色油状液体。
1H NMR (400 MHz, CDCl3) δ 7.61 (d, J=8.0 Hz, 2H), 7.29 (d, J=8.0 Hz, 2H), 7.21 (dd, J=7.2, 7.2 Hz, 2H), 7.07 (dd, J=7.2, 7.2 Hz, 2H), 6.88 (s, 2H), 4.76 (t, J=7.4 Hz, 1H), 3.72 (s, 6H), 3.34 (d, J=7.4 Hz, 2H), 1.36 (s, 9H)。
13C NMR (101 MHz, CDCl3) δ 137.3, 127.3, 126.7, 121.4, 119.5, 118.7, 117.6, 109.2, 42.3, 35.5, 34.3, 32.7, 31.0。
IR (KBr)ν (cm-1) 2955, 2922, 1735, 1719, 1655, 1637, 1468, 1363, 1180, 1154, 767, 738。
HPLC-MS (ESI) m/z (M)+C24H28N2SNa+理论值: 399.1865,实验值: 399.1864。
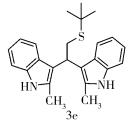
(5) 化合物3e结构式为
|
Rf=0.22 (V(石油醚): V(乙酸乙酯)=5:1),Y=28%,无色油状液体。
1H NMR (400 MHz, CDCl3) δ 7.66 (s, 2H), 7.60 (d, J=8.0 Hz, 2H), 7.21 (d, J=8.0 Hz, 2H), 7.08~6.97 (m, 4H), 4.70 (t, J=8.3 Hz, 1H), 3.56 (d, J=8.3 Hz, 2H), 2.35 (s, 6H), 1.33 (s, 9H)。
13C NMR (101 MHz, CDCl3) δ 135.1, 131.0, 128.2, 120.6, 119.2, 119.1, 113.7, 110.2, 42.2, 36.2, 33.6, 31.0, 12.8。
IR (KBr)ν (cm-1) 3391, 2960, 2922, 2357, 1457, 1435, 1418, 1386, 1362, 1299, 738。
HPLC-MS (ESI)m/z (M)+C24H28N2SNa+理论值: 399.1865,实验值: 399.1869。
2 结果与讨论 2.1 2-氯吡啶对产率的影响如图 4所示,在0 ℃下加入吲哚逐渐升至室温反应16 h,3a的产率为10%。考虑到反应中有三氟乙酸的生成,在加入三氟乙酸酐之前加入2倍当量(94 μL)的2-氯吡啶,3a的产率增加到16%。
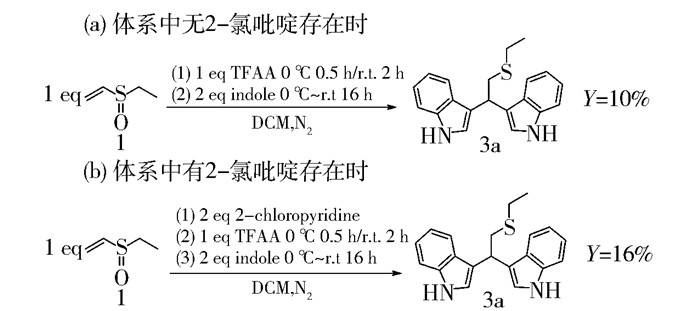
|
图 4 2-氯吡啶对产率的影响 Fig.4 Effect of the presence of 2-chloropyridine |
在合成双吲哚硫醚衍生物时,不同的原料配比会影响目标产物的产率。在图 5中,当n(乙基乙烯基亚砜):n(吲哚)= 1:2时,双吲哚硫醚衍生物3a的产率为10%;当n(乙基乙烯基亚砜):n(吲哚)= 1:3时,双吲哚硫醚衍生物3a的产率提高到18%。因此,乙基乙烯基亚砜、吲哚的物质的量比为1:3是较理想的配比。
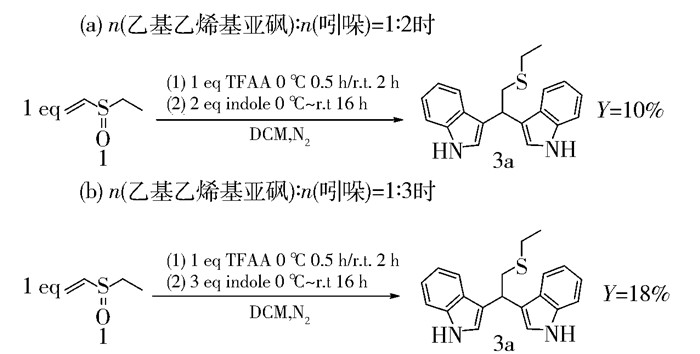
|
图 5 乙基乙烯基亚砜与吲哚的物质的量之比对产率的影响 Fig.5 Effect of varying the molar ratio of ethyl vinyl sulfoxide to indole on the yield |
如图 6所示,当加入吲哚的温度为0 ℃,逐渐升至室温反应16 h时产率为13%;当把加入吲哚时的温度降为-78 ℃,逐渐升至室温反应16 h时产率为26%。因此,在-78 ℃下加入吲哚更有利于产物的生成。
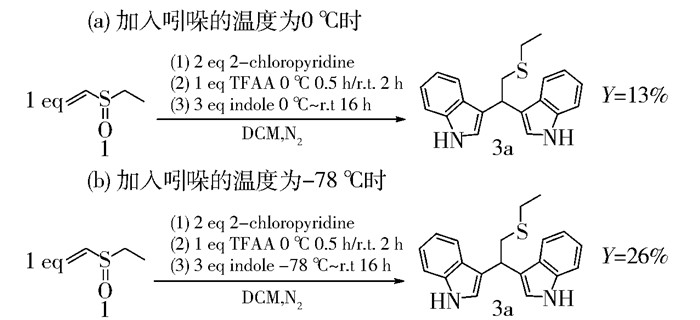
|
图 6 反应温度对产率的影响 Fig.6 Effect of varying the reaction temperature on the yield |
反应时间延长,有利于反应的完全进行。图 7分别为在-78 ℃时加入吲哚,逐渐升至室温反应16 h、26 h和50 h的情况,产率分别为26%、36%和41%。因此,反应的优化时间为50 h,即加入吲哚后反应50 h,双吲哚硫醚衍生物3a的产率可达到41%。
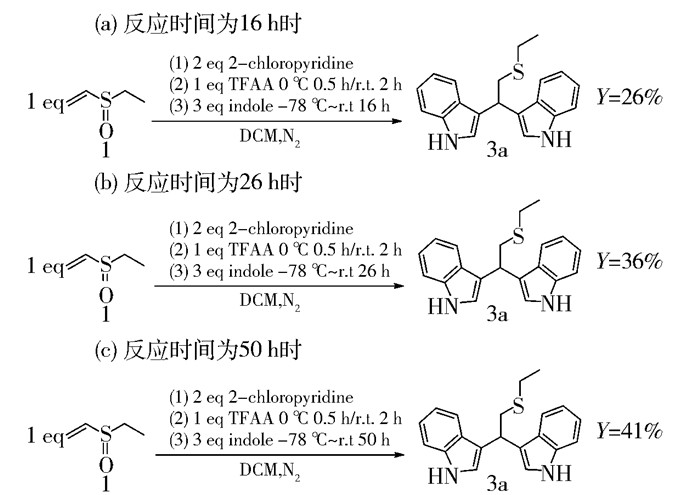
|
图 7 反应时间对产率的影响 Fig.7 Effect of varying the reaction time on the yield |
应用不同底物按照2.1节~2.4节探索的优化的反应条件进行了类似的合成。当把吲哚换为N-甲基吲哚时,由于甲基的给电子作用使得反应可以发生,生成3b;当把吲哚换为N-对甲苯磺酰吲哚时,由于对甲苯磺酰基的吸电子作用使得吲哚3位活性降低,没有得到预期产物。叔丁基乙烯基亚砜按照上述条件与吲哚、N-甲基吲哚和2-甲基吲哚反应分别得到3c、3d和3e(图 8)。
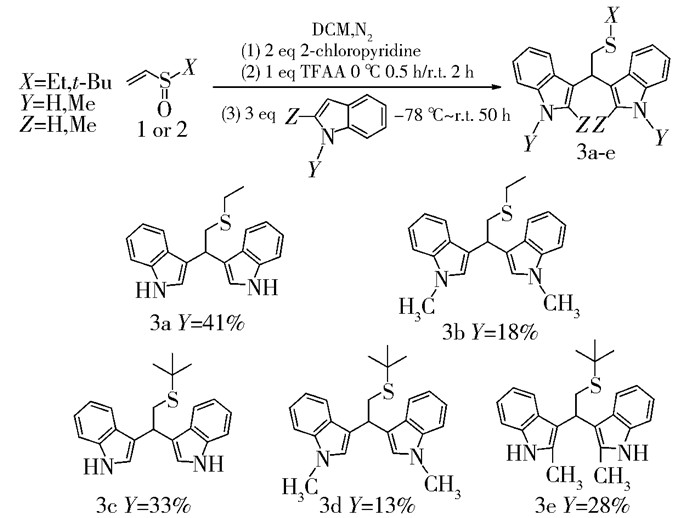
|
图 8 底物的适用范围 Fig.8 Range of substrates employed |
根据生成对称的双吲哚甲烷硫醚衍生物,本文提出如下机理:首先亚砜在三氟乙酸酐活化下生成中间体4,吲哚环对中间体4亲核进攻生成硫鎓盐5,5也可以写成其共振式6;由于苄位的碳正离子更稳定,6发生碳正离子重排成7,最后另一分子吲哚环的3号位再与7发生亲核进攻,得到双吲哚硫醚衍生物3(图 9)。
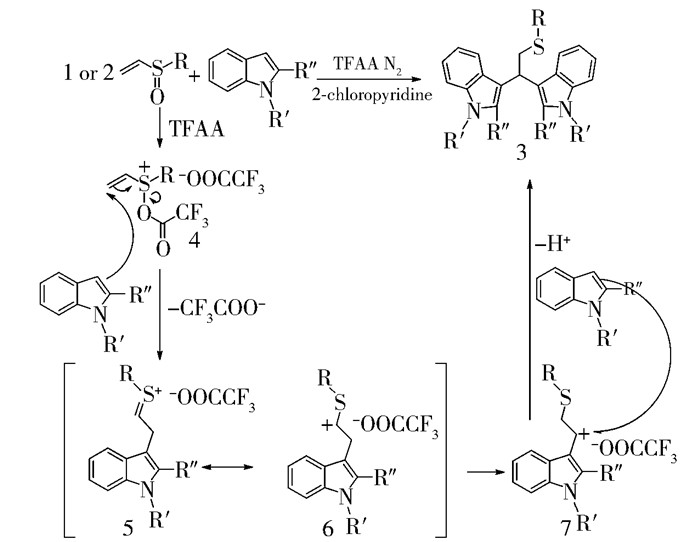
|
图 9 可能的反应机理 Fig.9 Suggested reaction mechanism |
本文采用三氟乙酸酐活化乙基乙烯基亚砜和叔丁基乙烯基亚砜与吲哚及其衍生物反应合成双吲哚硫醚衍生物,得到优化条件为:体系中有2-氯吡啶,n(乙基乙烯基亚砜):n(2-氯吡啶):n(吲哚)= 1:2:3,反应温度-78 ℃~室温,反应时间50 h。在该优化条件下,双吲哚硫醚衍生物3a~3e的产率为13%~41%。可能的反应机理为:亚砜在三氟乙酸酐的活化下,以吲哚及其衍生物作为亲核试剂发生两步反应,生成双吲哚硫醚衍生物。
| [1] |
Karthik M, Magesh C J, Perumal P T, et al. Zeolite-catalyzed ecofriendly synthesis of vibrindole A and bis(indolyl)methanes[J]. Applied Catalysis A:General, 2005, 286(1): 137-141. DOI:10.1016/j.apcata.2005.03.017 |
| [2] |
Kamble V T, Kadam K R, Joshi N S, et al. HClO4-SiO2 as a novel and recyclable catalyst for the synthesis of bis-indolylmethanes and bis-indolylglycoconjugates[J]. Catalysis Communications, 2007, 8(3): 498-502. DOI:10.1016/j.catcom.2006.07.010 |
| [3] |
Rahimi S, Amrollahi M A, Kheilkordi Z. An efficient ultrasound-promoted method for the synthesis of bis(indole) derivatives[J]. Comptes Rendus Chimie, 2015, 18(5): 558-563. DOI:10.1016/j.crci.2014.10.005 |
| [4] |
Tsuda M, Takahashi Y, Fromont J, et al. Dendridine A, a bis-indole alkaloid from a marine sponge dictyodendrilla species[J]. Journal of Natural Products, 2005, 68(8): 1277-1278. DOI:10.1021/np050076e |
| [5] |
Shin J, Seo Y, Cho K W, et al. New bis(indole) alkaloids of the topsentin class from the sponge spongosorites genitrix[J]. Journal of Natural Products, 1999, 62(4): 647-649. DOI:10.1021/np980507b |
| [6] |
Parrino B, Carbone A, Di Vita G, et al. 3-[4-(1H-indol-3-yl)-1, 3-thiazol-2-yl]-1H-pyrrolo[2, 3-b]pyridines, nortopsentin analogues with antiproliferative activity[J]. Marine Drugs, 2015, 13(4): 1901-1924. DOI:10.3390/md13041901 |
| [7] |
Jiang B, Yang C G, Xiong W N, et al. Synthesis and cytotoxicity evaluation of novel indolylpyrimidines and indolylpyrazines as potential antitumor agents[J]. Bioorganic & Medicinal Chemistry, 2001, 9(5): 1149-1154. |
| [8] |
Diana P, Carbone A, Barraja P, et al. Synthesis and antitumor properties of 2, 5-bis(3'-indolyl)thiophenes:analogues of marine alkaloid nortopsentin[J]. Bioorganic & Medicinal Chemistry Letters, 2007, 17(8): 2342-2346. |
| [9] |
EI Sayed M T, Ahmed K M, Mahmoud K, et al. Synthesis, cytostatic evaluation and structure activity relationships of novel bis-indolylmethanes and their corresponding tetrahydroindolocarbazoles[J]. European Journal of Medicinal Chemistry, 2015, 90: 845-859. DOI:10.1016/j.ejmech.2014.12.008 |
| [10] |
Swetha A, Babu B M, Meshram H M. An efficient and rapid protocol for the synthesis of diversely functionalized bisindolylmethanes[J]. Tetrahedron Letters, 2015, 56(14): 1775-1779. DOI:10.1016/j.tetlet.2015.02.032 |
| [11] |
Silveira C C, Mendes S R, Líbero F M, et al. Glycerin and CeCl3·7H2O:a new and efficient recyclable medium for the synthesis of bis(indolyl)methanes[J]. Tetrahedron Letters, 2009, 50(44): 6060-6063. DOI:10.1016/j.tetlet.2009.08.062 |
| [12] |
Nikoofar K. Ammonium monovanadate:a versatile and reusable catalyst for Friedel-Crafts alkylation and Michael addition of indoles[J]. Iranian Journal of Catalysis, 2014, 4(2): 105-111. |
| [13] |
惠永海, 王长春, 石伟, 等. 磷钨酸在吲哚与磺酰亚胺Friedel-Crafts反应中的应用[J]. 有机化学, 2014, 34: 898-902. Hui Y H, Wang C C, Shi W, et al. Friedel-Crafts reaction of indoles with N-sulfonyl imines catalyzed by H3PW12O40[J]. Chinese Journal of Organic Chemistry, 2014, 34: 898-902. (in Chinese) |
| [14] |
Sadaphal S A, Shelke K F, Sonar S S, et al. Ionic liquid promoted synthesis of bis(indolyl) methanes[J]. Central European Journal of Chemistry, 2008, 6(4): 622-626. |
| [15] |
Hu G, Xu J X, Li P F. Sulfur mediated allylic C-H alkylation of tri-and disubstituted olefins[J]. Organic Letters, 2014, 16(22): 6036-6039. DOI:10.1021/ol5031348 |
| [16] |
Zhang Z, Du H G, Xu J X, et al. Anti-Markovnikov rearrangement in sulfur mediated allylic C-H amination of olefins[J]. Chemical Communications, 2016, 52(77): 11547-11550. DOI:10.1039/C6CC05128F |
| [17] |
Abe H, Fujii H, Masunari C, et al. Construction of 1, 3-oxathiane ring through Pummerer reaction of γ, δ-unsaturated sulfinyl compounds[J]. Chemical & Pharmaceutical Bulletin, 1997, 45(5): 778-785. |
| [18] |
Block E, Gillies J Z, Gillies C W, et al. Allium chemistry:microwave spectroscopic identification, mechanism of formation, synthesis, and reactions of (E, Z)-propanethial S-oxide, the lachrymatory factor of the onion (Allium cepa)[J]. Journal of the American Chemical Society, 1996, 118(32): 7492-7501. DOI:10.1021/ja960722j |








