我国是动物源性食品(肉、蛋、奶、水产及其制品)的生产和消费大国,兽药残留问题一直受到高度重视,尤其是使用最多的抗生素类兽药,有关其残留问题和检测研究受到广泛关注。四环素(TC)是一种广谱抗生素,因具有较好的抗菌性、稳定性以及低廉的价格被广泛应用于动物疾病的预防和治疗上,但同时也因存在动物饲养时的滥用现象,导致动物源性食品中四环素大量残留,严重影响了消费者的身体健康[1]。目前关于四环素类抗生素的检测方法有微生物学法、酶联免疫吸附法(ELISA)、胶体金试纸条法、高效液相色谱法、毛细管电泳法及相关分析联用技术等[2-4]。其中,微生物学法操作简便,但专一性差,需要进一步辅以生物显影薄层层析法(TLC)、高效液相法(HPLC)或ELISA确证分析抗生素的种类;ELISA是基于抗原抗体的特异性反应,但抗体制备困难、不易保存且易存在交叉反应;胶体金试纸条法也是基于抗原抗体特异性结合,但灵敏度较低;其余几种方法结果准确度高、灵敏性好,但都需要复杂的前处理,且大型仪器价格昂贵、检测步骤繁琐,难以实现样品的大规模筛选检测,因此迫切需要更加方便快捷的检测方法。
核酸适配体是经体外指数富集的配基系统进化技术(SELEX)筛选得到的寡聚核苷酸序列,自1990年Tuerk等[5]和Ellington等[6]分别报道以来,核酸适配体已被广泛应用于分析化学、生物化学、疾病诊断、靶向治疗等多个领域[7-11]。酶联核酸适配体(ELAA)是将传统ELISA中的识别元件抗体替换成核酸适配体,借助核酸适配体的高特异性、储存稳定性、热复性等优点,实现对目标物的高灵敏度、高特异性检测,因此酶联核酸适配体分析法有望发展成为商业化试剂盒,具有广阔的市场前景。然而在ELAA检测方法的建立过程中,有多种因素会影响检测方法的灵敏度和特异性。其中,最主要的是非特异性吸附的影响。目前,尚无文献对酶联核酸适配体分析法中非特异性吸附的产生及其降低措施进行系统研究报道。
本文以蜂蜜中的四环素为检测对象, 基于间接竞争酶联核酸适配体检测分析方法,通过细致分析封闭剂种类、封闭时间、缓冲液体系等操作条件,发现选择合适的封闭剂及封闭时间、优化核酸适配体与四环素的结合缓冲液等手段均可提高本方法的特异性结合而减少体系中的非特异性吸附。随后在最佳条件下,构建间接竞争酶联核酸适配体分析方法,并用于检测蜂蜜中的四环素残留。
1 实验部分 1.1 实验原料和仪器 1.1.1 实验原料四环素-牛血清蛋白偶联物(TC-BSA),杭州南开日新生物技术有限公司;四环素标准品(TC),牛血清蛋白(BSA),酪蛋白(casein),上海Sigma-Aldrich公司;卵清蛋白(OVA),北京方程生物科技有限公司;辣根过氧化物酶标记的链霉亲和素(SA-HRP),3, 3′, 5, 5′-四甲基联苯胺(TMB),美国KPL;生物素标记核酸适配体(76 mer,aptamer-biotin),5′-CGTACGGAATTCGCTAGCCCCCCGGCAGGCCAC GGCTTGGGTTGGTCCCACTGCGCGTGGATCCGAGCT CCACGTG-3′-biotin (Mw=23747.43Da, 熔融温度83.77 ℃),由上海生工合成;吐温20(Tween 20) 及其他常用化学试剂,分析纯,北京化工厂。
本文所使用缓冲液包括50 mmol/L碳酸盐缓冲液(50 mmol/L CB, pH 9.6),10 mmol/L Tris-HCl缓冲液(10 mmol/L Tris, pH 8.0),10 mmol/L磷酸盐缓冲液(10 mmol/L PBS,pH 7.4),50 mmol/L磷酸盐缓冲液(50 mmol/L PBS,pH 7.2),100 mmol/L柠檬酸盐-磷酸盐缓冲液(100 mmol/L CPB, pH 5.0), 0.05%磷酸盐-吐温20缓冲液(0.05% PBST,10 mmol/L磷酸盐缓冲液中添加0.05%吐温20),缓冲液所用原料均为分析纯,购自北京化工厂。
1.1.2 实验仪器Nunc 96孔酶标板,丹麦Nunc公司;ELX800型酶标仪、Elx50型酶标板洗板机,美国BioTek公司;WH220 Plus数字式加热磁力搅拌器,德国WIGGENS公司;MX-M 96孔板混匀仪,北京大龙兴创实验仪器有限公司;VORTEX 1涡旋振荡器,德国IKA公司;5~1000 μL移液器,德国Effendorf公司;Barnstead Genpure超纯水机,美国Thermo Scientific公司。
1.2 实验方法针对四环素残留的间接竞争酶联核酸适配体分析法(ic-ELAA)构建过程如图 1所示。包被在酶标板底部的四环素-牛血清蛋白与样品中的四环素竞争有限的核酸适配体-生物素,然后经链霉亲和素-辣根过氧化物酶与生物素特异性结合,继而辣根过氧化物酶催化底物产生颜色反应而将竞争反应放大显色,最终样品中四环素的残留量与颜色的深浅程度成反比。

|
图 1 间接竞争酶联核酸适配体分析法检测四环素示意图 Fig.1 Schematic illustration of the indirect competitive enzyme-linked aptamer assay for tetracycline detection |
具体操作步骤如下。
(1) 四环素-牛血清蛋白的包被用适宜的包被缓冲液将四环素-牛血清蛋白稀释至一定的浓度,然后将其包被于酶标板,每孔加入100 μL,在4 ℃下孵育过夜。
(2) 酶标板的洗涤次日,用0.05%PBST将酶标板在洗板机上洗3次。
(3) 酶标板的封闭每孔加入200 μL封闭剂,在适宜温度、时间下封闭。
(4) 酶标板的洗涤用0.05% PBST将酶标板在洗板机上洗3次。
(5) 竞争过程在酶标板中依次加入50 μL/孔一系列浓度的TC标准品或实际样品及50 μL /孔的核酸适配体-生物素,在合适时间进行竞争反应。在实验前需对蜂蜜样品进行预处理以除去其中所含的金属离子,前处理过程按照以下方法进行:准确称取5 g蜂蜜于20 mL McILvaine-Na2EDTA缓冲液中(pH 4.0,100 mmol/L),充分涡旋震荡5 min,在4 ℃条件下以4000 r/min离心20 min,然后用NaOH调节pH至7.6, 4 ℃储存备用。
(6) 酶标板的洗涤用0.05% PBST将酶标板在洗板机上洗3次。
(7) 核酸适配体-生物素与链霉亲和素-辣根过氧化物酶的特异性结合在每孔中加入适宜浓度的SA-HRP,于适宜时间、温度下温育。
(8) 酶标板洗涤用0.05% PBST将酶标板在洗板机上洗3次。
(9) 酶催化显色反应在每孔加入100 μL TMB,在37 ℃下温育20 min,由HRP催化颜色反应。
(10) 强酸终止显色加入50 μL H2SO4终止颜色反应。
(11) 检测光吸光值利用ELX800型酶标仪迅速测定450 nm处的吸光值。
(12) 绘制浓度-响应值曲线根据公式(1) 计算各浓度TC的竞争效应,得到竞争曲线。
| $\frac{{{A_i} - {A_{\rm{b}}}}}{{{A_0}}} = a\lg {\rho _{{\rm{TC}}}} + b$ | (1) |
其中,Ai为各浓度TC作用后各孔的吸光度值,A0为阴性对照组(样品中无TC)的吸光度值,Ab为空白对照组(无TC,无aptamer)的吸光度值,a为线性斜率,b为线性截距, ρTC为四环素的质量浓度。
2 结果与讨论 2.1 减小SA-HRP引起的非特异性吸附链霉亲和素-过氧化物酶是显色反应的关键因素,因此降低SA-HRP的非特异性吸附尤为重要。SA-HRP浓度高也易引起非特异性吸附,使得酶标板整体显色深。SA-HRP的浓度选择标准为:在无四环素-牛血清蛋白、无核酸适配体-生物素条件下,经过1% BSA封闭,选择吸光度值较小的SA-HRP浓度作为最佳稀释度。不同浓度的SA-HRP引起的非特异性吸附结果如图 2所示,SA-HRP质量浓度低于6 μg/mL时非特异性吸附较小,此外还要保证体系的灵敏度,故6 μg/mL较为合适。其次,SA是一种偏酸性蛋白质(等电点为6.0),实验用离子浓度较小的pH= 7.5的Tris-HCl缓冲液,尽量减少其所带电荷,以减少SA与酶标板底部及内壁的非特异性吸附,同时,该缓冲液能确保HRP的生物活性。故选择SA-HRP质量浓度为6 μg/mL进行后续研究。

|
图 2 不同浓度SA-HRP的非特异性吸附 Fig.2 The non-specific adsorption assay with different concentrations of SA-HRP |
由于酶标板底部的位点有限,增强特异性结合即可降低非特异性吸附。在非竞争实验(无样品内四环素竞争)中,四环素-牛血清蛋白包被效果较好,则剩余的固相载体表面(酶标板底部)的空隙少,继而可以减少固相载体表面的非特异性吸附。影响四环素-牛血清蛋白包被效果的因素主要是包被浓度和包被缓冲液。如果包被浓度过小,则固相载体表面剩余空间大;包被浓度过大,则由于聚集作用(带状效应),蛋白质与基板材料(聚苯乙烯)的结合较弱,在洗板过程中易被洗掉,因此应选择适宜的包被浓度以提高特异性结合。如图 3(a)所示,优化四环素-牛血清蛋白浓度发现,5 μg/mL与2 μg/mL无显著性差异(显著性分析P=0.06335),故为提高检测灵敏度,选择2 μg/mL的四环素-牛血清蛋白包被浓度。另一方面包被过程实则基于蛋白质(BSA)与聚苯乙烯的物理吸附作用,故应选择合适的包被缓冲液,使牛血清蛋白带有较多的负电荷以使其与带正电荷的聚苯乙烯静电吸附。本文选择了不同的缓冲液体系,包括50 mmol/L碳酸盐缓冲液(CB, pH 9.6)、10 mmol/L Tris-HCl缓冲液(Tris, pH 8.0)、10 mmol/L磷酸盐缓冲液(PBS,pH 7.4)、50 mmol/L磷酸盐缓冲液(PBS,pH 7.2) 以及100 mmol/L柠檬酸盐-磷酸盐缓冲液(CPB, pH 5.0)。在包被浓度一定的条件下,选择吸光度值较大的包被缓冲液。如图 3(b)所示,当包被缓冲液为10 mmol/L Tris-HCl(pH 8.0) 时可得到较好的特异性结合。综合以上,选择2 μg/mL的四环素-牛血清蛋白在10 mmol/L Tris-HCl (pH 8.0) 缓冲液中包被进行后续研究。

|
图 3 四环素-牛血清蛋白包被条件优化 Fig.3 Optimization of the immobilization of TC-BSA |
封闭是本文实验中非常重要的步骤,若未经封闭或封闭不完全,核酸适配体-生物素、链霉亲和素-辣根过氧化物酶都会由于非特异性吸附作用而与微孔底部结合,其非特异性吸附引起的后续光密度值最大甚至可与特异性吸附光密度值接近,造成较高的背景值。故本文研究了不同封闭剂对链霉亲和素-辣根过氧化物酶非特异性吸附的影响,以选择合适的封闭剂及封闭条件。在封闭过程研究中,均是在空白酶标板中加入封闭剂封闭,再加入链霉亲和素-辣根过氧化物酶,观察封闭过程对链霉亲和素-辣根过氧化物酶的非特异性吸附的抑制影响。
2.3.1 封闭剂种类封闭作用主要受封闭剂种类、封闭剂浓度、封闭时间的影响。本文比较了牛血清蛋白、卵清蛋白、酪蛋白、吐温20等4种封闭剂在不同浓度及时间下的封闭作用,结果如图 4所示。综合比较发现,以酪蛋白做封闭剂时,0.5 g/mL至10 g/mL的酪蛋白在1 h内均可达到较好封闭效果;而以牛血清蛋白做封闭剂时,其封闭效果与时间、浓度有一定的关联性,需至少2 h方可达到较好封闭效果;相比之下,卵清蛋白和吐温20两种封闭剂的封闭效果不稳定。故后续对牛血清蛋白和酪蛋白两种封闭剂的封闭效果进行比较。

|
图 4 不同封闭剂对非特异性吸附的影响 Fig.4 The influence of different blocking agents |
为进一步比较牛血清蛋白和酪蛋白的封闭效果,依次在酶标板中添加封闭剂和链霉亲和素-辣根过氧化物酶,分别比较牛血清蛋白、酪蛋白在不同浓度、不同封闭时间下的作用。吸光度值越小,表明封闭效果越好,后续引起的SA-HRP非特异性吸附越小。牛血清蛋白的结果如图 5(a)所示,封闭时间较短时,高浓度牛血清蛋白反而引起较大的吸光度值(表明SA-HRP的非特异性吸附较大),原因可能为:牛血清蛋白与实验中所使用的孔板底部结合能力较弱,封闭时间不足时,高浓度牛血清蛋白由于分子间位阻而达不到良好的封闭效果,需要在封闭时间足够的条件下方可达到较好封闭效果。然而,作为检测方法应该尽量减少分析时间,不适宜用较长的封闭时间。其次,若在实验中选择10 g/mL牛血清蛋白进行长时间封闭以达到封闭效果,则会使得大量牛血清蛋白分子粘在固相载体表面,而牛血清蛋白会与四环素产生相互作用[12],故牛血清蛋白不适合作为本体系的封闭剂。如图 5(b)所示,酪蛋白则在1 h、0.5 g/mL条件下即可达到较好的封闭效果,且酪蛋白常用于生物素-链霉亲和素的分析系统中。综上分析,选择酪蛋白作为封闭剂进行后续研究。
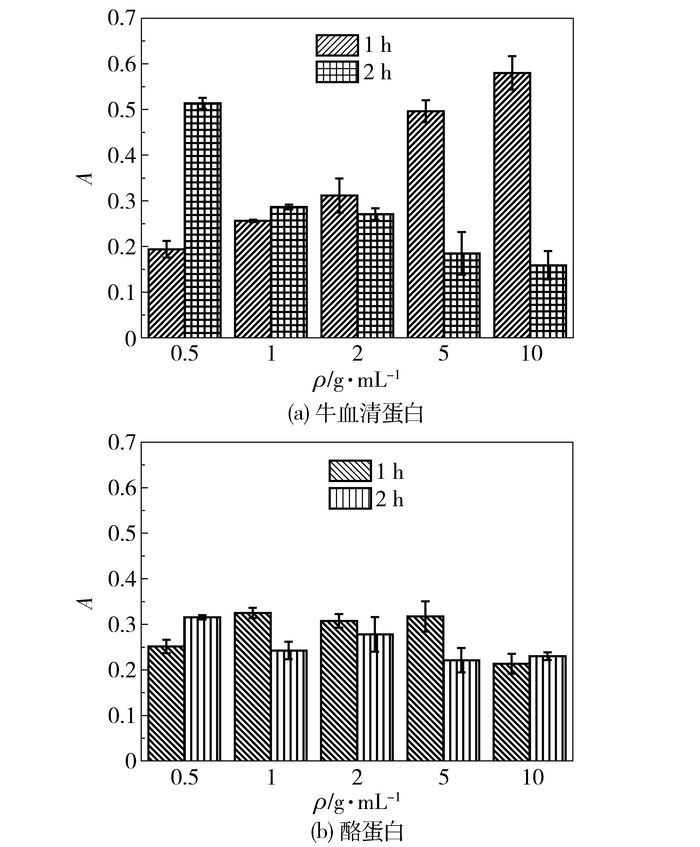
|
图 5 牛血清蛋白、酪蛋白封闭效果比较 Fig.5 Comparison of the blocking effects of BSA and casein |
根据前文优化得到的条件确定最佳反应条件为:选择2 μg/mL四环素-牛血清蛋白在10 mmol/L Tris-HCl(pH 8.0) 中过夜包被,次日用0.5 g/mL酪蛋白封闭1 h,标准品或样品中的四环素与四环素-牛血清蛋白发生竞争反应后用6 μg/mL链霉亲和素-辣根过氧化物酶催化颜色反应放大竞争效果,收集酶标板每孔的吸光度值,依据公式(1) 得到竞争曲线。
如图 6所示,选择0.005、0.05、0.5、5、50、500、5000、50000 ng/mL等一系列梯度的四环素溶液分别在缓冲液体系和蜂蜜样品体系中进行竞争反应得到竞争曲线,灵敏度定义为低于阴性样品3倍标准偏差所对应的浓度。结果表明,在浓度高于0.5 ng/mL时有明显竞争效果,并由曲线中的线性部分(图 6(b))得到该方法用于检测蜂蜜中四环素残留的灵敏度为0.035 ng/mL,具有与商用的ELISA试剂盒相近乃至更好的检测效果。

|
图 6 最佳选择条件下缓冲溶液和蜂蜜样品中的竞争抑制曲线 Fig.6 Competitive inhibition curves obtained with buffer and honey samples under the optimized conditions |
因实验中涉及到核酸适配体的使用,所以实验中所配制的缓冲液均需用无酶DNA水配制,以消除核酸酶对核酸适配体的降解影响。此外实验所用的包被液、结合缓冲液等均需经过0.22 μm的滤膜过滤之后方可使用,若发现任何缓冲液中出现絮状物时,应停止使用。
2.5.2 减小边缘效应的影响实验过程中发现96孔板存在边缘效应,即在相同实验条件下,最外一周的孔的吸光度值往往高于内侧吸光度值(酶标板外周颜色明显深于内侧,吸光度值最大相差约0.2)。为消除此效应的影响,实验采取如下措施:(1) 尽量留出最外一周的孔,实验时每步骤加入与其他孔等体积的水即可;(2) 实验所用酶标孔的条数少时,可将其拆下,逐条放入水浴中加热,以保证各孔受热相对均匀, 由此获得较均一的接近1.0的吸光度值。
2.5.3 适宜洗涤次数除去非特异性吸附洗涤液中应包含封闭缓冲液的成分外加吐温20或其他非离子表面活性剂以降低非特异性吸附。同时,洗涤次数需适宜,如图 7所示,洗涤不充分也会残留非特异性吸附,造成背景值偏高,而过度洗涤会造成特异性结合的解吸附,从而降低分析方法的灵敏度。此外,显色底物应提前检查是否被污染,因为本方法的颜色反应为HRP催化底物产生,底物一旦经酶污染,显色即出现假阳性。
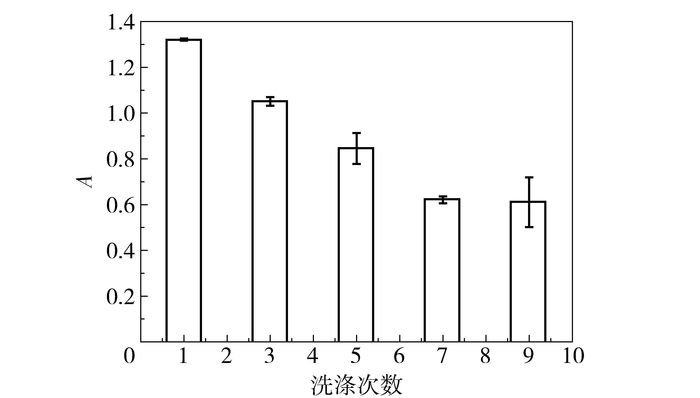
|
图 7 洗涤次数对吸光度值的影响 Fig.7 Influence of number of washing times on the final absorbance |
本文实验采用HRP催化TMB产生蓝色,后经酸终止反应产生黄色。在检测过程中,建议采用双波长法测定吸光度值,即除测定在450 nm的吸光度值A450外,同时测定630 nm处的吸光度值,从而减少电路(包括噪音、漂移、电压等)和酶标孔底部杂质引起的干扰。每孔的光吸收数值为两者之差Ai=A450-A630,得到各浓度TC作用下的竞争效应曲线如图 8所示。可以看出,由双波长处理得到的竞争曲线斜率相比于单波长有所增大,灵敏度提高。

|
实线为单波长读数,虚线为双波长读数。 图 8 相同条件下单波长和双波长读数得到的竞争曲线 Fig.8 Comparison of competitive curves using single-wavelength and double-wavelengths |
(1) 本文实验中非特异性吸附降至最低的最佳选择条件为:2 μg/mL四环素-牛血清蛋白在10 mmol/L Tris-HCl(pH8.0) 中包被过夜,次日用0.5 g/mL酪蛋白封闭1 h并进行竞争反应,竞争反应后用6 μg/mL链霉亲和素-辣根过氧化物酶催化颜色反应放大竞争效果。
(2) 在最佳条件下,得到线性较好(R2=0.9567) 的竞争曲线,并得出该方法的检测灵敏度为0.035 ng/mL。同时,还较为系统地提出了在构建酶联核酸适配体分析法时需要特别关注的几点措施,为非特异性吸附的研究提供参考。
| [1] |
徐冬梅, 刘广深, 李青, 等. 高效液相色谱法同时测定动物组织中3种抗生素残留量[J]. 中国公共卫生, 2002, 18(2): 233-234. Xu D M, Liu G S, Li Q, et al. Detection of three kinds of antibiotics in animal tissues using high performance liquid chromatography[J]. Chinese Journal of Public Health, 2002, 18(2): 233-234. (in Chinese) DOI:10.11847/zgggws2002-18-02-72 |
| [2] |
Boscher A, Guignard C, Pellet T, et al. Development of a multi-class method for the quantification of veterinary drug residues in feedingstuffs by liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2010, 1217: 6394-6404. DOI:10.1016/j.chroma.2010.08.024 |
| [3] |
Aslipashaki S N, Khayamian T, Hashemian Z. Aptamer based extraction followed by electrospray ionization-ion mobility spectrometry for analysis of tetracycline in biological fluids[J]. Journal of Chromatography B, 2013, 925: 26-32. DOI:10.1016/j.jchromb.2013.02.018 |
| [4] |
Jeon M, Paeng I R. Quantitative detection of tetracycline residues in honey by a simple sensitive immunoassay[J]. Analytica Chimica Acta, 2008, 626: 180-185. DOI:10.1016/j.aca.2008.08.003 |
| [5] |
Tuerk C, Gold L. Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase[J]. Science, 1990, 249(4968): 505-510. DOI:10.1126/science.2200121 |
| [6] |
Ellington A D, Szostak J W. In vitro selection of RNA molecules that bind specific ligands[J]. Nature, 1990, 346(6287): 818-822. DOI:10.1038/346818a0 |
| [7] |
Citartan M, Gopinath S C B, Tominaga J, et al. Assays for aptamer-based platforms[J]. Biosensors and Bioelectronics, 2012, 34: 1-11. DOI:10.1016/j.bios.2012.01.002 |
| [8] |
Dong Y Y, Xu Y, Yong W, et al. Aptamer and its potential applications for food safety[J]. Critical Reviews in Food Science and Nutrition, 2014, 54(12): 1548-1561. DOI:10.1080/10408398.2011.642905 |
| [9] |
Iliuk A B, Hu L H, Tao W A. Aptamer bioanalytical applications[J]. Analytical Chemistry, 2011, 83: 4440-4452. DOI:10.1021/ac201057w |
| [10] |
Song S P, Wang L H, Li J, et al. Aptamer-based biosensors[J]. Trends in Analytical Chemistry, 2008, 27(2): 108-117. DOI:10.1016/j.trac.2007.12.004 |
| [11] |
Tombelli S, Minunni M, Mascini M. Analytical applications of aptamers[J]. Biosensors and Bioelectronics, 2005, 20: 2424-2434. DOI:10.1016/j.bios.2004.11.006 |
| [12] |
Khan M A, Muzammil S, Musarrat J. Differential binding of tetracyclines with serum albumin and induced structural alterations in drug-bound protein[J]. International Journal of Biological Macromolecule, 2002, 30: 243-249. DOI:10.1016/S0141-8130(02)00038-7 |








