海洋以其丰富的自然资源在全球经济发展中发挥着越来越大的作用,海水逐步应用到人们的日常生活以及工业生产的各个方面。但是海水因其复杂的成分及高的盐分,具有强的腐蚀性,从而影响金属的使用性能及使用寿命。黄铜因具有良好的机械性能、导电导热性,是一种应用广泛的工业材料。黄铜主要应用于热交换及冷却系统,但在海水介质中会发生严重的腐蚀,造成重大的经济损失。因此,研究针对黄铜在海水溶液中所用的绿色、高效缓蚀剂具有重要意义。
缓蚀剂是常用的一种防腐方法。高效缓蚀剂一般含有电负性较大的氮、氧、磷、硫等元素,它们可以与金属原子形成配位键进而吸附到金属基体表面,大量的缓蚀剂分子吸附到金属表面并相互交织,形成致密的保护膜,从而抑制金属的腐蚀[1-3]。由于氨基酸在水溶液中的溶解性好,对自然环境无毒无害,天然环境下可生物降解,从而成为一种很有发展潜力的绿色缓蚀剂[4-6]。目前氨基酸用作缓蚀剂的研究已得到越来越多的关注。L-半胱氨酸一般在钢铁或黄铜金属基材的酸洗液中起到缓蚀作用,如曹毅等[7]研究了半胱氨酸、环烷基咪唑啉季铵盐和六次甲基四胺三元复配在盐酸中对碳钢的缓蚀作用,郭强强等[8]采用动电位极化和电化学阻抗研究了L-半胱氨酸、KI和抗坏血酸在1.0mol/L的HCl溶液中对Q235碳钢的缓蚀性能;而赖氨酸一般用于阻垢剂以及酸洗液体系,如钱建华等[4]研究了赖氨酸在盐酸溶液中对铜的缓蚀效率,最大值可达84%。然而,对于赖氨酸以及L-半胱氨酸在海水体系中电化学行为的研究还未见报道。本文分析了L-半胱氨酸及赖氨酸分别与葡萄糖酸钠复配在海水体系中对黄铜的缓蚀行为,通过氨基酸与葡萄糖酸钠的简单复配,研究其对海水中黄铜的缓蚀作用。
1 实验部分 1.1 实验原料采用黄铜(质量分数:Cu 64%,Zn 36%)作为实验电极,制作成1 cm×1 cm×1 cm的立方体,用环氧树脂封制成工作电极,电极表面积为1 cm2。实验采用的电解质溶液为取自青岛汇泉湾的海水,海水的主要成分见表 1。
| 下载CSV 表 1 汇泉湾海水成分表 Table 1 The composition of Huiquanwan seawater |
所有的电化学测试均在GAMRY1000电化学工作站(美国Gamry电化学公司)上进行,采用三电极体系测量,带有毛细管的饱和甘汞电极为参比电极(SCE),黄铜电极为工作电极,铂电极为对电极。在进行电化学测试前,先将制得的电极进行打磨抛光,具体方法为:使用水砂纸逐级(240#~2000#)打磨至镜面,然后使用蒸馏水冲洗干净,经无水乙醇超声除油,冷风干燥后备用。将工作电极在海水介质及含不同浓度氨基酸缓蚀剂的海水溶液中浸泡至开路电位(OCP)稳定,经测试时间在30 min左右。交流阻抗谱测试使用激励信号为正弦波,振幅为10 mV,扫描范围为105~10-2 Hz。动电位极化曲线的扫描速率为1 mV/s,电位范围为-250 mV~250 mV(vs. OCP)。
1.2.2 缓蚀效率测试失重实验使用静态全浸悬挂法,按照GB10124—88进行。将黄铜制作成25 mm×20 mm×5 mm的铜片,每组做3个试样作为平行试验,挂片的每个面依次用80#、120#、240#、400#、600#、800#水磨砂纸磨光,使用无水乙醇以及超声洗净,置于烘干箱干燥24 h,称重后用于挂片实验,浸泡7 d,通过公式(1)、(2) 得到缓蚀效率。
| $v = \frac{{{m_0} - {m_1}}}{{{m_0}}}$ | (1) |
| $E = \frac{{{v_0} - {v_1}}}{{{v_0}}}$ | (2) |
式中,v为试样的腐蚀速率,g/(m2·d);m0为实验前的试样质量,g;m1为除去腐蚀产物后试样的质量,g;E为缓蚀率,%;v0为空白海水中试样的腐蚀速率,g/(m2·d);v1为加入缓蚀剂后试样的腐蚀速率,g/(m2·d)。
1.2.3 扫描电子显微镜(SEM)分析利用JSM-5600LV型扫描电子显微镜(日本JEOL公司)观察失重试样挂片的表面形态,加速电压5 kV。
1.2.4 X射线衍射(XRD)分析利用D/MAX-2500型X射线衍射仪(日本Rigaku公司)分析黄铜试样表面腐蚀产物的成分,阳极为Cu靶,加速电压40 kV,扫描范围10°~55°,扫描速度5(°)/min。
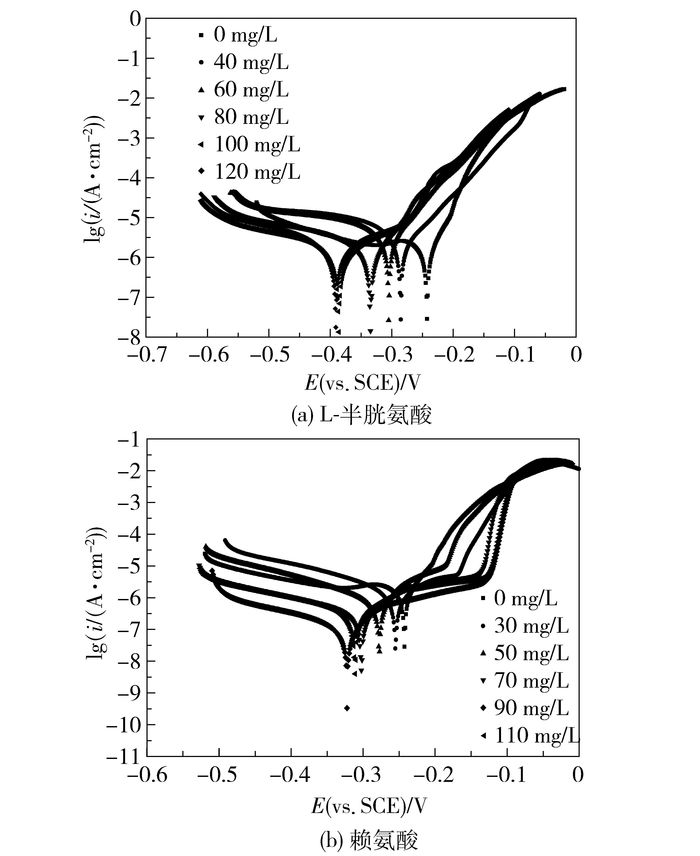
2 结果与讨论 2.1 黄铜试样的极化曲线在25 ℃下,将黄铜试样放于不同浓度L-半胱氨酸、赖氨酸海水溶液中测得的极化曲线如图 1(a)、(b)所示。对实验中L-半胱氨酸体系进行非线性拟合,拟合后参数列于表 2,对于氨基酸体系则在±50 mV的开路电势范围内,即弱极化区对极化曲线进行非线性拟合[9],拟合后所得参数列于表 3中,缓蚀剂的缓蚀效率通过公式(3) 计算[10-11]
| $\eta = \frac{{i_{{\rm{corr}}}^0 - {i_{{\rm{corr}}}}}}{{i_{{\rm{corr}}}^0}}$ | (3) |
|
图 1 298 K黄铜在不同质量浓度L-半胱氨酸、赖氨酸海水溶液中的极化曲线 Fig.1 Polarization curves of brass for different concentrations of L-cysteine and lysine at 298 K |
| 下载CSV 表 2 298 K黄铜在不同浓度L-半胱氨酸海水溶液中的极化数据 Table 2 Polarization curve parameters of brass for different concentrations of L-cysteine in seawater at 298 K |
| 下载CSV 表 3 298 K黄铜在不同浓度赖氨酸海水溶液中的极化数据 Table 3 Polarization curve parameters of brass for different concentrations of lysine in seawater at 298 K |
其中icorr0为海水中腐蚀电流密度,icorr为添加缓蚀剂的腐蚀电流密度,η为缓蚀效率。从图 1中可以看出,与空白海水溶液相比,随着溶液中氨基酸浓度不断增加,极化曲线自腐蚀电位负移,且腐蚀电流密度都有减小的趋势。从表 2中可以看出,当L-半胱氨酸加入量为100 mg/L时,自腐蚀电位为-0.386 V,负移明显(>85 mV)[12],所以L-半胱氨酸在当前腐蚀体系中是阴极型缓蚀剂。而由表 3可得,当赖氨酸加入量为90 mg/L时,缓蚀效果最佳,腐蚀电位变化小于85 mV,为混合型缓蚀剂。
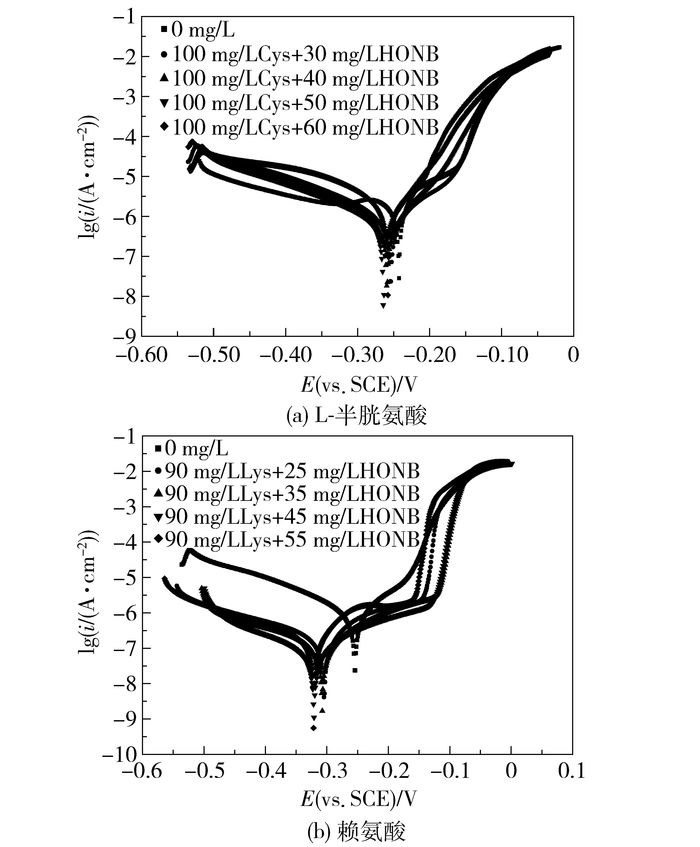
根据上述实验结果,本文选用两种氨基酸的最佳质量浓度与葡萄糖酸钠进行复合实验,测得的极化曲线结果见图 2。采用上述极化曲线拟合方法进行拟合后的结果分别列于表 4、5中。由表 4可以看出,当L-半胱氨酸质量浓度为100 mg/L、葡萄糖酸钠质量浓度为50 mg/L时,腐蚀电流密度最小,缓蚀效率达到一个最大值(97.35%)。由于曲线重复性较好且自腐蚀电位较空白实验的变化趋势小于85 mV,因而葡萄糖酸钠的加入改变了L-半胱氨酸的阴极缓蚀剂机理,当两者复合作用时表现为混合型缓蚀剂。而由表 5可知,当赖氨酸质量浓度为90 mg/L、葡萄糖酸钠质量浓度为45 mg/L时,腐蚀电流密度最小,缓蚀效率达到一个最大值(98.62%),与不加缓蚀剂的体系相比,二者复合后的自腐蚀电位移动约为85 mV,为阴极缓蚀剂。
|
图 2 298 K黄铜在不同浓度L-半胱氨酸、赖氨酸分别与葡萄糖酸钠复合缓蚀剂海水溶液中的极化曲线 Fig.2 Polarization curves of brass for different concentrations of compound corrosion inhibitors L-cysteine, lysine and sodium gluconate |
| 下载CSV 表 4 298K黄铜在不同浓度L-半胱氨酸与葡萄糖酸钠复合缓蚀剂溶液中的极化数据 Table 4 Polarization curves parameters of brass for different concentrations of L-cysteine with sodium gluconate in seawater at 298 K |
| 下载CSV 表 5 298 K黄铜在不同浓度赖氨酸、葡萄糖酸钠复合缓蚀剂溶液中的极化数据 Table 5 Polarization curve parameters of brass for different concentrations of lysine with sodium gluconate in seawater at 298 K |
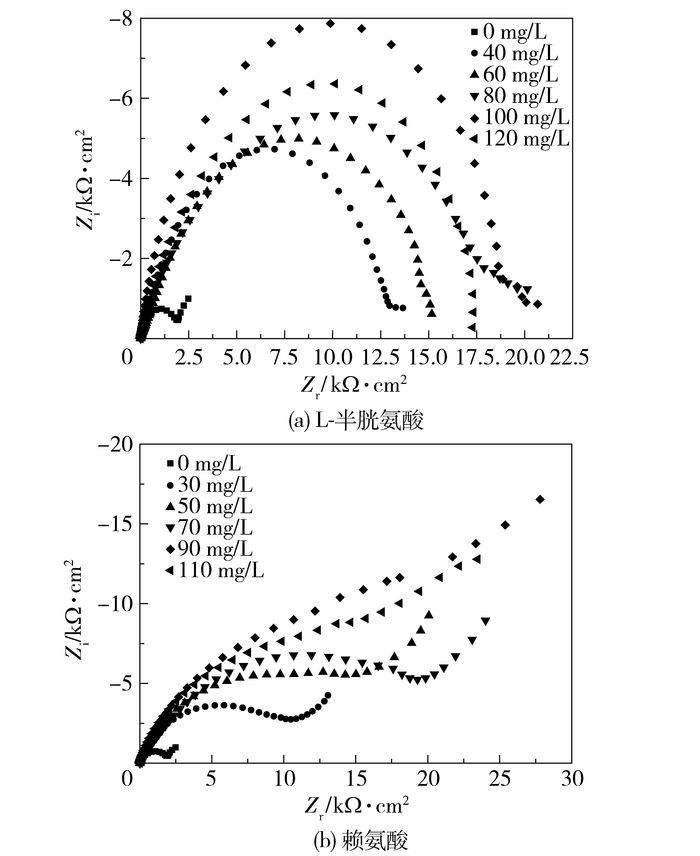
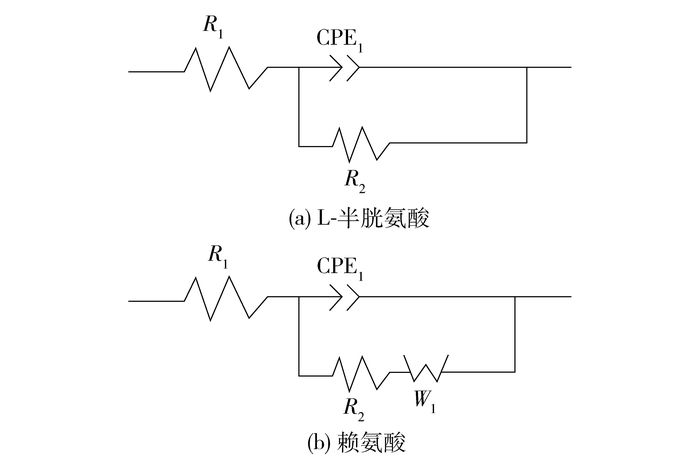
图 3是25 ℃时黄铜试样在不同质量浓度L-半胱氨酸和赖氨酸海水溶液中测得的交流阻抗图谱,使用ZSimWin软件进行拟合,其等效电路图如图 4所示。在图 4中,R1为工作电极与铂电极所产生的溶液电阻,R2为电荷转移电阻,CPEl是与吸附膜反应过程相关的常相位角元件,W1是由于存在腐蚀作用,电极界面的物质向本体溶液中扩散引起的Warburg阻抗,n是表征电极表面的不均匀程度[13]。常相位角原件CPE1是由于弥散效应[14-15]的存在,用来校准电极与溶液界面之间的电容,以代替纯电容,这是由膜的不完整性、电子的贯穿效应等造成的[16]。CPE1阻抗可表示为
|
图 3 25℃黄铜在不同浓度L-半胱氨酸、赖氨酸海水溶液中的交流阻抗图谱 Fig.3 Nyquist plots for brass in seawater with different concentrations of L-cysteine and lysine at 298 K |
|
图 4 等效电路 Fig.4 The equivalent circuit used to fit the EIS experimental data |
| ${Z_{{\rm{CPE}}}} = \frac{1}{{Y{{\left( {jw} \right)}^n}}}$ | (4) |
依据图 4所示的等效电路对相应的阻抗图进行参数拟合,缓蚀效率通过公式(5) 计算,所得结果列于表 6、7中。
| $\eta = \frac{{{R_{{\rm{ct}}}} - R_{{\rm{ct}}}^0}}{{{R_{{\rm{ct}}}}}}$ | (5) |
| 下载CSV 表 6 98 K黄铜在不同浓度L-半胱氨酸缓蚀剂溶液中的交流阻抗数据 Table 6 Impedance parameters of brass for different concentrations of L-cysteine in seawater at 298 K |
| 下载CSV 表 7 298 K黄铜在不同浓度赖氨酸缓蚀剂溶液中的交流阻抗数据 Table 7 Impedance parameters of brass for different concentrations of lysine in seawater at 298 K |
比较两种氨基酸的图谱(图 3)可知,半胱氨酸氨酸作缓蚀剂时,其质量浓度为100 mg/L的弧度半径最大,即电荷转移电阻Rct最大,说明此时L-半胱氨酸的存在减缓了电荷转移速度,腐蚀较难进行, 腐蚀速率极小[17]。同时,100 mg/L下CPE1最小,此时L-半胱氨酸吸附于黄铜的表面,界面层中介电常数很小的L-半胱氨酸分子取代了介电常数很大的水分子, 阻止了碳钢与海水系统的直接接触,减轻了电极的腐蚀电化学能力, 抑制金属离子离开电极进入海水溶液, 从而增强了其抗腐蚀能力[18]。而当L-半胱氨酸的质量浓度由100 mg/L继续增大时,L-半胱氨酸过多的吸附于黄铜的表面,由于重力作用,保护膜被破坏,减弱了其缓蚀作用,相应的缓蚀效率逐渐减小。因此,L-半胱氨酸最佳的质量浓度为100 mg/L[19]。赖氨酸作缓蚀剂的阻抗图与空白溶液相似,低频区的韦伯阻抗依然存在,这主要是因为腐蚀过程中生成的可溶性的CuCl2-向溶液中扩散,而溶液中的氧向电极表面扩散[20],为典型的具有Warburg阻抗的阻抗谱图,其扩散过程为电极过程的控制步骤。电荷传递电阻R2增大,说明电荷转移过程受到阻碍,因为缓蚀剂分子吸附在金属表面,体积较大的氨基酸分子取代了金属基体表面的水分子,而缓蚀剂分子介电常数很小,所以双电层厚度增大,Q逐渐减小,证明了半胱氨酸分子、H2O、Cl-在金属基体表面发生了竞争吸附,缓蚀效率随氨基酸浓度的增大而增大[21]。当L-半胱氨酸质量浓度为100 mg/L、赖氨酸质量浓度为90 mg/L时,两种缓蚀剂的缓蚀效率都达到最大值。进一步增加缓蚀剂的浓度,R2和缓蚀效率反而下降,可能是缓蚀剂分子与吸附膜层发生分子间作用力导致膜层不均匀所致,因此缓蚀效率也相应下降[20]。
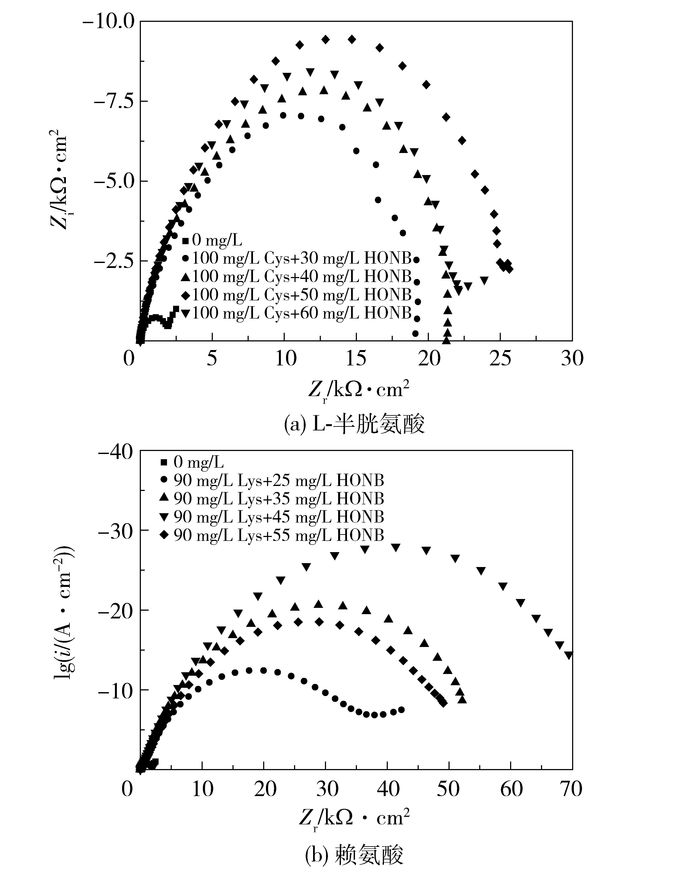
图 5是25 ℃时黄铜试样在不同浓度L-半胱氨酸、赖氨酸复合缓蚀剂海水溶液中测得的交流阻抗图谱,采用图 4所示的等效电路拟合所得到的参数列于表 8、9中。从L-半胱氨酸复合葡萄糖酸钠的交流阻抗图可以看出,高频区的容抗弧半径明显增大,主要是因为缓蚀剂吸附在了金属表面,同时由于葡萄糖酸钠的加入,葡萄糖酸根离子可以与Cu2+形成配合物覆盖在金属表面,进一步增加膜的致密性, 所以缓蚀效率大幅度提高[22]。当半胱氨酸质量浓度为100 mg/L、葡萄糖酸钠质量浓度为50 mg/L时,缓蚀效率达到最高值(93.01%)。当赖氨酸质量浓度为90 mg/L、葡萄糖酸钠质量浓度为45 mg/L时,缓蚀效率达到一个最高值(97.74%)。此结果与极化曲线的结果基本一致。
|
图 5 25 ℃黄铜在不同浓度L-半胱氨酸、赖氨酸与葡萄糖酸钠海水溶液中的交流阻抗图谱 Fig.5 Nyquist plots for brass in seawater with different concentrations of L-cysteine, lysine and sodium gluconate at 298 K |
| 下载CSV 表 8 298 K黄铜在不同浓度L-半胱氨酸与葡萄糖酸钠复合缓蚀剂溶液中的交流阻抗数据 Table 8 Impedance parameters of brass for different concentrations of L-cysteine with sodium gluconate in seawater at 298 K |
| 下载CSV 表 9 298 K黄铜在不同浓度赖氨酸与葡萄糖酸钠复合缓蚀剂溶液中的交流阻抗数据 Table 9 Impedance parameters of brass for different concentrations of lysine with sodium gluconate in seawater at 298 K |
根据2.2节电化学实验结果,选取最佳复配剂浓度,测定不同缓蚀剂以及空白试样的缓蚀效率,结果列入表 10中。由表 10可以看出,当添加半胱氨酸或赖氨酸与葡萄糖酸钠复合时,缓蚀效率与2.1节中电化学实验数据一致, 缓蚀效率可达90%左右。
| 下载CSV 表 10 黄铜在不同缓蚀剂中腐蚀速率及缓蚀率 Table 10 Corrosion rates of brass and inhibition rates for different concentrations of amino acids |
采用扫描电子显微镜观察经过不同处理的黄铜试样的表面形态。图 6(a)为刚打磨好的电极,可以看出表面非常平滑,经打磨产生的浅划痕清晰可见。图 6(b)为在未添加缓蚀剂的空白海水溶液中浸泡15 d后的黄铜电极表面形貌,此时金属电极受到了严重的腐蚀,表面变得粗糙不平,出现了明显的腐蚀坑洞。图 6(c)、(d)为添加有复合缓蚀剂的海水溶液浸泡15 d后金属电极的表面形貌,从图中可以看出黄铜试样表面腐蚀程度明显减弱,只出现了轻微的腐蚀现象,较图(b)中的腐蚀情况明显减轻。图(c)中依然可以看到打磨时产生的划痕,但存在明显的点蚀坑,图(d)中黄铜表面钝化,对黄铜基体起到了良好的保护作用。根据2.1节图 2的极化曲线所示,赖氨酸在阳极钝化区存在一个稳定钝化区,说明在浸泡过程中形成一层钝化膜,这与电镜图(图 2(d))完全一致。

|
图 6 新打磨的黄铜表面以及经空白海水溶液、添加半胱氨酸和葡萄糖酸钠的海水溶液、添加赖氨酸和葡萄糖酸钠的海水溶液处理的黄铜试样电镜图 Fig.6 SEM micrographs of freshly polished brass, brass immersed in seawater for 7 days without any inhibitor, with L-cysteine and sodium gluconate, and with lysine and sodium gluconate |
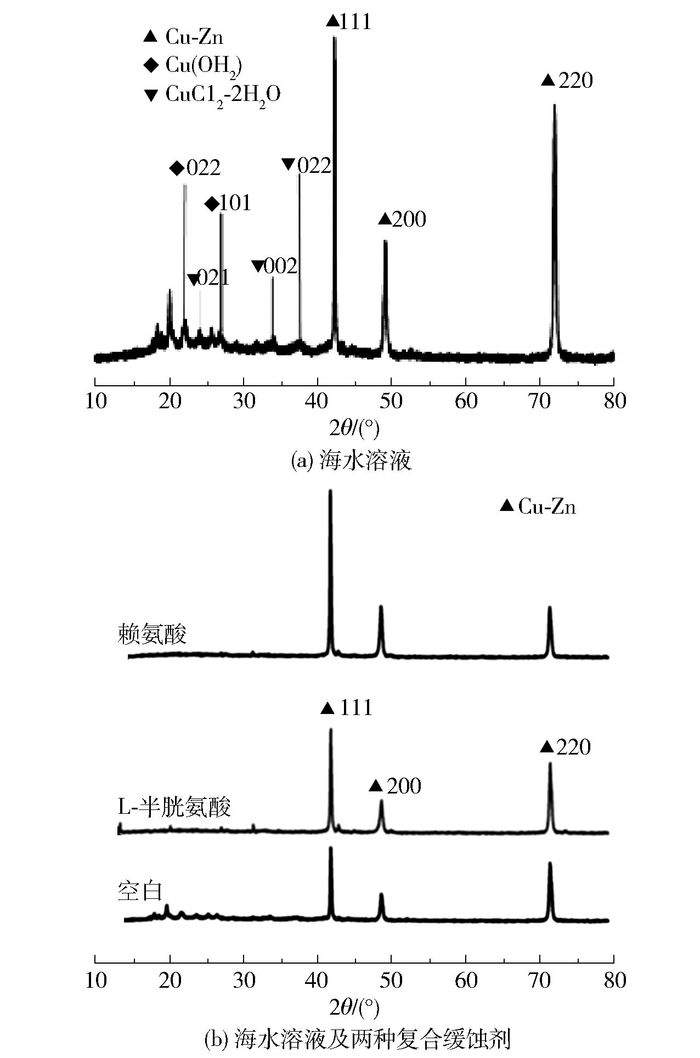
图 7为黄铜试样在海水溶液、海水溶液及两种复合缓蚀剂溶液浸泡7 d后的XRD图。从图中可以看出,空白溶液中金属表面主要出现了黄铜的特征峰,包括(111)、(220)、(200) 晶面等,且峰的强度较大,除了黄铜的特征峰外,还包括Cu(OH)2和CuCl2水合物的特征峰。加入缓蚀剂后,金属表面腐蚀产物的XRD谱图只出现了黄铜的特征峰,说明复合缓蚀剂的加入有效抑制了金属的腐蚀。
|
图 7 298 K黄铜在海水溶液、海水溶液及两种复合缓蚀剂溶液浸泡7天后的XRD图 Fig.7 XRD patterns of brass immersed in seawater and seawater with different inhibitor solutions for 7 days |
缓蚀剂与黄铜表面的作用机理可以通过吸附等温线进行研究。假设其吸附符合Langmuir吸附模型,即公式(5)
| $\frac{{{\rho _{{\rm{inh}}}}}}{\theta } = \frac{1}{k} + {\rho _{{\rm{inh}}}}$ | (5) |
式中,θ表示覆盖度,可近似等同于缓蚀效率,ρinh为缓蚀剂质量浓度,k为吸附平衡常数,θ可通过式(6) 得出
| $\theta = \frac{{v - v'}}{v}$ | (6) |
其中,v为不添加缓蚀剂的缓蚀速率,v′为添加缓蚀剂时的腐蚀速率。
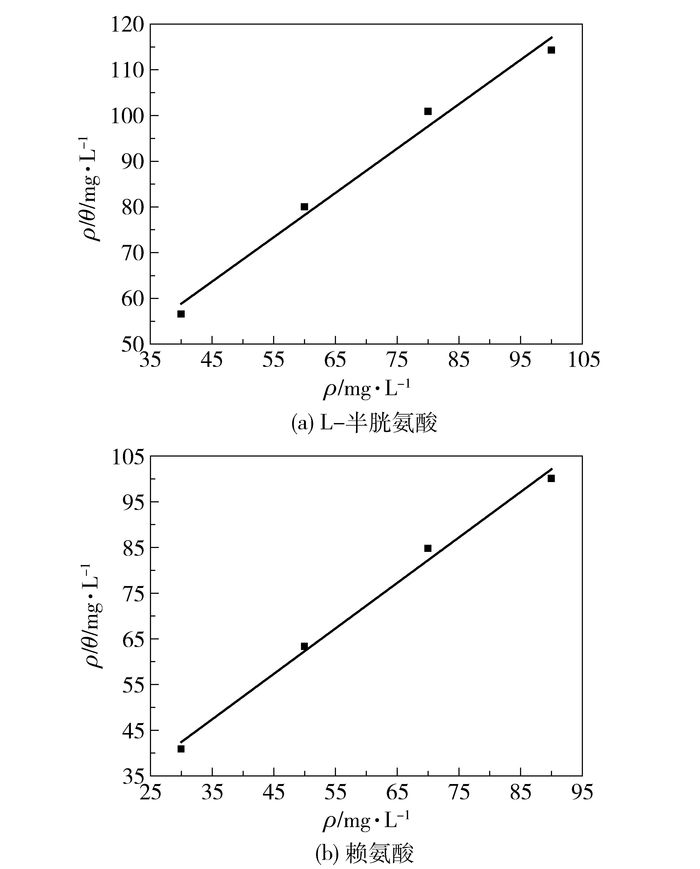
通过拟合发现ρinh/θ对ρinh作图呈一次函数关系,且赖氨酸线性系数高达0.9893,L-半胱氨酸线性系数高达0.9793,这表明氨基酸缓蚀剂对碳钢的缓蚀效果符合Langmuir吸附等温模型。
根据拟合结果(图 8)得出L-半胱氨酸吸附平衡常数ka为12.52, 赖氨酸吸附平衡常数kb为20.0221,则由式(7) 计算出吸附自由能ΔGa=-16.22 kJ/mol,ΔGb=-17.385 kJ/mol。
| $k = \left( {\frac{1}{{55.5}}} \right){\rm{exp}} - \left( {\frac{{\Delta G'}}{{RT}}} \right)$ | (7) |
|
图 8 黄铜在不同浓度L-半胱氨酸、赖氨酸溶液中的Langmuir吸附等温曲线 Fig.8 Langmuir adsorption plots for brass in seawater containing different concentrations of L-cysteine and lysine |
根据文献[23],当ΔG绝对值小于40 kJ/mol时,由于形成共价键或者电子的转移,表现为化学吸附,故而两种氨基酸缓蚀剂与黄铜之间的吸附类型为自发进行的化学吸附。氨基酸在黄铜上形成单分子吸附,从而起到缓蚀作用[24],与2.1节电化学实验结果一致。
3 结论(1) 两种氨基酸缓蚀剂单独使用时,缓蚀效率一般,其中L-半胱氨酸是一种阴极型缓蚀剂,赖氨酸是一种混合型缓蚀剂。当L-半胱氨酸与葡萄糖酸钠复配时,表现为混合型缓蚀剂,赖氨酸与葡萄糖酸钠复配时则表现为阴极型缓蚀剂。因此可以引入其他缓蚀基团,使缓蚀剂的缓蚀性能更加优良。
(2) 复合缓蚀剂的缓蚀性能相较两种单独的氨基酸缓蚀剂均显著提高,当半胱氨酸质量浓度为100 mg/L、葡萄糖酸钠质量浓度为50 mg/L时,缓蚀效率达到最高值,为93.01%;当赖氨酸质量浓度为90 mg/L、葡萄糖酸钠质量浓度为45 mg/L时,缓蚀效率达到最高值,为97.74%。由于缓蚀剂复配时的作用机理尚没有定论,两种氨基酸与葡萄糖酸钠复配的缓蚀机理还不清楚,后续会进行一系列的实验以研究该缓蚀剂的作用机理。
(3) L-半胱氨酸、赖氨酸在黄铜表面的吸附均符合Langmuir吸附等温模型,由共价键或电子转移形成,表现为化学吸附。
| [1] |
Bastidas D M, Criado M, La Iglesia V M, et al. Comparative study of three sodium phosphates as corrosion inhibitors for steel reinforcements[J]. Cement and Concrete Composites, 2013, 43: 31-38. DOI:10.1016/j.cemconcomp.2013.06.005 |
| [2] |
Nahali H, Dhouibi L, Idrissi H. Effect of phosphate based inhibitor on the threshold chloride to initiate steel corrosion in saturated hydroxide solution[J]. Construction and Building Materials, 2014, 50: 87-94. DOI:10.1016/j.conbuildmat.2013.08.054 |
| [3] |
Baldin E K K, Kunst S R, Beltrami L V R, et al. Ammonium molybdate added in hybrid films applied on tinplate:effect of the concentration in the corrosion inhibition action[J]. Thin Solid Films, 2016, 600: 146-156. DOI:10.1016/j.tsf.2016.01.034 |
| [4] |
钱建华, 张思倩, 刘琳. 五种氨基酸在HCl溶液中对铜的缓蚀作用[J]. 化学通报, 2014, 77(2): 170-173. Qian J H, Zhang S Q, Liu L. The corrosion inhibition action of five amino acid compounds on copper in HCl solution[J]. Chem Bull, 2014, 77(2): 170-173. (in Chinese) |
| [5] |
Kowsari E, Arman S Y, Shahini M H, et al. In situ synthesis, electrochemical and quantum chemical analysis of an amino acid-derived ionic liquid inhibitor for corrosion protection of mild steel in 1M HCl solution[J]. Corrosion Science, 2016, 112: 73-85. DOI:10.1016/j.corsci.2016.07.015 |
| [6] |
古户波, 庄稼, 严丽, 等. 鸟嘌呤-L-丙氨酸衍生物的合成及缓蚀性能[J]. 应用化工, 2014, 43(8): 1423-1427. Gu H B, Zhuang J, Yan L, et al. Synthesis and anti-corrosion performance of guanine-L-alanine derivative[J]. Applied Chemical Industry, 2014, 43(8): 1423-1427. (in Chinese) |
| [7] |
曹毅, 芮玉兰, 黄开宏. HCl溶液中氨基酸复合缓蚀剂对碳钢的缓蚀作用[J]. 表面技术, 2011, 40(5): 13-17. Cao Y, Rui Y L, Huang K H. Inhibition performances of compound of amino acid inhibitors for carbon steel in HCl solution[J]. Surface Technology, 2011, 40(5): 13-17. (in Chinese) |
| [8] |
郭强强, 田会娟, 王丽红. 氨基酸复配酸洗缓蚀剂的研究[J]. 表面技术, 2016, 45(7): 46-50. Guo Q Q, Tian H J, Wang L H. Amino acid corrosion inhibitor in hydrochloric acid[J]. Surface Technology, 2016, 45(7): 46-50. (in Chinese) |
| [9] |
马敬波. 氨基酸衍生物的合成及其缓蚀行为研究[D]. 辽宁大连: 大连理工大学, 2010. Ma J B.Synthesis and investigation on inhibition performance of amino acid derivatives[D]. Dalian, Liaoning:Dalian University of Technology, 2010. |
| [10] |
Qiang Y J, Zhang S T, Xu S Y, et al. Experimental and theoretical studies on the corrosion inhibition of copper by two indazole derivatives in 3.0% NaCl solutio[J]. Journal of Colloid and Interface Science, 2016, 472: 52-59. DOI:10.1016/j.jcis.2016.03.023 |
| [11] |
Wang D, Xiang B, Liang Y P. Corrosion control of copper in 3.5 wt.% NaCl solution by domperidone:experimental and theoretical study[J]. Corrosion Science, 2014, 85: 77-86. DOI:10.1016/j.corsci.2014.04.002 |
| [12] |
Asipita S A, Ismail M, Majid M Z A. Green Bambusa Arundinacea leaves extract as a sustainable corrosion inhibitor in steel reinforced concrete[J]. Journal of Cleaner Production, 2014, 67: 139-146. DOI:10.1016/j.jclepro.2013.12.033 |
| [13] |
姜琴, 李伟华, 侯保荣. 一种噻二唑类缓蚀剂对模拟海水中2024铝合金的缓蚀作用[J]. 腐蚀与防护, 2013, 34(8): 673-678. Jiang Q, Li W H, Hou B R. Corrosion inhibition of thiadiazole inhibitor in simulated seawater on 2024 aluminum alloy[J]. Corrosion & Protection, 2013, 34(8): 673-678. (in Chinese) |
| [14] |
Julien C, Stoynov Z. Materials for lithium-ion batteries[M]. Amsterdam: Springer, 2000.
|
| [15] |
Macdonald J R. Impedance spectroscopy and its use in analyzing the steady-state AC response of solid and liquid electrolytes[J]. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, 1987, 223(1/2): 25-50. |
| [16] |
Jeyaprabha C, Sathiyanarayanan S, Venkatachari G. Effect of cerium ions on corrosion inhibition of PANI for iron in 0.5M H2SO4[J]. Applied Surface Science, 2006, 253(2): 432-438. DOI:10.1016/j.apsusc.2005.12.081 |
| [17] |
曹楚南. 腐蚀电化学原理[M]. 3版. 北京: 化学工业出版社, 2008. Cao C N. Principles of electrochemistry of corrosion[M]. 3rd ed. Beijing: Chemical Industry Press, 2008. (in Chinese) |
| [18] |
Yağan A, Pekmez N Ö, Yildiz A. Corrosion inhibition by poly (N-ethylaniline) coatings of mild steel in aqueous acidic solutions[J]. Progress in Organic Coatings, 2006, 57(4): 314-318. DOI:10.1016/j.porgcoat.2006.09.010 |
| [19] |
李克华, 兰志威, 杨冰冰, 等. HJ曼尼希碱缓蚀剂的合成及其性能[J]. 腐蚀与防护, 2016, 37(6): 467-471. Li K H, Lan Z W, Yang B B, et al. Synthesis and performance of HJ Mannich base inhibitor[J]. Corrosion & Protection, 2016, 37(6): 467-471. (in Chinese) DOI:10.11973/fsyfh-201606007 |
| [20] |
杜海燕, 张燕芬, 高岩, 等. 表面增强拉曼散射及其在缓蚀剂研究中的应用[J]. 化学工业与工程技术, 2008, 29(2): 50-53. Du H Y, Zhang Y F, Gao Y, et al. Surface enhanced raman scattering and its application in research of corrosion inhibitor[J]. Journal of Chemical Industry & Engineering, 2008, 29(2): 50-53. (in Chinese) |
| [21] |
付占达, 芮玉兰, 周坤. 含盐体系中有机铜缓蚀剂及缓蚀机理研究进展[J]. 化工生产与技术, 2007, 14(1): 38-42. Fu Z D, Rui Y L, Zhou K. Research and development of organic inhibitor mechanism for copper corrosion in NaCl solution[J]. Chemical Production and Technology, 2007, 14(1): 38-42. (in Chinese) |
| [22] |
王克诚, 刘欣, 王丽红, 等. 聚天冬氨酸及其与葡萄糖酸钠复配物对碳钢的缓蚀性能研究[J]. 材料保护, 2007, 40(6): 60-62. Wang K C, Liu X, Wang L H, et al. Corrosion inhibition of carbon steel by polyaspartic acid and its mixture with sodium gluconate[J]. Materials Protection, 2007, 40(6): 60-62. (in Chinese) |
| [23] |
Khamis E, Bellucci F, Latanision R M, et al. Acid corrosion inhibition of nickel by 2-(triphenosphoranylidene) succinic anhydride[J]. Corrosion, 1991, 47(9): 677-686. DOI:10.5006/1.3585307 |
| [24] |
李文军, 刘大扬, 魏开金. 在南海海域铜合金8年腐蚀行为研究[J]. 腐蚀科学与防护技术, 1995, 7(3): 232-236. Li W J, Liu D Y, Wei K J. Corrosion behavior of Al-Clad LF6M alloy at mean tide zone by Xiamen sea area[J]. Corrosion Science and Protection Technology, 1995, 7(3): 232-236. (in Chinese) |







